Introducción
Infliximab (IFX) es un anticuerpo monoclonal quimérico IgG1 que actúa frente al factor de necrosis tumoral alfa (TNF-α). Se trata de una citocina proinflamatoria con un papel importante en la colitis ulcerosa y la enfermedad de Crohn1. Los fármacos inhibidores del TNF, incluyendo infliximab, han mejorado el tratamiento de la enfermedad inflamatoria intestinal, utilizados tanto en monoterapia como en combinación con inmunosupresores2. Aprobado inicialmente en 1998, infliximab se ha empleado en el tratamiento de más de 2,6 millones de pacientes y su perfil de eficacia y seguridad a largo plazo está bien establecido3,4. El elevado coste de estos fármacos exige por parte de los profesionales sanitarios la utilización correcta de los mismos para maximizar su eficacia, minimizar su toxicidad y evitar costes innecesarios5. La patente para infliximab original (Remicade®) expiró en Europa en 2015 y en febrero de ese mismo año infliximab biosimilar CT-P13 (Remsima®) obtuvo la licencia de comercialización en España. La aparición del biosimilar ha supuesto una importante disminución del coste y una mejora del acceso a este tratamiento.
La adherencia al tratamiento se define como la toma de la medicación por parte del paciente tal y como se le ha prescrito6. La falta de adherencia afecta a la efectividad de los tratamientos, con el consiguiente incremento de los riesgos asociados a la medicación y los costes7. No hay un consenso sobre un estándar de medición de referencia, por lo que existen múltiples métodos de medición: cuestionarios, registros de dispensación o dispositivos electrónicos, pero ninguno tiene buena sensibilidad de forma aislada8. Es por ello que en los últimos años se ha comenzado a utilizar el término persistencia para complementar el concepto de adherencia. La persistencia es un indicador fácil de medir para el beneficio terapéutico a largo plazo de un medicamento y se define como “la duración del tiempo transcurrido desde el inicio hasta la interrupción de la terapia”9. En este contexto, resulta fundamental la confirmación de los resultados clínicos en la práctica real, donde algunos autores han planteado la medida de la persistencia como un indicador adecuado para la evaluación de la efectividad, seguridad y satisfacción del tratamiento10.
El objetivo de este estudio es comparar la persistencia, tasa de retención, cambios en la dosificación (intensificaciones y desintensificaciones) e impacto económico de infliximab CT-P13 frente a infliximab original en dos cohortes de pacientes naive a biológicos con colitis ulcerosa en un hospital general de tercer nivel.
Métodos
Se realizó un estudio ambispectivo y observacional no aleatorizado desde enero de 2012 hasta noviembre de 2021. Se incluyeron pacientes adultos diagnosticados de colitis ulcerosa naive a tratamiento biológico que recibieron en primera línea infliximab (Remicade®) o infliximab CT-P13 (Remsima®). Se incluyeron en el estudio todos aquellos pacientes adultos con colitis ulcerosa de moderada a severa que fracasaron a tratamiento con glucocorticoides, inmunosupresores o ambos, y que completaron el periodo de inducción a Remicade® y Remsima®. Las variables recogidas fueron: sexo, edad, diagnóstico, fecha de inicio, número de administraciones por fármaco, pauta posológica y número de intensificaciones y desintensificaciones. Se calculó el número de pacientes que habían suspendido el tratamiento, la persistencia y la tasa de retención de Remicade® y Remsima® a los 6, 12 y 24 meses analizada mediante el análisis de las curvas de Kaplan-Meier y el test estadístico log rank.
El tiempo de persistencia con Remicade® y Remsima® se determinó a partir de las fechas de inicio y fin del tratamiento. Se consideró como fecha de fin de tratamiento aquella en que el médico decidió dicha interrupción, la cual fue confirmada consultando la historia clínica del paciente. En el caso de que el paciente continuara en tratamiento, la persistencia se calculó a partir de la fecha de finalización del seguimiento (01/11/2021). Las pérdidas de seguimiento, entendidas como pacientes que no acudieron a la consulta ni del digestivo ni del farmacéutico en un año, se consideraron como fallos en el análisis del tiempo de persistencia9. Los datos se obtuvieron del programa de preparación y validación de terapia IV del Servicio de Farmacia (Oncofarm® IMF) y de la historia clínica electrónica del hospital (Integrador® y Abucasis®). El cálculo del coste paciente/año de Remicade® y Remsima® se realizó de forma individual en función de las administraciones durante el periodo de estudio, y los costes reales de adquisición fueron obtenidos de una base de datos de Concursos Públicos (https://www.acobur.es. Último acceso: 02/02/2022).
El análisis estadístico se llevó a cabo a través del programa SPSS Statistics® versión 23. Los resultados de las variables categóricas se describieron a través de frecuencias (%) y se compararon a través de la chi de Pearson. Los resultados de las variables cuantitativas se describieron a través de medias y desviación estándar en el caso de que siguieran una distribución normal, siendo previamente confirmado este supuesto a través del test de normalidad de Shapiro-Wilk, y a través de medianas y rangos intercuartílicos (RIQ) en el caso de que su distribución no fuese normal.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital siguiendo las directrices de la declaración de Helsinki.
Resultados
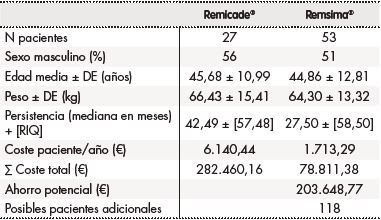
Durante el periodo de estudio se incluyeron 80 pacientes adultos diagnosticados de colitis ulcerosa naive a tratamiento biológico que recibieron tratamiento en primera línea, 27 con infliximab original y 53 con el biosimilar. En la tabla 1 se muestran los datos demográficos (sexo, edad y peso), no existiendo diferencias entre ambos grupos. A fecha de finalización del estudio (noviembre de 2021) 3 pacientes con Remicade® y 32 pacientes con Remsima® continuaban en tratamiento.
Tabla 1. Características demográficas, persistencia y evaluación de costes de Remicade® y Remsima®.
DE: desviación estándar; RIQ: rango intercuartílico.
En la figura 1 se presenta el número de pacientes activos con Remicade® y Remsima® por cada año (2012-2021). El número de pacientes con Remicade® se mantuvo estable hasta 2015. En esa fecha, tras la inclusión en la Guía Farmacoterapéutica del hospital de Remsima® y su posicionamiento como tratamiento de elección para infliximab en el paciente con colitis ulcerosa naive a biológicos, se observa un incremento paulatino de los pacientes que alcanza su mayor número en 2021 con 32 pacientes. La tasa de inicio de tratamiento por año con infliximab fue de 6,75 para Remicade® y de 8,83 en el caso de Remsima®.
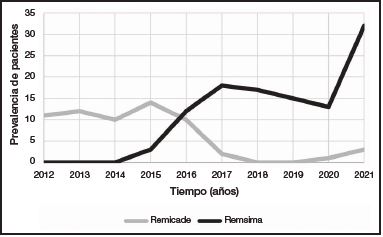
Figura 1. Prevalencia anual de pacientes naive a biológicos diagnosticados de colitis ulcerosa en tratamiento con infliximab.
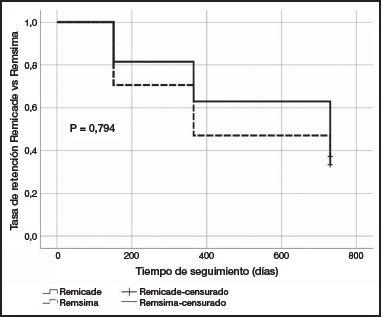
La persistencia al tratamiento para infliximab fue similar para el original y el biosimilar. Remicade® mostró una mediana (± RIQ) de 42,49 ± 57,48 meses (mínimo 6 meses y máximo 63 meses) y Remsima® 27,50 ± 58,50 meses (mínimo 5 meses y máximo 59 meses). El análisis estadístico demuestra la no existencia de diferencias significativas entre ambos tratamientos (p = 0,455) (Tabla 1). La tasa de retención se expresó como porcentaje de pacientes que continuaban con el tratamiento a los 6, 12 y 24 meses. La tasa de retención a los 6 meses fue del 81% (22/27) para Remicade® frente al 71% (36/51) para Remsima®, a los 12 meses del 63% (17/27) para Remicade® frente al 47% (24/51) para Remsima®, y a los 24 meses del 33% (9/27) para Remicade® frente al 37% (19/51) para Remsima®. El análisis de la tasa de retención mediante curvas de Kaplan-Meier no mostró diferencias estadísticamente significativas entre ambos tratamientos (p = 0,794) (Figura 2).
Las intensificaciones del tratamiento por disminución del intervalo entre administraciones fueron las siguientes: 9 intensificaciones para el grupo de pacientes tratados con Remicade® (1 paciente con un intervalo de 4 semanas y 8 pacientes con un intervalo de 6 semanas) frente a 11 (4 pacientes con un intervalo de 4 semanas y 7 pacientes con un intervalo de 6 semanas) para el grupo de pacientes tratados con Remsima®. Las intensificaciones por aumento de dosis (> 5 mg/kg) fueron las siguientes: 1 para el grupo de Remicade® frente a 5 para el grupo de Remsima®. Las desintensificaciones del tratamiento por aumento del intervalo entre administraciones fueron las siguientes: 5 desintensificaciones para el grupo de Remicade® (4 pacientes con un intervalo de 10 semanas y 1 paciente con un intervalo de 12 semanas) frente a 7 (5 pacientes con un intervalo de 10 semanas y 2 pacientes con un intervalo de 12 semanas) para el grupo de pacientes tratados con Remsima®. Las desintensificaciones por disminución de dosis (< 5 mg/kg) fueron las siguientes: 2 desintensificaciones para el grupo de pacientes tratados con Remicade® y 5 para el grupo de pacientes tratados con Remsima®.
El coste medio por paciente al año fue de 6.140,44 € para el grupo de pacientes tratados con Remicade® frente a 1.713,29 € para el grupo de pacientes tratados con Remsima®. El ahorro que hubiéramos obtenido en nuestro hospital si los 27 pacientes tratados con Remicade® hubieran sido tratados con Remsima® hubiese sido de 203.648,77€, lo que equivaldría al coste de tratar a 118 nuevos pacientes durante un año (Tabla 1).
Discusión
Como se observa en los resultados, la inclusión de infliximab biosimilar CT-P13 en la Guía Farmacoterapéutica del hospital en el año 2015, debido a su menor coste, ha facilitado el acceso de pacientes con colitis ulcerosa naive a biológicos al tratamiento, con una mayor tasa anual de inicios de tratamiento para Remsima® (Figura 1).
Es importante destacar que en ambas cohortes la edad, sexo y peso no presentaron diferencias significativas. Además, las dos cohortes estudiadas fueron atendidas por los mismos especialistas siguiendo los mismos protocolos de manejo clínico del paciente con colitis ulcerosa naive a biológicos. Por lo tanto, ninguno de estos factores puede considerarse como un sesgo a la hora de comparar los valores de la persistencia, tasa de retención y modificaciones de pauta posológica prescrita presentados en nuestro estudio.
La persistencia al tratamiento para infliximab fue similar para el original y el biosimilar, ya que, a pesar de obtener una mediana mayor en el grupo de pacientes con Remicade®, el análisis de los datos mostró la no existencia de diferencias estadísticamente significativas entre ambos tratamientos. Una posible causa de estas diferencias absolutas podría ser que desde mediados de 2015 no se iniciaron nuevos tratamientos de Remicade®, por lo que este dato de persistencia se podría considerar cercano a su madurez, ya que sólo 3 pacientes seguían en tratamiento en noviembre de 2021. Por el contrario, 32 pacientes continuaban en tratamiento con Remsima® en noviembre de 2021, por lo que si se evaluase la persistencia en el futuro, probablemente se modificaría sustancialmente. Los datos de persistencia presentados en nuestro estudio están en consonancia con otros estudios publicados en la literatura en práctica de la vida real tanto para Remicade®11 como para Remsima®12. Martínez-Lozano et al.13 realizaron un estudio retrospectivo multicéntrico evaluando la persistencia de Remicade® y Remsima® en pacientes con colitis ulcerosa naive a biológicos mostrando una persistencia media similar para ambos grupos de tratamiento incluidos en su estudio. Además, en la semana 14 y 54 ambos grupos alcanzaron un resultado clínico similar con tasas de respuesta y remisión comparables13.
En cuanto a la tasa de retención, la obtenida con Remsima® a los 6 y a los 12 meses fue algo inferior a la de Remicade® pero no presentó diferencias estadísticamente significativas. Asimismo, la tasa de retención a los 24 meses de ambos grupos se igualó, siendo del 33% para Remicade® y del 37% para Remsima®, mostrando un perfil muy similar en el análisis de curvas de Kaplan-Meier (Figura 2). Sin embargo, en otros estudios13 se obtuvieron datos de tasa de retención del 47,5% de los pacientes tratados con Remicade® a los 59 meses y del 76,1% de los pacientes tratados con Remsima® a los 33 meses. Avouac et al.14 realizaron un cambio de infliximab de referencia a infliximab biosimilar en pacientes diagnosticados de enfermedades crónicas inflamatorias. La tasa de retención alcanzó un 85% en la tercera infusión, sin encontrar diferencias clínicas objetivas tras el cambio de tratamiento. Kin et al.15 alcanzaron una tasa de retención en pacientes naive a infliximab biosimilar del 69,7%, 46,0% y 26,7% a 1, 3 y 5 años, respectivamente. Adicionalmente, los pacientes que hicieron un cambio de infliximab de referencia a infliximab biosimilar alcanzaron una tasa de retención del 73,9%, 42,5% y 42,5% a 1, 3 y 5 años, respectivamente. No se encontraron diferencias estadísticamente significativas entre los pacientes que iniciaron terapia biológica con infliximab biosimilar y aquellos que realizaron un cambio.
Las intensificaciones, tanto por disminución del intervalo entre administraciones como por aumento de la dosis estándar, tuvieron una prevalencia del 37% en el grupo de pacientes con Remicade® y del 30% en el grupo de pacientes con Remsima®. Estos resultados son similares a los presentados por Long et al.16 que estudiaron las intensificaciones de dosis de infliximab, siendo del 34,8%. Martínez-Lozano et al.13 publicaron recientemente que el 40% de los pacientes tratados con Remicade® y el 32,6% de los pacientes tratados con Remsima® requirieron una pauta posológica intensificada. Las desintensificaciones tuvieron una prevalencia del 30% en el grupo de pacientes con Remicade® y del 22% en el grupo de pacientes con Remsima®. En este caso, las diferencias pueden deberse al hecho de que un porcentaje superior al 30% de los pacientes del grupo Remsima® está con tratamiento de duración inferior a 1 año. Además, hay que tener en cuenta que para realizar una desintensificación es necesario que el paciente presente remisión clínica durante un periodo de al menos 6 meses17.
En lo que respecta al estudio económico, la terapia con biosimilares representa un gran beneficio potencial al demostrar una misma eficacia clínica en comparación con el de referencia, con un menor impacto monetario13. Teniendo en cuenta a todos los pacientes del estudio, el coste medio por paciente naive al año fue de 6.140,44 € para el grupo de pacientes tratados con Remicade® versus 1.713,29 € para el grupo de pacientes tratados con Remsima®. La llegada de los biosimilares ha propiciado esta disminución de costes de los tratamientos biológicos, reflejando en nuestro estudio un ahorro total de 203.648,77 €. Esta cantidad equivale al coste de tratar hasta 118 nuevos pacientes con infliximab biosimilar durante 1 año y, por tanto, se facilita el acceso de un mayor número de pacientes al tratamiento con un mismo presupuesto. Por otra parte, dado que los datos anteriores reflejan un ahorro sustancial en el tratamiento biológico de la colitis ulcerosa por la utilización de un biosimilar, esta estrategia podría ser aplicada en otras áreas clínicas similares contribuyendo a una mayor eficiencia del sistema18.
En cuanto a las limitaciones del estudio, cabe destacar que: al tratarse de un estudio en vida real no se realizó asignación aleatoria de los tratamientos. En adición, no se midió la eficacia, seguridad, adherencia o satisfacción de los pacientes. En ambas cohortes estudiadas no se ha realizado monitorización farmacocinética para el ajuste posológico de Remicade® ni de Remsima®, únicamente la determinación de anticuerpos neutralizantes. También se debe indicar que los resultados obtenidos pertenecen a un único centro hospitalario, por lo que nuestra intención es realizar este análisis con otros centros con el fin de confirmar los resultados presentados en este estudio.
Como conclusión, puede afirmarse que no existen diferencias significativas en la persistencia, tasa de retención y número de intensificaciones y desintensificaciones entre los pacientes con colitis ulcerosa naive a biológicos que fueron tratados con Remicade® o con Remsima®. Nuestros resultados además, corroboran el ahorro económico que supone la utilización de biosimilares en el tratamiento del paciente con colitis ulcerosa naive a biológicos y el mayor acceso a estos tratamientos al poder tratar más pacientes con un mismo o incluso menor presupuesto.
Los resultados obtenidos permiten ampliar la información disponible acerca de los beneficios de la terapia biológica biosimilar en la colitis ulcerosa. Sin embargo, se necesita un mayor número de estudios multicéntricos que confirmen nuestros resultados para conocer los posibles factores que puedan influir en la persistencia y tasa de retención del infliximab CT-P13.
Aportación a la literatura científica
La llegada de los tratamientos biológicos biosimilares en la colitis ulcerosa ha supuesto una oportunidad para contribuir a un mayor acceso a las terapias biológicas y a una mayor eficiencia del sistema sanitario.
Nuestro artículo puede servir de referencia al demostrar una persistencia y tasa de retención similares entre los pacientes diagnosticados de colitis ulcerosa naive a biológicos que fueron tratados con infliximab original versus infliximab biosimilar. Además de determinar el considerable impacto económico que tiene el empleo de los biosimilares en pacientes con colitis ulcerosa en tratamiento con infliximab.