Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.16 no.7 Madrid oct. 2009
Eficacia analgésica de la asociación duloxetina más pregabalina en el dolor neuropático: experiencia en 60 casos
Analgesic efficacy of the association of duloxetine plus pregabalin in neuropathic pain: experience in 60 patients
L. Cánovas Martínez, I. Gómez Gutiérrez, M. Castro Bande, E. Peralta Espinosa, J.M. Prieto Gutiérrez e I. Segado Jiménez
Servicio de Anestesia, Reanimación y Dolor, Complexo Hospitalario de Ourense, Ourense, España
Dirección para correspondencia
RESUMEN
Objetivo: Duloxetina y pregabalina han demostrado su eficacia por separado, y cuentan con la aprobación de la Food and Drug Administration para el tratamiento de determinados tipos de dolor neuropático. Nuestro objetivo fue valorar si la asociación de ambos puede mejorar su eficacia analgésica y el impacto de esta asociación en la calidad de vida del paciente.
Material y métodos: Se estudiaron 60 pacientes con dolor neuropático severo (escala visual analógica [EVA] > 6) durante un período de 3 meses. Se distribuyeron aleatoriamente en 3 grupos (n = 20): grupo A (duloxetina 30 mg/24 h los primeros 3 días y luego 60 mg/24 h en medio del desayuno, con incrementos progresivos de 30 mg/3 días hasta alivio del dolor); grupo B (pregabalina 75 mg/noche los primeros 3 días, con incrementos de 75 mg/3 días hasta alivio del dolor; pautado/12h), y grupo C (A+B). Las variables estudiadas fueron: edad; sexo; diagnóstico; EVA; componente lancinante, sordo y alodinia (EVA); dosis necesaria para alivio del dolor > 50%; impresión clínica de mejoría del paciente y del sueño (0-3; 0: nula, 1: leve, 2: moderada y 3: importante), y efectos indeseables. Los pacientes fueron evaluados semanalmente el primer mes, cada 15 días el segundo mes y luego mensualmente.
Resultados: No se encontraron diferencias significativas en edad y diagnóstico según el grupo, siendo los diagnósticos más frecuentes: radiculopatía cervical y lumbar (68%), fibrosis poscirugía (17%), estenosis de canal (12%) y neuralgia postherpética (8%). Hubo un predominio del sexo femenino, excepto en el grupo A, con una distribución similar (50% F/M). La reducción del dolor > 50% se produjo con: 96,2 ± 24,1 mg de duloxetina en el 60% de los pacientes del grupo A; 532 ± 63 mg de pregabalina en el 68% de los pacientes del B, y 298,5 ± 56 mg de pregabalina + 65,2 ± 31,1 mg de duloxetina en el 73% de los pacientes del C (p < 0,05). También se consiguió una reducción > 50% del componente lancinante y sordo con esas mismas dosis, no así de la alodinia (< 50%). La mejoría del sueño fue importante en el 71% del grupo C y en el 67% del B, y moderada en el 59% del grupo A. La impresión de mejoría global por parte del paciente se correlacionó con el alivio del dolor.
Conclusiones: La asociación duloxetina-pregabalina mejoró la eficacia analgésica de ambos fármacos, consiguiendo con dosis menores un alivio mayor del dolor en un porcentaje mayor de pacientes, con relación a otros estudios.
Palabras clave: Duloxetina, Pregabalina, Dolor neuropático, Analgesia.
ABSTRACT
Objective: The efficacy of duloxetine and pregabalin has been demonstrated separately and both drugs are approved by the Food and Drug Administration for the treatment of specific types of neuropathic pain. Our objective was to determine whether the association of both drugs improves their analgesic effectiveness and the effect of this association on patients' quality of life.
Material and methods: We studied 60 patients with severe neuropathic pain (visual analog scale [VAS] > 6) over a 3-month period. The patients were randomized to three groups (n = 20): group A (duloxetine 30 mg/24 h the first 3 days followed by 60 mg/24 h at breakfast, with progressive increases of 30 mg every 3 days until pain relief was achieved). Group B (pregabalin 75 mg/night for the first 3 days, with increases of 75 mg every 3 days until pain relief was achieved. Group C (A+B). The variables studied were age, sex, diagnosis, VAS; stabbing pain, dull pain and allodynia (VAS); the dose required for pain relief > 50%, and subjective feeling of overall symptom improvement in patients and their sleep quality (0-3: 0 = none; 1 = mild; 2 = moderate; 3 = excellent). Patients were evaluated weekly in the first month, every 15 days in the second month and then once a month.
Results: No significant differences were found in age or diagnosis among the three groups. The most common diagnoses were cervical and lumbar radiculopathy (68%), fibrosis after lumbar disc surgery (17%), lumbar canal stenosis (12%) and postherpetic neuralgia (8%). There were more women, except in group A, with equal distribution of men and women (50% F/M). Pain relief > 50% was achieved with 96.2 ± 24.1 mg of duloxetine in 60% of patients in group A, 532 ± 63mg of pregabalin in 68% of patients in group B, and 298.5 ± 56 mg of pregabalin plus 65.2 ± 31.1 mg of duloxetine in 73% of patients in group C (p > 0.05). Dull and stabbing pain was also reduced by > 50% with these doses but not allodynia (< 50%). Improvement in sleep quality was excellent in 71% of group C and in 67% of group B and was moderate in 59% of group A. The patients' subjective feeling of overall symptom improvement was correlated with pain relief.
Conclusions: The association of duloxetine and pregabalin improved the analgesic efficacy of both drugs, achieving more effective pain control with lower doses in a greater percentage of patients compared with other studies.
Key words: Duloxetine, Pregabalin, Pain relief, Neuropathic pain.
Introducción
Los antidepresivos y anticonvulsionantes se consideran fármacos de primera línea en el tratamiento del dolor neuropático1,2.
La duloxetina es el primer fármaco antidepresivo que cuenta con la aprobación, tanto en Europa como en Estados Unidos, para el tratamiento del dolor neuropático periférico diabético (DNPD). Es un inhibidor dual de la recaptación de serotonina y noradrenalina, con un efecto balanceado sobre estos neurotransmisores3,4. La eficacia de duloxetina en DNPD se evaluó en 3 ensayos clínicos aleatorizados, doble ciego, controlados con placebo y con una duración de 12 semanas5-7.
La pregabalina es un ligando de la subunidad a-2d de los canales de calcio dependientes del voltaje, con propiedades anticonvulsionantes, analgésicas y ansiolíticas8 y es la primera medicación que se ha aprobado para 2 afecciones de dolor neuropático: DNPD y neuralgia postherpética9,10.
Ambos fármacos, en monoterapia, han demostrado su eficacia en el tratamiento del dolor neuropático. Pero cuando la monoterapia es bien tolerada pero parcialmente efectiva, estaría indicada la combinación de fármacos11.
Nuestro objetivo fue valorar si la asociación de duloxetina y pregabalina mejoró su eficacia analgésica en comparación con los 2 fármacos en monoterapia, y el impacto de esta asociación en otras medidas secundarias, como la impresión de mejoría clínica por parte del paciente y la mejoría en la calidad del sueño.
Material y métodos
Una vez obtenida la aprobación por parte del comité ético del hospital y el consentimiento verbal y escrito de los pacientes del estudio, se incluyeron de forma prospectiva 60 pacientes con diagnóstico de dolor neuropático severo, con una escala visual analógica (EVA) > 6, durante un período de 3 meses. Se distribuyeron aleatoriamente en 3 grupos (A, B y C) (n = 20).
Los pacientes del grupo A recibieron duloxetina 30 mg/ día los primeros 3 días y luego 60 mg/día en medio del desayuno. Si la dosis analgésica resultaba insuficiente, se realizaron incrementos progresivos de 30 mg cada 3 días hasta conseguir alivio del dolor.
Los pacientes del grupo B recibieron pregabalina 75 mg por la noche los primeros 3 días, con incrementos de 75 mg cada 3 días hasta alivio del dolor, en una pauta de 2 dosis al día (cada 12 h).
Los pacientes del grupo C recibieron una combinación de ambos fármacos con la misma posología descrita para los grupos A y B.
Las variables estudiadas fueron: edad; sexo; diagnóstico; eficacia analgésica (medida por la EVA), al mes (V1), a los 2 meses (V2) y a los 3 meses (V3), considerando un alivio significativo del dolor la disminución > 50% en la puntuación de la EVA; el grado de alivio del componente lancinante, sordo y alodinia (medido por la EVA) al final del estudio (V3); dosis de fármaco necesaria para conseguir un alivio del dolor > 50% en cada uno de los grupos. También se valoraron otras medidas secundarias, como la impresión clínica de mejoría por parte del propio paciente, mediante una escala de 4 puntos (que van desde nula mejoría a importante mejoría) y la mejoría en la calidad del sueño medida con una escala de 0 a 3 (0 nula, 1 leve, 2 moderada, 3 importante). Por último, se valoró la incidencia de efectos indeseables.
Los pacientes fueron evaluados desde la visita basal (V0): semanalmente el primer mes (V1), cada 15 días el segundo mes (V2) y luego mensualmente. Al final del V3 se realizó la evaluación final del estudio y la obtención de resultados.
El estudio estadístico se realizó con SPSS 14.0. Se utilizó la t de Student para la comparación de medias. Se trabajó con una fiabilidad del 95% (p < 0,05%).
Resultados
No se encontraron diferencias significativas en edad y diagnóstico según el grupo. Los diagnósticos más frecuentes fueron: radiculopatía cervical y lumbar (68%), fibrosis poscirugía (17%), estenosis de canal (12%) y neuralgia postherpética (8%). Hubo un predominio del sexo femenino, excepto en el grupo A, con una distribución similar (el 50% pertenecía al sexo femenino y el 50% al masculino) (tabla 1).
El grado de alivio del dolor en los 3 grupos fue significativo en las sucesivas visitas. En la V3, de evaluación final, no se encontraron diferencias significativas en el grado de alivio del dolor entre los grupos (tabla 2).
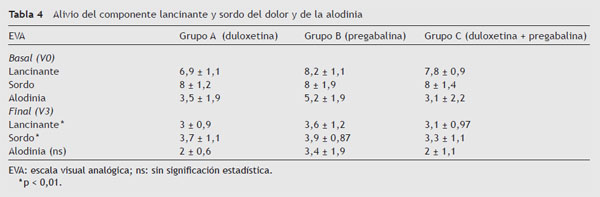
Una reducción del dolor > 50% se produjo con 96,2 ± 24,1 mg de duloxetina en el 60% de los pacientes del grupo A y 532 ± 63 mg de pregabalina en el 68% de los pacientes del B. En el 73% de los pacientes del grupo C, las dosis de ambos fármacos necesarias para esta misma reducción del dolor fueron significativamente menores (p < 0,05) a las de los otros 2 grupos (298,5 ± 56 mg de pregabalina + 65,2 ± 31,1 mg de duloxetina) (tabla 3).
A las dosis descritas, también se consiguió una reducción > 50% del componente lancinante y sordo, no así de la alodinia (< 50%) (tabla 4; fig. 1).

Figura 1 Reducción del componente lancinante, sordo y alodinia (alivio > 50% del componente
lancinante y sordo a las dosis expuestas en la tabla 3, pero no de la alodinia).
La mejoría del sueño fue importante en el 71% del grupo C y el 67% del B, y moderada en el 59% del grupo A. La impresión de mejoría global por parte del paciente fue significativamente superior en el grupo C (p < 0,05) con relación a los otros grupos (tabla 5). Los efectos indeseables en el grupo C fueron menores a los de A y B, pero sin diferencias significativas. Los más frecuentes fueron mareo y náuseas, de intensidad leve-moderada, que no ocasionaron la retirada de pacientes del estudio. Dos pacientes del grupo B precisaron titulaciones más lentas.
Discusión
Antidepresivos y anticonvulsionantes son coadyuvantes analgésicos frecuentemente utilizados en cuadros de dolor crónico severo, especialmente de carácter neuropático. En los últimos años, la elección de un fármaco de primera línea se ha basado en la relación eficacia analgésica y sus potenciales efectos adversos12.
Estudios publicados con duloxetina en el tratamiento del DNPD demuestran un alivio significativo del dolor en el 50% de pacientes con dosis de 60 a 120mg7. A estas mismas dosis, duloxetina procuró una mejoría significativa de parámetros como el sueño e impresión global de mejoría del paciente respecto al placebo. La dosis de 120 mg fue ligeramente más eficaz que la de 60 mg, pero esta diferencia no tuvo significación estadística5,6,13. Estos resultados son similares a los de nuestro estudio para el grupo de pacientes que recibió sólo duloxetina.
Pregabalina, a dosis de 300 a 600 mg/día, originó una reducción del dolor del 50% en aproximadamente un 60% de pacientes con dolor neuropático: neuralgia postherpética10, DNPD14,15 o en ambos cuadros dolorosos indistintamente16. Con dosis menores de 300 mg/día los resultados fueron contradictorios; en unos, el 26% de los pacientes obtuvieron una reducción del 50%17 mientras que en otros estudios no hubo diferencias respecto a placebo18. Los resultados publicados acerca de la mejoría del sueño y la impresión de cambio por parte del paciente mejoraron con dosis de 300 a 600 mg, por debajo de éstas se obtuvieron resultados contradictorios19. En nuestro estudio, los pacientes tratados con pregabalina consiguieron alivio del dolor, mejoría del sueño e impresión de mejoría global en intensidad y porcentajes similares a los publicados en la bibliografía mundial.
La asociación antidepresivo-anticonvulsionante se utiliza con frecuencia en el tratamiento del dolor neuropático porque muchos pacientes experimentan una respuesta parcial a un único fármaco20,21. En nuestro estudio, la asociación duloxetina-pregabalina permitió un alivio eficaz del dolor en un porcentaje elevado de pacientes, con dosis significativamente inferiores a las utilizadas en los grupos de tratamiento con duloxetina o pregabalina solas y a las publicadas en otros estudios7,16. La mejoría del sueño y la impresión de mejoría global por parte del paciente fueron también superiores en el grupo duloxetina-pregabalina, en parte debido a la reducción de efectos indeseables consecuentes de la reducción de dosis, pues parece haber un efecto relacionado con la dosis.
Pregabalina tiene una favorable farmacocinética, no tiene interacciones medicamentosas, ni se metaboliza, por lo que se convierte en una elección razonable y fácil de usar en terapia coadyuvante con otros fármacos, como en este caso duloxetina. Dicha asociación en este estudio mejoró los resultados de eficacia analgésica, sueño y mejoría global del paciente, por lo que la consideramos una opción válida para el tratamiento del dolor neuropático
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Namaka M, Gramlich C, Ruhlen D, Melanson M, Sutton I, Major J. A treatment algorithm for neurophatic pain. Clinical Therapeutics. 2004;26:951-79. [ Links ]
2. Finnerup NB. A review of central neuropathic pain states. Curr Opin Anesthesiol. 2008;21:586-9. [ Links ]
3. Bymaster FP, Dreshfield-Ahmad LJ, Threlkeld PG, Shaw JL, Thompson L, Nelson DL, et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors. Neuropsychopharmacology. 2001;25:871-80. [ Links ]
4. Wong DT, Bymaster FP. Dual serotonin and noradrenaline uptake inhibitor class of antidepressants potential for greater efficacy or just hype? Prog Drug Res. 2002;58:169-222. [ Links ]
5. Wernicke JF, Lu Y, D´Souza DN, Waninger A, Tran P. Duloxetine at doses of 60 mg QD and 60 mg BID is an effective treatment of diabetic neuropathic pain. Neurology. 2006;67:1411-20. [ Links ]
6. Raskin J, Pritchett YL, Wang F, D´Souza DN, Waninger AL, Iyengar S, et al. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med. 2005;6:346-56. [ Links ]
7. Pritchett Y, Mc Carberg B, Watkin J, Robinson M. Duloxetine for the manegement of diabetic peripheral neurophatic pain: response profile. Pain Med. 2007;8:397-409. [ Links ]
8. Sills GJ. The mechanisms of action of gabapentin and pregabalin. Curr Opin Pharmacol. 2006;6:108-13. [ Links ]
9. Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripherals neuropathy: a double blind, placebo controlled trial. Pain. 2004;110:628-38. [ Links ]
10. Dworkin RH, Corbin AE, Young JP Jr, Sharma U, LaMoreaux L, Bockbrader H, et al. Pregabalin for the treatment of postherpetic neuralgia: a randomized, placebo-controlled trial. Neurology. 2003;60:1274-83. [ Links ]
11. Dworkin RH, Backonja M, Rowbottham MC, Allen RR, Argoff CR, Bennett GJ, et al. Advances in neurophatic pain: diagnosis, mechanisms, and treatment recommendations. Arch Neurol. 2003; 60:1524-34. [ Links ]
12. Iseki M. Indication and use of adjuvant analgesics on chronic pain. Masui. 2008;57:1359-70. [ Links ]
13. Goldstein DJ, Lu Y, Detke MJ, Lee TC, Iyengar S. Duloxetine vs placebo in patients with painful diabetic neuropathy. Pain. 2005;116:109-18. [ Links ]
14. Rowbotham MC. Mechanisms of neuropathic pain and their implications for the design of clinical trials. Neurology. 2005;65 Suppl 4:S66-73. [ Links ]
15. Lesser H, Sharma U, LaMoreaux L, Poole RM. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized, controlled trial. Neurology. 2004;63:2104-10. [ Links ]
16. Freynhagen R, Strojek K, Griesing T. Efficacy of pregabalin in neuropathic pain evaluated in a 12 week, randomised, doubleblind, multicentre, placebo-controlled trial of flexible-and fxed-dose regimens. Pain. 2005;115:254-63. [ Links ]
17. Van Seventer R, Feister HA, Young JP Jr, Stoker M, Versavel M, Rigaudy L. Efficacy and tolerability of twice-daily pregabalin for treating pain and related sleep interference in postherpetic neuralgia: a 13-week, randomized trial. Curr Med Res Opin. 2006;22:375-84. [ Links ]
18. Richter RW, Portenoy R, Sharma U, Lamoreaux L, Bockbrader H, Knapp LE. Relief of painful diabetic peripherals neuropathy with pregabalin: a randomized placebo-controlled trial. J Pain. 2005;6:253-60. [ Links ]
19. Frampton JE, Foster RH. Pregabalin: in the treatment of postherpetic neuralgia. Drugs. 2005;65:111-8. [ Links ]
20. Stacey BR. Management of peripheral neuropathic pain. Am J Phys Med Rehabil. 2005;84 Suppl:S4-16. [ Links ]
21. Gallagher RM. Management of neuropathic pain: translating mechanistic advances and evidence-based research into clinical practice. Clin J Pain. 2006;22 Suppl:S2-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: lcanovas@mj.e.telefonica.net
(L. Cánovas Martínez).
Recibido: 6 de febrero de 2009
Aceptado: 25 de abril de 2009