Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.23 no.4 Madrid jul./ago. 2016
https://dx.doi.org/10.20986/resed.2016.3420/2016
Reflexiones sobre la neurotoxicidad inducida por opioides en el contexto de una anestesia general en población pediátrica
Opioid related neurotoxicity on pediatric population after general anestesia
P. Mesa Suárez, M. V. Ramos Ramos1, J. D. Santotoribio Camacho2, J. Estudillo Lobato y A. Muñoz Hoyos3
Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital Universitario de Puerto Real. Cádiz.
1 Servicio de Pediatría. Hospital Universitario de Jerez de la Frontera. Cádiz.
2 Departamento de Bioquímica. Hospital Universitario de Puerto Real. Cádiz.
3 Servicio de Pediatría. Hospital San Cecilio. Granada
Dirección para correspondencia
RESUMEN
Introducción: Desde el año 2000 vienen apareciendo en distintas publicaciones científicas los resultados de numerosos estudios experimentales realizados en animales, evaluando el impacto neurotóxico que sobre sus cerebros tenía la exposición a combinaciones de anestésicos de uso habitual. Se constata que la exposición en periodo de máxima sinaptogénesis conlleva una apoptosis neural diseminada. Comienzan entonces a preocuparse los anestesiólogos que trabajan con niños, pues quizás ese daño neuronal también pudiera acontecer a la población pediátrica. Así, son varios los estudios que están en marcha desde hace años valorando el desarrollo neurocognitivo de cohortes de niños que se sometieron a anestesias generales en edades tempranas de sus vidas.
En este sentido, la necesidad de medir un daño cerebral agudo nos anima a utilizar marcadores que han demostrado su asociación con dicho deterioro cerebral en diferentes situaciones clínicas como la hipoxia perinatal, la parada cardiorrespiratoria o el traumatismo craneoencefálico.
Objetivos: Planteamos este trabajo con el objetivo de determinar si la proteína S100B podría comportarse como un biomarcador de daño cerebral agudo postanestésico y si pudiéramos establecer asociación entre la elevación de este marcador en sangre y alguno de los fármacos anestésicos utilizados habitualmente.
Metodología: Determinación sanguínea de la proteína S100B en 76 pacientes pediátricos intervenidos de hipertrofia amigdalar bajo anestesia general, antes y después de la cirugía.
Conclusión: Tras analizar los resultados podemos concluir que existe una elevación estadísticamente significativa entre los niveles de proteína S100B antes y después de la exposición anestésica. En segundo lugar, podemos establecer una correlación positiva, también con significación estadística, entre el fentanilo administrado y la elevación de dicha proteína al final del acto anestésico.
Palabras clave: Neurotoxicidad, neuroapotosis, proteína S100B, anestesia general, fentanilo.
ABSTRACT
Introduction: In the last decade many scietific publications bring out the results of experimental studies about the neurotoxic impact of an anesthetic expossure in animal's brain. It is confirm that when this expossure occurs in a maximum synaptogenesis period of the animal's live a widespread neuroapoptosis befall. From there on all the pediatrics anesthesiologist warried about if this damage could also affect the pediatric population. Nowadays there are several observational studies exploring the neurobehavioral conduct of many children who underwent general anesthesia early in their lives.
Objetive: As a results of this we propose to use actual neuronal damage biomarkes, wich have demonstrated association between brain damage and perinatal hypoxia, or cardiac arrest or mild brain injury.
When we planned this essay we intend to determine if S100B protein could work as an accute postanesthetic expossure neuronal damage biomarker, and if there would be any relationship between the biomarker elevation and any of the drugs commonly use for anesthesia.
Metodology: In order to determinate the S100B protein serum level is, we obtained a blood sample before and after general anaesthesia expousure in 76 paediatric patient undergoing amigdalar hypertropy surgery.
Conclusions: Once we analized our results we can coclude that an elevation of the blood levels of S100B protein occurs after anesthesia. We have also found a possitive correlation between the total amount of fentanyl administred and the higher level of this protein concentration at the end of the anesthetic expossure.
Key words: Neurotoxicity, neuroapoptosis, S100B protein, general anestesia, fentanyl.
Introducción
La morfina, la meperidina, el fentanilo, el sufentanilo, el alfentanilo y el remifentanilo son los opioides más usados en la anestesia general. Su efecto principal es la analgesia, que consiguen mediante la interacción con receptores opioides específicos del cerebro y de la médula espinal. El sistema opioide endógeno incluye las endorfinas, encefalinas y dinorfinas, péptidos endógenos que interaccionan con los receptores opioides, (μ, κ, δ) con diferentes grados de afinidad. Esta interacción da lugar a un mecanismo inhibitorio que modula de forma fisiológica las transmisiones nociceptivas. Estos receptores son el lugar de acción de los opioides que usamos y la activación de los mismos origina una serie de efectos en distintos sistemas.
A nivel del SNC producen sedación y analgesia de forma dosis-dependiente y con frecuencia euforia. Disminuyen el flujo sanguíneo cerebral y el índice metabólico. A nivel cardiovascular ofrecen buena estabilidad hemodinámica, convirtiéndolos en analgésicos de elección frente a pacientes críticos o con compromiso hemodinámico, pudiendo ser responsables de una bradicardia dependiente de la dosis, sin afectar la contractilidad cardiaca, y con poca afectación de las cifras tensionales. Causan depresión respiratoria dosis-dependiente, además de miosis, aumento de las secreciones y disminución de la motilidad del tracto gastrointestinal. Pueden producir también rigidez muscular relacionada con la potencia y la dosis del opioide usado. En cuando a la sedación y a la depresión respiratoria, su efecto es sinérgico con el uso de hipnóticos.
El fentanilo es un opioide sintético que se utiliza ampliamente en anestesia para brindar analgesia al paciente. Por sus características farmacocinéticas: su gran liposolubilidad le confiere un inicio de acción de 2-5 minutos, su vida media es de unas 3-4 horas y su potencia es de unas 100 veces la de la morfina. Estas características farmacocinéticas lo convierten en ideal para su uso en el intraoperatorio. En algunas ocasiones se asocia al midazolam en el preoperatorio inmediato para reforzar la ansiolisis o incluso para conseguir un nivel de sedación consciente antes de la anestesia general. Las dosis que habitualmente utilizamos para complementar la anestesia es de 1-3 microgramos (µg) por cada kg de peso del paciente. Como la gran mayoría de los opioides, su acción ocurre al unirse a los receptores µ repartidos en el SNC y en la médula espinal (asta posterior). Al producirse esta unión en las neuronas nociceptoras ocurre una modificación en la conductancia de los canales de potasio y calcio de estas neuronas y se inhibe la activación a los neurotransmisores excitatorios, como la acetilcolina y la sustancia P. Como efectos secundarios podemos encontrar naúseas y vómitos, íleo paralítico, bradicardia y depresión respiratoria. No son fármacos que depriman la contractilidad miocárdica y si causan hipotensión, ésta es leve. Entre otros efectos adversos tenemos la sudoración profusa, la euforia y la temible adicción.
Desde principios del año 2000, aparecen en la literatura médica los resultados de numerosos estudios experimentales llevados a cabo en animales en desarrollo (ratones, monos y cerdos) mencionando la aparición de un posible efecto neurotóxico en el cerebro tras haberse sometido a anestesia general (1-3). Los fármacos estudiados incluyen todos aquellos con los que estamos familiarizados, hipnóticos, ansiolíticos, agentes volátiles y, cómo no, los opioides (4-6). Estas evidencias han hecho que, en la última década, los anestesiólogos pediátricos estén preocupados en elaborar planes anestésicos menos tóxicos. A esto hay que añadir que, a partir de este año 2015, comenzarán a publicarse los resultados preliminares de trabajos realizados en población pediátrica, valorando su desarrollo neurocognitivo años después de haberse sometido a uno o varios episodios de anestesia general.
En el año 1965, el bioquímico Blake W. Moore, del departamento de psiquiatría de la escuela de medicina de la Universidad de Washington, identificó una familia de proteínas que, al ser solubles al 100 % en sulfato de amonio, denominó proteínas S100. Una de ellas, la proteína S100B, se encuentra fundamental pero no exclusivamente, bien en el citoplasma o como proteína de membrana en astrocitos, oligodendrocitos, ependimomiocitos y otras células del sistema nervioso. La proteína S100B tiene un papel fundamental en el buen desarrollo del SNC. Así, promueve la comunicación entre células, la proliferación y la diferenciación, la dinámica del citoesqueleto de las células y sus cambios de morfología. En resumen, se trata de un factor trófico en condiciones normales. Las cifras de concentración plasmática en esta situación es del orden de ng/l. Cuando una noxa activa al sistema defensivo de la microglia, se produce una sobreexpresión de esta proteína que pasa a alcanzar cifras del orden de µg/l y de localización fundamentalmente extracelular (7,8). El aumento de concentración puede ser secundario a la lesión directa de los astrocitos, o bien a la secreción por parte de estos en respuesta a dicha agresión. Nuestra proteína pasa de ser un agente neurotrófico a comportarse como una sustancia proinflamatoria que conduce a la disfunción neuronal. Así, la proteína S100B, por su origen glial, es considerada como un marcador indirecto de daño neuronal.
Se ha establecido su utilización en la valoración del recién nacido que nace en el contexto de una asfixia perinatal para valorar el grado de encefalopatía hipóxica-isquémica que sufre, y la posibilidad de beneficiarse de terapia de hipotermia sistémica (9). También se ha introducido en el algoritmo de manejo clínico del traumatismo craneoencefálico leve o moderado en el sentido de orientar al equipo médico de urgencias hacia la realización de una tomografía axial computarizada o, por el contrario, mantener al paciente en observación sin necesidad de pruebas complementarias en ese momento (10,11). Un tercer ejemplo es su correlación con el pronóstico en cuanto a supervivencia o mortalidad en pacientes que consiguen superar una parada cardiorespiratoria después de una resucitación avanzada (12,13).
Objetivo
Empleando la determinación de la proteína S100B en sangre, queremos valorar su utilidad como biomarcador de daño agudo tras una exposición anestésica, y relacionarla con la dosis de fentanilo administrado a pacientes pediátricos.
Material y Métodos
Para lograr nuestros objetivos, diseñamos un estudio cuasiexperimental tipo antes/después. Tras la autorización por parte de la comisión de investigación y ética del hospital, se recogió el consentimiento informado por escrito de los padres. Se seleccionaron pacientes pediátricos propuestos para ser intervenidos de hipertrofia amigadalar y vegetaciones adenenoideas.
Se establecieron unos criterios de exclusión: enfermedades neurológicas, antecedentes de prematuridad, cirugía urgente, discrasias sanguíneas o alteraciones en las funciones hepática o renal, tumores de partes blandas y cartílagos o traumatismos extensos en un periodo de 3 meses antes de la intervención.
El día de la visita preanestésica se extrajo una muestra de sangre venosa periférica en un tubo de suero con gel separador (Vacuette®). Ésta fue la muestra basal. La segunda muestra sanguínea, denominada postexposición, se obtuvo al finalizar la intervención quirúrgica, con el paciente aún en quirófano durante la educción anestésica.
Las muestras sanguíneas basal y postexposición de cada paciente se centrifugaron durante 4 minutos a 4.000 revoluciones por minuto para obtener suero. Se determinó en suero de ambas muestras la concentración de la proteína S100B mediante inmunoensayo de electroquimioluminiscencia (ECLIA) en el autoanalizador MODULAR E-170 (Roche Diagnostics®), con valores de referencia para la normalidad entre 0 y 105 picogramos por mililitro (pg/ml). Los datos obtenidos se procesaron mediante los programas estadísticos SPSS® y MEDCALC®, siendo considerada significación estadística una p < 0,05.
Resultados
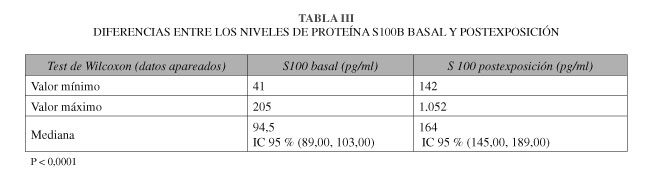
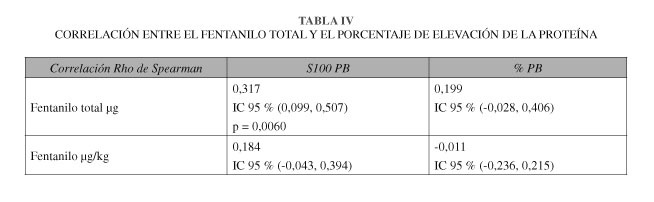
El tamaño muestral fue de 76 pacientes pediátricos (hasta 15 años) con 46 varones y 30 hembras. Los resultados de la estadística descriptiva se expresan a modo de tablas para una visión más sencilla (Tablas I y II). Debido a las características de nuestra muestra, a lo revisado en la bibliografía y tras la aplicación del test D-Agostino, se realizaron pruebas de estadística no paramétrica encontrándose correlación (test de Wilcoxon para datos apareados) entre la proteína S100B basal y postexposicón (p < 0,0001) (Tabla III). En el caso del fentanilo, se encontró una correlación estadísticamente significativa (correlación de Rho de Spearman positiva de 0,317) entre la dosis total administrada y el porcentaje de elevación de la proteína S100B (% PB) (Tabla IV).
Discusión
En los últimos congresos de la sección pediátrica de la Sociedad Española de Anestesiología (SEDAR) (2014 San Sebastián, 2012 Málaga), y de la Asociación Andaluza Extremeña de Anestesiología (AAEAR) (2014 Cádiz), se abordó el tema de la neurotoxicidad inducida por la exposición anestésica en niños. En ellas se revisó la evidencia científica de la que disponemos hasta ahora y se lanzó el reto de trabajar en líneas concretas de investigación y de mantener una actitud activa frente a los nuevos resultados que pudieran ir surgiendo. Con nuestro trabajo aportamos evidencia de cómo una proteína que indica daño neuronal se eleva de manera significativa tras la exposición a una anestesia general y, además, añadimos el dato de que existe una correlación significativa estadísticamente entre esta elevación y el fentanilo utilizado. Uniendo estos resultados con los puntos clave de muchos artículos revisados en la bibliografía, me atrevería a reflexionar, a modo de conclusión, sobre algunos aspectos. Primero, debemos estar absolutamente familiarizados con las dosis correctas de fentanilo para la población pediátrica en sus distintas vías de administración para evitar sobredosificaciones. Segundo, debemos explorar la posibilidad de reducir dichas dosis aplicando estrategias de analgesia preventiva con otro tipo de fármacos (paracetamol, metamizol y otros antinflamatorios) (14-16). En tercer lugar, y debido a la existencia de otros opiáceos sintéticos en la práctica clínica, invito a realizar estudios similares a éste en busca de más evidencias. Quizás el potencial neurotóxico varíe de unos opioides a otros (17). Por último, y también como línea de investigación, creo oportuno estudiar los efectos neuroprotectores de diferentes fármacos que pudieran introducirse en nuestra rutina anestésica (18,19).
Bibliografía
1. Mellon RD, Simone AF, Rappaport BA. Use of anesthetic agents in neonates and young children. Anesth Analg 2007;104(3):509-20. DOI: 10.1213/01.ane.0000255729.96438.b0. [ Links ]
2. Jevtovic-Todorovic V, Hartman RE, Izumi Y, Benshoff ND, Dikranian K, Zorumski CF, et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits. J Neurosci 2003;23(3):876-82. DOI: 10.1097/00008506-200307000-00029. [ Links ]
3. Soriano SG, Anand KJ. Anesthetics and brain toxicity. Curr Opin Anaesthesiol 2005;18(3):293-7. DOI: 10.1097/01.aco.0000169238.36927.c2. [ Links ]
4. Abut YC, Turkmen AZ, Midi A, Eren B, Yener N, Nurten A. Neurotoxic effects of levobupivacaine and fentanyl on rat spinal cord. Rev Bras Anestesiol 2015;65(1):27-33. DOI: 10.1016/j.bjan.2013.07.005. [ Links ]
5. Lai HC, Hu MH, Liaw WJ, Lu CH, Huang GS. Atypical involuntary movements following fentanyl anesthesia. J Clin Anesth 2013;25(1):58-61. DOI: 10.1016/j.jclinane.2012.06.007. [ Links ]
6. Fukushima S, Takenami T, Yagishita S, Nara Y, Hoka S, Okamoto H. Neurotoxicity of intrathecally administered fentanyl in a rat spinal model. Pain Med 2011;12(5):717-25. DOI: 10.1111/j.1526-4637.2011.01084.x. [ Links ]
7. Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw GS. Calcium-dependent and - independent interactions of the S100 protein family. Biochem J 2006;396:201-14. DOI: 10.1042/BJ20060195. [ Links ]
8. Donato R. Intracellular and extracellular roles of S100 proteins. Microsc Res Tech 2003;6:540-51. DOI: 10.1002/jemt.10296. [ Links ]
9. Serpero LD, Pluchinotta F, Gazzolo D. The clinical and diagnostic utility of S100B in preterm newborns. Clin Chim Acta 2015;444:193-8. DOI: 10.1016/j.cca.2015.02.028. [ Links ]
10. Aridas JD, Yawno T, Sutherland AE, Nitsos I, Ditchfield M, Wong FY, et al. Detecting brain injury in neonatal hypoxic ischemic encephalopathy: Closing the gap between experimental and clinical research. Exp Neurol 2014;261:281-90. DOI: 10.1016/j.expneurol.2014.07.009. [ Links ]
11. Heidari K, Vafaee A, Rastekenari AM, Taghizadeh M, Shad EG, Eley R, et al. S100B protein as a screening tool for computed tomography findings after mild traumatic brain injury: Systematic review and meta-analysis. Brain Inj 2015;11:1-12. DOI: 10.3109/02699052.2015.1037349. [ Links ]
12. Di Battista AP, Buonora JE, Rhind SG, Hutchison MG, Baker AJ, Rizoli S. blood biomarkers in moderate-to-severe traumatic brain injury: potential utility of a multi-marker approach in characterizing outcome. Front Neurol 2015;26;6:110. DOI: 10.3389/fneur.2015.00110. [ Links ]
13. Larsson IM, Wallin E, Kristofferzon ML, Niessner M, Zetterberg H, Rubertsson S. Post-cardiac arrest serum levels of glial fibrillary acidic protein for predicting neurological outcome. Resuscitation 2014;85(12):1654-6. DOI: 10.1016/j.resuscitation.2014.09.007. [ Links ]
14. Liu S, Zhang Y, Zhao Y, Cui H, Cao C, Guo J. Effects of hypothermia on S100B and glial fibrillary acidic protein in asphyxia rats after cardiopulmonary resuscitation. Cell Bioche Biophys 2015;71(1):401-6. DOI: 10.1007/s12013-014-0212-1. [ Links ]
15. Abback PS, Ben Sallah T, Hilly J, Skhiri A, Silins V, Brasher C, et al. Opioid-sparing effect of ketamine during tonsillectomy in children. Ann Fr Anesth Reanim 2013;32(6):387-91. DOI: 10.1016/j.annfar.2013.02.026. [ Links ]
16. Vons KM, Bijker JB, Verwijs EW, Majoor MH, de Graaff JC. Postoperative pain during the first week after adenoidectomy and guillotine adenotonsillectomy in children. Paediatr Anaesth 2014;24(5):476-82. DOI: 10.1111/pan.12383. [ Links ]
17. Bartkowska-niatkowska A, Bienert A, Wiczling P, Rosada-Kurasi ska J, Zieli ska M, Warzybok J, et al. Pharmacokinetics of sufentanil during long-term infusion in critically ill pediatric patients. J Clin Pharmacol 2015;56(1):109-5. doi: 10.1002/jcph.577. DOI: 10.1002/jcph.577. [ Links ]
18. Yang ZJ, Wang YW, Li CL, Ma LQ, Zhao X. Pre-treatment with a Xingnaojing preparation ameliorates sevoflurane-induced neuroapoptosis in the infant rat striatum. Mol Med Rep 2015;11(3):1615-22. [ Links ]
19. Duan X, Li Y, Zhou C, Huang L, Dong Z. Dexmedetomidine provides neuroprotection: Impact on ketamine-induced neuroapoptosis in the developing rat brain. Acta Anaesthesiol Scand 2014;58(9):1121-6. DOI: 10.1111/aas.12356. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pablo Mesa Suárez
mesa.pms@gmail.com
Recibido: 05-08-15.
Aceptado: 20-10-15.