Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Gerokomos
versión impresa ISSN 1134-928X
Gerokomos vol.21 no.1 Barcelona mar. 2010
COMUNICACIONES
Evolución del peso seco en pacientes ancianos en hemodiálisis y posible influencia de la actividad física en el mismo
Evolution of the dry weight in elderly patients in hemodialysis and the possible influence of the physical activity in the same one
Pilar Peña Amaro1; Juan García López2; Rosel Jimeno Ucles3
1Doctora. Licenciada en Enfermería y en Antropología Social y Cultural. Diplomada en Enfermería. Profesora titular. Universidad de Jaén.
2Diplomado en Enfermería. Especialista en Enfermería Médico Quirúrgica y en Salud Mental. Unidad de Nefrología. Hospital Médico Quirúrgico Ciudad de Jaén.
3Diplomada en Enfermería. Máster en Nefrología y en Gerontología. Experta en Dependencia. Geriátrico Edades. Los Villares, Jaén.
Dirección para correspondencia
RESUMEN
El objetivo de este trabajo es analizar la evolución del "peso seco" -masa muscular, masa grasa y agua- en una población de pacientes ancianos afectados por insuficiencia renal crónica terminal (IRCT) en un programa sustitutivo de la función renal en Hemodiálisis (HD), que realizan una actividad física moderada y constante comparada con otra población que no la realiza. La actividad física se ha utilizado como un medio para conservar o mejorar la salud de todos los individuos desde hace muchos años y, por supuesto, en los ancianos también. Es muy valorado en algunas patologías (hipertensión arterial, cardiopatías isquémicas, osteoporosis, diabetes y problemas psicológicos/psiquiátricos). Hemos usado para monitorizar estos parámetros un analizador de masa corporal por Bioimpedancia (BIA) que nos aporta los datos objetivos en cuanto a la composición del cuerpo de un anciano. Así, podremos observar los posibles cambios producidos por el ejercicio.
Palabras clave: Ancianos, hemodiálisis, ejercicio físico, peso seco, bioimpedancia.
SUMMARY
The aim of this work is to analyze the evolution of the dry weight, muscular mass, mass fat and water in a population of patients ancients affected by Renal Insufficiency Terminal Chronicle (IRCT) in program of haemodialysis (HD) that perform a constant and moderate physical activity and other population that not making it. Physical activity has been used as a way to preserve or improve the health of all individuals for many years and certainly in the ancient as well. Very valued in some pathologies (arterial hypertension, cardiopathies isquémicas, osteoporosis, diabetes and psychiatric psychological/problems). to monitorice these parameters we used body mass analyzer Bioimpedance (BIA) that shows us objective data regarding the composition of the body of an elder. Then we can observe the possible changes produced by exercise.
Key words: Ancient, haemodialysis, physical exercise, dry weight, bioimpedance.
Introducción
Se ha comprobado científicamente la efectividad del ejercicio físico en determinadas patologías (1) como, por ejemplo, la hipertensión arterial (2), las cardiopatías isquémicas (3), la osteoporosis (4), la diabetes no insulino dependiente (5) y en alteraciones psicológicas y psiquiátricas (ansiedad, depresión) (6).
En otras patologías todavía no está tan claro el papel que puede desempeñar la actividad física (distrofias musculares, fibromialgias (7), enfermedad pulmonar crónica (EPOC) obstructiva (8), fibrosis quística (9), cáncer (10), Parkinson (11), epilepsias (12), Alzheimer (13), aunque sí hay estudios sobre ello.
En pacientes con IRCT y en tratamiento sustitutivo con HD, hemos encontrado algunos estudios que relacionan el ejercicio físico con la calidad de vida (14, 15), la administración de eritropoyetina (16-18), con la obesidad, la diabetes (19), la cinética de la hemoglobina (20) y, sobre todo, con datos nutricionales (21). Pero todos ellos se han tenido que basar en parámetros bioquímicos (analíticas de laboratorio) o subjetivos del paciente y la percepción que tienen de su calidad de vida.
Nuestra aportación a este tema se debe a que no sólo contemplamos los aspectos bioquímicos sino que, además, utilizamos un analizador de masa corporal por bioimpedancia (BIA) que nos va a aportar una serie de datos objetivos sobre la distribución y composición corporal de estos pacientes, aportándonos parámetros tales como materia grasa, masa muscular o líquidos, tan importantes en las personas mayores en las que no sólo no hay una estabilidad hemodinámica sino que, además, tienen grandes y bruscas variaciones de la misma como consecuencia de su tratamiento.
Quizá fuese pertinente recordar los principios en los que se basa la bioimpedancia y el analizador corporal que usamos.
La BIA (22) es una técnica que permite analizar la composición corporal del adulto sano con una hidratación normal y constante.
El método de medida (impedancia) se basa en la inyección de una corriente eléctrica alterna de una intensidad muy pequeña, muy por debajo de los umbrales de percepción en el cuerpo humano o en el tejido a medir. Esta corriente produce una tensión eléctrica que es tanto mayor cuanto mayor sea la impedancia eléctrica del material a medir. El equipo obtiene el valor de la impedancia del material objeto de medición a partir de las medidas de amplitud de la corriente, de la amplitud de la tensión y del desfase entre tensión y corriente (23, 24).
La impedancia que se obtiene representa la oposición que muestran los materiales (biológicos, en este caso) al paso de una corriente eléctrica alterna que se puede descomponer en dos miembros medibles: la resistencia y la reactancia.
La BIA se basa en el principio de que los tejidos biológicos se comportan como conductores, en mayor o menor medida, de la corriente eléctrica y/o dieléctricos (aislantes), dependiendo de su composición. Las soluciones electrolíticas intra y extracelulares de todos los tejidos blandos (en particular, de los tejidos no grasos) son conductores óptimos, mientras que el hueso no es atravesado tan fácilmente por las corrientes eléctricas y se comporta como un mal conductor (aislante).
En el tejido adiposo, la corriente puede atravesar las soluciones electrolíticas del intersticio y los adipositos. Las gotas lipídicas hidrofóbicas no conducen corriente (23). Por tanto, la BIA sólo puede analizar el compartimento de los tejidos blandos atribuibles a la masa delgada sin hueso y a la masa grasa.
Es corriente encontrar en la bibliografía que términos como masa libre de grasa (FFM), masa delgada (LBM), tejidos blandos y tejidos blandos delgados se usen indistintamente (25, 26).
En cuanto a la técnica en sí, la impedancia medida en la superficie del cuerpo puede ser originada por el paso de corriente alterna a diferentes frecuencias (ya sean éstas únicas o múltiples) y, colocando los electrodos en diferentes regiones cutáneas (posición distal, proximal o segmental), se hace el registro. La técnica estándar que se venía utilizando consistía en una sola frecuencia (monofrecuencia), cuatro electrodos (tetrapolar) y una posición distal (dos electrodos en la mano y dos sobre el pie homolateral). Se conocía el error de medida en la técnica estándar, monofrecuencia con el mismo analizador sobre el mismo sujeto en tiempos diferentes, y se estimaba en un 2%, añadiendo otro 2% en la variabilidad de la posición de los electrodos entre diferentes operadores (23, 24, 27).
El cuerpo humano o sus segmentos se pueden considerar como conductores de forma cilíndrica irregular con una longitud determinable de forma fácil y un área (en su sección transversal) que es bastante más difícil de determinar. En la BIA estándar, se usa la estatura como longitud del cuerpo ya que es más fácil de determinar.
Considerando que el cuerpo es un conductor cilíndrico y sabiendo que la impedancia en el mismo es proporcional a la longitud e inversamente proporcional a la sección transversal (ley de Ohm), en un cuerpo no homogéneo cada tejido contribuirá con sus propiedades dieléctricas (que, claro está, pueden variar según el estado clínico en el que se encuentra el organismo y con un peso relativo que va a depender de su posición y volumen al valor de impedancia medida).
Como hay varios tipos de analizadores corporales y, en general, no se conocía demasiado bien la variabilidad que había entre ellos en cuanto a los valores que se obtenían, se comprobó que no existe una reglamentación entre los fabricantes de los mismos, por lo que los sistemas eran heterogéneos y no todo lo fiables que cabría esperar. Los nuevos sistemas de medición de la BIA han minimizado el error y resuelto alguno de estos inconvenientes.
La utilización de la BIA para la valoración de la composición corporal como consecuencia de la evolución tecnológica de la última década del pasado siglo XX ha alcanzado, en la actualidad, un papel destacado en la medida de la composición corporal. Nos aporta grandes ventajas como, por ejemplo:
• Es un método no invasivo.
• Económico.
• De simple ejecución en cualquier contexto clínico, desde la consulta a la unidad de cuidados intensivos (UCI).
• Reproducible.
• Apto para la rutina médica.
Todo esto hace posible que las ecuaciones de regresión múltiple de la BIA convencional, que incluyen generalmente estatura, peso, edad y sexo, transformen la propiedad eléctrica medida (impedancia) en volúmenes (intracelular y extracelular), masas (grasa, delgada, celular), metabolismo basal y otras variables (Na/K celular, densidad corporal) de composición corporal.
Actualmente, es la única técnica no invasiva capaz de valorar específicamente variaciones de hidratación en cualquier condición clínica e independientemente del peso corporal en el análisis de las variaciones de impedancia de los tejidos blandos.
Ya hemos comentado que hay diferentes modelos y formas de medir la impedancia: la BIA con electrodos (que se colocan distales, proximales o segmentales según sea en el cuerpo entero, en la fosa antecubital, en la fosa poplítea o en los extremos del miembro superior/inferior del tronco), y otros sistemas que llevan los electrodos incorporados (del tipo de una báscula de baño), en las que el paciente sólo tiene que "pesarse" e, incluso, hay otros sistemas donde los electrodos se cogen con la mano. Evidentemente, no todos son igual de fiables ni de precisos (Fig. 1).
En los estudios con electrodos que se han hecho en la BIA distal (con electrodos en la mano y el pie), la referencia estándar es el miembro derecho, aunque en los pacientes renales hay que utilizar el miembro que esté libre de acceso vascular (fístula arteriovenosa). También esto puede ser un inconveniente puesto que algunos pacientes tienen fístulas antiguas paradas y otros tienen incluso dos fístulas funcionantes.
Ya hemos esbozado un poco cómo funciona la BIA en un organismo estable, pero es necesario ahora ubicarnos en los que no lo son.
Sobre la HD en ancianos
Por definición, la IRCT es la disminución lenta, progresiva e irreversible de la capacidad de funcionamiento renal (34). Se habla de ella cuando el filtrado glomerular es inferior al 20%-30% del valor normal, es decir, cuando se ha perdido el 80%-90% de la función renal. No debemos obviar que el proceso de envejecimiento, en lo que al riñón respecta, condiciona una serie de cambios anatómicos y funcionales que hacen al anciano más vulnerable. La reducción fisiológica del filtrado glomerular, como recordamos, es de 10 ml/min por cada década de vida. Se habla ya de que dos tercios de los pacientes en HD son mayores de 65 años (Fig. 2).
Estos pacientes manifiestan de forma temprana una alteración en la necesidad de movimiento. Para valorarla, los criterios que se utilizan son: conocer si hay debilidad y fatiga debido a la anemia y falta de reposo, si hay pérdida de fuerza muscular, amplitud limitada de movimiento de las articulaciones, si existen deformidades y fracturas óseas, y si hay presencia de depósitos de fosfocálcicos en tejidos blandos y articulaciones.
Todas estas manifestaciones son debidas a la alteración del metabolismo fosfocálcico, la anemia y las polineuropatías que provoca la uremia. Esto, que limita tanto la actividad como el movimiento del paciente, está haciendo cada vez más patente la necesidad de que él mismo retome su independencia y, si su estado físico y psíquico lo permiten, continúe o vuelva a la normalidad en todos los ámbitos: trabajo, estudios, relaciones sociales, ocio y actividad física.
El tema consiste en determinar el tipo de ejercicio que sea apropiado para cada uno y conseguir la motivación necesaria para su práctica (28-31).
En el paciente urémico en HD, la variación continua de la hidratación de los tejidos puede ser considerada como una propiedad característica. Es prácticamente imposible localizar a lo largo del día del urémico en diálisis una sola hora de estado estacionario en su hidratación ya que, en las dos técnicas de depuración (sobre todo en HD), se alternan el estado de hiperhidratación y el de deshidratación.
En HD, el peso alcanzado por el paciente al final de una sesión que haya removido el máximo de fluidos sin inducir hipotensión es considerado, convencionalmente, un objetivo terapéutico y se define como el "peso seco". El logro del mismo peso en el paciente con un aumento de masa delgada y grasa consiguiente a una mejor nutrición en las semanas anteriores, inducirá la aparición de una progresiva intolerancia dialítica debido a una excesiva deshidratación. Por esto, es deseable poder determinar dichos parámetros (peso seco, masa magra, masa grasa y agua).
Un problema técnico peculiar de la hemodiálisis es la elección de los tiempos de medida de la bioimpedancia. Felizmente, después de una sesión de hemodiálisis, no hay ningún rebote eléctrico (del tipo de la urea) y, por tanto, las medidas pueden ser tomadas inmediatamente al inicio y al final de la sesión. Trabajos realizados demuestran, que pasados 90-180 minutos después de una sesión de hemodiálisis, sólo se han observado reducciones irrelevantes (32) de soluciones electrolíticas intra y extracelulares e incrementos irrelevantes igualmente de impedancia (33).
También hemos visto cómo el organismo está compuesto por tejidos magros, grasos y agua, y que los tejidos "magros" son los músculos, los huesos y los órganos vitales. Tanto los tejidos magros como el adiposo contienen agua (aunque el adiposo en menor proporción). Y es el agua, precisamente, nuestro mayor problema en estos pacientes.
Por otra parte, para tener un organismo sano que funcione es importante que los niveles de masa magra y masa grasa se hallen en las proporciones correctas. A mayor cantidad de masa magra, más activo es el metabolismo, mayor el consumo de calorías en reposo y más alto el gasto metabólico basal; es decir, necesitamos mayor cantidad de calorías para estar vivos.
Sobre la disminución de la funcionalidad física del paciente renal
En los estudios previos hay un predominio de malnutrición en los pacientes en hemodiálisis (34). Esta malnutrición se refleja en una pérdida de masa muscular, así como en una disminución de la funcionalidad física del paciente, que suele cambiar sus hábitos y merma su calidad de vida. La intervención del personal sanitario que cuidamos a estos pacientes ha consistido siempre en el consejo dietético, ya que éste le puede permitir al paciente renal controlar mejor su estado nutricional. Los estudios que hay sobre la materia siempre han relacionado el aumento del hematocrito con la mejora en la calidad de vida y con la administración de eritropoyetina (EPO).
Pero ya se está comenzando, también, a observar los beneficios que le puede aportar a estos pacientes el ejercicio físico (35) y las intervenciones se van dirigiendo hacia un entrenamiento físico idóneo que mantenga una capacidad funcional adecuada e impida el mayor deterioro de la masa muscular, valorando la pérdida que exista en función del tiempo que el paciente lleva en el programa de hemodiálisis. Igualmente, hay que establecer una relación entre la capacidad funcional del paciente y el ejercicio físico que realice, estableciendo unas pautas o recomendaciones sobre él. Por ello, comenzamos con una actividad de bajo impacto osteoarticular, como puede ser caminar (aunque también podemos recomendar ciclismo o nadar).
Por lo expuesto, creemos y planteamos a modo de objetivos que los efectos beneficiosos que podríamos obtener con nuestra intervención en la actividad física en ancianos en HD serían:
1. Activar los mecanismos depurativos del organismo.
2. Reducir el riesgo de enfermedades cardíacas e intentar que no progrese la hipertrofia ventricular o que no se produzca.
3. Conservar y, a ser posible, aumentar la masa magra.
4. Ejercitar la actividad cardiopulmonar.
5. Retrasar o evitar la osteodistrofia.
6. Mejorar los dolores de espalda o articulares.
7. Proporcionar bienestar.
8. Evitar o prevenir la obesidad.
Material y método
Esta investigación está concebida desde la perspectiva de la salud y la actividad física, y no supone un riesgo para los sujetos experimentales. Al ser un estudio biomédico, la participación médica es indispensable y hemos mantenido en él los requisitos éticos generales subrayados en la Declaración de Helsinki (1960), acordados por la Asociación Médica Mundial, revisados posteriormente en 1975, y en el Nuevo Código de Ética y Deontología Médica, aprobado por la Organización Médica Colegial Española, en su capítulo IV, artículo 32. Igualmente, hemos observado la confidencialidad de los datos y el secreto profesional, y los pacientes lo han sabido desde el comienzo del estudio, aceptando libremente su participación en el mismo.
Como habíamos comprobado experimentalmente que algunos analizadores de masa corporal no medían la masa grasa por encima del 50% y otros no nos parecían demasiado precisos, elegimos para realizar esta exploración un analizador fácil, seguro y fiable. Nuestra experiencia con el analizador Tanita es bastante buena y no le ocasiona al paciente ninguna molestia, por lo que fue nuestro elegido (después de comprobar dos analizadores más). Queremos hacer constar que no hay conflicto de intereses en nuestro estudio.
Los datos que obtenemos de él son: peso corporal, índice de masa corporal, gasto metabólico basal, impedancia, porcentaje de agua, grasa y masa proteica.
En apariencia, es muy parecido a una báscula de baño normal que va conectada a una unidad de control donde hay que introducir una serie de datos del paciente: estado de desarrollo (deportista habitual o no) y la altura en centímetros. La persona debe subir a la plataforma con los pies descalzos y apoyarlos en las bases o sensores marcados para ello. El aparato envía una pequeña corriente (inapreciable para nuestra sensibilidad) a través de uno de los sensores marcados para ello. Esta pequeña corriente se transmite de un pie a otro pasando por todo el cuerpo. Unos instantes después aparecen por la impresora de la unidad de control los datos solicitados, marcando un porcentaje que está en función de los parámetros introducidos y las mediciones hechas. Nos indica la proporción de grasa corporal, la impedancia, el porcentaje de agua, la masa proteica y el cálculo del gasto metabólico basal.
Como son pacientes hemodinámicamente inestables, hemos elegido como día de la valoración el segundo día de diálisis semanal (miércoles o jueves, según los turnos).
Para controlar la cantidad de ejercicio físico (caminar) que nuestros pacientes están haciendo, les hemos proporcionado un podómetro Van Allen 32763 (a todos el mismo modelo, después de comprobar otros dos tipos más) (Fig. 3).
La muestra sobre la que estamos trabajando es de 22 pacientes (5 conforman el grupo experimental y 17 el grupo control). Con una edad media de 74,9 años (grupo experimental con una media de 73,2 y grupo control de 75,2) y un peso medio de 61,07 kilos (grupo experimental con una media de 62,76 kilos y grupo control con una media de 60,5 kilos).
El criterio de inclusión ha sido que ellos hayan querido colaborar, y el único criterio de exclusión, que no puedan caminar o quedarse de pie.
El ejercicio físico consiste en caminar un mínimo de 20 minutos diarios; no establecemos ni ritmo ni intensidad. Cesan su realización cuando se cansan y continúan después, si se han recuperado (usamos la Escala de Borg para que lo controlen). Los días que están en diálisis caminan menos y el día que descansan del tratamiento suelen caminar más.
Les hemos proporcionado un registro mensual en el que tienen que anotar la hora que conectan el podómetro, la hora en que lo desconectan y el número de pasos que éste marca.
Resultados
Exponemos los resultados de nuestros dos grupos de población.
En la Tabla 1, correspondiente al grupo experimental, se muestra en la primera columna la edad del paciente, en la segunda la media de metros que ha caminado durante el tiempo que ha llevado el podómetro. Las siguientes columnas muestran las variaciones que se han producido en la medición de la BIA en las dos ocasiones medidas (al inicio y al año) (Fig. 4).
El grupo control ha tenido los resultados que se exponen en la Tabla 2 y la Fig. 5.
Comparando ambos grupos, observamos en qué porcentaje han evolucionado los pacientes en los parámetros medidos (Tabla 3).
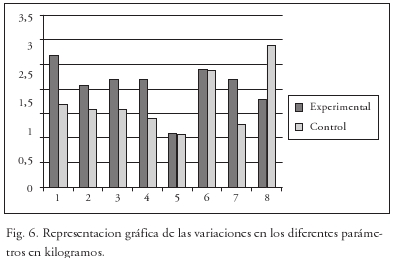
La pérdida/ganancia media en kilos de dichas sustancias se pueden ver en la Tabla 4 y el la Fig. 6.
Discusión
La bioimpedancia, como técnica, nos parece un método en el que se puede confiar, a pesar de que hay requisitos que cumplir y variables que afectan a la validez y a la precisión de la medición. Vemos que pequeños porcentajes de cambio en el volumen o en la conductividad de los compartimentos fluidos causarían cambios en la impedancia resultante. A la inversa, cambios más importantes en el volumen o en la conductividad de regiones con alta resistencia, tales como hueso o masa grasa, no parecen afectar demasiado a la medición de la bioimpedancia.
También hemos comprobado que la posición con relación a los sensores, el estado de hidratación del organismo, la posición del cuerpo, el consumo previo de alimentos o bebidas, la temperatura de la piel y del ambiente y la actividad física reciente influyen en las mediciones realizadas. Igualmente, la ingesta de una comida sólida lleva a una disminución de la bioimpedancia que se mantiene hasta cuatro horas después de ella, probablemente debido a cambios en la distribución de fluidos y electrolitos que siguen a la absorción y distribución de una comida, por lo que un mínimo de cuatro horas de ayuno es necesario para que no haya distorsión de los resultados.
Ya hemos comprobado que la desnutrición de los pacientes ancianos en HD tiene varias causas y que una de ellas es al aporte inadecuado de nutrientes. Este aporte proteico insuficiente, junto con el descenso del anabolismo y el incremento del catabolismo, se traduce en una pérdida de masa muscular. Esta pérdida ha dado lugar a una disminución de la funcionalidad física (definiendo ésta como la capacidad de tener una actividad cotidiana dentro de lo normal). Hasta ahora, la solución clásica a este problema es la EPO y la práctica del ejercicio físico. Por eso, en el programa de ejercicio que hemos recomendado a nuestros pacientes, hemos intentado potenciar la actividad física: una actividad aeróbica moderada, con grandes grupos musculares, con una intensidad variable (dependiendo del día de la semana, puesto que cuando el paciente descansa de HD se encuentra más activo que el día que acude a diálisis). Es realmente importante individualizar todos los datos debido a la gran variabilidad que nos encontramos en los resultados.
Nos ha llamado la atención la poca participación obtenida entre las personas mayores cuando se habla de actividad física. Mientras que siempre se muestran colaboradoras con otros temas y situaciones, nos ha costado trabajo obtener una muestra (que, además, reconocemos como pequeña), aunque ellos podían escoger la cantidad, el momento y el tiempo.
Conclusiones
Aunque con estos pacientes no podemos hablar de valores absolutos (debido a las grandes variaciones fisiológicas que tienen en poco tiempo), sí podemos -utilizando las medidas de impedancia- conseguir una valoración semi-cuantitativa (como una especie de escala de percentiles) del estado de hidratación de un sujeto en cualquier condición clínica en la que se encuentre (incluyendo no sólo hidratación, sino también nutrición).
Los pacientes que han realizado actividad física han bajado mayoritariamente su "peso seco", y los que lo han subido ha sido a costa del compartimento graso, disminuyendo -ilógicamente- la materia muscular.
El grupo control también ha aumentado su masa grasa (en menor proporción que el grupo experimental) y ha disminuido su masa muscular y el agua compartimental.
Creemos que la pérdida de masa muscular y el aumento de grasa no esta influido por la actividad física realizada (aunque sí la acentúa un poquito), sino por el propio proceso de envejecimiento. El beneficio que el aumento de la actividad física ha proporcionado a nuestra población no es significativamente cuantificable en términos objetivos, pero sí lo es en términos cualitativos subjetivos, porque manifiestan su satisfacción y el "encontrarse mejor y más ágiles".
Bibliografía
1. Gallo Vallejo MA, De la Plata J, Galán L. El ejercicio físico como arma terapéutica. DMD. Monografías 4. Centro Andaluz de Medicina del Deporte, 2000. [ Links ]
2. Hagberg JM, Park JJ, Brown MD. The role of exercise training in the treatment oh HTA. Sports Medicine 2000; 30 (3): 193-206. [ Links ]
3. Hambrecht R, Gielen S, Linke AJ,Walter, C et al. Effects of exercise training on left ventricular function and Periheral resistence in patients with chronic Heart faillure. JAMA 2000; 283 (23): 3095-101. [ Links ]
4. Heinonen A, Sievanen H, Kannus P, Pasanen M, Vouri I. High-impact exercise and bones of growing girls: a 9-month controlled trial. Osteoporos Int 2000; 11 (12): 1010-7. [ Links ]
5. Krisca A. Physical activity and the prevention of type 2 diabetes mellitus. Sports Med 2000; 29 (3): 147-51. [ Links ]
6. Lame AM, Lovejo Y. The effects of exercise on mood changes: the moderating effect of depressed mood. J Sports Med Phys Fitness 2001; 41 (4): 539-45. [ Links ]
7. Mannerkorpi K, Nyberg B et al. Pool exercise combined with an education program for patients with fibromyalgia syndrome. A prospective randomized study. J Rheumatol 2000; 27 (10): 2473-81. [ Links ]
8. Lisboa C, Villafranca C et al. Calidad de vida en pacientes con EPOC e impacto del entrenamiento físico. R Med Chile 2001; 129 (4): 359-66. [ Links ]
9. Martín P. Sintomatología respiratoria en deportistas y prescripción de ejercicio para personas con enfermedades pulmonares. Selección 2001;10 (3): 152-60. [ Links ]
10. Ortega E, Peters C et al. ¿Puede la actividad física reducir el riesgo de cáncer? Arch Med Dep 1997; 58: 127-34. [ Links ]
11. Scandalis TA, Bosak et al. Resistance training ad gait function in patients with Parkinson's disease. Am J Phys Med Rehábil 2001; 80 (1):38-43, Quiz 44-6. [ Links ]
12. Nakken KO. Physical exercise in outpatients with epilepsy. Epilepsia 1999; 40 (5): 643-51. [ Links ]
13. Rolland Y, Rival L, Pillard F, Lafont C et al. Feasibily of regular physical exercise for patients with moderate to severe Alzheimer disease. J Nutr Health Aging 2000; 4 (2): 109-13. [ Links ]
14. Sociedad Española de Enfermería Nefrológica. Capacidad de ejercicio y CV en pacientes en edad avanzada en hemodiálisis tratados con EPO. Bilbao: Libro de Comunicaciones, 1990. [ Links ]
15. Tsai TJ, Lai JS et al. Breating coordinated exercise improves the quality of live in hemodiálisis patients. J Am Soc Nephrol 1995; 5 : 1392-400. [ Links ]
16. Congreso de la Sociedad Española de Enfermería Nefrológica. Efecto de la EPO en la calidad de vida y capacidad de ejercicio en pacientes en Hemodiálisis. BISEDEN 1er trimestre, 1991. [ Links ]
17. Canadian Erytropoietin Study Group. Association between recombinant human erythropoietin and quality of life and exercise capacity of patients receiving haemodialysis. BMJ 1990; 300 (6724): 573-8. [ Links ]
18. Lundin AP, Akermen MJ et al. Exercise en hemodialisis patients after treatment with recombinant human EPO. Nephron 1991; 58(3): 315-9. [ Links ]
19. Haber P, Burghuber OC. Principles and general practice of goaloriented planning of training in patients with diabetic nephropathy and in dialysis patients. Wien Med Wochenschr 1988; 138 (14):350-2. [ Links ]
20. McMahon LP, McKenna MJ, Sangkabutra T, Mason K, Sostaric S, Skinner SL, Burge C, Murphy B, Crankshaw D. Physical performance and associated electrolyte changes after Haemoglobin normalization: a comparative study in HD patients. Nephrol Dial Transplant 1999; 14 (5):1182-7. [ Links ]
21. Cappy CS, Jablonka J, Schroeder ET. The effects of exercise during hemodialysis on physical performance and nutrition assessment. Ren Nutr 1999; 2: 63-70. [ Links ]
22. Piccoli A, Nescolarde Y, Rosell J. Análisis convencional y vectorial de bioimpedancia en la práctica clínica. Nefrología 2002; XXII (3):228-38. [ Links ]
23. Grimmes S, Martinsen G. Bioimpeda-nce and bioelectricity basics. London: Academic Press, 2000. [ Links ]
24. Foster KF, Lukaski HC. Whole-body impedance. What does it measure? Am J Clin Nutr 1996; 64: 388-96. [ Links ]
25. Lukaski HC. Biological indexes considered in the derivation of the biolelectrical impedance analysis. Am J Clin Nutr 1996; 64: 397-404. [ Links ]
26. Heymsfield SB, Wang ZM et al. Human body composition: advances in models and methods. Annu Rev Nutr 1997; 17:527-8. [ Links ]
27. Houtcooper LB. Why bioelectrical impedance análisis should be used for estimating adiposity. Am J Clin Nutr 1996; 64: 436-48. [ Links ]
28. Painter P, Zimmerman SW. Exercise in end-stage renal disease. Am J Kidney Dis 1986; 7 (5): 386-94. [ Links ]
29. Stephens R, Willians A et at. Effects of self-monitored exercise on selected blood chemistry parameters of end-stage renal disease patients. Am J Phys Med Rehabil 1991; 70 (3): 149-53. [ Links ]
30. Harter HR, Golberg AP. Endurance exercise training. An effective therapeutic modality for hemodialysis patients. Med Clin North Am 1985;69 (1): 159-75. [ Links ]
31. Painter PL, Nelson Worel JN. Effects of exercise training during henmodialysis. Nephron 1986; 43 (2): 87-92 [ Links ]
32. Maggiore Q, Nigrelli S et al. Nutritional and prognostic correlates of bioimpedance indexes in Hemodiálisis patients. Kidney IN 1996; 50:2103-8. [ Links ]
33. Kushner RF, de Vries PM et al. Use of bioelectrical impedance analysis measurements in the clinical management of patients undergoing dialysis. Am J Clin Nut 1996; 64 (Suppl.): 503-9. [ Links ]
34. Llack, Valderrabano F. Insuficiencia Renal crónica. Madrid: Editorial Norma, 1990. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pilar Peña Amaro
C/ San Francisco Javier 2 (escl. der. 2 B).
23006-Jaén
Tfno.: 636 133 574/95 308 45 50
E-mail: ppena@ujaen.es