INTRODUCCIÓN
Las úlceras por presión (UPP) son un importante problema de salud que lejos de mejorar sigue creciendo incluso en países con decididas políticas activas de seguridad de los pacientes como Estados Unidos.
Su frecuencia de aparición no solo no ha disminuido en los últimos años, sino que incluso se ha duplicado en los centros sociosanitarios. Esta afirmación se sustenta en las cifras de prevalencia del 4º Estudio Nacional de Prevalencia realizado por el Grupo Nacional para el Estudio y Asesoramiento sobre Úlceras Por Presión y Heridas Crónicas (GNEAUPP) realizado en 20131, donde se muestran unas cifras de prevalencia preocupantes: un 11,28% de prevalencia bruta de lesiones crónicas en hospitales y un 13,31% en centros sociosanitarios (con una mayor prevalencia en los privados frente a los públicos).
Pero no solo son un importante problema de salud por el número de pacientes a los que afectan sino que, por sus costes, directos e indirectos, también empiezan a preocupar a los sistemas sanitarios. Se estima que el 1-2% de la población puede padecer una herida crónica a lo largo de su vida y con ello un altísimo coste asociado. En el Sistema Sanitario Público Británico (NHS) se estimó que el coste de la curación de pacientes con heridas crónicas era de unos 3 billones de libras al año2. En nuestro medio se ha estimado que el coste total anual del tratamiento únicamente de las UPP sería de 602 millones de euros al año3.
Se considera que en todas las heridas hay presencia de bacterias que tienen un gran impacto en el proceso de cicatrización desde la fase de colonización crítica a la de infección. El desarrollo de una infección en la herida viene determinado por la cantidad inicial de microorganismos, la virulencia de estos y los mecanismos defensivos del huésped (el paciente)4.
La reciente campaña “Think Sepsis” (“piensa en la sepsis”) realizada a nivel internacional menciona que la pérdida de la integridad cutánea incrementa el riesgo de sepsis. Esto confirma que un deficiente manejo de la carga bacteriana de una herida puede conllevar consecuencias fatales5.
La elección del apósito correcto es uno de los temas más controvertidos en la cura avanzada de heridas. Por un lado, nos encontramos con un continuo desarrollo de productos y, por otro, la reciente preocupación por el impacto en los costes de la indicación correcta de estos productos.
Uno de los factores de aumento de costes en las heridas es la evolución tórpida y una de las razones para esta mala evolución es la presencia de biofilm, una comunidad de microorganismos que se adhieren a una superficie, integrados en el limo que producen y que los protege de los agentes antimicrobianos y las defensas del huésped6.
La presencia de biofilm en heridas retrasa la cicatrización al interferir en la formación de tejido7. El biofilm crea una inflamación que retrasa la epitelización y la granulación8,9. Esta inflamación persistente es incluso más destructiva para el tejido que el propio biofilm.
En estudios controlados in vivo se ha encontrado que el biofilm impide el normal crecimiento del tejido de granulación y epitelización, y actúa como una barrera física para el proceso de cicatrización.
El biofilm está implicado en, al menos, el 80% de las infecciones bacterianas en humanos10. Estudios publicados han identificado la presencia de comunidades bacterianas en forma de biofilm en las heridas crónicas11, y se ha observado que el 60% de las muestras de desbridamiento de heridas crónicas contenía biofilm12.
El objetivo básico para el abordaje del biofilm es romper la capa de limo presente en la lesión y poder exponer los gérmenes a la acción de los antimicrobianos tópicos. Un elemento clave a la hora de combatir el biofilm es el desbridamiento mecánico. De esta manera se altera la anatomía del biofilm, retirando tejido y abriendo canales13. También podemos encontrar en el mercado una serie de sustancias que pueden ayudar a romper el limo del biofilm, como la polihexametilbiguanida (PHMB), el ácido etilendiaminotetraacético (EDTA) o el cloruro de benzetonio (BeCl).
El cuidado de la herida con biofilm es, por tanto, uno de los mayores retos para los clínicos, y la selección del apósito adecuado y más costo-efectivo, un reto suplementario.
En este contexto, ante una situación de crisis económica y la necesidad imperiosa de reducir el déficit público, lo razonable sería aprovechar la oportunidad de mejorar la eficiencia, incluido el sector sanitario, básicamente mediante la reducción del consumo inapropiado14.
Los métodos instrumentales para la medición de los costes y los resultados sanitarios o el análisis comparativo de diferentes intervenciones sanitarias en términos de coste y beneficio deben convertirse en herramientas necesarias en la toma de decisiones sobre gasto sanitario, incluida la atención a los pacientes con heridas. Sin embargo, existe una tendencia a abordajes sumamente reduccionistas en la evaluación de los costes, primando el precio de los apósitos como la cuantía más importante del gasto total, cuando los estudios que han valorado estos aspectos reflejan que este coste solo representa un 15-20% de la atención a una persona con heridas15, despreciando los costes derivados de los tiempos de enfermería, las hospitalizaciones relacionadas, la pérdida de días de trabajo u otros costes.
Por este motivo, durante este período de crisis económica, las políticas destinadas a la contención del gasto han incidido de manera muy intensa en la reducción de los catálogos de productos disponibles o con la compra de productos de menor precio.
A continuación, se muestra un estudio con simulación de escenarios y costes reales que trata de evaluar si la elección de apósitos mediante el criterio de precio unitario más bajo supone en todos los casos un ahorro para el sistema.
OBJETIVO
Evaluar la costoeficiencia de utilizar un apósito de hidrofibra con plata, EDTA y cloruro de benzetonio como apósito de primera elección en las heridas con presencia de biofilm basado en un modelo teórico propio.
MÉTODO
Se establece un modelo teórico propio compuesto por 200 heridas crónicas según el esquema de la Figura 1.
En el primer grupo de 100 heridas (grupo A) se utiliza un apósito de alginato con plata como primera elección y en otro grupo de 100 heridas (grupo B) se utiliza un apósito de hidrofibra con plata, EDTA y cloruro de benzetonio como primera elección.
Considerando que las heridas crónicas presentan biofilm en un 60% de los casos, se estima que 60 heridas de cada grupo requieren una segunda evaluación. Se generan así dos nuevos subgrupos: uno con heridas sin biofilm (subgrupo 1) y uno con heridas con biofilm (subgrupo 2). Tras la evaluación, el subgrupo A2 requiere utilizar un apósito de hidrofibra con plata, EDTA y cloruro de benzetonio como segunda línea de tratamiento, mientras que en el subgrupo B2 no es necesario cambiar el apósito utilizado, ya que la primera línea de tratamiento resulta efectiva.
El modelo teórico global se dispondría según el esquema de la Figura 1.
Se ha establecido que los períodos de uso y evaluación de cada producto sean de 15 días. Como medida conservadora y para evitar sesgos, no se incluyen en el cálculo de costes ni los tiempos de enfermería ni diferencias en el tamaño del apósito; ambas características se consideran constantes e inherentes al número total de días de curación.
A efectos de comparación de costes y para el cálculo del coste medio de una herida con presencia de biofilm, se realiza una revisión de 14 casos clínicos publicados entre 2013 y 2016, que presentan alto grado de variabilidad clínica. En la Tabla 1 se observan las características basales de la población a estudio contemplando los diferentes apósitos utilizados, sus costes unitarios y los días de uso de cada apósito. Se han desestimado todos los casos en los que faltaba alguno de estos datos. Se ha calculado el promedio de días hasta la mejoría y el promedio de coste de cada herida, así como el promedio de coste/día de las heridas con biofilm.
Tabla 1 Costes totales en los casos analizados*

*En los casos en que no aparece la frecuencia de curas se utiliza siempre la estándar c/48 h.
Para el cálculo de costes se han tomado como referencia los precios públicos de la oferta de precios de los apósitos objeto de estudio en la presentación con medidas 10 ×10 cm del concurso público de apósitos de la Plataforma Logística Provincial de Sevilla dependiente del Servicio Andaluz de Salud.
RESULTADOS
La tabla de costes resultante (Tabla 2) muestra los costes medios de cada grupo y de cada subgrupo al que hemos añadido un margen de error del 5%.
Tabla 2 Comparativa de costes según tratamiento de primera elección (utilizando apósitos de 10 × 10 cm)
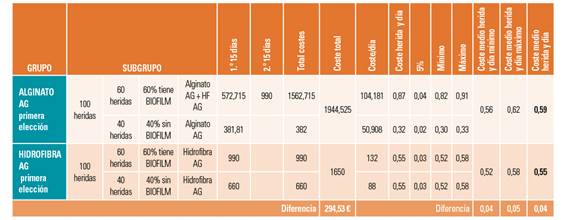
Según nuestro modelo teórico de costes, el coste medio por herida y día del grupo A sería de 0,59 (±0,03) €, mientras que el coste medio por herida y día del grupo B sería de 0,55 (±0,03) €, lo que supone una diferencia media de 0,04 € por herida y día de tratamiento.
Podemos observar que mientras en el grupo B, los costes medios por herida y día son similares en ambos subgrupos, en el grupo A, los costes medios por herida y día son significativamente diferentes en ambos subgrupos: subgrupo A1 0,32 ((±0,02) € y subgrupo A2 0,87 (±0,04) €.
En ambos escenarios se observa un coste inferior al coste medio diario de la variabilidad clínica que es de 1,48 €.
Unitariamente, la diferencia de precio no sugiere que sea significativa, pero si comparamos el coste total de las 200 heridas para un tratamiento de 30 días, la diferencia de costes es del 295 €.
DISCUSIÓN
Es frecuente que los decisores de gasto, sobre todo en períodos de reducción presupuestaria, tomen las decisiones erróneas basando el ahorro presupuestario en la reducción de los precios unitarios de compra de los materiales16.
Este ejercicio teórico pretende demostrar que para tomar estas decisiones deben realizarse desde la racionalización, mediante proyecciones y basándose en la mejor evidencia disponible. Para ello, los conceptos y herramientas de la economía de la salud pueden contribuir positivamente a tomar las decisiones de compra mucho más eficientes en el medio plazo.
En este ejercicio teórico se ha demostrado que el producto con un precio unitario más bajo puede resultar, en el medio plazo, más costoso que uno con un precio unitario más caro. El estudio de Yan y cols.17, realizado en un entorno socioeconómico distinto, con un modelo teórico más amplio, con una proyección a futuro y comparando los mismos apósitos, obtiene resultados similares.
En ambos casos, la posible razón de esta diferencia pueda deberse al menor número de días de curación entre un apósito con una formulación antibiofilm y otro sin ella.
La frecuencia de cambios de apósitos tiene un impacto en el aumento de los costes del cuidado de las heridas18. Si se hubieran tenido en cuenta los costes asociados a los tiempos de enfermería o al tipo de intervención, hospitalaria o en atención primaria, posiblemente habríamos obtenido una diferencia de costes aún mayor, ya que son también componentes fundamentales de los costes.
Pese a las limitaciones inherentes a que los resultados se basan en un modelo teórico propio, tras este ejercicio de análisis, de evaluación de costes directos e indirectos, se considera que los apósitos en cuya composición se han incluido soluciones activas frente a biofilm deben ser tenidos en cuenta como apósitos de primera elección mientras no se desarrolle una herramienta que permita identificar explícitamente qué lesiones tienen o no presencia de biofilm.
Sería necesario evaluar mediante estudios con escenarios más amplios si los métodos de control de costes basados únicamente en el precio unitario de los apósitos tienen un impacto negativo en los resultados en salud de los pacientes con heridas crónicas.
CONCLUSIÓN
El modelo teórico desarrollado sugiere que el apósito de hidrofibra con plata, EDTA y cloruro de benzetonio es costo-efectivo frente al apósito comparado y frente al coste medio calculado para la variabilidad de la práctica clínica en heridas con biofilm.
Con estos resultados, con la limitación de estar basados en un modelo teórico propio, y la evidencia científica disponible podemos considerar que el apósito de hidrofibra con plata, EDTA y cloruro de benzetonio es el apósito de primera elección para heridas con presencia de biofilm















