Introducción
Las enfermedades neurodegenerativas, en especial la enfermedad de Alzheimer (EA), se han estudiado ampliamente debido al aumento de su prevalencia en la población; actualmente están presentes en 46,8 millones de personas y se proyecta una duplicación en los próximos 20 años1.
El envejecimiento de la población debido al aumento de la esperanza de vida hace que las enfermedades neurodegenerativas sean un reto cada vez más presente en la sociedad. A pesar de los numerosos estudios respecto de los mecanismos y etiopatogenia de la enfermedad, no hay una línea clara de evidencia sobre la que actuar. Diversas revisiones de la literatura apuntan a una base genética, estilos de vida y modificaciones fisiológicas del envejecimiento, cuya interacción aumenta el riesgo de padecer EA y otros tipos de demencia2,3. Se atribuye un peso importante a factores modificables por la persona, sobre los que una intervención precoz mediante la prevención y adopción de medidas preventivas tendría un gran impacto. Así es el caso del sueño, el ciclo sueño-vigilia y los ritmos circadianos que lo regulan.
Otros marcadores biológicos a los que se apunta como posibles predictores de la EA son la presencia del polimorfismo 4 en el gen APOE y actividad relacionada con la Tau hiperfosforilada y otras hipótesis relacionadas con el desequilibrio del glutamato, la noradrenalina, la serotonina, la acetilcolina, la alteración de las orexinas y la teoría inflamatoria4,5. Todas ellas mantienen en común una predisposición al desajuste de la autorregulación del depurado de beta-amiloide (bA) en el LCR, entre otras sustancias de deshecho, cuyo acúmulo da lugar a los agregados en forma de placas que causan la conocida neurodegeneración6. Igual que diversas modificaciones neurológicas empiezan a aparecer 20 años antes de síntomas evidentes, también aparecen alteraciones en los biomarcadores mencionados, que se evalúan como posibilidad para el diagnóstico de la demencia en sus primeras etapas y de alteraciones circadianas, donde una intervención precoz puede frenar un agravamiento del círculo de desregulación de los ciclos sueño-vigilia7.
Objetivo
Sintetizar la producción científica relacionada con las alteraciones del sueño que tienen lugar en personas mayores con demencia.
Metodología
Se realizó una revisión sistemática mediante el estudio de la evidencia científica publicada en los últimos 5 años, proporcionando una síntesis narrativa de los artículos seleccionados. La búsqueda tuvo lugar en el período que abarca del 20 de marzo de 2021 al 20 de abril de 2021.
Las fases establecidas fueron las siguientes: búsqueda de bibliografía, selección de artículos, evaluación de la calidad de los resultados, extracción e interpretación de los datos. La calidad metodológica de los artículos se estudió mediante las listas de verificación, en función del tipo de diseño del estudio. Para los estudios observacionales se empleó la lista de declaración STROBE (STrengthening the Reporting of OBbservational studies in Epidemiology), según el documento oficial publicado por Von Elm et al. en 20088, para ensayos clínicos la lista de declaración CONSORT (CONsolidated Standards of Reporting Trials)9 y para revisiones sistemáticas la declaración PRISMA10.
La búsqueda se realizó en las bases de datos PubMed, Scopus y Cochrane. Se emplearon los descriptores de ciencias de la salud: alzheimer disease, dementia, sleep wake disorders, sleep disorders, circadian rhythm, circadian clocks. La estrategia de búsqueda se configuró de acuerdo con los dos temas principales unidos entre ellos mediante los términos boleanos “AND” y mediante el “OR” para la relación de términos equivalentes dentro del mismo bloque temático. Los términos de búsqueda, así como los filtros utilizados en cada base de datos, se recogen en la Tabla 1.
Tabla 1. Términos de búsqueda en las distintas bases de datos.
| Base de datos | Términos de búsqueda | Filtros de cribado |
|---|---|---|
| PubMed | ((Dementia) OR (“Alzheimer Disease”)) AND ((“Sleep Wake Disorders”) OR (circadia*) OR (“sleep disorders, intrinsic”) OR (“Sleep Disorders”) OR (“Circadian Rhythm”) OR (“Circadian Clocks”) OR (“sleep disorders, circadian rhythm”) OR (“circadian dysregulation”) | Tipo de artículo: metaanálisis, estudio observacional, ensayo controlado aleatorizado, revisión sistemática Fecha de publicación: últimos 5 años Especie: humanos |
| Scopus | TITLE-ABS-KEY (((dementia) OR (“Alzheimer Disease”)) AND (( circadia*) OR (“Sleep Disorders”) OR (“Circadian Rhythm”) OR (“circadian dysregulation”))) AND (LIMIT-TO (PUBYEAR, 2020) OR LIMIT-TO (PUBYEAR, 2019) OR LIMIT-TO (PUBYEAR, 2018) OR LIMIT-TO (PUBYEAR, 2017) OR LIMIT-TO (PUBYEAR, 2016)) AND (LIMIT-TO (SUBJAREA, “NEUR”)) AND (LIMIT-TO (DOCTYPE , “ar” ) OR LIMIT-TO (DOCTYPE, “re”) | Fecha de publicación: últimos 5 años Subárea: neurociencia, psicología y enfermería Tipo de documento: artículo y revisión |
| Cochrane | Demencia en: Título, Resumen, Palabra clave AND alteración del sueño en Título, Resumen, Palabra clave | Fecha de publicación: últimos 5 años |
Criterios de inclusión: estudios observacionales (transversales, caso-control y de cohortes), estudios experimentales (ensayo controlado aleatorizado, ensayo clínico controlado) y revisión sistemática; publicaciones destinadas a estudio de población con demencia y alteraciones del sueño en mayores de 65 años; artículos publicados en los últimos 5 años.
Criterios de exclusión: revisiones bibliográficas, artículos de opinión y literatura gris.
Resultados
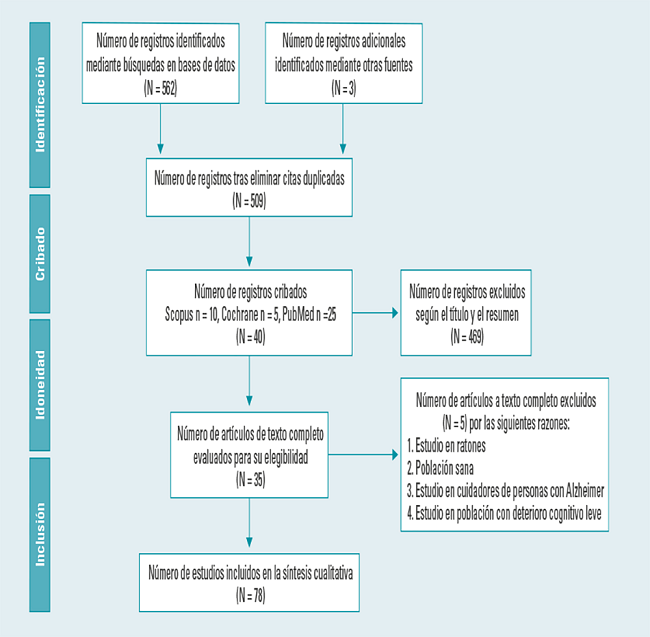
En total se recopilaron 562 documentos. Se procedió a cribar los artículos por título y resumen, aplicando los criterios de inclusión y exclusión, y se obtuvieron 40 artículos. Finalmente, tras la lectura a texto completo fueron 35 (Tabla 2) los artículos seleccionados en función de los requisitos de exclusión e inclusión (Fig. 1).
Tabla 2. Resultados de los artículos completos incluidos en la revisión.
| Autoria / (ano) | Número artículos /número participantes | País | Tipo de estudios | Variables de estudio | Instrumentos | Resultados | Check List |
|---|---|---|---|---|---|---|---|
| De Almondes (2016) | 5 artículos | - | Revisión sistemática y metaanálisis | Riesgo combinado de demencia en mayores con insomnio | PubMed, Scopus y PsycInfo | Insomnio asociado a un riesgo relativo de 1,53 respecto a la demencia | 25 |
| De Kathy (2019) | 54 personas | EE. UU. | Ensayo clínico piloto cuasiexperimental | Procesamiento psicomotor/cognitivo Memoria Atención Somnolencia diurna Función diaria | 1. Hopkins Verbal Learning Test-Revised 2. Digit Symbol-DS. Cognición cotidiana 3. Estudio cooperativo de la EA 4. Escala de impresión clínica global del cambio 5. Calificación clínica de demencia | Retraso del deterioro cognitivo en el grupo con adherencia a la CPAP respecto al grupo control | |
| Guoyu Zhou (2019) | 176 pacientes | China | Estudio observacional transversal | Relación entre el trastorno del sueño, síntomas neurológicos y la cognición en EA | 1. Minimental 2. Actividades de estudio cooperativo de la vida diaria 3. Calificación clínica de demencia 4. Inventario neuropsiquiátrico 5. El índice de calidad del sueño de Pittsburgh y la escala de somnolencia de Epwort | Pacientes con EA 56% tienen trastorno del sueño. El 89% con EA tienen síntomas neurológicos: 64% apatía y depresión | 21 |
| Milán-Tomás (2018) | 85 artículos | - | Revisión sistemática | Descripción fisiopatológica del cambio en los ritmos circadianos en EA y los trastornos de sueño | 1. Medline 2. PubMed 3. Embase | Vínculo recíproco entre la EA y los trastornos del sueño, incluidas las alteraciones de los ritmos circadianos | 26 |
| Sindi (2018) | Estudio CAIDE: 1.409 participantes Estudio H70: 827 participantes Proyecto Kungsholmen: 1.810 personas | -. Estudio CAIDE: Finlandia -. Estudio H70: Suecia -. Proyecto Kungsholm: Suecia | Estudio multicéntrico de 3 estudios de cohortes prospectivos | Asociaciones entre los trastornos del sueño y el riesgo de demencia | Manual diagnóstico y estadístico de trastornos mentales Entrevistas con informantes TC, EEG, análisis líquido cefalorraquídeo, RM y ECG | El insomnio en la mediana edad y el insomnio terminal en la vejez o la duración prolongada del sueño, se asociaron con un mayor riesgo de demencia en la vejez | 21 |
| Fernández-Arcos (2019) | 35 pacientes | Hospital Clínic de Barcelona y Sant Pau | Estudio observacional transversal | Evaluación de la conducta del sueño REM y otros trastornos del sueño en DCL | Entrevista clínica sobre el sueño Cuestionarios sobre el sueño Videopolisomnografía nocturna Flujo CPAP | En la DCL, los trastornos de sueño en la fase REM y en el sueño-vigilia son frecuentes, heterogéneas y complejas | 22 |
| Polsek (2018) | No especifica | Reino Unido | Revisión | Propuestas de mecanismos compartidos entre la AOS y la EA | No especifica | Promotores comunes de la AOS y EA: actividad neuronal excesiva y prolongada en ausencia de sueño estructurado, la inflamación y la obesidad | 21 |
| Pase (2017) | 321 participantes | Framingham | Estudio de cohortes prospectivo | Asociaciones entre la arquitectura del sueño y el riesgo prospectivo de incidencia de demencia | Polisomnografía domiciliaria / Minimental | Ondas lentas y mecanismos REM como predictores de demencia clínica | 22 |
| You (2019) | 52 participantes | Filadelfia, Pensilvania | Estudio transversal | Asociación entre depósitos de βA en el cerebro y calidad subjetiva de sueño en la demencia | - . Cuestionarios del sueño - . Tomografía por emisión de positrones - . Miniexamen del estado mental | Despertares nocturnos y somnolencia diurna asociada a depósitos de βA y deterioro cognitivo | 22 |
| Bokenberger (2017) | 11.247 participantes | Suecia | Estudio de cohortes prospectivo en 17 años | Asociación entre características del sueño e incidencia en demencia | - . Cuestionario de sueño de Karolinska - . Índice de calidad del sueño validado - . Índice de sueño reparador - . Cribado cognitivo inicial - . Diagnóstico de demencia incidente | Más de 9 h o menos de 6 h de sueño y despertar después de las 8 de la mañana se asociaron con mayor incidencia de demencia | 22 |
| Burke (2016) | 11.453 participantes | EE. UU. | Estudio de cohortes prospectivo (286-3.229 días) | Relación de causalidad entre alteración del sueño, depresión, genotipo de APOE e en la demencia | - . Historia clínica, episodios de salud para diagnóstico de depresión - . Cuestionario de inventario neuropsiquiátrico y la entrevista para el sueño - . Isopo bucal y análisis de sangre para detección de APOE e | Los trastornos del sueño, la depresión y el APOE e 4 genotipos están asociados con la EA | 20 |
| Djonlagic (2019) | 85 mujeres | Minneapolis y Pittsburgh, EE. UU. | Estudio de cohortes prospectivo de 5 años | Evaluación polisomnográfica cuantitativa en fase preclínica de la EA | Polisomnografía / Minimental | Evidencias de cambios cuantitativos en el EEG que preceden al inicio clínico de la EA | 20 |
| Wang (2020) | 254 artículos | - | Revisión bibliográfica | Relación bidireccional entre el sueño y la EA a través de bA | Revisión de la literatura disponible | Niveles altos de βA disminuyen calidad/duración sueño-vigilia de forma recíproca y bidireccional | 22 |
| Bugalho (2019) | 19 participantes | Lisboa | Estudio de cohortes prospectivo de 2 años | Comparar datos polisomnográficos entre pacientes con DCL y valores normativos | Videopolisomnografía - . Estructura del sueño - . Índice apnea-hipopnea - . Índice atonía del sueño REM - . Eventos motores en el sueño | En la DCL hay una elevada fragmentación del sueño, reducción del sueño total y REM, y mayor tasa de parasomnias | 22 |
| Liguori (2020) | 258 participantes | Roma | Estudio observacional transversal | Estudio de los cambios nocturnos en la arquitectura del sueño, biomarcadores de EA en el LCR y deterioro de la memoria | Evaluación diagnóstica Antecedentes, examen neurológico, EEG, polisomnografía, RM cerebral, punción lumbar y análisis LCR | Los biomarcadores de la EA del sueño, la memoria y el LCR están relacionados con la progresión de la EA desde las etapas preclínicas | 21 |
| Tadokoro (2020) | 63 participantes | Okayama, Japón | Estudio observacional transversal | Evaluación de problemas de sueño objetivos y subjetivos en la demencia leve y la EA | - . Dispositivo portátil “WatchPAT” - . Índice de calidad del sueño de Pittsburgh | Reducción del tiempo de fase REM y aumento de tiempo de sueño ligero en la EA | 21 |
| Webster (2020) | 18 profesionales sanitarios de 4 residencias | Reino Unido | Estudio cualitativo por entrevistas | Efecto de la alteración del sueño en los residentes con demencia | Entrevista con personal cualificado Redacción del guion de entrevista basado en la revisión de la literatura disponible sobre el tema | Las alteraciones del sueño afectaron física y psicológicamente a los residentes y a su entorno, aumentando el estrés en los que les rodean | |
| Winer (2019) | 101 participantes | California, EE. UU. | Estudio longitudinal prospectivo de cohortes | Evaluaciones retrospectivas del sueño y mediciones de PET de proteína Tau y βA en la EA | PET de βA y Tau registros del sueño de EEG y evaluaciones retrospectivas del sueño | Efectividad del sueño como biomarcador predictor de la EA y del deterioro cognitivo | 20 |
| Van Erum (2019) | No especifica | Bélgica | Revisión bibliográfica | Comprensión fisiopatología del sueño en la EA | Revisión de la literatura disponible | Complejidad en los procesos del sueño-vigilia implicados en la EA Efectividad del EEG como predictor de desarrollo de EA | 20 |
| Burke (2018) | 12.083 participantes. | EE. UU. | Estudio longitudinal de cohorte prospectiva de 10 años | Estudio de la hipótesis de causalidad entre los trastornos del sueño, la depresión y la ansiedad, con respecto al riesgo de incidencia de EA | - . Diagnóstico médico de depresión - . Alteración del sueño autoinformada - . Cuestionario de inventario neuropsiquiátrico | Riesgo elevado de EA en la ansiedad, depresión y alteraciones del sueño, de forma independiente No se encontró adición entre comorbilidades | 22 |
| Irwin (2019) | No especifica | - | Revisión bibliográfica | Literatura científica disponible sobre el tema | Implicaciones del sueño y la inflamación en la EA | 20 | |
| Macedo (2017) | 119 estudios | Reino Unido | Revisión bibliográfica | Mecanismos subyacentes entre la alteración del sueño y la progresión de la EA | Literatura científica disponible sobre el tema | Alteraciones del sueño como inductor de bA, alteraciones inflamatorias y oxidativas se asocian con la EA | 25 |
| Lysen (2018) | 4.835 participantes | Rotterdam, Países Bajos | Estudio de cohortes prospectivo de 13 años | Vínculo entre la calidad subjetiva del sueño y el riesgo de demencia en la población general | - . Índice de calidad del sueño de Pittsburgh - . Monitoreo de registros médicos - . Modelo de regresión de Cox | No hubo evidencias significativas entre una mala calidad de sueño subjetiva con mayor riesgo de demencia | 22 |
| Sung (2017) | 92.079 participantes | Taiwán, China | Estudio de cohortes prospectivo de 11 años | Estudio a gran escala del grado de asociación entre trastornos del sueño y la demencia | Base de datos de investigación nacional de seguros de salud de Taiwán | Trastorno del sueño como indicador temprano de demencia a corto y largo plazo | 21 |
| Cedernaes (2017) | 111 estudios | - | Revisión bibliográfica | Estudio de los mecanismos comunes entre la patogénesis de la EA y los ciclos del sueño-vigilia que pueden acelerar el desarrollo y la progresión de la enfermedad | Literatura científica disponible sobre el tema | Los mecanismos compartidos aumentan la progresión de la demencia. Principalmente el insomnio, la carga amiloidea y los niveles oxidativos | 25 |
| Diem (2016) | 1.245 mujeres | EE. UU. | Estudio de cohorte longitudinal prospectivo en 5 años | Estudio de la asociación entre las medidas objetivas de sueño-vigilia y el riesgo de deterioro cognitivo incidente | Evaluación cognitiva: - . Minimental - . Actigrafía: Sleeo-Watch ambulatory monitoring - . Escala de depresión geriátrica | Menor eficiencia del sueño, mayor latencia y variabilidad en la eficiencia y tiempo total de sueño, se asocian con mayores probabilidades de desarrollar deterioro cognitivo | 21 |
| Kim (2019) | 83 casos 331 controles | EE. UU. | Estudio de casos y controles | Patrones de sueño discriminativos | - . Variables clínicas - . EEG | Se extrajeron 5 patrones significativos que / proporcionaron un vínculo entre el sueño y la vigilia repetida, el sueño REM anormal e insomnio | 22 |
| Zhao (2018) | 15 artículos | - | Revisión selectiva | Influencia de la dieta, del ejercicio físico y de la calidad del sueño en el riesgo/protección frente a la demencia | Literatura científica disponible sobre el tema | Factores modificables basados en el estilo de vida tienen evidentes repercusiones sobre el desarrollo de demencia | 20 |
| Cagnin (2017) | 30 participantes con DCL 32 con EA 33 controles | Italia | Estudio de casos y controles | Perfil del sueño-vigilia en la DCL, EA y controles | - . Índice de calidad del sueño de Pittsburgh - . Escala de somnolencia de Epworth - . Diarios de sueño de 12 días | 21 | |
| Levendowski (2019) | 24 DCL 15 EA 6 cuerpos de Lewy 120 controles | EE. UU. | Estudio de casos y controles | Estudio de la asociación de la posición supina del sueño con los trastornos neurodegenerativos | - . Grabaciones de Sleep Profiler en el hogar | Mayor tiempo en posición supina (> 2 h/noche) se asoció con mayor prevalencia de enfermedad neurodegenerativa diagnosticada | 22 |
| Wilfling (2019) | 38 residencias 1.187 residentes con demencia | Alemania | Estudio observacional transversal multicéntrico | Prevalencia de alteraciones del sueño y posibles factores asociados | - . Inventario de trastornos del sueño (SDI) - . Registro de residencias de Alemania | Prevalencia del 23% de los casos en alteraciones del sueño | 22 |
| Pyun (2019) | 104 participantes con EA y APOE conocido | Corea | Estudio observacional transversal | Prevalencia del “síndrome de la puesta de sol” en pacientes con EA y la asociación entre puesta de sol y ser portador del gen APOE | - . Cuestionario de calidad del sueño para pacientes con demencia - . Cuestionario sobre el síndrome de la puesta de sol | Presencia del síndrome de puesta de sol en el 27,8% de la muestra / APOE, alteraciones de fase NREM y una demencia más grave se asocian con mayor riesgo de síndrome de puesta de sol | 22 |
| Hung (2018) | 51.734 participantes con insomnio primario y 25.8715 con insomnio no primario | Taiwán | Estudio de casos y controles | Asociación entre insomnio primario y demencia | - . Clasificación internacional de enfermedades - . Base de datos del instituto nacional de salud de Taiwán | Insomnio primario como predisponente en el desarrollo de demencia con aumento de riesgo 2,14 veces Mayor riesgo en cuanto a menor edad se contraiga el insomnio | 22 |
| Andrade (2018) | 184 estudios | - | Revisión bibliográfica | Estudio de la relación entre la AOS y la EA | Literatura científica disponible sobre el tema | Aumento del riesgo de EA en la patología de la AOS relacionada con alteraciones de la arquitectura del sueño, hipoxia intermitente, estrés oxidativo y cambios hemodinámicos | 22 |
| Kim (2018) | 93 estudios | - | Revisión bibliográfica | Estudio de la relación entre ritmo circadiano y trastornos del sueño-vigilia en adultos mayores | Literatura científica disponible sobre el tema | Incremento fisiológico de cambios en el ritmo circadiano que intensifica el deterioro de la EA mediante trastornos del sueño-vigilia | 22 |
βA: beta-amiloide; AOS: apnea obstructiva del sueño; APOE: apolipoproteína E; DCL: demencia con cuerpos de Lewy; EA: enfermedad de Alzheimer; ECG: electrocardiograma; EEC: electroencefalograma; LCR: líquido cefalorraquídeo; PET: tomografía por emisión de positrones; RM: resonancia magnética; TC: tomografía computarizada.
Relación insomnio-demencia
La literatura revisada apunta a la relación bidireccional entre el insomnio y la demencia, en especial en la EA y los cuerpos de Lewy. El insomnio tiende a ser consecuencia de la demencia y, a su vez, factores intrínsecos de la demencia, promotores de la desorientación y la alteración del ritmo circadiano, que tienen como consecuencia el insomnio. Así apuntan revisiones como la de Almondes et al. en 201611, que encuentran un riesgo aumentado en 1,53 veces de que haya demencia en adultos mayores con insomnio. Quedando bocetado en estudios observaciones transversales como el de Zhou (2019)12, donde los trastornos del sueño se produjeron en el 55,9% de los pacientes con EA frente a solo el 15,2% de los controles, con una latencia y un período de sueño prolongado13-15, t en el grupo de EA se refirió una disminución de la calidad subjetiva de sueño, lo que, a su vez, se relacionó con un aumento de la presencia de síntomas psicóticos. Asimismo, una disminución de la calidad del sueño se asoció positivamente con la depresión y la apatía (64,2%)12.
Diversos estudios parecen argumentar que una vigilia prolongada o una actividad neuronal excesiva es la característica más unificadora que subyace al vínculo entre el sueño y la patología de la EA15.
Influencia de las alteraciones del sueño en la demencia
Las alteraciones más comunes son somnolencia diurna excesiva, síndrome de la puesta de sol (SPS), sueño fragmentado, largos períodos de inducción del sueño, reducción cuantitativa de la fase REM, alteraciones de los usos y complejos k, disminución de las ondas lentas y disminución de la cantidad-calidad de este14-16.
La prevalencia por categorías sería del 10-20% en quejas de insomnio o insatisfacción con el sueño, mientras que el trastorno del insomnio se describe con una prevalencia del 6-10% en la población general, que se acentúan en mayores de 60 años de sexo femenino, con más comorbilidades y de nacionalidad estadounidense e hispanos14,17.
Si nos centramos en el sexo, la bibliografía existente muestra como las mujeres tienen un mayor riesgo de EA en comparación con los hombres, así como de experimentar quejas del sueño, más probabilidades de tener niveles más altos de inflamación sistémica, y mayor aumento de la inflamación asociada con la alteración del sueño17,18.
Alteraciones del sueño como factor de riesgo en la demencia
Una reducción de la calidad del sueño y un aumento de la vigilia nocturna causan un aumento de los depósitos de bA en las primeras etapas de la EA. Contribuyendo así a la progresión de la enfermedad y a la degeneración de estructuras cerebrales que per se regulan procesos cognitivos y del sueño, acelerándose y acentuándose el proceso14,17.
La influencia del sueño fragmentado en individuos con mayores niveles de alteración del sueño muestra una tasa más rápida de deterioro cognitivo y un mayor riesgo de desarrollar EA durante los 6 años de seguimiento, en comparación con individuos con niveles más bajos de alteración del sueño (fragmentación del sueño en el percentil 10)17.
Se ha descrito que de manera autoinformada, tanto una duración habitual del sueño corta (< 5 h) como larga (> 10 h) se asoció con un aumento de la morbilidad y la mortalidad17. Sin embargo, el insomnio adquirido en la vejez no se asoció significativamente a demencia, así como la reducción de sueño. Pero una duración prolongada del sueño, más de 9 h, en comparación con aquellos con 7-8 h de sueño, sí supone un factor asociado6,19.
Consecuencias de la alteración de sueño y retroalimentación positiva
La propia alteración de los ciclos sueño-vigilia tiene repercusiones anatómicas y cerebrales que perpetúan el desajuste. Los problemas crónicos del sueño podrían aumentar el riesgo de deterioro cognitivo y demencia. Estas asociaciones se apoyan en fundamentos biológicos, que postulan que el sueño fisiológico se implica en la eliminación de bA, un sello patológico de la EA17,20.
Tanto el deterioro cognitivo, como las alteraciones en el ciclo sueño-vigilia, son típicas de la etapa de la senescencia, y aún son más pronunciadas en el EA, tanto en cuanto a la gravedad y grado de la patología, reforzándose la visión causal subyacente entre estos dos fenómenos que ocurren en el envejecimiento, y aún son más pronunciadas en la EA, debido a la gravedad de la enfermedad21.
Desequilibrio de glutamato
Al reducir el sueño, resulta una disfunción en la depuración de astrocitos ApoE regulada por el metabolismo del lactato. Este mecanismo sustenta que una pérdida de las oscilaciones diurnas de bA, tras su agregación, conduciría a una respuesta astroglial localizada favorecida, reduciendo el apoyo neurometabólico de los astrocitos, lo que provocaría un exceso de glutamato en la hendidura sináptica y, con ello, propicionaría la vigilia. El exceso de glutamato desencadena una afluencia patológica de calcio, la cual provoca sinaptotoxicidad y muerte neuronal, lo que favorece la progresión de la EA y justifica el deterioro21.
Influencia de la demencia en alteraciones en el sueño
Varias líneas de evidencia sugieren que los procesos neurodegenerativos asociados con la EA pueden causar trastornos del sueño y del ritmo circadiano en los seres humanos.
Estudios con videopolisomnografía22 muestran que la neurodegeneración de las áreas subcorticales que modulan el ciclo sueño-vigilia da como resultado una arquitectura anormal del sueño, provocando alteraciones en la fase REM y en las características del sueño.
De la misma forma, en el estudio de Cedernales et al. en 2017, se observó una correlación entre el detrimento de sueño y el menor número de neuronas en el núcleo ventrolateral en 45 adultos mayores. Dicha región se describe bajo funciones que promueven el sueño e inhiben las regiones del cerebro que activan la vigilia23.
En la revisión de Cedernales et al. en 2017 se proporcionó un apoyo adicional para la existencia de un vínculo bidireccional en lugar de unidireccional entre la interrupción del sueño y la EA. El estudio mostró como aquellos con una alta carga de bA en la corteza prefrontal medial (característica típica de la EA) tenían una menor actividad de onda lenta durante el sueño NREM. Además, se encontró que la carga de bA prefrontal estaba asociada con una consolidación de la memoria dependiente del sueño deficiente, muy probablemente mediada por sus efectos sobre las ondas lentas en fase NREM23.
Alteraciones del ritmo circadiano
La bidireccionalidad causa-efecto de las alteraciones en el sueño y la demencia, se fundamenta al orientar la búsqueda fisiopatológica en las alteraciones de los ciclos circadianos. En la EA se observa deterioro de la función del núcleo supraquiasmático, responsable de la regulación del ritmo circadiano y, con ello, del ritmo de sueño-vigilia, siendo una de sus causas el depósito de bA y de placas seniles, descrito anteriormente como producto de la privación de sueño, y la pérdida de células en esta región en la EA15,17. Sin embargo, hay autores que señalan que los trastornos del sueño-vigilia en la EA pueden tratarse más de una consecuencia que de una causa, puesto que la deposición de bA en el cerebro es detectable años antes del inicio clínico de la EA13,23.
Las alteraciones del sueño han demostrado tener repercusiones anatómicas en trabajadores a turnos que eran más propensos a dormir poco. Se apreció mayor neurodegeneración y envejecimiento cognitivo en aquellos con menor capacidad para recuperarse después de turnos más exigentes. En estos, se visualizó el aumento de la atrofia del lóbulo temporal en pruebas de resonancia magnética18,23.
Se ha observado que los trabajadores por turno de mayor edad reportan más problemas para dormir y tienen tasas más altas de uso de hipnóticos que los trabajadores más jóvenes18.
Kim et al. en 2018 midieron los ritmos de actividad circadiana mediante actigrafía de muñeca en 1.282 mujeres mayores sanas que vivían en la comunidad (edad media, 83 años), que se evaluaron clínicamente y clasificaron tras 5 años según su estado cognitivo (normal, deterioro cognitivo leve y demencia). Descubrieron que los ritmos de actividad circadiana se asociaron prospectivamente con la demencia incidente o deterioro cognitivo leve. Las mujeres mayores que presentaban ritmos disminuidos de actividad tenían más probabilidades de desarrollar demencia o deterioro cognitivo leve. Siendo las alteraciones más frecuentes una amplitud de ritmo disminuida frente a la media y un retraso en el momento de la actividad máxima18,23. En promedio, el período circadiano en las mujeres es más corto que en los hombres, lo que se considera un predisponente para trastornos del sueño18.
Criterios de inclusión solo para 3 fármacos: melatonina, trazodona y ramelteón.
Síndrome de la puesta de sol
El SPS, es el empeoramiento de los síntomas neuropsiquiátricos al final de la tarde o al anochecer en personas con desorientación, predominantemente en personas con EA y otros tipos de demencia. Se describe como causa fundamental, la existencia de un mayor deterioro de las zonas reguladoras del ritmo circadiano en la EA. Lo que produciría desajustes en los ritmos de actividad, como una mayor actividad nocturna y una acrofase retardada de actividad. El SPS tiene lugar de forma más habitual entre las 6 y las 9 de la tarde. Aquellos con SPS presentan de forma más frecuente estados de ansiedad, depresión, labilidad emocional, delirio y alucinaciones.
Discusión
La EA se considera una de las patologías más incapacitantes y prevalentes en personas mayores de 65 años, y en un futuro se estima un aumento de esta circunstancia. El principal factor invalidante es la pérdida de memoria y el detrimento en las funciones de la vida diaria, disminuyendo la calidad de vida. Sin embargo, otro de los factores que más afecta a la cotidianidad de estas personas son las alteraciones del sueño, que además las sufren sus cuidadores en las etapas más avanzadas de la enfermedad24.
Estas alteraciones del sueño se han discutido ampliamente en el estudio que nos ocupa, tratando de abordarlo desde varias perspectivas para una mejor compresión de los mecanismos fisiopatológicos que comparten la demencia y las alteraciones en el sueño, en busca de su bidireccionalidad causal.
La literatura apunta, en una porción significativa de los casos, que las alteraciones en el sueño y en patrones polisomnográficos se pueden observar hasta en 20 años antes del desarrollo de la EA y otras demencias. Y, aunque este puede ser un factor causal o consecuencia de una predisposición a la patología, en los resultados se observa que una intervención en la calidad del sueño de personas mayores con EA repercute en una disminución del cuadro clínico y una disminución de la incidencia en personas que previamente podrían estar predispuestas por factores genéticos, de comorbilidades o por historia previa de alteraciones del sueño.
Los resultados de este estudio ponen en valor la importancia del sueño como determinante de la salud, como se mostró en el informe Lalonde en 197425, en el que se describe que el estilo de vida marca más del 40% de los determinantes de la salud, frente al 3% de los recursos que se destinan a ello, que cobra especial sentido en el caso de la EA, que empieza a acumularse de 15 a 20 años antes de las primeras manifestaciones de disfunción cognitiva y de deterioro funcional, y que un retraso de 5 años en la aparición puede reducir los costes del tratamiento en un 40%24.
De tal forma, que una detección temprana de alteraciones en el sueño y su seguimiento mediante polisomnografía podría ser especialmente interesante en las personas mayores con antecedentes familiares y portadores de alelos de APOE4, o en pacientes con otras enfermedades neurodegenerativas20.
Otros estudios enfocan la corrección del ciclo sueño-vigilia en el ajuste de los ritmos circadianos, mediante exposición regular a intensidades adecuadas de luz y ejerciendo cierta actividad, para un mayor contraste de ciclos de actividad-reposo para favorecer la actividad del núcleo supraquiasmático26,27. Actualmente no existe un tratamiento modificador de la enfermedad comprobado para la EA, solo se dispone de tratamientos sintomáticos. Aunque una de las posibles causas detectadas fue que los tratamientos se iniciaron demasiado tarde en la progresión de la EA28, por lo que la prevención mediante la mejora de los ritmos circadianos y el sueño, junto con una detección precoz, podría ser clave en la reducción de la progresión de la enfermedad o para la atenuación de sus síntomas.
Conclusiones
Las principales conclusiones que se pueden extraer de presente trabajo muestran que hay una bidireccionalidad causal entre la presencia de demencia y las alteraciones en el sueño. Esto hace que la interacción de los mecanismos fisiopatológicos de ambos, constituyan una sinergia promoviendose el uno al otro.
En cuanto a los factores implicados en el desarrollo de demencias pueden ser modificables o no modificables. Los modificables son: uso de CPAP en la apnea obstructiva del sueño, comorbilidades debidas a la dieta, tabaco, alcohol y factores inflamatorios derivados del estilo de vida, así como los no modificables son: APOE4.
Finalmente, destacar la existencia de predictores de la EA en biomarcadores bioquímicos (bA, Tau, orexinas, promotores de la inflamación, alteraciones en la serotonina, noradrenalina, glutamato, etc.) y genéticos (APOE en alelo 4), que tienen efectos sobre el sueño, así como cambios en alteraciones del patrón polisomnográfico (reducción de la fase no REM y el sueño de onda lenta, fragmentación del sueño, aumento de la latencia, despertar precoz, reducción del tiempo total de sueño, aumento excesivo del tiempo total de sueño, somnolencia diurna y sensación de sueño poco reparador) también predicen la EA hasta 20 años antes de la aparición de síntomas cognitivos y psicológicos.