Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.83 no.1 Madrid ene./feb. 2009
De la utilidad de los medicamentos al valor terapéutico añadido y a la relación coste-efectividad incremental
From the therapeutic utility to the added therapeutic value and the incremental cost-effectiveness ratio
Jaume Puig-Junoy (1) y Salvador Peiró (2)
(1) Departament dEconomia i Empresa i Centre de Recerca en Economia i Salut (CRES). Universitat Pompeu Fabra, Barcelona.
(2) Centro Superior de Investigación en Salud Pública (CSISP). Dirección General de Salud Pública, Conselleria de Sanitat. Valencia.
Financiación: Este trabajo forma parte del Proyecto de Investigación SEJ2007-66133 que contó una ayuda del Ministerio de Educación y Ciencia.
Conflicto de intereses: JP y SP han recibido honorarios por participar como conferenciantes o profesores en cursos o reuniones científicas, y otras actividades financiadas total o parcialmente por diversas compañías farmacéuticas y por diversas administraciones sanitarias. También han dirigido o participado en proyectos de investigación financiados por la industria farmacéutica o por administraciones sanitarias.
Dirección para correspondencia
RESUMEN
Desde la perspectiva social los conceptos de utilidad terapéutica y grado de innovación de los nuevos medicamentos deben ser referidos al valor social añadido por los mismos en relación a las alternativas de tratamiento disponibles y los costes añadidos que comporten, esto es, a su relación coste-efectividad incremental. Los elementos analíticos que destacan en esta aproximación son: 1) las dimensiones del valor social del medicamento, que van más allá de las medidas de resultado convencionales para incorporar también medidas de calidad de vida relacionada con la salud, comodidad de los pacientes y sus familias, consumo de recursos sanitarios evitado y pérdidas productivas evitadas; 2) el carácter relativo o incremental de este valor, que debe cuantificarse frente a las alternativas preexistentes, no frente a placebo, y en condiciones de uso real; y 3) el gasto incremental que conlleve la administración del nuevo medicamento. El enfoque de la relación coste-efectividad incremental es el adecuado para las decisiones de cobertura de un determinado tratamiento por las aseguradoras públicas, del precio que se está dispuesto a pagar por él y de las situaciones clínicas y grupos de pacientes en los que se recomienda. El análisis coste-efectividad incremental y el establecimiento de un umbral indicativo del coste máximo que se está dispuesto a pagar por año de vida ajustada por calidad ganado son los elementos esenciales de esta aproximación, que no exige fijar el precio de los nuevos medicamentos en el umbral de la disponibilidad a pagar.
Palabras clave: Farmacoeconomía. Coste-efectividad. Evaluación de medicamentos. Coste de los medicamentos. Aseguramiento sanitario.
ABSTRACT
From the social perspective, the concepts of therapeutic utility and degree of innovation of new drugs should be referred to their social added value in relation to the available treatment alternatives and the added costs that they imply; that is, to their incremental cost-effectiveness ratio. The analytic elements highlighting this approach are: 1) the dimensions of the social value of the medication that should go beyond the conventional outcomes measures to also incorporate measures of health related quality of life, patient and family comfort and convenience, healthcare consumption avoided and productive losses avoided; 2) the relative or incremental character of this value that should be quantified in front of previous alternatives –not versus placebo– and under conditions of real use; and 3) the incremental costs that bears the administration of the new medication. The incremental cost-effectiveness ratio is the appropriate approach for decisions about coverage of a treatment by the public insurer, the price that he is willing to pay for the drug, and the clinical situations and patient groups in which it is recommended. The incremental cost-effectiveness analysis and the use of an indicative threshold of the maximum cost that the society is willing to pay for one additional quality adjusted life year are the essential elements of this approach, which doesnt require to fix the price of the new medications at the threshold of the willingness to pay.
Key words: Pharmacoeconomics. Cost-Effectiveness. Drug evaluation. Drug costs. Insurance, health, reimbursement.
Introducción
En los recurrentes debates sobre la deseabilidad de los aumentos del gasto sanitario la cuestión relevante reside en saber si más dinero para la atención sanitaria permitirá conseguir una mejor salud y una mayor calidad de vida relacionada con la salud (CVRS). La deseabilidad social del aumento de la financiación destinada a los servicios sanitarios depende básicamente del valor de las mejoras de salud y de bienestar que supongan los servicios concretos en los que se invierta. El problema real que enfrenta el Sistema Nacional de Salud (SNS) no es tanto el de la factibilidad o sostenibilidad de los aumentos del gasto sanitario público como el de la deseabilidad social de los resultados de su aplicación. Esto es, aún cuando podamos permitirnos determinados crecimientos en el gasto la pregunta relevante es si estos incrementos valen (en términos de mejora de salud) más de lo que cuestan (en términos de recursos consumidos y de los usos alternativos de tales recursos).
Conseguir mejoras de la relación entre la cantidad y calidad de vida ganada y los recursos empleados para obtener tales ganancias requiere políticas de salud adecuadas, pero sobre todo se trata de propiciar decisiones clínicas coste-efectivas. La eficiencia de un sistema sanitario depende esencialmente de que los profesionales asistenciales (quienes adoptan la mayoría de las decisiones de prevención, diagnóstico, tratamiento y rehabilitación) tengan la información y los incentivos necesarios para actuar de forma coste-efectiva.
En este trabajo se revisan algunos elementos del concepto de utilidad terapéutica de los medicamentos y su utilización en el marco de las decisiones relacionadas con la autorización y acceso al mercado sanitario de nuevos medicamentos, la regulación de precios, el nivel de financiación pública, y su incorporación a formularios, guías terapéuticas, y recomendaciones de los sistemas electrónicos de prescripción. La trama que relaciona estos elementos une, de forma directa, el concepto de utilidad terapéutica con la valoración de la contribución de las innovaciones farmacéuticas al incremento marginal en el estado de salud (supervivencia, reducción de morbilidad, CVRS, comodidad y otros) y al incremento marginal en el consumo de recursos (relación coste-efectividad incremental).1
La caja de herramientas para ensamblar estos conceptos pasa por los instrumentos clásicos del análisis de eficacia (ensayos clínicos de eficacia y seguridad), del análisis de efectividad (estudios observacionales o ensayos pragmáticos, estudios de utilización de medicamentos, de adecuación y calidad de la prescripción) y del análisis de eficiencia (evaluación económica y, fundamentalmente, los análisis coste-efectividad y coste-utilidad). Este es el instrumental al que acudir para modernizar la información que debe orientar (no necesariamente determinar) unas decisiones más eficientes y responsables en la financiación pública de medicamentos. Otros conceptos importantes a tener en cuenta, además del central que gira sobre la relación entre los beneficios adicionales que aportan los nuevos medicamentos sobre los previamente disponibles (eficacia y efectividad relativa o marginal) y los incrementos de gasto que suponen sobre lo que ya gastábamos (la relación coste-efectividad incremental),2 se refieren a la disposición social a pagar por las mejoras y al impacto presupuestario de éstas.
El valor de los medicamentos: de la perspectiva clínico-farmacológica a la perspectiva del conjunto de la sociedad
Desde la perspectiva social, los conceptos de utilidad terapéutica y de grado de innovación de los nuevos medicamentos deben ser referidos al valor social añadido por los mismos en relación a las alternativas de tratamiento y/o de diagnóstico disponibles para la misma indicación. Los elementos analíticos que destacan desde esta perspectiva son las dimensiones del valor social del medicamento y el carácter relativo o incremental de este valor. En general, el valor de las innovaciones sanitarias y farmacéuticas depende conjuntamente de su efecto incremental sobre los resultados en salud y en CVRS (outcomes), y de su efecto sobre los recursos implicados (coste de oportunidad). El valor de estas innovaciones puede ser cuantificado adoptando una perspectiva restringida (por ejemplo, la perspectiva del financiador de los servicios, del proveedor sanitario, del paciente, etc.) o bien desde una perspectiva social amplia que reúna el impacto global sobre pacientes y poblaciones en resultados y consumo de recursos.
La utilidad terapéutica
Desde la perspectiva clínico-farmacológica, la comúnmente denominada utilidad terapéutica se suele limitar, como se puede verificar fácilmente en la literatura sobre el tema, a valorar la eficacia de los medicamentos a través de los resultados de ensayos clínicos con variables clínicas intermedias (surrogate endpoints) o variables finales (outcomes) convencionales (mortalidad, morbilidad), incluyendo los aspectos de seguridad y tolerabilidad (efectos adversos, complicaciones). Se trata de un enfoque riesgo/beneficio centrado en los resultados de eficacia y seguridad obtenidos de estudios experimentales (ensayos clínicos), en buena parte frente a comparadores inactivos (placebo) y más o menos alejados de la práctica clínica real. Esta aproximación sólo recoge algunos de los aspectos de interés desde la perspectiva más amplia de la sociedad dado que no incluye buena parte de los beneficios y olvida los costes. Aunque se trata de un enfoque útil en la autorización de medicamentos para su comercialización, y es lógico que sea el fundamentalmente empleado por las agencias públicas de autorización de medicamentos, es una perspectiva insuficiente para las decisiones sobre regulación de precios, financiación pública de medicamentos e incorporación a guías terapéuticas o recomendaciones de los sistemas electrónicos de prescripción.
Conviene advertir que la combinación de esta perspectiva, básicamente clínica y farmacológica, con criterios pseudo-económicos como el coste farmacéutico por tratamiento/día o el coste por dosis diaria definida (DDD) se aleja aún más de la perspectiva social, y puede conducir a la utilización ineficiente de medicamentos de bajo precio (si su beneficio en términos de mejora de salud es pequeño) o a la no-utilización de medicamentos eficientes de alto precio (pese a que sus beneficios pudieran compensar sobradamente sus costes).
El valor terapéutico añadido
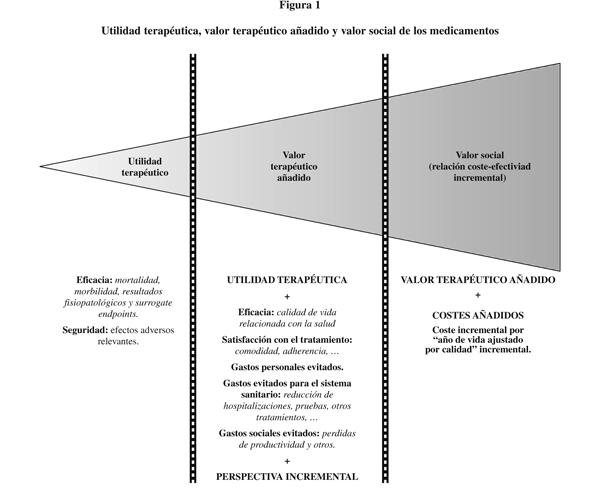
El valor social de un medicamento no puede limitarse a las medidas de eficacia y seguridad clásicas de los ensayos clínicos controlados, sino que debe extenderse a todos los posibles efectos positivos sobre la salud (incluyendo las medidas de CVRS) y sobre el bienestar de los pacientes (satisfacción con el tratamiento, comodidad y preferencias del paciente), así como a los posibles gastos individuales y sociales evitados (incluyendo las ventajas en productividad laboral).3 El concepto de valor terapéutico añadido (added therapeutic value) amplia el de utilidad terapéutica (figura 1) para incluir estos otros resultados que –más allá de los resultados clínicos clásicos– son importantes desde el punto de vista de los pacientes, sus familias y la sociedad.
Pero, además, el concepto de valor terapéutico añadido incorpora la dimensión incremental, esencial desde el punto de vista del valor social de las innovaciones. Nuevo no significa forzosamente más valioso o mejor, y por ello el valor terapéutico debe definirse de forma incremental respecto a las alternativas de tratamiento preexistentes. El hecho de que se trate de una métrica de carácter incremental limita el interés de las comparaciones frente a placebo (aunque mantengan su interés en los estudios de seguridad) y exige un mejor conocimiento de la eficacia y efectividad comparada con los tratamientos ya disponibles para condiciones similares. Esta dimensión requiere ser reevaluada a lo largo del tiempo, en la medida que la mejora de la información (eficacia frente a placebo versus eficacia frente a comparadores, efectividad versus eficacia) permita una estimación más apropiada del valor incremental de las innovaciones.
Conocer el valor terapéutico realmente añadido por un medicamento también requiere valorar su utilización en condiciones próximas a la realidad, esto es, en estudios de efectividad y seguridad en condiciones reales o casi-reales (ensayos pragmáticos y estudios observacionales). Por ejemplo, el valor añadido por los inhibidores de la bomba de protones (IBP) es muy diferente en las poblaciones seleccionadas de los ensayos clínicos (con úlceras pépticas, esofagitis de reflujo, y otras indicaciones autorizadas) que cuando se usa para molestias gástricas indefinidas o como gastroprotección generalizada. En otras palabras: los IBP no muestran los mismos beneficios sociales en las indicaciones para las que fueron autorizados que para sustituir las sales de fruta.
El análisis incremental, en todo caso, comporta importantes dificultades: la elección del comparador (elección, dosis y posología), la selección de pacientes y grupos de riesgo, y diversos sesgos en la investigación clínica4,5 y económica6 que complican notoriamente la valoración respecto al enfoque riesgo-beneficio de la utilidad terapéutica. Pero estimar el valor terapéutico añadido es la pieza central para determinar el lugar de un fármaco en el arsenal terapéutico y su superioridad (o no) respecto a medicamentos con similares indicaciones. Por ello es tan importante que la investigación clínica, farmacoepidemiológica y la investigación en resultados, aborden estos aspectos desde perspectivas locales.
La relación coste-efectividad incremental
Pero el valor terapéutico añadido supone todavía un enfoque limitado del valor social de los medicamentos. Desde una perspectiva comprehensiva del conjunto de la sociedad, el valor social de los nuevos medicamentos depende de este valor terapéutico añadido pero también de los costes añadidos -farmacéuticos, sanitarios y otros- que conlleve su administración (figura 1). El hecho de que un nuevo medicamento aporte mejoras adicionales respecto a sus predecesores no implica que social –o individualmente– estemos dispuestos a pagar cualquier precio por estas mejoras, y la decisión al respecto depende tanto de la importancia de las mejoras como de la importancia del incremento de gasto que supongan (o, en otras palabras, de las mejoras que podrían obtenerse en un uso alternativo de ese mismo gasto: de su coste de oportunidad). No considerar los costes adicionales de los medicamentos sería como elegir los platos de un restaurante con un menú sin precios. Por ello, la lógica de la perspectiva social rebasa la de la utilidad terapéutica y la del valor terapéutico añadido para pivotar sobre la relación coste-efectividad incremental, esto es, la relación entre el valor terapéutico añadido y el coste de oportunidad.
Nótese que desde esta perspectiva la aportación de valor puede darse en ambos lados de la balanza o tan sólo en uno de ellos: en los resultados y/o en los costes. La mejora de la relación coste-efectividad incremental puede darse por el lado del valor terapéutico añadido, pero la ausencia de un valor incremental importante por este lado (el caso de los denominados mee-too) no constituye prueba de ausencia de valor social de un nuevo medicamento si éste, con un precio más bajo, presenta una mejor relación coste-efectividad que las alternativas disponibles. La idea de excluir de la financiación pública los sustitutos terapéuticos o me-toos, aún justificable porque en países como España suelen comercializarse a precios más altos que el fármaco original, sólo se puede sostener si se olvida su potencial para incrementar la relación coste-efectividad por reducción del primer término de la relación.
El enfoque de la relación coste-efectividad incremental es el adecuado a las decisiones de cobertura de un determinado tratamiento por las aseguradoras públicas, del precio que se esta dispuesto a pagar por él, y de las situaciones clínicas y grupos de pacientes en que se recomienda (esto es, de las guías farmacoterapéuticas, las recomendaciones informáticas, y los sistemas de indicadores de prescripción asociados o no a incentivos).
Obviamente, en la adopción de decisiones de cobertura y financiación pública, las administraciones sanitarias pueden considerar, además de la perspectiva conjunta de la sociedad, las limitaciones presupuestarias del conjunto del sector público, lo que le podría llevar a no financiarlo (tienen usos alternativos para estos recursos que producirían más salud o bienestar) o a financiarlo parcialmente. Ello situaría las decisiones de financiación más allá de la simple inclusión/exclusión de la cobertura y abriría margen objetivo para la inclusión parcial, con una aportación financiera (copago) a cargo del paciente en función de la efectividad relativa del medicamento y de su relación coste-efectividad incremental. Así, por ejemplo, un seguro público puede establecer una disposición a pagar reducida o incluso nula por el valor del medicamento relacionado con la simple mejora de la comodidad en la administración del mismo, como podría ser el caso de las formas de liberación prolongada o retardada de un principio activo, pero sí podría manifestar una disposición a pagar positiva por la potencial mejora en la adherencia terapéutica (copagos diferenciales y evitables).
Innovaciones regulatorias en el sistema comparado
Existen evidencias para apoyar que la financiación eficiente de innovaciones farmacéuticas esté informada y guiada por criterios objetivos relacionados con la aportación marginal del fármaco a la mejora del estado de salud y a la relación coste-efectividad incremental7,8. Para ello resulta extremadamente útil una evaluación objetiva y transparente realizada por una agencia especializada, externa e independiente de los agentes implicados, en lugar de precios inflexibles para toda la vida establecidos de forma poco transparente. Esta agencia podría ser de ámbito europeo (un Euro-NICE, National Institute for Clinical Excelence)9,10 aunque las decisiones de financiación y cobertura en cada sistema sanitario quedaran retenidas a nivel nacional o regional.
La tarea de un euro-NICE, o la de las agencias nacionales creadas con un propósito similar, se enfrenta al problema de la adaptabilidad o externalidad de los estudios de evaluación económica realizados en otros medios. Aunque un estudio sea técnicamente impecable, puede no ser aplicable a nuestro entorno por diversas razones (diferencias epidemiológicas en el riesgo basal entre poblaciones, diferentes estructuras de costes, diferencias en esperanza de vida que afecten al resultado final, etc.)11-12. Las agencias tendrían que realizar una importante labor de adaptación de sus informes a la realidad sanitaria de cada país. A este respecto, los problemas de calidad de los estudios publicados pueden resultar una gran dificultad: Antoñanzas et al, al revisar una muestra de 27 estudios sobre enfermedades infecciosas encontraron que 11 de ellos no son transferibles de ninguna manera y el índice global de externalidad para los restantes era de sólo 0,54 en una escala entre 0 y 113.
En los últimos años, varios países -de la Unión Europea y otros- han adoptado medidas tendentes a incorporar la evaluación económica en el conjunto de herramientas que guían las estrategias de adopción y difusión de las innovaciones sanitarias14-17. Muchos de ellos hacen también estudios de impacto presupuestario que –aunque el análisis de las reglas de decisión basadas en el coste de oportunidad escapan al alcance y objetivo de este texto– no deben ser interpretados tanto como un conflicto entre las reglas de eficiencia y las presupuestarias, sino precisamente como forma de tener en cuenta el coste de oportunidad para los aseguradores18. Cada país ha adoptado diferentes procesos en sus respectivas apuestas por insertar la información proveniente de la evaluación económica de tecnologías sanitarias en la toma de decisiones,19-21 pero lo relevante es que la cultura evaluadora proveniente de este campo ha impregnado a los agentes sanitarios en diferentes ámbitos de decisión. Es el primer paso de un proceso que se debe consolidar y en el que se debería avanzar en los próximos años.
La relación coste-efectividad (el coste por Año de Vida Ajustado por Calidad, AVAC) puede y debe ser una buena guía para la identificación de prioridades relacionadas con la financiación pública de los nuevos medicamentos y tecnologías médicas para un financiador inteligente. Resulta difícil imaginar una aproximación a la valoración de la utilidad terapéutica y del grado de innovación que se encuentre alejada de la medida de la aportación marginal del fármaco, así como a la mejora del estado de salud y a la relación coste-efectividad incremental. ¿Cuál es el valor económico de las mejoras adicionales en el estado de salud que han aportado los cambios tecnológicos en el diagnóstico y tratamiento de las enfermedades? ¿Qué parte de la mejora en la esperanza de vida y en la calidad de vida es atribuible a la atención sanitaria y a los medicamentos? ¿Valen lo que cuestan los aumentos en el gasto en medicamentos?
Los criterios para una priorización transparente, eficiente y equitativa en las decisiones de financiación pública de los medicamentos deben estar guiados por la evidencia sobre la relación entre el beneficio marginal (contribución marginal a la mejora del estado de salud) y el coste marginal del tratamiento completo (a no confundir con el precio de venta del medicamento), por ejemplo mediante el establecimiento de un umbral indicativo de coste máximo por AVAC. El principal criterio de financiación pública (accesibilidad) para los medicamentos innovadores protegidos por una patente debe ser que el nivel de esta financiación dependa de la eficacia relativa de la innovación y de la relación coste-efectividad, siendo éstos criterios la mejor expresión de la utilidad terapéutica y del grado de innovación de los nuevos medicamentos desde el punto de vista de la sociedad.
El marco regulador en España: oportunidades para el cambio
En España el marco regulatorio y la voluntad de los gestores sanitarios que toman las decisiones no ha favorecido hasta el momento el desarrollo de la evaluación económica de medicamentos aplicada a la financiación pública de las prestaciones sanitarias y sobre los precios de medicamentos y de tecnologías médicas. Hay declaraciones políticas pero se obvia su traslación normativa21. Tampoco se ha favorecido el uso de instrumentos y criterios objetivos tendentes a la inclusión del valor social de los medicamentos en la negociación del precio y del nivel de financiación, más allá de algunas experiencias voluntarias y secundarias.3 Aunque la Ley del Medicamento de 1990 establecía que la prestación farmacéutica del SNS se debería realizar mediante la financiación selectiva en función de los recursos disponibles y, por tanto, dejaba abierta la puerta a la introducción de la evaluación económica de medicamentos, ello no se tradujo en la implementación de mecanismos que de forma transparente establecieran los elementos determinantes del proceso de fijación del precio.
El Plan Estratégico de Política Farmacéutica para el SNS (2004) apostaba claramente por el análisis farmacoeconómico en varios de sus puntos. No obstante, en la Ley de Uso Racional y Garantías de Medicamentos y Productos Sanitarios de 2006 no se hacía ninguna referencia explícita a esta aproximación y por el momento habrá que esperar su desarrollo reglamentario para ver si el análisis coste-efectividad incremental y el de impacto presupuestario se incorporan como criterios de peso en la negociación del precio y en la decisión de financiación pública de los medicamentos. La promulgación del reglamento que ordene las funciones de la Agencia Española de Medicamentos y Productos Sanitarios y la creación del Comité de Evaluación de la utilidad terapéutica de los nuevos medicamentos serán las piedras de toque en esta cuestión.
Por otra parte, no parecería lógica la exclusión de la evaluación económica dentro de las medidas de evaluación de los costes y beneficios terapéuticos de los nuevos medicamentos. No sólo por la dinámica europea sino por coherencia con la financiación de otro tipo de tecnologías sanitarias. Así, el Real Decreto 1030/2006 por el que se establece la cartera de servicios comunes del SNS y el procedimiento para su actualización, sí establece que Para la definición, detalle y actualización de la cartera de servicios comunes se tendrá en cuenta la seguridad, eficacia, eficiencia, efectividad y utilidad terapéuticas de las técnicas, tecnologías y procedimientos, así como las ventajas y alternativas asistenciales, el cuidado de grupos menos protegidos o de riesgo y las necesidades sociales, y su impacto económico y organizativo , aspecto ampliado y reforzado por la Orden SCO/3422/2007, de 21 de noviembre por la que se desarrolla el procedimiento de actualización de la cartera de servicios del SNS. No sería razonable que este criterio se aplicara a un programa de cribado o a un determinado dispositivo médico y no a un medicamento sin estar dispuestos a asumir un elevado coste social derivado de la distorsión que supondría tener un sistema con reglas diferentes para la adopción de tecnologías sanitarias en función de su naturaleza (medicamento vs. no medicamento). En las Comunidades Autónomas (CCAA) y en el Consejo Interterritorial el apresurado proceso de toma de decisiones del SNS relacionadas con la financiación pública y el precio de la vacuna del virus del papiloma humano ofrece un buen ejemplo en España, que también se da en otros países, de la vigencia de un marco de competencia política y electoral, ajena al criterio coste-efectividad y a cualquier ejercicio de transparencia y de rendición de cuentas de las decisiones públicas, y debería inducir a la reflexión y a la revisión de los procedimientos actuales de toma de decisiones.22
Junto a los recientes cambios en el marco normativo nacional merece destacar otra serie de factores impulsores de la evaluación económica de medicamentos. En primer lugar, y aunque desde hace años existen agencias –en plural– de evaluación de tecnologías sanitarias, en los últimos tiempos han crecido tanto en número como en recursos. A las partidas presupuestarias aportadas por las respectivas CCAA, se han sumado los fondos acordados por la Conferencia de Presidentes, las crecientes convocatorias de proyectos de evaluación de tecnologías sanitarias convocadas por el Instituto Carlos III y las propias CCAA, y la incorporación de algunas de estas agencias a los grupos CIBER o a las Redes temáticas de Investigación Cooperativa. Aunque en España, a diferencia de otros países,23,24 aún no se ha realizado un estudio sobre el impacto de los estudios de evaluación de tecnologías, el escenario que ofrece el florecimiento de agencias regionales de evaluación (aún ajenas a la existencia de economías de escala en la sistematización y producción de evidencia científica) ofrece un amplio margen para la mejora de la información necesaria para las decisiones públicas.
En segundo lugar, en un contexto de crecimiento del gasto en medicamentos, tanto en términos absolutos como en porcentaje del total de recursos sanitarios del SNS, y dada la ambigüedad mostrada por la Administración Central sobre el papel que ha de jugar la evaluación económica de medicamentos, varias CCAA han creado unidades de evaluación de medicamentos que han ido incorporando el componente económico. Fruto de ello ha sido la creación del Comité Mixto de Evaluación de Nuevos Medicamentos compuesto por Andalucía, País Vasco, Navarra, Aragón y Cataluña, cuyo objetivo principal es el análisis de la aportación terapéutica de los nuevos medicamentos.
En tercer lugar, en el medio sanitario, incluso a niveles de microgestión, se comienza a transitar del todo vale, sea cual sea el precio a la pregunta relevante de si ¿vale lo que cuesta?. El esfuerzo realizado en programas de formación que incorporan conceptos generales de economía y gestión de la salud o específicos de evaluación económica y los propios sistemas de incentivos a prescriptores van cambiando la mirada de los profesionales y provocan que el discurso de la eficiencia vaya calando. Un buen ejemplo de este cambio de cultura es la experiencia desarrollada por el Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos (GENESIS) de la Sociedad Española de Farmacia Hospitalaria, con el desarrollo de Guías Farmacoterapéuticas que incorporan información relativa a la relación coste-efectividad de los fármacos analizados25.
En suma, parece que en parte por ver que en Europa y otros países se consolidan iniciativas de empleo de la evaluación económica y que son útiles para reducir la opacidad de la regulación farmacéutica26, y en parte por el convencimiento de distintos actores del sistema sanitario de la utilidad de estas herramientas, se está produciendo una cierta efervescencia en el empleo de la evaluación económica en el SNS. Pero aún falta mucho esfuerzo para culminar este proceso. Y para ello deben emitirse las señales adecuadas desde los más altos niveles del SNS (Consejo Interterritorial).
A modo de conclusión (y un apunte sobre los 30.000 euros por AVAC)
En España parece conveniente y necesario revisar la clasificación y los criterios para establecer el grado de aportación relativa que supone un nuevo medicamento.27 Las CCAA y el Consejo Interterritorial deberían tomar la palabra y seguir el ejemplo de lo que ya existe y funciona en Europa. La omisión de los criterios de coste-efectividad incremental en el desarrollo reglamentario de la Ley de Uso Racional y Garantías de Medicamentos de 2006 supondría un baño de naftalina para el recién estrenado marco legal español, por comparación con las innovaciones reguladoras en Europa28.
En este contexto, las decisiones de autorización y comercialización (seguridad, eficacia y calidad) deberían ser independientes de las de financiación pública (efectividad marginal relativa y relación coste/efectividad incremental). A efectos de la financiación pública, en términos generales debería distinguirse el tratamiento regulador de las innovaciones con una elevada efectividad marginal (cada vez más establecida en el ámbito europeo) del resto de innovaciones (muy numerosas, con una reducida efectividad marginal y con una deficiente relación coste/efectividad incremental). Para las primeras es recomendable establecer la disposición a pagar, por parte de la administración pública, sobre la base de criterios relativos al coste/efectividad incremental (cuarta garantía de la evaluación económica de medicamentos), al estilo del NICE británico29 o, mejor, un NICER (National Institute for Cost-Effectiveness Reviews), tal como propuso Alan Williams30.
A los nuevos medicamentos (y a las tecnologías médicas) hay que pedirles no sólo eficacia respecto del placebo sino eficacia relativa respecto a los medicamentos con los que van competir o que van a sustituir. La evidencia disponible indica que en muchos casos la aportación marginal es muy pequeña pero, en cambio, el coste es mucho más elevado. La estandarización de los procedimientos de evaluación económica,31 el requerimiento y realización en condiciones de transparencia e independencia de este tipo de estudios para las innovaciones (alejamiento de las evaluaciones promocionales cercanas a los departamentos de marketing de la industria) y el establecimiento de un umbral indicativo del coste máximo por AVAC que no se debiera superar (por ejemplo 30.000 euros por AVAC o un valor análogo mejor fundamentado, flexible pero representativo de la disposición social a pagar)32 serían actuaciones en la línea de determinar la disposición pública a pagar en función del valor adicional del medicamento y para proporcionar una orientación inequívoca a la actividad investigadora.
A este respecto hay que señalar que en un sistema que pretende fomentar la innovación mediante patentes, mientras la patente esté vigente y se mantenga el poder de monopolio, la condición de eficiencia puede aproximarse si el precio del medicamento es inferior a su utilidad marginal desde la perspectiva social (sean 30.000 euros por AVAC o cualquier otro valor que refleje mejor la disponibilidad social a pagar máxima). Por tanto la evaluación económica cumple su cometido estableciendo si una innovación está por dentro o fuera de este límite. Al revelar este límite la industria tiende a buscar precios en torno al mismo (endogeneización), pero si el precio por AVAC adicional iguala el límite máximo de la disponibilidad a pagar todo el excedente (bienestar) que supone la innovación va a parar a manos del fabricante. La evaluación económica convencional no es útil para establecer el reparto del excedente entre el consumidor y el productor, una tarea que en régimen de competencia corresponde a los mercados y en un entorno de monopolios (patentes) y monopsonios (sistemas de salud públicos de amplia cobertura) debe establecerse mediante negociación entre las partes.
En todo caso, el financiador público no tiene por qué considerar que por debajo de este límite de 30.000 euros por AVAC adicional cualquier precio es aceptable, sino que debe buscar una distribución equilibrada del excedente con los productores (salvo que esté dispuesto a ceder todo el valor monetario del excedente social que puede conseguirse con una innovación, al innovador). Hay que señalar que el problema de la endogeneización de precios no es una limitación de la evaluación económica (que no está diseñada para esto) ni un comportamiento inadecuado de la industria, sino una responsabilidad del regulador/financiador público que, además de tener en cuenta el valor social del medicamento (aspecto en el que sí tiene la ayuda de la evaluación económica) debe considerar la distribución del excedente. Es especialmente en este terreno donde la utilización de los umbrales indicativos del coste por AVAC debe ser matizada por otros factores, desde las características de la enfermedad y la población afectada (volumen, gravedad, existencia de otros tratamientos disponibles, etc.), al impacto presupuestario y, si se quiere, las políticas industriales (aunque para abordar estas últimas existen otras fórmulas más transparentes que las políticas de precios).
Los umbrales reales de coste por AVAC adicional deben ser flexibles (más orientativos que barreras rígidas). Pero también revisables en el tiempo. En el momento de autorizar y decidir cobertura y precio, la información sobre medicamentos es todavía muy escasa (especialmente en los aspectos de mayor interés para valorar efectividad incremental: ausencia de estudios en condiciones reales y respecto a comparadores activos). La evaluación económica puede lidiar con la incertidumbre sobre los parámetros y los modelos, pero también suele ser muy sensible a sus modificaciones, lo que requiere reevaluación y revisión de las decisiones ante nuevas informaciones que afecten a estos parámetros.
Adicionalmente, basar los precios en el valor añadido ofrece señales inequívocas sobre qué innovaciones son más valoradas y qué tipo de nuevos medicamentos se espera de la industria farmacéutica33. Y aunque es cierto que las señales emitidas desde España, muy periférica en el terreno de la innovación farmacéutica, tienen escasa capacidad para fomentar la innovación verdadera, no es menos cierto que su alineamiento con otros países europeos que ya han empezado a transitar estas políticas contribuiría a estimular unos objetivos de investigación de más interés desde la perspectiva social.
Agradecimientos
Los autores agradecen los valiosos comentarios y sugerencias a Pedro Cervera, Beatriz González, Ricard Meneu, Juan Oliva y Lluís Segú. Una versión previa de este trabajo fue utilizada como base de discusión para un proyecto sobre Utilidad Terapéutica desarrollado por la Fundación Gaspar Casal. El apartado sobre el marco regulador está parcialmente basado en un trabajo previo de Juan Oliva, Enrique Bernal y Jaume Puig referenciado en la bibliografía.
Bibliografía
1. Detsky AS, Laupacis A. Relevance of cost-effectiveness analysis to clinicians and policy makers. JAMA. 2007; 298(2):221-4. [ Links ]
2. Rawlins MD, Culyer AJ. National Institute for Clinical Excellence and its value judgements. BMJ. 2004;329:224-7. [ Links ]
3. Soto Álvarez J. Valor terapéutico añadido de los medicamentos: ¿qué es, cómo se evalúa y cuál debería ser su papel en política farmacéutica? An Med Interna. 2005;22(1):39-42. [ Links ]
4. Peiró S. La construcción de la evidence b(i)ased Medicine. Gest Clín Sanit. 2005; 7:131-8. [ Links ]
5. Smith R. Medical journals are an extension of the marketing arm of pharmaceutical companies. PLoS Med. 2005; 2(5):100-2. [ Links ]
6. Peiró S, Sanfélix-Gimeno G, Ridao M, Cervera-Casino P. La evaluación económica de medicamentos: ¿Ciencia o marketing farmacéutico?. Farm Aten Primaria. 2006; 4(1):28-30. [ Links ]
7. Del Llano J, Pinto JL, Abellán JM. Eficiencia y Medicamentos: Revisión de las Guías de Evaluación Económica. La Cuarta Garantía. Madrid: Forum Sanofi Aventis; 2008. [ Links ]
8. Tierney M, Manns B; Members of the Canadian Expert Drug Advisory Committee. Optimizing the use of prescription drugs in Canada through the Common Drug Review. CMAJ. 2008; 178(4):432-5. [ Links ]
9. Drummond M. Time for a change in drug licensing requirements? Eur J Health Econ. 2002; 3: 137-8. [ Links ]
10. Maynard A. Towards a Euro-NICE? Eurohealth. 2001; 7(2):26. [ Links ]
11. Manca A, Willan AR. Lost in translation: accounting for between-country differences in the analysis of multinational cost-effectiveness data. Pharmacoeconomics. 2006; 24(11):1101-19. [ Links ]
12. Sculpher MJ, Drummond MF. Analysis sans frontières: can we ever make economic evaluations generalisable across jurisdictions? Pharmacoeconomics. 2006; 24(11):1087-99. [ Links ]
13. Antoñanzas F, Rodríguez-Ibeas R, Juárez C, Hutter F, Lorente R, Pinillos M. Transferability indices for health economic evaluations: methods and applications. Health Econ. 2008; [Epub ahead of print]. [ Links ]
14. Hutton J, McGrath C, Frybourg JM, Tremblay M, Bramley-Harker E, Henshall C. Framework for describing and classifying decision-making systems using technology assessment to determine the reimbursement of health technologies (fourth hurdle systems). Int J Technol Assess Health Care. 2006;22(1):10-8. [ Links ]
15. Morgan SG, McMahon M, Mitton C, Roughead E, Kirk R, Kanavos P, Menon D. Centralized drug review processes in Australia, Canada, New Zealand, and the United kingdom. Health Aff (Millwood). 2006; 25(2):337-47 [ Links ]
16. Laupacis A. Economic evaluations in the canadian common drug review. Pharmacoeconomics. 2006;24(11):1157-62. [ Links ]
17. Wettermark B, Godman B, Andersson K, Gustafsson LL, Haycox A, Bertele V. Recent national and regional drug reforms in Sweden: implications for pharmaceutical companies in Europe. Pharmacoeconomics. 2008;26(7):537-50. [ Links ]
18. Cohen JP, Stolk E, Niezen M. Role of budget impact in drug reimbursement decisions. J Health Polit Policy Law. 2008;33(2):225-47. [ Links ]
19. Pinto JL, Abellán JM. Farmacoeconomía: el gran reto de la sanidad Pública. Humanitas. 2008. En prensa. [ Links ]
20. Sacristán JA, Dilla T, Antoñanzas F, Pinto JL. Evaluación económica de medicamentos: experiencias y vías de avance. Gac Sanit. 2008; 22(4):354-7. [ Links ]
21. Oliva J, Puig-Junoy J, Bernal Q. Evaluación económica de medicamentos: experiencias y vías de avance. Una visión complementaria. Gac Sanit. 2008; 22(4):358-61. [ Links ]
22. Puig-Junoy J. El cost doportunitat de la vacunació massiva del VPH: just do it versus whats the hurry?, En: Valoració del risc i priorització de polítiques de salut pública: a propòsit de la pertinència de la vacuna del papillomavirus humà. Barcelona: Comitè Consultiu de Bioètica de Catalunya; 2008. p. 25-30. [ Links ]
23. Sheldon TA, Cullum N, Dawson D, Lankshear A, Lowson K, Watt I, et al. Whats the evidence that NICE guidance has been implemented? Results from a national evaluation using time series analysis, audit of patients notes, and interviews. BMJ. 2004; 329:999 [ Links ]
24. Hanney S, Buxton M, Green C, Coulson D, Raftery J. An assessment of the impact of the NHS Health Technology Assessment Programme. Health Technol Assess. 2007; 11:1-200. [ Links ]
25. Magem D, Gilabert A, Argimon JM. Evaluaciones económicas como instrumento de soporte a la gestión de la prestación farmacéutica. XXVIII Jornadas de Economía de la Salud. Asociación de Economía de la Salud. Salamanca, 28-30 de mayo de 2008. [ Links ]
26. Dhalla I, Laupacis A. Moving from opacity to transparency in pharmaceutical policy. CMAJ. 2008; 178(4):428-31. [ Links ]
27. Asociación de Economía de la Salud (AES). Posición de la Asociación de Economía de la salud en relación a la necesidad de un mayor uso de la evaluación económica en las decisiones que afectan la financiación pública de las prestaciones y tecnologías en el Sistema Nacional de Salud. Barcelona: Asociación de Economía de la Salud; 2008. Accesible en HYPERLINK http://www.aes.es www.aes.es [ Links ]
28. Puig-Junoy J. La financiación y la regulación del precio de los medicamentos en el Sistema Nacional de Salud: cambios y continuidad. Gac Sanit. 2007; 21(1):1-4. [ Links ]
29. Pearson SD, Rawlins MD. Quality, innovation, and value for money, NICE and the British National Health Service. JAMA. 2005; 294(20): 2618-22. [ Links ]
30. Williams A. What could be NICER than NICE? OHE Annual Lecture. London: The Office of Health Economics; 2004. [ Links ]
31. López-Bastida J, Oliva J, Antoñanzas F, García-Altés A, Gisbert R, Mar J, et al. Una propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias: ¿ha llegado el momento?. Econ Salud. 2008. 21(62):1-2. [ Links ]
32. Sacristán JA, Oliva J, Del Llano J, Prieto L, Pinto JL. ¿Qué es una tecnología sanitaria eficiente en España? Gac Sanit. 2002; 16(4):334-43. [ Links ]
33. Jayadev A, Stiglitz J. Two Ideas To Increase Innovation And Reduce Pharmaceutical Costs And Prices. Health Aff (Millwood). 2008; Dec 16. [Epub ahead of print]. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Jaume Puig-Junoy
Departament dEconomia i Empresa
Universitat Pompeu Fabra
C/ Trias Fargas 25-27
08005 Barcelona
Correo electrónico: jaume.puig@upf.edu