INTRODUCCIÓN
La enfermedad neumocócica es considerada como una causa importante de morbi-mortalidad, especialmente en niños pequeños y personas de edad avanzada o con condiciones de riesgo. Sin embargo, su incidencia real es difícil de estimar considerando que no siempre se establece un diagnóstico etiológico de la infección neumocócica, que existe amplia variabilidad entre las tasas reportadas en diferentes regiones y que, además, la epidemiología de la enfermedad está cambiando en los últimos años1,2.
En cuanto a su prevención, la existencia de más de 90 distintos serotipos de Streptococcus pneumoniae ha complicado enormemente la obtención de una vacuna plenamente eficaz3. Hasta principios de la pasada década solo se disponía de la “clásica” vacuna neumocócica polisacárida tricosavalente (VNP23), vacuna que era y sigue siendo recomendada para los adultos de edad avanzada y/o alto riesgo pero que tiene el inconveniente de no ser inmunógena en niños pequeños4. Dado que la vacuna polisacárida no resultaba efectiva en la población infantil (grupo de riesgo para la infección neumocócica), en el año 2000 se introdujo una vacuna neumocócica conjugada heptavalente (VNC7) incluyendo siete tipos de polisacáridos capsulares conjugados con una proteína transportadora (lo cual convertía la vacuna en T-dependiente y permitía ser empleada a partir de las seis semanas de edad)5.
La VNC7, que cubría el 70-90% de los serotipos causantes de enfermedad invasiva en los niños cuando la vacuna fue comercializada5, proporcionó inicialmente excelentes resultados, observándose importantes reducciones en la incidencia de infecciones invasivas causadas por los siete serotipos vacunales entre los niños y también entre los adultos (mediante un efecto indirecto por inmunidad de grupo)6,7. Sin embargo, posteriormente se observó un fenómeno de reemplazo de serotipos (con aparición de algunos serotipos emergentes)8,9 y dos nuevas vacunas conjugadas incorporando progresivamente más serotipos (VNC10 y VNC13) fueron comercializadas en 2009 y 2010, respectivamente, para reemplazar a la pionera VNC7 en la inmunización infantil10,11. Posteriormente, considerando buenos datos de inmunogenicidad la nueva VNC13 fue también aprobada en 2012 para su uso en adultos con condiciones de alto riesgo12,13.
Durante la pasada década, tras la introducción de la VNC7 en pediatría, diferentes estudios reportaron cambios en la incidencia y distribución de serotipos causantes de ENI (tanto en los niños como en los adultos) en nuestro país14,15,16,17,18. En la actualidad, tras la introducción de la segunda generación de vacunas conjugadas y considerando el posible impacto epidemiológico directo e indirecto que pudiera derivarse de su uso, resulta imprescindible disponer de datos actualizados sobre la epidemiología de la enfermedad neumocócica después de la introducción de estas vacunas.
En nuestro ámbito, los datos publicados sobre cobertura de vacunación antineumocócica en adultos de Cataluña muestran coberturas intermedias/altas para la clásica VNP23 (aproximadamente un 60% en personas de alto riesgo y/o mayores de 65 años) y bastante bajas para la nueva VNC13 (aproximadamente 1-2% en individuos de alto riesgo).19 Si consideramos vacunación infantil, se ha reportado una cobertura vacunal VNC7/VNC13 del 48% en niños con algún factor de riesgo en Cataluña20.
El presente estudio tuvo como objetivo describir la incidencia, letalidad y distribución serotípica de la enfermedad neumocócica invasiva (ENI) en la población general de la región de Tarragona durante el periodo 2012-2015 (cuatrienio inmediatamente posterior a la introducción de la VNC13).
SUJETOS Y MÉTODOS
Estudio obsevacional retrospectivo que incluye todos los casos de ENI (Streptococcus pneumoniae aislado en sangre, líquido cefalorraquídeo, líquido pleural/articular/peritoneal o muestras de tejidos profundos obtenidas de forma estéril mediante punción-aspiración o biopsia) ocurridos en personas de cualquier edad en la región de Tarragona (comarcas del Tarragonès, Alt Camp y Baix Penedès) entre 01/01/2012 y 31/12/2015. La región de estudio incluye 19 Áreas Básicas de Salud (ABS) y dos hospitales de referencia (Hospital Universitario Joan XXIII y Hospital Santa Tecla) que cuentan con sendos servicios de Laboratorio y Microbiología que realizan las analíticas y cultivos tanto de los pacientes hospitalizados como ambulatorios correspondientes a las 19 ABS de las tres comarcas de estudio (con una población total de 395.178 habitantes al inicio del estudio)21. El estudio no incluye muestras procedentes de exudados oculares, óticos, nasofaríngeos, bronquiales, cutáneos/heridas u orina.
El estudio fue aprobado por el comité ético de la institución (CEIC IDIAP Jordi Gol, expediente P14/134) y fue realizado conforme a los principios requeridos a los estudios observacionales.
Los códigos diagnósticos CIE-9 (Clasificación Internacional de Enfermedades, 9ª revisión) del Conjunto Mínimo Básico de Datos (CMBD) de altas hospitalarias/urgencias de los dos hospitales de referencia fueron utilizados para identificar inicialmente la ocurrencia de posibles casos de infección neumocócica (códigos CIE-9: 038.2, 041.2, 320.1, 481, 510.9, 567.1 y 711.0). Adicionalmente, los registros específicos de Microbiología de los dos laboratorios de referencia del ámbito del estudio fueron también revisados para identificar posibles casos de ENI no detectados en los códigos diagnósticos de altas hospitalarias/urgencias. Los presuntos casos de ENI inicialmente identificados fueron posteriormente revisados por parte de dos investigadores médicos que confirmaron el diagnóstico clínico y microbiológico y clasificaron los casos en función de la forma de presentación clínica de la ENI.
La identificación y aislamiento de S. pneumoniae fue realizada mediante técnicas microbiológicas convencionales en los dos laboratorios de referencia del área de estudio. Las cepas fueron enviadas al Laboratorio Nacional de Referencia de Neumococcos del Instituto de Salud Carlos III (Majadahonda, Madrid) donde fueron serotipadas mediante reacción de Quellung22.
Análisis estadístico. Las tasas de incidencia fueron calculadas considerando en el denominador la población adscrita al inicio del estudio (66.811 niños ≤14 años; 269.391 personas 15-64 años; 58.976 personas ≥65 años)19. Los intervalos de confianza (IC) para las tasas de incidencia fueron calculados asumiendo una distribución de Poisson para eventos infrecuentes.
Se calculó la prevalencia de infecciones causadas por serotipos incluidos en la VNC7 (tipos 4, 6B, 9V, 14, 18C, 19F y 23F), en la VNC10 (tipos 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F y 23F), en la VNC13 (tipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F) y en la VNP23 (tipos 1, ,2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F). Chi cuadrado y test exacto de Fisher fueron usados en la comparación de proporciones, considerándose diferencias significativas si p<0.05 (bilateral).
RESULTADOS
Se observaron 171 casos de ENI, de los que 99 (57,9%) ocurrieron en varones y 72 (42,1%) en mujeres. Por grupos etarios, 21 (12,3%) ocurrieron en niños ≤14 años, 64 (37,4%) en personas de 15-64 años y 86 (50,3%) en personas ≥65 años. Ochenta casos (46,8%) ocurrieron en invierno, 33 (19,3%) en primavera, 16 (9,3%) en verano y 42 (24,6%) en otoño.
De las 171 muestras estudiadas, 133 (77,8%) correspondían a hemocultivos, 15 (8,8%) líquido cefalorraquídeo, 13 (7,6%) líquido pleural, 5 (2,9%) líquido articular, 4 (2,3%) tejido muscular/partes blandas profundas y 1 (0,6%) líquido peritoneal.
La incidencia global de ENI fue de 10,82 episodios por 100.000 personas-año (IC 95%: 7,89-14,50). La incidencia fue 5,38 por 100.000 (IC 95%: 3,33-8,55) para neumonía bacteriémica, 0,76 por 100.000 (IC 95%: 0,16-2,22) para empiema, 0,95 por 100.000 (IC 95%: 0,26-2,43) para meningitis, 0,63 por 100.000 (IC 95%: 0,13-1,84) para sepsis, 2,40 por 100.000 (IC 95%: 1,15-4,42) para bacteriemia no focal y 0,63 por 100.000 (IC 95%: 0,13-1,84) para otras manifestaciones (tabla 1).
Tabla 1 Incidencia de enfermedad neumocócica invasiva (ENI) según grupos de edad y tipo de presentación clínica, en la región de Tarragona durante 2012-2015
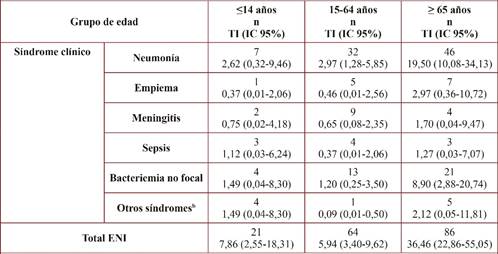
TI: Tasas de incidencia expresadas por 100.000 personas/año; bIncluye 5 casos de artritis, 4 abcesos musculares/partes blandas profundas y 1 peritonitis
Se produjeron 12 casos fatales, lo cual supuso una letalidad del 6,8% (ninguno en niños, 9,3% en personas de 15-64 años, 6,9% en personas ≥65 años; p<0,001)
El serotipo responsable fue identificado en 132 (77,2%) de los 171 casos totales de ENI. Siete serotipos (3, 7F, 8, 12F, 14, 19A y 22F) representaron más de la mitad (56,8%) del total de serotipos identificados. Entre los niños (n=13), el serotipo más frecuente fue el 15B (23,1%) seguido por el 14 (15,4%). En personas de 15-64 años (n=50), los serotipos más prevalentes fueron el 7F (14%), 8 (12%), 12F (10%), 14 (10%) y 19A (10%). En personas ≥65 años (n=69), los serotipos más prevalentes fueron el 12F (10,1%), 19A (8,7%) y 22F (8,7% (tabla 2).
Tabla 2 Distribución de los 132 serotipos identificados según grupos de edad de los pacientes
| Grupo de edad | Serotipo (nº casos)a |
|---|---|
| ≤14 años (n=13) | 3, 7F, 12F, 14 (2), 15B (3), 19A, 19F, 24, 24F, 35B |
| 15-64 años (n=50) | 1 (2), 3 (3), 6B (2), 7F (7), 8 (6), 9N (2), 9V, 10A (2), 12F (5), 14 (5), 15A (2), 15B, 17F, 19A (5), 21, 22F, 23A, 23B, 31, 35F |
| ≥65 años (n=69) | 1, 3 (5), 4 (2), 6C (3), 7F (5), 8 (5), 9N (4), 10A, 12F (7), 14 (3), 15A, 15B, 16F, 18C, 19A (6), 19F (2), 21, 22F (6), 23B, 24, 24F (2), 31 (3), 33F (2), 34, 35B (2), 35F, 38 |
aEl número entre paréntesis indica el número de casos en los que un serotipo específico fue identificado en cada grupo de edad
Del total de 132 serotipos identificados, 19 (14,4%) fueron causados por serotipos incluidos en la VNC7, 35 (26,5%) en la VNC10, 56 (42,4%) en la VNC13 y 104 (78,8%) en la VNP23 (p<0,001). La tabla 3 muestra la distribución de los serotipos causantes de ENI, por grupos de edad, en función de si el serotipo responsable estaba incluido en las distintas formulaciones vacunales.
Tabla 3 Distribución de los serotipos causantes de enfermedad neumocócica invasiva, por grupos de edad, en función de si el serotipo responsable estaba incluido en las distintas formulaciones vacunales conjugadas (VNC) o polisacárida (VNP), Tarragona 2012-2015
| Serotipos vacunales | ≤14 años (N=13) n (%) | 15-64 años (N=50) n (%) | ≥ 65 años (N=69) n (%) | p | Total (N=132) n (%) |
|---|---|---|---|---|---|
| VNC7 serotipos | 3 (23,1) | 8 (16,0) | 8 (11,6) | 0,511 | 19 (14,4) |
| VNC10 serotipos | 4 (30,8) | 17 (34,0) | 14 (20,3) | 0,231 | 35 (26,5) |
| VNC13 serotipos | 6 (46,2) | 25 (50,0) | 25 (36,2) | 0,311 | 56 (42.4) |
| VNP23 serotipos | 10 (76,9) | 43 (86,0) | 51 (73,9) | 0,277 | 104 (78,8) |
| No VNP23/VNC13 serotiposa | 3 (23,1) | 7 (14,0) | 18 (26,1) | 0,277 | 28 (21,2) |
aNingún caso fue ocasionado por el serotipo 6A (único serotipo incluido en la VNC13 que no está incluido en la VNP23)
Cuatro de los doce casos fatales estaban vacunados con la VNP23, siendo uno de ellos un varón de 54 años con sepsis (cepa no serotipada) mientras que los otros tres correspondían a personas mayores de 65 años con neumonía bacteriémica (serotipo 7F), empiema (serotipo 6C) y meningitis (serotipo 24F). De los ocho casos fatales que no habían recibido previamente la vacuna antineumocócica, cinco eran menores de 65 años (dos meningitis (una por serotipo 14 y otra no serotipada), dos sepsis [una por serotipo 9N y otra no serotipada] y un empiema por serotipo 6B), mientras que entre los mayores de 65 años no vacunados los casos letales fueron dos pacientes con neumonía bacteriémica (una por serotipo 3 y otra no serotipada) y un paciente con sepsis (serotipo 8).
DISCUSIÓN
Como hallazgos principales, el presente estudio muestra una tasa global de incidencia que podría calificarse como intermedia y una letalidad relativamente baja. Las personas ≥65 años soportaron la mayor carga de la enfermedad, con una tasa de incidencia que casi quintuplicó a la observada en niños y sextuplicó a la observada en personas de 15-64 años.
En comparación al periodo 2006-2009 en la misma región23, la incidencia global de ENI se redujo un 49%. Los datos muestran un descenso en la incidencia de ENI en todos los grupos etarios, apreciándose una reducción del 70% entre los niños, del 51% en personas de 15-64 años y del 39% en personas >65 años23. A destacar, sin embargo, que la letalidad apenas se ha modificado en estos años23.
La importante reducción en el número de casos de ENI pediátricos refleja el impacto de la introducción sucesiva de la VNC7/VNC13 en la población infantil17,18, a pesar de alcanzarse sólo coberturas intermedias puesto que la vacuna no era entonces financiada públicamente para todos los niños en Cataluña24. Por otra parte, considerando que la cobertura de vacunación en adultos con la vacuna polisacárida 23-valente apenas ha variado en la última década (alrededor del 55-60%) y que el uso de la VNC13 es muy bajo en adultos (menor al 1%)19,nuestros resultados sugieren también la existencia de un cierto efecto indirecto de la vacunación infantil en las reducciones de incidencia observadas en adultos25-26.
Resaltamos que entre las personas >65 años la cobertura de serotipos causantes de ENI fue más del doble para la vacuna 23-valente que para la VNC13. Este resultado fue a expensas de la notable incidencia de infecciones por los serotipos 8, 12F y 22F (no contenidos en la VNC13 pero sí en la VNP23), lo cual debería ser tenido en cuenta para priorizar el uso de una u otra vacuna en estos pacientes (actualmente en el centro del debate sobre si extender o no el uso de la VNC13 en adultos)13,27. En este sentido, un estudio que evaluó la prevalencia de serotipos causantes de ENI en adultos de seis países ya reportó un incremento en el diferencial de cobertura serotípica entre la VNC13 y la VNP23 en los últimos años28, y similar tendencia ha sido también observada en nuestra región (donde la proporción de casos de ENI causados por serotipos incluidos en la VNC13 y la VNP23 alcanzaban un 73% y un 80%, respectivamente, en 2006-2009)29.
Como principales fortalezas del presente estudio señalamos su diseño poblacional (englobando tres comarcas en la región de Tarragona) y resaltamos el hecho de que la metodología empleada fue similar a la utilizada previamente en 2006-2009 (lo cual facilita la comparabilidad de los resultados)23. Como limitación, el estudio está realizado en un área geográfica relativamente pequeña, lo cual limita la generalización de sus resultados. Resaltamos, no obstante, que nuestros resultados son concordantes con los últimos datos reportados por el Sistema de Notificación Microbiológica de Cataluña (que estimó una incidencia global de ENI de 12,3 episodios por 100.000 habitantes/año durante 2012-2014)30.
En conclusión, en los primeros años tras la introducción de las nuevas vacunas conjugadas, la incidencia y letalidad de la ENI en la región de Tarragona puede calificarse como intermedia-baja, destacando que las personas >65 años soportaron la mayor carga de la enfermedad (con un 50% de todos los casos) y que la cobertura serotípica fue casi doble para la vacuna 23-valente que para la 13-valente. Futuros estudios deberán evaluar posibles efectos directos/indirectos que pudieran producirse a partir de 2016 (año en el que se incorporó la vacunación infantil universal con VNC13 al calendario de vacunaciones infantiles sistemáticas en Cataluña)24.














