Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 supl.3 Pamplona 2004
Tratamiento del dolor en el paciente oncológico
Treatment of pain in the oncology patient
A.M. Araujo, M. Gómez, J. Pascual, M. Castañeda, L. Pezonaga, J.L. Borque
| RESUMEN El dolor es un síntoma de alta prevalencia en los pacientes con cáncer y deteriora de forma importante su calidad de vida. Con las medidas enunciadas por la OMS en 1986, que divide en tres escalones ascendentes las distintas opciones terapéuticas de las que disponemos, el dolor puede ser controlado en un alto porcentaje de casos. Aquellos pacientes difíciles de controlar con estas medidas, se pueden beneficiar de la aplicación de técnicas de neuromodulación por expertos en el tratamiento del dolor crónico. Palabras clave. Dolor. Escalera analgésica. Opiáceos. | ABSTRACT Pain is a symptom with a high prevalence in patients with cancer and causes an important deterioration in their quality of life. With the measures laid out by the WHO in 1986, which divides the different therapeutic options available in three ascending steps, pain can be controlled in a high percentage of cases. Those patients who are difficult to control with these measures can benefit from the application of neuromodulation techniques by experts in the treatment of chronic pain. Key words. Pain. Analgesic ladder. Opiates. |
| Servicio de Anestesiología. Reanimación y Terapia del Dolor. Hospital de Navarra. Pamplona. | Correspondencia: Ana Araujo Fernández Servicio de Anestesiología, Reanimación y Terapia del dolor Hospital de Navarra C/ Irunlarrea, 3 31008 Pamplona Tfno. 848422174 |
INTRODUCCIÓN
El dolor en el paciente oncológico es un problema que involucra a muchos protagonistas: el paciente y su familia, médicos, enfermeros, autoridades sanitarias y autoridades de la enseñanza médica, dado que en alguna medida todos lo sufren si no es tratado correctamente.
El dolor no tratado es un determinante clave del deterioro de la calidad de vida ya que disminuye la actividad del enfermo, interfiere con el apetito, el sueño, el estado del ánimo y conlleva a la pérdida del autocontrol.
En la situación actual el 50% de los pacientes con cáncer presentan dolor a lo largo de su enfermedad, independientemente del estadio y en la etapa terminal el dolor está presente en 74% de los casos1.
Dependiendo de los autores, el 80-95% de los cuadros dolorosos se controlan con medicación vía oral. Sólo un bajo porcentaje de casos no responden inicialmente, pero incluso esta cifra disminuye en manos de expertos2.
El informe del Nacional Institute Workshop on Cancer Pain del año 1990 indica que "el tratamiento inadecuado del dolor y de otros síntomas del cáncer es un problema de salud pública serio"3.
TIPOS DE DOLOR EN EL PACIENTE ONCOLÓGICO
Según la OMS el dolor se clasifica en dos tipos: nociceptivo (somático y visceral) y neuropático4,5.
Dolor nociceptivo
Somático
Se produce por estimulación de los nociceptores de la piel, hueso o partes blandas (metástasis óseas, incisiones quirúrgicas y lesiones músculo-esqueléticas). Clínicamente se manifiesta como dolor sordo continuo y bien localizado.
Visceral
Hay una activación de los nociceptores por infiltración, compresión, distensión, tracción o isquemia de las vísceras pélvicas, abdominales o torácicas, así como espasmo de la musculatura lisa de la víscera hueca. La clínica es un dolor mal localizado, profundo y opresivo. Si es agudo se acompaña de cortejo vegetativo: náuseas, vómitos, sudoración, taquicardia y aumento de tensión arterial. Puede irradiarse a zonas distantes de la lesión primaria donde puede existir hiperestimulación cutánea (ej. dolor escapular y de hombro derecho en lesiones biliares).
El dolor nociceptivo es un dolor que responde muy bien a la escalera terapéutica de la OMS, que se comenta más adelante, incluidos los opioides.
Dolor neuropático
Está producido por una lesión del sistema nervioso por compresión tumoral, infiltración de un nervio periférico o médula espinal o por una lesión nerviosa o medular secundaria a cirugía, radioterapia o quimioterapia. La lesión nerviosa condiciona unos cambios anatómicos y neurofisiológicos que inducen la transmisión de impulsos y reorganización del procesamiento central. Se pueden activar los receptores nociceptivos y producir dolor sin estímulo externo. Los nervios lesionados pueden generar descargas rítmicas consecuencia de hiperexcitabilidad de receptores NMDA.
Se manifiesta como un dolor intenso, sensación de escozor o quemazón. Muchas veces se asocia a pérdida de la sensibilidad con o sin hiperalgesia y alodinia. Se pueden producir paroxismos de sensaciones urentes o descargas eléctricas provocadas por potenciales de acción espontáneos.
Indistintamente de que el dolor sea visceral, somático, neuropático o psicógeno, el enfermo oncológico tiene dos secuencias distintas de presentación en el tiempo. La primera es un dolor crónico continuo de fondo, sordo, que le impide dormir, moverse y realizar las tareas elementales de la vida y que es de intensidad variable. Podemos denominarlo dolor basal. La segunda se identifica por episodios de crisis agudas de dolor espontáneas o inducidas de elevada intensidad (EVA 7-9/10), de frecuencia variable y duración incierta y que se producen a lo largo del día y de la noche. A estos episodios de dolor agudo intenso transitorio, previsibles o no, se denominan crisis de dolor irruptivo. Cuando estos incidentes son provocados por el movimiento u otra causa desencadenante conocida (previsibles) hablamos de crisis de dolor incidental. El dolor irruptivo se trata y el dolor incidental se previene. El dolor basal se alivia con una pauta analgésica de opiodes de horario regular y dosis fija que hay que titular en cada paciente. Las crisis de dolor agudo se tratan con una segunda pauta analgésica distinta de la anterior, a demanda, con un fármaco igual o diferente y por una vía de administración en ocasiones diversa. Ambas vías necesitan ser tituladas y para ello es imprescindible saber evaluar bien la respuesta analgésica en cada enfermo.
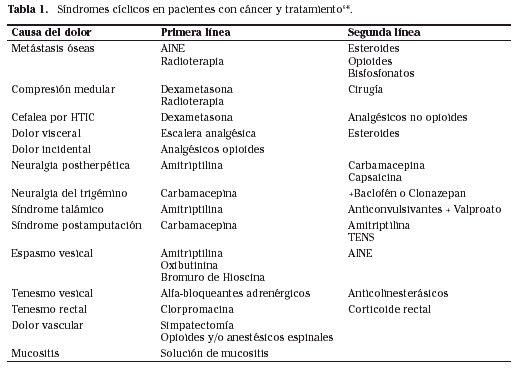
Los diferentes síndromes cíclicos en pacientes con cáncer y su tratamiento6-8 se describen en la tabla 1.
EVALUACIÓN CLÍNICA DEL DOLOR EN PACIENTES CON CÁNCER
El tratamiento correcto del dolor debe comenzar por una evaluación integral del dolor y de las consecuencias que tiene sobre el estado funcional del paciente1,5. Es importante preguntar siempre si hay dolor, ya que el paciente puede no referirlo espontáneamente, recoger y creer todo lo que el paciente nos refiere, establecer una buena comunicación, crear la confianza y seguridad mediante una escucha atenta y dedicación de un tiempo suficiente.
En humanos la respuesta al dolor es expresada generalmente de forma verbal. Los procedimientos para evaluarlo se clasifican en tres grupos: métodos verbales, evaluaciones conductuales y medidas fisiológicas. Los más utilizados son los primeros.
Métodos verbales
Pueden ser de tres tipos: historia clínica, los autoinformes, y los autorregistros.
La historia clínica
Deben ser evaluados los siguientes factores: patocronia, etiología y patogenia, localización e intensidad de los dolores, factores acompañantes, impacto del dolor en la vida personal, terapia analgésica recibida y técnicas no farmacológicas. Hay que completarla con otros procedimientos de evaluación.
Los autoinformes
Son técnicas que evalúan las impresiones subjetivas de los individuos y constituyen el grupo de mayor objetividad en la cuantificación de la intensidad del dolor. De los distintos tipos que existen las más importantes son las escalas cuantitativas. En ellas el paciente hace una valoración global de su dolor. Son de fácil aplicación y tienen niveles de fiabilidad aceptables. Incluye las escalas verbales, las numéricas y las analógico-visuales.
Verbales categóricas
El sujeto escoge el adjetivo o adverbio que más se ajusta a las características de su dolor: ligero, intenso e insoportable.
Escalas numéricas
Las personas escogen un número del uno al diez. Cero es la ausencia de dolor y diez es el máximo dolor soportable.
Escalas visuales analógicas (EVA)
El enfermo marca un punto que corresponde a la intensidad del dolor en un segmento de 10 cm cuyos extremos están clasificados como mínima y máxima intensidad del dolor respectivamente (Fig. 1). Una variante es la escala para niños de Wong-Baquer (Fig. 2).
Los autorregistros
Son procedimientos que se solicitan al paciente para comunicar todos los eventos relacionados con el dolor durante las 24 horas del día. Funcionan como un diario del dolor. Recogen también la repercusión funcional y el grado de bienestar. Son útiles en la fase de titulación de los opioides.
TRATAMIENTO DEL DOLOR
Para tratar adecuadamente el dolor oncológico hay que realizar una correcta evaluación clínica del mismo y una exploración física completa, así como aquellas exploraciones complementarias que puedan aportar resultados de utilidad clínica práctica. Los pacientes con dolor oncológico han de ser evaluados de modo continuo y sus quejas siempre han de tenerse en cuenta, abarcando aspectos físicos, psicológicos y sociales. La estrategia terapéutica se basa en los siguientes principios9,10:
– Tratamiento de la posible causa del dolor.
– Prontitud en el tratamiento para evitar sufrimiento.
– Evaluación de las diferentes posibilidades terapéuticas existentes (farmacológica, radioterapia...)
En principio, el mejor sistema para un control adecuado del dolor en pacientes oncológicos será basarse en la escalera analgésica de la OMS11-13 (Tabla 2). La principal característica de la escalera analgésica de la OMS es la recomendación de prescribir fármacos básicamente analgésicos en función de su potencia analgésica y del tipo de dolor que acusa el paciente. Así se hace un uso más racional e individualizado del tratamiento. Sin embargo, aproximadamente un 20% de ellos no mejora a pesar de la utilización de altas dosis de opiáceos más coadyuvantes y no opiáceos o su utilización se asocia a un alto número de efectos secundarios indeseables. Este hecho ha conllevado que distintos autores hayan propuesto la creación de un cuarto escalón que incluiría entre otras opciones terapéuticas las diferentes técnicas de neuromodulación que se comentan brevemente más adelante.
Principales medicamentos usados en el manejo del dolor oncológico14
Analgésicos no opioides
Constituyen un grupo amplio de medicamentos, químicamente heterogéneos, con diversos grados de actividad analgésica, antiinflamatoria y antipirética. Tienen techo terapéutico, es decir, una dosis máxima diaria por encima de la cual no se consigue un mayor efecto analgésico. Las indicaciones son: dolor de intensidad leve o moderada con afectación ósea o músculo-tendinosa y en la compresión mecánica de pleura o peritoneo. Potencian la acción analgésica de los opioides en el dolor moderado e intenso.
Paracetamol
Dosis inicial: 650-1000 mg cada 4-6 horas por vía oral o rectal. Dosis máxima: 1000 mg/ 4 horas. Potencia analgésica similar al ácido acetilsalicílico.
Los efectos secundarios son: -toxicidad hepática-: dosis dependiente, habitualmente con dosis de 140 mg/kg. Esta dosis disminuye en pacientes alcohólicos o con patología hepática incluso a 2 gramos. A veces aparecen: desorientación, mareos, nefritis intersticial...
Los efectos secundarios generales de los AINE (Tabla 3) son:
– Gastrointestinales: dispepsia, pirosis, úlcera gastroduodenal, hemorragia y perforación.
– Renales: insuficiencia renal, nefritis intersticial, síndrome nefrótico, necrosis papilar.
– Pulmonares: broncoespasmo.
– Hematológicos: discrasias sanguíneas.
– Reacciones de hipersensibilidad: shock anafiláctico, urticaria.
Inhibidores de la COX-2
Estudios recientes en la comprensión del dolor y sus mecanismos fisiopatológicos han permitido el desarrollo de nuevos fármacos. Entre éstos se encuentran los inhibidores de la COX-2, cuya eficacia analgésica es similar a los AINE. Son fármacos que inhiben de manera específica la ciclooxigenasa 2 (COX-2), enzima responsable de la biosíntesis de prostaglandinas y otros mediadores de la inflamación. Debido a que no inhiben la isoenzima COX-1 a concentraciones farmacológicas, no presentan muchas de las toxicidades típicas de los AINE, sobre todo la gastrolesividad. Con esto se abre el horizonte de la incorporación de estos fármacos en los algoritmos de tratamiento del dolor oncológico15. Sin embargo, los inhibidores de la COX-2 no son fármacos exentos de riesgos. Se debe tener especial precaución en ancianos pluripatológicos, debido a sus efectos secundarios cardiovasculares (edema maleolar, HTA, insuficiencia cardíaca congestiva).
Estudios recientes comienzan a mostrar la eficacia de éstos en el tratamiento del Alzheimer, de la poliposis colónica y del cáncer de colon, así como en el de pulmón.
Analgésicos opioides débiles
Tramadol
Dosis inicial: 50 mg cada 6-8 horas. Incluso la mitad si se administra en suspensión.
Dosis máxima: 400 mg diarios repartidos cada 6-8 horas
Vía: oral, rectal, subcutánea, intramuscular o intravenosa. Una vez conseguido el control del dolor es aconsejable utilizar las presentaciones de liberación retardada, que son equipotentes.
Potencia analgésica: 10 mg de tramadol oral equivalen a 2 mg de morfina oral.
Efectos secundarios: sus efectos secundarios son similares a los de la codeína, aunque el estreñimiento es menos frecuente.
Codeína
Dosis inicial: 30 mg cada 4-6 horas.
Dosis máxima: 60 mg/4horas.
Vía: oral o rectal.
Potencia analgésica: 30 mg equivalen a 650 mg de AAS.
Precaución: en insuficiencia hepática.
Efectos secundarios:
– Estreñimiento, es el más frecuente. Se debe usar siempre acompañada de un laxante.
– Náuseas y vómitos, sobre todo a dosis elevadas. Disminuyen después de varios días de tratamiento. Se tratan con antieméticos.
– Somnolencia; se presenta habitualmente con dosis altas.
Analgésicos opioides potentes
Morfina oral
Es el opioide potente de elección en el dolor oncológico intenso. No tiene techo analgésico. Siempre que sea posible, se utilizará por vía oral, porque es igual de eficaz que por otras vías.
1. Presentaciones farmacéuticas
Comprimidos de acción rápida: se administra cada cuatro horas. Se puede fraccionar, masticar o machacar.
Comprimidos o cápsulas de liberación retardada (MST® y Skenan®). Se utilizan cada doce horas. Existe una presentación de administración cada 24 horas cuyo nombre es MST Unicontinus®. Los comprimidos de MST® no pueden ser masticados ni machacados, tienen que tragarse enteros. Las cápsulas de Skenan® pueden abrirse y administrar así el contenido. No existen diferencias en la potencia analgésica entre la acción rápida y la lenta.
2. Inicio de tratamiento
Es recomendable iniciar el tratamiento con morfina oral rápida, ya que las dosis analgésicas se pueden ajustar con mayor rapidez.
Dosis inicial: 5- 10 mg cada 4 horas.
Transcurridas 24 horas desde el inicio del tratamiento, si el paciente:
– No tiene dolor: se mantienen las mismas dosis.
– Continúa con dolor: se aumenta la dosis total diaria en un 50% y así sucesivamente hasta obtener un alivio adecuado del dolor.
– Está excesivamente sedado: se reduce la dosis diaria total en un 50 %.
3. Paso de morfina rápida a retardada
Una vez que el paciente tiene controlado el dolor con morfina rápida, se sustituye este tipo de morfina por una de liberación retardada, utilizando la misma dosis diaria repartida cada 12 horas ó 24 horas.
A lo largo de la evolución clínica, con el fin de mantener controlado el dolor, el paciente puede necesitar incrementos en la dosis de morfina retardada. Esto se hará aumentando un 50 % la dosis diaria total que se repartirá cada 12 horas o 24 horas. Ej. un paciente que toma 60 mg/12 horas ó 120 mg/24 horas, el incremento del 50% sería 90 mg/12 horas ó 180 mg/24 horas.
Con la morfina retardada, los incrementos han de espaciarse 48 horas. Pero si el paciente tiene dolor tomará suplementos de morfina rápida (dosis 10-20% de la dosis diaria total utilizada que podrá repetir cada 4 horas).
Morfina subcutánea
Se utiliza cuando no es posible usar la vía oral y en las agudizaciones del dolor oncológico.
– Dosis inicial: 5 mg cada 4-6 horas. Las modificaciones de las dosis se realizarán del modo visto en la morfina oral rápida.
– Agudizaciones del dolor oncológico: en este caso se administraran dosis extras de 5 ó 10 mg, manteniendo las dosis y pauta previas.
– Incremento de dosis: si continúa con dolor, se aumenta la dosis total diaria en un 50%. Los incrementos podrán realizarse cada 24 horas si el dolor no está controlado.
– Modo de administración: Se coloca una "palomilla" en el tejido subcutáneo del paciente (área pectoral); las dosis se inyectan en la palomilla.
La disminución de la dosis de morfina oral o subcutánea se realizará de modo gradual, a razón de un 25% de la dosis diaria total previa de morfina. La morfina por vía rectal, im o iv no tiene ninguna ventaja respecto a la morfina oral y subcutánea.
– Paso de morfina oral a subcutánea: El cálculo de la dosis de morfina a administrar en 24 horas por vía subcutánea se obtiene dividiendo por dos o tres la dosis diaria total de morfina oral, la dosis obtenida se reparte cada cuatro horas.
– Paso de morfina subcutánea a oral: multiplicar por tres la dosis diaria total de morfina subcutánea, la dosis obtenida se repartirá en dos dosis (cada 12 horas) si se utiliza morfina retardada, o bien en seis dosis (cada cuatro horas) si se utiliza morfina rápida.
Efectos secundarios
– Depresión respiratoria: el riesgo en pacientes con dolor oncológico intenso es mínimo. La depresión respiratoria es tratada con naloxona.
– Estreñimiento, muy frecuente. Hay que realizar profilaxis con laxantes.
– Náuseas y vómitos. Tratamiento: antieméticos (metoclopramida) o haloperidol (1,5 mg/noche).
– Sedación, suele desaparecer espontáneamente. Si persiste, se debe hidratar adecuadamente al paciente y administrar psicoestimulantes (Rubifen®).
– Confusión y/o agitación. Más intensos si el paciente tiene insuficiencia renal (por acumulación de los metabolitos de la morfina). Tratamiento: hidratación y administrar neurolépticos.
– Vértigo, se trata con cinarizina.
– Retención urinaria, puede precisar sondaje.
– Prurito, puede ceder con antihistamínicos o paroxetina.
– Sudoración, puede responder a corticoides o anticolinérgicos.
– Mioclonias, son más frecuentes si existe insuficiencia renal. Pueden revertir con clonazepán (2-8 mg/24 horas) e hidratación adecuada.
Fentanilo TTS (Durogesic®)
No tiene techo analgésico. Se administra por vía transdérmica mediante parches. Tras ser aplicado un parche, las concentraciones séricas de fentanilo aumentan gradualmente a lo largo de un período de 12 a 24 horas; a partir de este momento permanecen relativamente constantes durante el resto de las 72 horas de su aplicación. Con las aplicaciones siguientes (cada 72 horas), utilizando parches del mismo tamaño, se mantienen concentraciones séricas de equilibrio. Al retirar el parche e interrumpir su uso, las concentraciones séricas de fentanilo disminuyen gradualmente a la mitad al cabo de 17 horas (rango 13-22 horas) debido a la absorción del depósito que se formó en la piel16.17,18.
Es especialmente útil en los siguientes casos:
– Pacientes con dificultad o imposibilidad para ingerir morfina oral.
– Intolerancia a los efectos secundarios de la morfina.
– Imposibilidad para realizar correctamente la pauta de administración de morfina distribuida a lo largo del día.
– Pacientes con cuadro clínico compatible con obstrucción intestinal parcial.
– Pacientes con obstrucción del conducto biliar.
– Pacientes con insuficiencia renal.
Precaución en: pacientes ancianos, caquécticos o febriles.
Contraindicado en los siguientes supuestos:
– Pacientes con dolor agudo postoperatorio porque en esta situación puede causar depresión respiratoria.
– Niños menores de 12 años.
1. Inicio de tratamiento
– Pacientes no tratados con opioides potentes: utilizar parches de 25 µg/h y administrar conjuntamente morfina oral de liberación rápida (5-10 mg) o subcutánea (5 mg) que podrá repetir cada 4 horas si el paciente tiene dolor.
– Pacientes tratados previamente con opioides potentes: calcular la dosis (en mg) diaria total equianalgésica de morfina oral utilizada en las últimas 24 horas y dividirla por dos. Ej. Paciente que recibía 100 mg diarios de morfina oral, el parche de fentanilo que necesita es de 50 µg/h. Junto con el primer parche, al paciente se le administrará la última dosis de morfina retarda. Si recibía morfina rápida oral o subcutánea se la administrarán las tres dosis siguientes tras colocar el primer parche.
2. Continuación del tratamiento: los parches se cambian cada tres días. Un 25% de los pacientes pueden precisar cambio cada 48 horas.
3. Agudizaciones del dolor.
En el intervalo de tiempo entre los cambios de parches, si el paciente tiene agudizaciones del dolor se le administrará morfina oral de liberación rápida (10-20 mg) o subcutánea (5-10 mg) que podrá repetirse cada 4 horas. También puede utilizarse citrato de fentanilo oral transmucoso (Actiq®).
Si el paciente tiene mal controlado el dolor (necesita 4 dosis diarias suplementarias de morfina o Actiq®, cuatro días consecutivos), se incrementará la dosis previa de fentanilo TTS (Durogesic®) en 25 µg/h.
4. Aplicación del parche de fentanilo TTS.
– Retirar la lámina posterior y colocar el parche en una zona de piel sana (no irritada ni irradiada), sin pelo (si fuera necesario, cortar el vello con tijera, no afeitar), previamente se limpiará con agua (no usar jabón, alcohol, lociones...) y se secará cuidadosamente.
– Los parches no se pueden cortar.
– Cada nuevo parche se aplicará en una zona de piel distinta.
5. Pasar de fentanilo TTS a morfina: determinar la dosis diaria total correspondiente de morfina oral, para ello multiplicamos por dos la dosis del parche de fentanilo. Ej. Paciente con un parche de fentanilo de 50, sustituir por morfina oral a razón de 100 mg diarios, que se repartirá cada 12 horas si es retardada y cada 4 horas si es oral de liberación rápida. Si se utiliza morfina subcutánea se administrará un tercio de la dosis diaria total oral repartida cada 4-6 horas.
6. Interrupción del tratamiento: debe realizarse de modo gradual, disminuyendo la dosis previa de fentanilo TTS en 25 µg/h o retirar el parche de fentanilo TTS y administrar la dosis correspondiente de morfina. Posteriormente, si el paciente tiene mal controlado el dolor se incrementará la dosis de morfina del modo ya comentado.
7. Efectos secundarios:
– Produce menos estreñimiento, sedación y deterioro cognitivo que la morfina.
– Las náuseas son ligeramente más frecuentes con fentanilo que con morfina.
– En la piel puede producir eritema y prurito.
– Debido a la farmacocinética del fentanilo TTS, los efectos secundarios pueden persistir varias horas tras la retirada del parche.
Citrato de Fentanilo oral transmucosa (Actiq®)
Indicado en agudizaciones del dolor crónico oncológico tratado con opiodes. La dosis adecuada para cada paciente se determina de modo individual y no puede predecirse en base a la dosis de mantenimiento con opiodes20.
1. Inicio
– Administrar una dosis de 200 µg.
– Si no se obtiene una analgesia adecuada dentro de los 15 minutos siguientes después del consumo completo de una sola unidad, el paciente podrá consumir una segunda unidad de la misma concentración.
– No deben utilizarse más de dos unidades para tratar un solo episodio de agudización del dolor.
– Si para tratar episodios consecutivos de agudizaciones se necesita más de una unidad de dosificación por episodio, considerar el aumento de la dosis hasta la siguiente concentración disponible.
2. Mantenimiento
Determinada la dosis eficaz (aquella que permita tratar con eficacia un episodio con una sola unidad) debe mantenerse dicha dosis y limitar el consumo a un máximo de cuatro unidades al día.
3. Reajuste de la dosis
– Si el paciente tiene más de cuatro episodios de agudización del dolor al día, durante un período de más de cuatro días consecutivos, se debe volver a calcular la dosis del opioide de acción prolongada utilizado para el dolor persistente.
– Si se aumenta la dosis del opioide de acción prolongada, puede que sea preciso revisar la dosis de Actiq® para tratar las agudizaciones.
4. Administración
– Colocar la unidad en la boca contra la mejilla y desplazarse por la boca con la ayuda del aplicador, de modo que se aumente al máximo la zona mucosa expuesta al producto.
– La unidad debe chuparse, procurando tragar lo mínimo posible y no masticarse. En pacientes con sequedad de boca, se puede utilizar agua para humedecer la mucosa oral.
– Debe consumirse en el transcurso de 15 minutos. Si se manifiestan signos de efectos opioides excesivos antes de consumir totalmente la unidad, ésta debe retirarse inmediatamente y debe plantearse la reducción de las dosificaciones posteriores.
Buprenorfina transdérmica21
Tiene techo terapéutico. Es un opioide agonista-antagonista, esto condiciona su acción analgésica, efectos secundarios y puede originar un cuadro de abstinencia si se administra a pacientes que toman opiodes agonistas puros (tramadol, morfina y fentanilo).
El efecto analgésico se evaluará a las 24 horas tras la aplicación del primer parche debido a la absorción paulatina transdérmica.
1. Indicaciones
– Dolor moderado o intenso.
– Opioide potente de segunda línea tras la morfina.
– No apropiado en el dolor agudo.
2. Presentaciones: parches transdérmicos de 35, 52,5 y 70 µg/h (Transtec®).
3. Inicio de tratamiento
– Pacientes no tratados con opioides potentes: utilizar parches de 35 µg/h y administrar conjuntamente un comprimido sublingual de buprenorfina.
– Pacientes tratados previamente con opioides: ver tabla de equivalencia (Tabla 4).
4. Continuación del tratamiento: los parches se cambian cada tres días.
5. Agudizaciones del dolor:
– Tomará un comprimido (0,2 mg) de buprenorfina sublingual que podrá repetir a las 12 horas.
– Si precisa tres o cuatro comprimidos diarios de buprenorfina sublingual debe utilizar el parche de la siguiente concentración.
6. Dosis máxima diaria: dos parches de 70µg/h.
7. Precauciones
– No autorizado en menores de 18 años.
– En pacientes con insuficiencia hepática.
– Pacientes febriles (puede aumentar la absorción).
8. Método de aplicación
– Los parches se pueden cortar.
– Retirar la lámina posterior y colocar el parche en una zona de piel sana (no irritada ni irradiada), sin pelo (si fuera necesario, cortar el vello con tijera, no afeitar), previamente se limpiará con agua (no usar jabón, alcohol, lociones...) y se secará cuidadosamente.
– Cada nuevo parche se aplicará en una zona de piel distinta.
9. Efectos secundarios
Son similares a los producidos por otros opiodes potentes. En caso de depresión respiratoria la naloxona deberá utilizarse a dosis más altas que la utilizada con la morfina.
Oxicodona (Oxycontin®)
Recientemente ha sido comercializado en nuestro país la oxicodona (Oxycontin®). Se presenta en forma de comprimidos de liberación controlada de 10, 20, 40 y 80 mg, para ser administrado eficazmente cada 12 horas22.
Se trata de un derivado sintético de la tebaína, un análogo estructural de la codeína. Su efecto analgésico está mediado por receptores, µ,δ y κ. Posee una alta biodisponibilidad oral lo que le confiere un perfil farmacocinético predecible y fiable y parece ser tan eficaz como la morfina en el tratamiento del dolor oncológico23. Para pacientes que no estaban tomando opiáceos una dosis inicial recomendable puede ser 10 mg cada doce horas. Los ajustes de dosis se realizan cada 1-2 días, la dosis total diaria de oxicodona puede ser aumentada en un 25-50% de la dosis corriente en cada incremento.
Coadyuvantes analgésicos
Son medicamentos, químicamente heterogéneos, que son utilizados para tratar tipos específicos de dolor oncológico asociados a medicamentos analgésicos.
Corticoides sistémicos7
La analgesia es debida a su acción antiinflamatoria, dando lugar a disminución del edema y descompresión nerviosa. La dexametasona tiene la mayor potencia antiinflamatoria.
1. Dosis: 8-40 mg/24 horas durante 3-5 días. Vía oral o parenteral. La dosis será reducida a la mínima eficaz para reducir sus efectos secundarios. El tratamiento prolongado está indicado en dolor oncológico debido a: metástasis óseas, hipertensión intracraneal, tumores de cara o cuello, compresión medular o nerviosa y hepatomegalia.
2. Efectos secundarios: candidiasis bucal, molestias gástricas, hiperglucemia e insomnio.
Antidepresivos
Su indicación principal es el dolor neuropático. La analgesia puede manifestarse a la semana del inicio del tratamiento, en otras ocasiones han de transcurrir dos a cuatro semanas de tratamiento continuado. La amitriptilina y otros tricíclicos tienen una eficacia similar.
Los inhibidores selectivos de la recaptación de la serotonina probablemente son menos efectivos que los antidepresivos tricíclicos.
Antidepresivos como la venlafaxina y la mirtazapina también se usan como coadyuvantes en el dolor neuropático.
Amitriptilina
Dosis inicial de la amitriptilina: 25 mg al acostarse (ancianos y pacientes debilitados10 mg).
Incremento de dosis: 10-25 mg cada semana si el paciente tiene dolor.
Dosis máxima: 100-150 mg diarios.
Efectos secundarios:
– Anticolinérgicos: sequedad de boca, visión borrosa, estreñimiento, retención urinaria.
– Cardiovasculares: hipotensión postural, palpitaciones, taquicardia.
– Neurológicos: sedación, desorientación y alucinaciones.
Anticonvulsivantes24
Su indicación principal es el dolor neuropático. Son eficaces: gabapentina, clonazepan, fenitoína, ácido valproico y carbamacepina. La dosis analgésica adecuada para cada paciente se determina de modo individual, sin sobrepasar los niveles plasmáticos máximos de cada medicamento. El efecto analgésico puede tardar cuatro semanas. Si un anticonvulsivante no es útil, usar otro anticonvulsivante.
Gabapentina
– Dosis inicial. Día 1º: 300 mg a la noche. Día 2º: 300 mg cada 12 horas. Día 3º y siguientes: 300 mg cada 8 horas.
– Incremento de dosis: el 7º día, si el paciente tiene dolor, aumentar 300 mg la dosis diaria, y así cada 5-7 días hasta la dosis máxima.
– Efectos secundarios: somnolencia, cansancio y mareo.
Clonazepan
– Dosis inicial: 0,5-1 mg a la noche.
– Incremento de dosis. Al 4º día pautar 0,5-1 mg cada 12- 8 horas. Cada semana incrementos progresivos hasta dosis máxima.
– Dosis máxima: habitualmente: 4-8 mg diarios repartidos cada 8 horas.
– Efectos secundarios: somnolencia, cansancio y mareo.
Ácido valproico
– Dosis inicial: 200-400 mg a la noche.
– Incremento de dosis. Cada 3 días incrementos de 200 mg/ día hasta dosis máxima.
– Dosis máxima: habitualmente: 2.500 mg diarios repartidos cada 8 horas.
– Efectos secundarios: somnolencia, cansancio y mareo. Intolerancia gastrointestinal.
Bisfosfonatos8
Indicados en el dolor debido a metástasis óseas, si los analgésicos o la radioterapia fueron inefectivos.
Si son efectivos el efecto analgésico se manifiesta en el plazo de 14 días, con 4-6 semanas de duración. Si no son efectivos puede realizarse un nuevo ciclo de tratamiento después de 2 semanas. Si el 2º ciclo tampoco es eficaz, no deben realizarse más intentos.
1. Vía oral: etidronato. 5-10 mg/kg/día en ciclos de 4 semanas de tratamiento y 4 semanas de descanso.
2. Vía intravenosa (uso hospitalario): pamidronato: 90 mg diluidos en 500 cc de suero fisiológico infundidos durante 2-4 horas, repetir si es eficaz cada 4 semanas.
3. Efectos secundarios: náuseas y vómitos.
TÉCNICAS DE NEUROMODULACIÓN, EL CUARTO ESCALÓN ANALGÉSICO
Su descripción sobrepasa el interés de esta revisión, por lo que simplemente realizaremos una breve descripción de los dos más comunes. Su realización y seguimiento debe ser llevada a cabo por un especialista en el tratamiento del dolor crónico.
Infusión espinal de opiodes
El descubrimiento de receptores morfínicos específicos a nivel de los cordones posteriores de la médula espinal ha permitido una interrupción selectiva de los impulsos nociceptivos antes de su entrada el sistema nervioso central, mediante la aplicación directa de sustancias opiodes en los espacios subaracnoideo o epidural. La infusión continua de opiáceos tiene su principal indicación en el tratamiento del dolor somático por exceso de nocicepción. Produce una analgesia segmentaria predecible y segura, que afecta a metámeras medulares progresivamente por la difusión rostral de opiodes, sin pérdida de la sensiblilidad epicrítica ni disminución de la potencia muscular25.
Estimulación medular de cordones posteriores
Sus principales indicaciones son el tratamiento del dolor isquémico y del dolor neuropático. Supone la creación de un campo eléctrico estimulador mediante la aplicación de corrientes de bajo voltaje a través de electrodos colocados en el espacio epidural. Su acción parece estar mediada por el efecto sobre las raíces nerviosas y sobre el asta posterior medular, activando las fibras Aß, cuya estimulación podría inhibir la transmisión de las fibras C, basados en la teoría de compuerta. La colocación de los electrodos se realiza en quirófano, con anestesia local y control radioscópico.
BIBLIOGRAFÍA
1. Bonica JJ. Cancer Pain. En: Bonica JJ. The management of pain. 2nd edition. Philadelphia: Lea and Phebiger, 1990: 400-460. [ Links ]
2. Manfredini PL, Chandler S, Pigazzi A, Payme R. Outcome of cancer pain consultations. Cancer 2000; 89: 920-924. [ Links ]
3. National Cancer Institute. NCI. Workshop on cancer pain 1990. [ Links ]
4. Bonica JJ. Definitions and taxonomy of pain. En: Bonica JJ. The management of pain. 2nd edition. Philadelphia: Lea and Phebiger, 1990: 18-27. [ Links ]
5. Catalá E et al. Tratamiento del dolor en el paciente oncológico: visión integral. 2º edición. Ed Saned SL, 1994. [ Links ]
6. Foley KM. Síndromes dolorosos en pacientes con cáncer. Clin Med N A 1987; 2: 265-289. [ Links ]
7. Feuer DJ et al. Corticosterioids for the resolution of malignant bowel obstruction in advanced gynaecological and gastrointestinal cancer.(Cochrane Review). En: The Cochrane Library, Issue 4, 2002. [ Links ]
8. Wong R et al. Bisphosphonates for the relief of pain secondary to bone metastases. (Cochrane Review). En: The Cochrane Library, Issue 4, 2002. [ Links ]
9. Back, I. Palliative Medicine Handbook. 3red. Cardiff: BPM Books 2001. [ Links ]
10. Hanks WC, MacDonald N, Doyle D. Oxford Texbook of Palliative Medicine. Oxford: University Press; 1999 [ Links ]
11. World Health Organitation Cancer Pain Relief. Albany,NY:WHO Publications Center; 1986. [ Links ]
12. Lamer TJ. Treatment of cancer-related pain: when orally administered medications fail. Mayo Clin Proc 1994; 69: 473-480. [ Links ]
13. Miguel R. Interventional treatment of cancer Pain: The fourth step in the world health organization analgesic ladder? JMCC 2000; 7: 149-156. [ Links ]
14. Flórez J, Reig E. Terapéutica farmacológica del dolor. Pamplona: Eunsa; 1993. [ Links ]
15. Jayr C. Analgesic effects of cyclooxygenase 2 inhibitors. Bull Cancer 2004 ; 91 Spec No: S125-131. [ Links ]
16. Donner B, Zenz M, Strumpf M, Rober M. Long-Term. Treatment of cancer pain with transdermal fentanyl. J Pain Sympton Manag 1998; 15: 168-175. [ Links ]
17. Jeal W, Benfield P. Transdermal fentanyl. A review of its pharmacological properties and therapeutic in pain control. Drugs 1997; 53: 109-138. [ Links ]
18. Sanz Ortiz J. Fentanilo transdérmico: reservorio cutáneo Fentanilo. En: El control del sufrimiento evitable. Terapia analgésica. Jaime Sanz Ortiz ed. Madrid: You & Us; 2001: 117-124. [ Links ]
19. Monferrer Bort MA, Nuñez Olarte JM, Conti Jiménez M, López López C. Rotación de opiodes: a proposito de dos casos de empleo simultáneo de Fentanilo transdérmico y metadona. Med Paliativa 1999; 6: 39-41. [ Links ]
20. Muriel C, García-Castaño M, Yusta G, Sánchez-Montero F. Citrato de Fentanilo oral transmucosa: revisión. Rev Soc Esp Dolor 2000; 7: 319-326. [ Links ]
21. Evans HC, Easthope SE. Transdermal Buprenorphine. Drugs 2003; 63. 1999-2010. [ Links ]
22. Kaiko R et al. Pharmacokinetics-pharmacodynamic relationship of controlled-release oxicodone. Clinical Pharmacology and therapeutics,vol 59, nº1. [ Links ]
23. Bruera E, Belzile M, Pituskin E, Fainsinger R, Darke A, Harsanyi Z et al. Randomized, double-blind,cross-over trial comparing safety and efficacy of oral controlled-release oxycodona with controlled release morphine in patients with cancer pain. J Clin Oncol 1998; 16: 1998: 3222-3229. [ Links ]
24. Wiffen P et al. Anticonvulsant drugs for acute and chronic pain. Cochrane Review). En: The Cochrane Library Issue 4, 2002. [ Links ]
25. Leavens ME, Hill CS, Cech DA, Weyland JB, Weston JS. Intratecal and intraventricular morphine for pain in cancer patients: Initial study. J Neurosurg 1982; 56: 241-243. [ Links ]