Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.33 no.2 Pamplona may./ago. 2010
Narcolepsia: actualización en etiología, manifestaciones clínicas y tratamiento
Narcolepsy: update on etiology, clinical features and treatment
R.M. Pabón, I. García de Gurtubay, G. Morales, J. Urriza, L. Imirizaldu, F. Ramos-Argüelles
Servicio de Neurofisiología Clínica. Hospital Virgen del Camino. Pamplona.
Dirección para correspondencia
RESUMEN
La narcolepsia es una enfermedad que consiste en una alteración en la generación y organización del sueño. Los principales síntomas son la excesiva somnolencia diurna y la cataplejía así como las alucinaciones hipnagógicas, parálisis del sueño y fragmentación del sueño nocturno. La prevalencia de la narcolepsia típica oscila entre el 25 y 50 por cada 100.000 habitantes. Recientemente se ha observado un pico de incidencia en pacientes nacidos en el mes de marzo.
Según la nueva clasificación, el test de latencias múltiples de sueño (TLMS) es imprescindible para el diagnóstico de narcolepsia sin cataplejía y aconsejable para el diagnóstico de la narcolepsia típica.
Hasta ahora se trataban de forma independiente los síntomas, aunque actualmente las más recientes directrices de tratamiento proponen nuevos fármacos que actúan en todo el grupo de síntomas de forma global.
La aplicación de nuevos criterios diagnósticos y terapéuticos permitirá un diagnóstico precoz y mejores opciones de tratamiento en esta patología.
Palabras clave: Cataplejía. Diagnóstico. Narcolepsia. Tratamiento. Oxibato sódico.
ABSTRACT
Narcolepsy is a disease that involves an alteration in the generation and organisation of sleep. The main symptoms are excessive daytime sleepiness and cataplexy, followed by hypnagogic hallucinations, sleep paralysis and disrupted nocturnal sleep. The prevalence of typical narcolepsy oscillates between 25-50: 100.000 in general. Recently there has been a peak incidence in patients born in the month of March.
According to the new classification, the Multiple Sleep Latency Test (MSLT) is mandatory for diagnosing narcolepsy without cataplexy, and advisable for diagnosing narcolepsy with cataplexy.
Until now, the attempt has been made to control each symptom by its own specific treatment. At present, new American and European treatment guidelines propose new drugs that act on all the symptoms.
The application of new criteria of diagnosis and treatment has improved the diagnosis, giving better options of treatment.
Key words: Cataplexy. Diagnosis. Narcolepsy. Treatment. Sodium oxybate.
Introducción
La narcolepsia fue descrita por primera vez en el año 1780 aproximadamente, por Westphal1 y Gelineau2 como un cuadro de excesiva somnolencia diurna y episodios de debilidad muscular desencadenada por emociones. Posteriormente se describieron los demás síntomas, alteración del sueño nocturno, alucinaciones hipnagógicas y parálisis del sueño.
Esta patología afecta de manera importante a los pacientes en sus relaciones personales y laborales, pudiendo ser causa de desempleo, pérdida de autoestima y otros efectos. Según diferentes estudios, la narcolepsia afecta más a la calidad de vida que la enfermedad de Parkinson o la epilepsia3.
Hoy esta enfermedad no tan rara como se cree, pasa muchas veces desapercibida y conlleva un importante impacto socioeconómico4. En este artículo revisamos los conocimientos más recientes respecto a la etiología, diagnóstico y tratamiento.
Definición y epidemiología
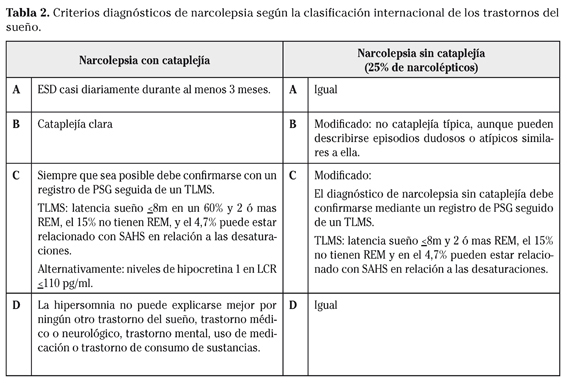
La narcolepsia es una enfermedad crónica, relacionada con la alteración de los mecanismos que regulan el sueño (sistema hipocretina/orexina). Según la segunda edición de la clasificación internacional de los trastornos del sueño (ICSD) de la American Academy of Sleep Medicine del año 20055 (Tabla 1) pertenece al grupo de las hipersomnias de origen central.
La narcolepsia con cataplejía tiene una incidencia similar en ambos sexos, su prevalencia varía según muchos estudios desde 25 y 50 por cada 100.000 habitantes6 hasta 20 a 260 por cada 100.00 habitantes, estimada por asociaciones de pacientes. Se sitúa entre la miastenia gravis (5-12,5 por cada 100.00 habitantes) y la esclerosis múltiple (60 a 100 por cada 100.000 habitantes)7. Se ha descrito mayor prevalencia en Japón, respecto a Europa, y muy baja en Israel8. Esta variabilidad en los datos de prevalencia se explica por numerosos factores9.
La edad de presentación se da generalmente en dos grandes picos, uno mayor sobre los 15 años de edad y otro en adultos jóvenes sobre los 36 años de edad10, aunque puede presentarse en la infancia o en la quinta década. En general se considera que la narcolepsia es una enfermedad infradiagnosticada. En primer lugar por la variabilidad de su clínica (actualmente se reconoce la posibilidad de sufrir narcolepsia sin cataplejía), y en segundo lugar por el retraso que suele haber en su diagnóstico. El tiempo desde el inicio de los síntomas hasta el diagnóstico suele ser aproximadamente de 10 años, disminuyendo en países con más conciencia de la enfermedad11. Los diagnósticos equívocos contribuyen también a este retraso. A todo esto se suma la no centralización de esta patología, aunque estos pacientes son vistos por especialistas no siempre hay una adscripción específica de estos pacientes a un especialista concreto en patología del sueño y en esta dispersión el diagnóstico y el manejo de los pacientes se dificulta.
Fisiopatología y etiología
La causa de la narcolepsia es desconocida. Sus síntomas son secundarios a una alteración del sistema hipocretina/orexina (Hcrt/Ox), encargado de regular el ciclo sueño vigilia. Este sistema fue descubierto en 1998 por dos grupos, de Lecea que descubrió el péptido hipocretina12 y Sakurai el péptido orexina13. Poco tiempo después se confirmó que eran el mismo péptido. Se han descrito dos tipos de hipocretina, la Hcrt1 y la Hcrt2, sintetizados por un grupo de neuronas localizadas en el hipotálamo posterolateral. Estas hipocretinas participan en múltiples funciones, entre ellas, la regulación del ciclo vigilia sueño favoreciendo la vigilia a través de proyecciones excitadoras a estructuras aminérgicas y colinérgicas inhibiendo el sueño REM14. La mayoría de estas proyecciones van al núcleo locus coeruleus con receptores únicamente para la Hcrt115.
La narcolepsia se presenta en el 95-99% de los pacientes de forma esporádica, con una trasmisión hereditaria baja. Su hipótesis etiológica más apoyada es autoinmune, posiblemente debida a degeneración neuronal selectiva de las células productoras de Hcrt en el hipotálamo lateral, en individuos susceptibles genéticamente portadores de uno o más alelos del HLA DQB1*0602 expuestos a factores medioambientales observados no sólo por el aumento de pacientes diagnosticados nacidos en el mes de marzo16 sino porque el 75% de gemelos idénticos presentan características diferentes para esta enfermedad. Esta hipótesis de la autoinmunidad se ha visto reforzada además por respuestas observadas a tratamientos con Ig IV17.
Todo esto sugiere que los dos posibles factores etiológicos principales son:
1. Alelo mutado HLA II en leucocitos (DQB1*0602). La asociación del HLA-DR2/DQ1 con la narcolepsia se vio por primera vez en 1983.18 El alelo más susceptible es el HLA DQB1*060219.
2. Alteración del sistema hipocretina/orexina.
De acuerdo con resultados observados en modelos animales, se relaciona este sistema con la narcolepsia en humanos. En un estudio de 9 pacientes narcolepticos, 7 de ellos presentaron disminución del la Hcrt 1 en el LCR20 y otro estudio en pacientes narcolépticos reveló una perdida del 85-95% de neuronas hipocretinérgicas en el hipotálamo lateral21.
Genéticamente se ha confirmado en animales la alteración del gen responsable del sistema Hcrt/Ox. La mutación del gen de la preprohiprocretina con narcolepsia y cataplejía en humanos sólo se ha descrito en un caso a los 6 meses de edad21.
Clínica
Los cinco principales síntomas de la narcolepsia son la excesiva somnolencia diurna (ESD), la cataplejía, la alteración del sueño nocturno, las alucinaciones hipnagógicas y la parálisis del sueño. Sólo el 10-15% de los pacientes presentan todos los síntomas22.
Excesiva somnolencia diurna (ESD)
Es un síntoma definitorio de la narcolepsia que está presente en el 100% de los pacientes22 y el primero en aparecer10. Se manifiesta como ataques de sueño irresistibles, principalmente durante las actividades monótonas y sedentarias. En ocasiones estos ataques se dan en situaciones inusuales como al caminar, hablar o conducir. Su duración suele ser de 20 minutos o menos. La principal característica, que la diferencia de otras patologías, es que los ataques de sueño son reparadores permitiéndole reanudar sus actividades, aunque al poco tiempo reaparece la somnolencia. La ESD persiste durante toda la vida, diariamente, fluctuando en periodos de semanas o meses, aunque puede disminuir con la edad.
Cataplejía
Es el síntoma más específico de la narcolepsia. Se define como atonías musculares bilaterales (parciales o completas) súbitas, con conservación de la conciencia, desencadenadas por emociones (risa, alegría, sorpresa, ira, etc.) que revierten de forma espontánea. La cataplejía parcial se restringe a la pérdida del tono de un grupo muscular específico como caídas de la cabeza o mioclonías faciales.
Durante los episodios de cataplejía se observa parálisis flácida, arreflexia y ausencia de respuesta a la estimulación plantar que fisiopatológicamente corresponden a la atonía característica del REM pero en vigilia. Los síntomas asociados pueden ser dificultad respiratoria, sudoración, palpitaciones y ocasionalmente se superpone una actividad motora fásica a la atonía muscular provocando fasciculaciones o temblores que pueden confundirse con convulsiones, permaneciendo el paciente estable sin afectación cardiovascular o respiratoria.
La cataplejía se da aproximadamente en el 60-90% de los narcolépticos22 y puede debutar conjuntamente con la ESD o aparecer entre 1 y 20 años después con una media de 5-6 años. Su frecuencia es variable y oscila desde un episodio al mes hasta más de diez episodios al día de diversa intensidad22, con una duración de unos pocos segundos hasta unos minutos. Aunque excepcionalmente pueden repetirse durante varias horas o días, lo que se conoce como estado de mal catapléjico, esta situación se da principalmente en retiradas bruscas de medicación anticatapléjica.
Parálisis del sueño
Su frecuencia oscila entre el 25-60%23 de los pacientes narcolépticos. Consiste en incapacidad generalizada para moverse o hablar durante el inicio del sueño o al despertarse, respetando musculatura ocular y respiratoria, sin pérdida de la conciencia, lo que causa una gran ansiedad. Al igual que la cataplejía se considera una intrusión parcial del sueño REM en vigilia. Su duración es de 20 a 30 segundos, es transitoria y cede espontáneamente con estímulos al paciente. Puede darse en sujetos sanos con o sin antecedentes familiares de parálisis de sueño o narcolepsia.
Alucinaciones hipnagógicas e hipnopómpicas
Se producen en el 30-65% de los pacientes22,23. Son fenómenos pseudoalucinatorios generalmente visuales seguidos de auditivos y cinestésicos (sensación de que alguien le toca). Usualmente se reconocen como irreales, presentándose en la transición vigilia-sueño (hipnagógica), al despertar (hipnopómpica) o en siestas diurnas y no suelen durar más de un minuto.
Episodios de comportamiento automático
Su prevalencia estimada es alrededor del 40%23. Son acciones semideliberadas (lenguaje y escritura inapropiado, colocar objetos en lugares equivocados o la conducción de un vehículo sin conocer exactamente el destino) con posterior amnesia parcial o total, que se dan en los estados de somnolencia que preceden a los ataques de sueño. Su duración suele ser de minutos, aunque a veces duran más de una hora.
Sueño nocturno fragmentado
Afecta aproximadamente al 75% de los pacientes22, considerándose también uno de los principales síntomas. En estos pacientes la cantidad total de sueño en 24 horas es igual a la de cualquier persona pero su calidad es distinta. Tienen un sueño superficial debido a despertares frecuentes breves, sin que el paciente sea consiente de ello, aunque a veces pueden durar hasta una hora. Otras patologías asociadas como la apnea del sueño, algunas parasomnias como el trastorno de conducta del sueño REM (TCR), el sonambulismo y los movimientos periódicos de las piernas (MPP) contribuyen a la fragmentación del sueño. En general no tiende a mejorar espontáneamente con el tiempo.
Otros síntomas de la enfermedad
Son menos específicos, no esenciales para el diagnóstico, entre ellos el trastorno de conducta REM (TCR), parasomnia que se caracteriza por la pérdida de la atonía muscular característica del sueño REM, con actividad del sistema motor de carácter violento y agresivo. En los narcolépticos los episodios de TCR son menos violentos y su edad de inicio es más baja (25 a 30 años) ayudando a predecir la narcolepsia en una tercera parte de los pacientes24. Otros síntomas adicionales son la cefalea, las dificultades de memoria y concentración y la depresión.
Pruebas complementarias
Test de latencia múltiple de sueño (TLMS)
En la actualidad es la prueba complementaria básica para el diagnóstico con un nivel de evidencia I-II25. Mide la tendencia al sueño y la aparición o no de sueño REM. Consiste en 5 siestas de 20 minutos cada una con intervalos de 2 horas, previo estudio polisomnografico, en el que se registran canales de electroencefalografía, electrooculograma, electromiograma de mentón y electrocardiograma. Los pacientes no deben realizar el día anterior actividades de gran esfuerzo y se deben retirar los medicamentos estimulantes y supresores de REM 2 semanas antes. El resultado del test se considera como patológico si la latencia de sueño es menor o igual a 8 minutos y la presencia de dos o más entradas en REM25. En los narcolépticos la latencia media es de 3,1+/- 2,9 minutos siendo en el 60% menor de 5. Además un 15% de los pacientes no tienen sueño REM25.
El TLMS según las últimas recomendaciones es aconsejable en la narcolepsia con cataplejía e imprescindible en la narcolepsia sin cataplejía5. Repetir el TLMS puede estar indicado en las siguientes situaciones: Nivel I-II.
- Cuando el test inicial esta artefactado o no es valorable por no realizarse en las condiciones apropiadas.
- Cuando el test es ambiguo o inenterpretable.
- Cuando se sospecha narcolepsia en el paciente pero la realización muy precoz del test no proporciona confirmación.
Polisomnografía (PSG)
La PSG, además de ser un requisito previo al TLMS para asegurar una buena eficiencia de sueño, permite descartar otros trastornos del sueño que causen ESD o que se asocian esta patología, fundamentalmente el síndrome de apnea-hipoapnea obstructiva del sueño (SAHS), mostrándonos además la fragmentación del sueño nocturno, la presencia de mayor sueño superficial principalmente fase 1 y la baja eficiencia de sueño con despertares frecuentes.
En la narcolepsia lo específico en la PSG es una latencia de REM menor de 20 minutos en el 40-50% de los pacientes y una latencia de sueño menor de 10 minutos22. Además, es importante evitar el uso de estimulantes o antidepresivos que pueden llevar a falsos positivos tanto en la PSG como en el TLMS.
Solo en el caso de agravamiento de los síntomas o aparición de otros nuevos debe contemplarse la realización de otra PSG, que no está indicada en la evaluación de respuestas a tratamientos en genera24.
Medidas en líquido cefalorraquídeo (LCR) de Hcrt1
Se miden los niveles de Hcrt 1 porque además de ser la más específica es la única que se puede determinar. Es una técnica no estandarizada de la que no se dispone en todos los centros. Se considera diagnóstica cuando es inferior a 110 pg/ml, siendo prácticamente inexistente en el LCR de pacientes narcolépticos. Los resultados entre 110 y 200 pg/ml son inciertos. Es muy específica en pacientes narcolépticos con cataplejía (99%) pero la sensibilidad es baja (16%) en casos sin cataplejía o con cataplejía atípica. Además puede estar alterada en otras patologías como el síndrome de Guillain Barre. No es sensible a fármacos psicotrópicos u otros trastornos del sueño comunes. Las principales indicaciones son TLMS dudosos y en niños a quienes no se les puede realizar un TLMS. También se puede realizar a pacientes con diagnóstico reciente de narcolepsia con cataplejía con TLMS negativos, pacientes que no pueden suspender los tratamientos psicótropos y fallos en el tratamiento.
Tipificación HLA-DQ para DQB 1*0602
Estos alelos son positivos en el 90% de pacientes con narcolepsia con cataplejía, y en el 70% en narcolepsia familiar. Pero en narcolepsia sin cataplejía disminuye al 40% y se da en un 24% de pacientes normales por lo que su especificidad es muy baja, del 8% al 38%. Esta técnica no está incluida en los criterios diagnósticos de narcolepsia (Tabla 2).
Criterios diagnósticos
El principal criterio diagnóstico de la narcolepsia es la ESD, seguida de la cataplejía entre otros. Estos criterios varían en las 2 formas de narcolepsia, narcolepsia con cataplejía y narcolepsia sin cataplejía, según la segunda edición de la ICSD de la American Academy of Slepp Medicine del año 2005 (Tabla 2). Según esta clasificación el diagnóstico parece sencillo, pero están descritos porcentajes significativos de errores diagnósticos y los porcentajes de diagnósticos correctos se acercan al 55% en el mejor de los casos26.
Diagnóstico diferencial
Patologías que cursan con ESD
- Hipersomnia idiopática (HI). ESD sin otra causa que lo justifique. Su principal diferencia con la narcolepsia sin cataplejía es que sus siestas no son reparadoras. En el TLMS la latencia de sueño es menor de 10 minutos sin ser tan bajas como en la narcolepsia y no hay entradas en REM. Respecto a la PSG es normal y existe poca asociación con el HLA. En la HI recientemente se ha incorporado como síntoma sugestivo en el ICSD-2 la dificultad prolongada en el despertar por la mañana y un sueño nocturno prolongado mayor de 10 horas.
- Síndrome de apnea-hipoapnea obstructiva del sueño (SAHS). Caracterizado por ESD, trastornos cognitivos, respiratorios, cardiacos, metabólicos o inflamatorios secundarios a episodios repetitivos de obstrucción de la vía aérea superior en el sueño27. En el TLMS puede haber latencias de entrada en sueño inferiores a 5 minutos y 2 o más entradas a REM. Su prevalencia es mayor en narcolépticos. Otros trastornos respiratorios pueden asociar ESD, como el síndrome de hipoventilación alveolar central, síndrome de hipoventilación por obesidad, el asma y la enfermedad pulmonar obstructiva crónica.
- Trastornos del ritmo circadiano. El trastorno de retraso o de adelanto de la fase del sueño entre otros descritos en la ICSD-2.
- Movimiento periódico de las piernas. Esta patología produce frecuentes despertares que inducen una ESD. Su prevalencia aumenta en los narcolépticos.
- Síndrome de Kleine-Levin. Es un síndrome autosómico dominante que cursa con ESD, hiperfagia y conducta sexual desinhibida.
- Alteración del comportamiento por sueño insuficiente.
- Distrofia miotónica de Steinert tipo I. Presentan ESD hasta en un 77%, algunos por SAHS o hipoventilación alveolar crónica. Sin embargo, el hecho de que la ESD no siempre desaparece al corregir estos trastornos ha sugerido un origen central por alteraciones del sistema hipotálamo-hipófisis con disminución de la hipocretina. Estos pacientes presentan alteraciones del REM en TLMS.
- Insomnio letal familiar. Enfermedad priónica que cursa con alteraciones del ciclo sueño/vigilia produciendo pérdida progresiva del sueño, periodos breves de ESD y pérdida del ritmo circadiano, asociándose a alucinaciones complejas, y entradas súbitas en REM.
- Somnolencia de causa psiquiátrica. El 10% de los pacientes que consultan por somnolencia diurna excesiva presentan una patología psiquiátrica, principalmente psicosis, procesos adaptativos, ansiedad y depresión.
Patologías que cursan con cataplejía
- Narcolepsia secundaria. Ataques de sueño y cataplejía con o sin los demás síntomas de la narcolepsia secundarios a lesiones estructurales en diencéfalo y tronco encefálico superior y en ocasiones a trauma craneoencefálico. La presencia de otros síntomas de afectación del SNC indican una narcolepsia secundaria.
- Encefalitis paraneolásica anti Ma2. Etiología autoinmune. En ocasiones con cataplejía y disminución de la hcrt 1 en posible relación a daño hipotalámico.
- Síndrome de Prader Willi. Enfermedad genética que se caracteriza por obesidad, retraso mental, talla baja y hipotonía pre y pos natal entre otros, presenta alteraciones en el funcionamiento del hipotálamo asociándose ocasionalmente a episodios de cataplejía y disminución de los niveles de hcrt 1.
- Enfermedad de Norrie (ceguera congénita debida a displasia vitreoretinianal ligada al cromosoma X que afecta solamente a varones) y síndrome de Moebius (enfermedad congénita caracterizada por falta de desarrollo del 6o y 7o par craneal) se asocian a daño a nivel cerebral medio y hipotalámico presentando en ocasiones episodios de cataplejía like y trastornos del sueño.
- Enfermedad de Nieman Pick tipo C. Enfermedad de depósito graso por un trastorno genético del metabolismo, que cursa con cataplejía y disminución de los niveles de Hcrt 1.
- Epilepsia. Ocasionalmente convulsiones subclínicas y la ESD por medicación de pacientes epilépticos pueden confundirse con narcolepsias o viceversa, episodios de parálisis del sueño o parasomnias pueden confundirse con epilepsias.
- Otros. La cataplejía también debe diferenciarse de crisis atónicas, isquemia vertebrobasilar en forma de pérdida súbita del equilibrio (dropattacks), síncopes, lipotimias y parálisis hiper o hipopotasémicas.
Tratamiento
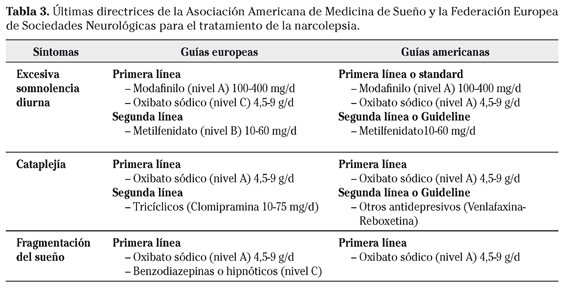
Hasta hace poco los diferentes tratamientos se dirigían a controlar por separado cada uno de los síntomas. Recientemente las nuevas directrices europeas24 y de la Asociación Americana de Medicina de Sueño (AASS)28 (Tabla 3) incorporan nuevos fármacos capaces de controlar los principales síntomas de la narcolepsia. A continuación se exponen las guías de la Federación Europea de Sociedades Neurológicas (EFNS).
Directrices en el tratamiento de la ESD
Están autorizados en el tratamiento de la ESD como primera línea, el modafinilo a una dosis de 100-400 mg/día, máximo 600 mg en 2 tomas. Sus posibles mecanismos de acción son la estimulación adrenérgica alfa-1, interacciones en los sistemas dopaminérgicos o la participación de mecanismos serotoninérgicos/GABAérgicos (ácido gamma-aminobutírico)24. Sus principales efectos adversos suelen ser cefalea, náuseas y, en ocasiones, rinitis24. Como segunda línea está indicado el metilfenidato a una dosis de 10-60 mg/día. éste actúa induciendo la liberación de dopamina y sus efectos secundarios son la irritabilidad, hiperactividad, alteraciones del estado de ánimo, cefalea, palpitaciones, sudoración, temblores, anorexia e insomnio24. En la actualidad en Europa está siendo presentado el oxibato sódico (nivel B) para su autorización en todos los síntomas de la narcolepsia. Las guías americanas solo se diferencian porque indican como primera línea, además del modafinilo, el oxibato sódico con un nivel A de evidencia. Respecto a las medidas conductuales, las siestas diurnas, ya sean una única siesta prolongada o cinco pequeñas siestas distribuidas durante el día, el nivel de evidencia es B.
Directrices en el tratamiento de la cataplejía y síntomas asociados al REM
Las guías europeas indican el oxibato sódico como primera línea. éste neurotransmisor/neuromodulador natural actúa a través de sus propios receptores o a través de la estimulación de los receptores GABA-B24. Los efectos secundarios descritos son las náuseas, enuresis, despertares con confusión y cefalea24. No se recomienda durante el embarazo. La dosis inicial es de 4,5 g/noche dividida en 2 tomas iguales de 2,25 g, hasta un máximo de 9 g/noche con incrementos progresivos de de 1,5 g. En segunda línea de tratamiento está indicado los antidepresivos tricíclicos inhibidores de la recaptación de noradrenalina y/o serotonina como la clomipramina, a una dosis de 10-75 mg/día. Los efectos adversos descritos consisten en acciones anticolinérgicas, como sequedad de boca, sudoración, estreñimiento, taquicardia, aumento de peso, hipotensión, dificultad miccional e impotencia24. Otros antidepresivos de segunda línea, como venlafaxina y reboxetina, no tienen evidencia contrastada de su eficacia. Respecto a las medidas conductuales se evitarán, siempre que sea posible, los desencadenantes conocidos. En las guías americanas no recomiendan como segunda línea la clomipramina sino los demás antidepresivos.
Directrices en el tratamiento de otros síntomas de la narcolepsia y manifestaciones asociadas
- Alteraciones del sueño. El oxibato sódico es el único capaz de aumentar el sueño profundo (nivel A), una vez se autorice para el tratamiento de todos los síntomas de la narcolepsia. Las benzodiazepinas u otros hipnóticos pueden ser eficaces (nivel C).
- Apnea obstructiva del sueño. No se ha documentado tratamientos del SAHS en narcolépticos. Sin embargo, estos pacientes no deben recibir un tratamiento diferente. Es importante tener en cuenta que el oxibato sódico puede inducir depresión respiratoria y apneas durante el sueño29, aunque recientemente se ha descrito que su uso a corto plazo en pacientes con SAHS no genera efectos depresores respiratorios30. En general, se considera que, salvo en casos de SAHS severo, el oxibato sódico es un fármaco seguro. En la práctica se realiza una PSG nocturna al iniciar tratamiento con oxibato sódico para evidenciar la influencia que éste pueda tener en el SAHS del sujeto.
- Movimientos periódicos de las extremidades durante el sueño (MPES). Las guías recomiendan, como posiblemente eficaz, (Nivel B) la bromocriptina en MPES asociados con narcolepsia31. En MPES no asociado a narcolepsia, tanto la levodopa como el clonacepam son posiblemente eficaces (nivel B)31.
- Parasomnias. Debido a la información existente es difícil establecer directrices diferentes a las recomendaciones convencionales de la narcolepsia.
Futuro del tratamiento de la narcolepsia
Los siguientes pasos son la búsqueda de fármacos que controlen todos los síntomas principales de la narcolepsia con eficacia demostrada a largo plazo. Existen tres tratamientos emergentes principales24:
1. Tratamientos sintomáticos de modulación endocrina/transmisora. Agonistas selectivos de la histamina (antagonistas H3), antagonistas de la hormona liberadora del crecimiento (GHRH), agonistas del gamma-hidroxibutirato (GHB) y agonistas del ácido gamma-aminobutírico tipo B (GABA-B).
2. Tratamientos basados en la hipocretina. Agonistas de la hipocretina y trasplantes celulares, orientados hacia la reposición de hipocretina o incluso prevenir la pérdida de neuronas que contienen este neuropéptido.
3. Tratamientos de base inmunitaria. Corticoides, Ig IV y la plasmaféresis17.
Consideraciones finales
Es de gran importancia la conciencia pública de esta enfermedad y la actualización y aplicación de recientes guías diagnósticas y terapéuticas por los médicos de atención primaria y especializada a través de una buena historia clínica y un seguimiento regular. Las unidades especializadas, con abordaje multidisciplinario de patología del sueño, permiten una detección temprana, mayores opciones de tratamiento y vigilancia de la respuesta a estos, mejorando la calidad de vida y disminuyendo además los principales costos de esta enfermedad, que son los indirectos4, en pacientes con una patología en su mayoría infradiagnosticada.
Bibliografía
1. Westphal C. Eigentümliche mit Einschlafen verbundene Anafälle. Arch Psvchiatr Nervenkr 1877; 7: 631-35. [ Links ]
2. Gélineau J. De la narcolepsie. Gazette des Hópitaux (Paris) 1880; 53: 626-628. [ Links ]
3. Beusterien KM, Rogers AE, Walsleben JA, Emsellem HA, Reblando JA, Wang L et al. Health-related quality of life effects of modafinil for treatment of narcolepsy. Sleep 1999; 22: 757-765. [ Links ]
4. Dodel R, Peter H, Walbert T, Spottke A, Noelker C, Berger K et al. The socioeconomic impact of narcolepsy. Sleep 2004; 27: 1123-1128. [ Links ]
5. The International Classification of Sleeep Disorder. 2nd edition. Westchester, IL, USA: American Academy of Sleep Medicine 2005. [ Links ]
6. Longstreth WT Jr, Koepsell TD, Ton TG, Hendrickson AF, van Belle G. The epidemiology of narcolepsy. Sleep 2007; 30: 13-26. [ Links ]
7. Billiard M, Dauvilliers Y. Narcolepsy. En: Billiard M, ed. Sleep: Physiology, Investigations and Medicine. New York: Kluwer Academic/Plenum Publishers; 2003: 403-406. [ Links ]
8. Ohayon MM, Priest RG, Zulley J, Smirne S, Paiva T. Prevalence of narcolepsy symptomatology and diagnosis in the European general populution. Neurology 2002; 58: 1826-1833. [ Links ]
9. Pabón RM, García Gurtubay I, Ramos-Argüelles F, Gila L, Morales G, Alonso MT. Narcolepsia. Una enfermedad infradiagnosticada. XLVI Reunión de la Sociedad Española de Neurofisiología Clínica. Rev Neurol 2008; 47: 547-555. [ Links ]
10. Dauvilliers Y, Montplaisir J, Molinari N, Carlander B, Ondze B, Besset A et al. Age at onset of narcolepsy in two large populations of patients in France and Quebec. Neurology 2001, 57: 2029-2033. [ Links ]
11. Morrish E, King MA, Smith IE, Shneerson JM. Factors associated with a delay in the diagnosis of narcolepsy. Sleep Med 2004; 5: 37-41. [ Links ]
12. De Lecea L, Kilduff TS, Peyron C, Gao X, Foye PE, Danielson PE et al. The hypocretins: Hypothalamus-specific peptides with neuroexcitatory activity. Oroc Natl Acad Sci USA 1998; 95: 322-327. [ Links ]
13. Sakuray T, Amemiya A, Ishii M, Matsuzaki I, Chemelli RM, Tanaka H et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G-protein. Coupled receptors that regulate feeding behavior. Cell 1998; 92: 573-585. [ Links ]
14. Del Cid-Pellitero E, Garzón M. El sistema de neurotrasmisión hipocretinérgico/orexinergico en la regulación de los estados de vigilia y sueño. Rev Neurol 2007; 45: 482-490. [ Links ]
15. Hagan JJ, Leslie RA, Patel S, Evans ML, Wattan TA, Holmes S et al. Orexin A activates locus coeruleus cell firing and increases arousal in the rat. Proc Natl Acad Sci USA 1999; 96: 10911-10916. [ Links ]
16. Dauvilliers Y, Carlander B, Molinari N, Desautels A, Okun M, Tafti M et al. Month of birth as a risk factor for narcolepsy. Sleep 2003; 26: 663-665. [ Links ]
17. Lecendreux M, Maret S, Bassetti C, Mouren MC, Tafti M. Clinical efficacy of high-dose intravenous immunoglobulins near the onset of narcolepsy in a 10-year-old boy. J Sleep Res 2003; 12: 347-348. [ Links ]
18. Honda Y, Asaka A, Tanaka Y, Juji T. Discrimination of narcolepsy by using genetic markers and HLA. Sleep Res 1983; 12: 254. [ Links ]
19. Matsuki k, Grumet FC, Lin X, Gelb M, Guilleminault C, Dement WC et al. DQ (rather than DR) gene marks susceptibility to narcolepsy. Lancet 1992; 339: 1052. [ Links ]
20. Nisshino S, Ripley B, Overeem S, Lammers GJ, Mignot E. Hypocretin (orexin) deficiency in human narcolepsy. Lancet 2000; 355: 39-40. [ Links ]
21. Peyron C, Faraco J, Rogers W, Ripley B, Overeem S, Charnay Y et al. A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains. Nat Med 2000; 6: 991-997. [ Links ]
22. Overeem S, Mignot E, Van Dijk JG, Lammers GJ. Narcolepsy: clinical features new pathophysiologic insights, and future perpectives. J Clin Neurophysiol 2001; 18: 78-105. [ Links ]
23. Thorpy M. Current concepts in the etiology, diagnosis and treatment of narcolepsy. Sleep Med 2001; 2: 5-17. [ Links ]
24. Billiard M, Bassetti C, Dauvilliers Y, Dolenc-Groselj L, Lammers GJ, Mayer G et al. EFNS guidelines on management of narcolepsy. Eur J Neurol 2006; 13: 1035-1048. [ Links ]
25. Littner MR, Kushida C, Wise M, Davila DG, Morgenthaler T, Lee-Chiong T et al. Practice parameters for clinical use of the multiple sleep latency test and the maintenance of wakefulness test. Standards of Practice Committee of the American Academy of Sleep Medicine. Sleep 2005; 28: 113-121. [ Links ]
26. Kryger MH, Walld R, Manfreda J. Diagnoses received by narcolepsy patients in the year prior to diagnosis by a sleep specialist. Sleep 2002; 25: 36-41. [ Links ]
27. Eguía VM, Cascante JA. Síndrome de apnea-hipopnea del sueño. Concepto, diagnostico y tratamiento médico. An Sist Sanit Navar 2007; 30 (Suppl. 1): 53S-74S. [ Links ]
28. Morgenthaler TI, Kapur VK, Brown T, Swick TJ, Alessi C, Aurora RN et al. Practice parameters for the treatment of narcolepsy and other hypersomnias of central origin. Standards of Practice Committee of the American Academy of Sleep Medicine. Sleep 2007; 30: 1705-1711. [ Links ]
29. Poza-Aldea JJ. Tratamiento integral con oxibato sódico de los síntomas del síndrome narcolepsia-cataplejía. Rev Neurol 2009; 48: 27-31. [ Links ]
30. George CF, Feldman N, Zheng Y, Steininger TL, Grzeschik SM, Lai C et al. A 2-week, polysomnographic, safety study of sodium oxybate in obstructive sleep apnea syndrome. Sleep Breath (revista electrónica) 2010; 1522-1709 (consultado 25-01-2010). Disponible en: http://www.springerlink.com/content/x282v13138q5805q/ [ Links ]
31. Vignatelli L, Billiard M, P Clarenbach, García-Borreguero D, Kaynak D, Liesiene V et al. EFNS guidelines on management of restless legs syndrome and periodic limb movement disorder in sleep. Eur J Neurol 2006; 13: 1049-1065. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Rocío-Milena Pabón Meneses
Servicio de Neurofisiología Clínica
Hospital Virgen del Camino
Irunlarrea, 4
31008 Pamplona. España.
E-mail:
drarociomilena@hotmail.com
Recepción el 6 de agosto de 2009
Aceptación provisional el 19 de enero de 2010
Aceptación definitiva el 8 de marzo de 2010