INTRODUCCIÓN
Los niños presentan con frecuencia ganglios palpables en la región subangulomandibular. Pero las adenopatías generalizadas pueden ser indicativas de múltiples enfermedades: desde la mononucleosis infecciosa (la más frecuente), las adenitis bacterianas y otras infecciones (enfermedad por arañazo de gato, tularemia, toxoplasmosis, rickettsiosis, VIH, sífilis, etc.); a otras causas menos frecuentes como la enfermedad de Kawasaki, el linfoma, las metástasis, etc.1. La realización de una buena historia clínica, exploración física minuciosa y pruebas complementarias guiadas por la clínica pueden ayudar a establecer el diagnóstico diferencial de linfoadenopatías2.
En este artículo presentamos los casos de dos niños que acuden a nuestra consulta por linfoadenopatías regionales compatibles con el cuadro clínico conocido como linfoadenopatía transmitida por garrapatas, tick-borne lymphadenopathy (TIBOLA), d ermacentor-m borne necrosis erythema lymphadenopathy (DEBONEL) o scalp eschar and neck lymphadenopathy (SENLAT)3.
CASOS CLÍNICOS
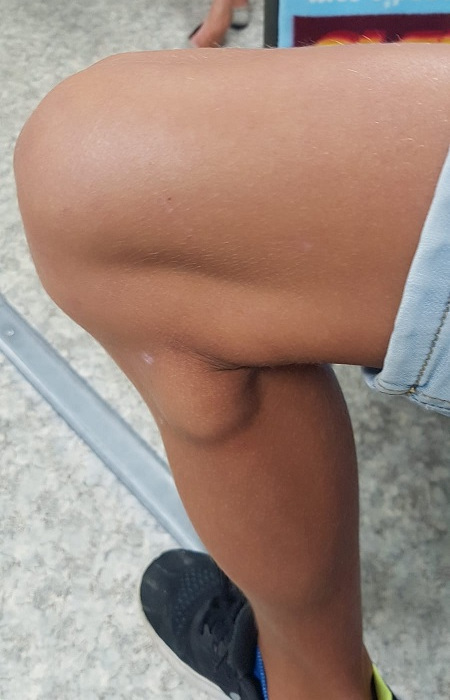
Niño de nueve años, sin antecedentes personales de interés que acude durante el mes de julio a nuestro centro de salud por presentar adenopatías de 4 × 3 cm en el hueco poplíteo de ambas rodillas (Fig. 1). Tenía contacto cercano con un hámster, una tortuga y un perro que vivían en la casa. Refería la picadura por garrapata hacia 17 días extraída por ellos mismos, y fiebre de bajo grado, sin exantema, una semana después. En la exploración física presentaba buen estado general, escara paritooccipital derecha negruzca y se apreciaban adenopatías cervicales posteriores y retroauriculares de pequeño tamaño entre 1 y 1,5 cm de diámetro; y axilares, inguinales, y poplíteas de mayor tamaño (Figs. 2 y 3), todas ellas de consistencia blanda, ligeramente dolorosas a la palpación y no adheridas a planos profundos. El resto de la exploración era normal. En la analítica sanguínea mostraba un hemograma normal, con un perfil general que incluía velocidad de sedimentación globular y proteína C reactiva sin hallazgos patológicos. Los resultados de la serología mostraron negatividad para citomegalovirus, virus de Epstein-Barr, Bartonella henselae, Francisella tullarensis y positividad a Borrelia burgdorferi y Rickettsia conorii (IgM). Ante la sospecha de TIBOLA se realizó tratamiento antibiótico con azitromicina. Tras un periodo de cuatro semanas las adenopatías persistían, por lo que se solicitó una ecografía que mostró adenopatías de características benignas, sin superar los 15 mm de diámetro, y se remitió una muestra de sangre total al servicio de microbiología de nuestra área de salud para realización de una prueba de reacción en cadena de la polimerasa (PCR) de Rickettsia spp ., con resultado negativo.
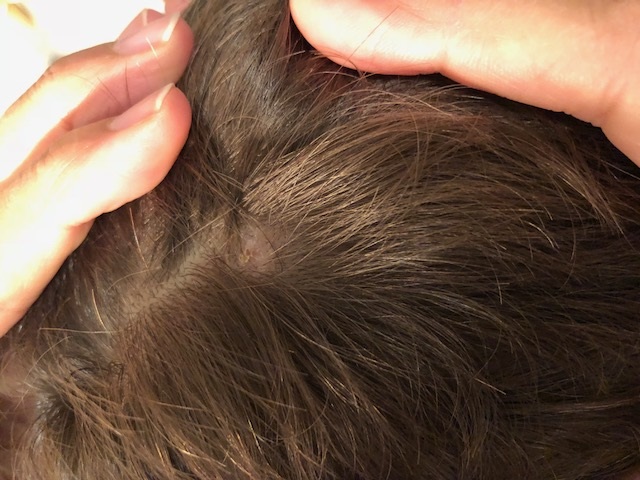
Niño de cuatro años con alergia al pescado que acude en el mes de julio a la consulta del médico de familia del medio rural por presentar un eritema en la región del cuero cabelludo, con escara y adenopatías submandibulares, axilares e inguinales, no dolorosas, de consistencia blanda, no adheridas a planos profundos. No había presentado fiebre, ni exantema, pero referían que hacía 15 días le habían descubierto una garrapata en el cuero cabelludo, que fue extraída por los padres. Ante la sospecha de sobreinfección bacteriana, le pautaron ácido fusídico en el cuero cabelludo y amoxicilina por vía oral durante ocho días y se solicitó analítica con serología para rickettsias. Diez días más tarde acudía a nuestra consulta para resultados de la analítica, que resultó positiva límite para Borrelia y negativa para R. conorii , y normal para el resto de los parámetros analíticos. Presentaba pequeña área alopécica en el cuero cabelludo (Fig. 4) y las adenopatías estaban disminuyendo de tamaño. Ante la sospecha de TIBOLA se completó tratamiento con azitromicina durante cinco días y se remitió muestra de sangre total al servicio de microbiología de nuestra área de salud para la realización de PCR Rickettsia spp ., con resultado negativo.
DISCUSIÓN
Las rickettsiosis en sentido estricto son infecciones transmitidas por especies del género Rickettsia y Orientia (con una sola especie, Orientia tsutsugamushi ).
Con base a análisis filogenéticos, se proponen dos clasificaciones para las diferentes especies de este género. En la primera se describen cuatro grupos: grupo de las fiebres manchadas ( R. rickettsii , R. conorii y R. parkeri , entre otras), grupo del tifus ( R. prowazekii y R. typhi ), grupo transicional ( R. akari , R. australis y R. felis ) y grupo ancestral ( R. bellii y R. canadensis ). En la segunda, se contemplan únicamente dos grupos con subgrupos: grupo de las fiebres manchadas (subgrupo R. rickettsii , subgrupo R. massiliae , subgrupo R. helvetica y subgrupo R. akari ) y grupo del tifus (subgrupo R. prowazekii ).
Las rickettsias son bacilos cortos gramnegativos de crecimiento intracelular obligado. Excepto R. prowazekii , el agente causal del tifus exantemático que tiene como principal reservorio el hombre, todas las demás rickettsias infectan a diferentes especies de animales y artrópodos siendo el ser humano un huésped accidental. El hombre se ve afectado después de la inoculación bacteriana mediante la picadura de garrapatas (gran parte de las especies del grupo de las fiebres manchadas) o ácaros ( R. akari y Orientia tsutsugamushi ) y por el contacto de abrasiones cutáneas con heces de pulgas ( R. typhi y R. felis ) o piojos ( R. prowazekii ).
Dentro del grupo de las fiebres manchadas, consideradas rickettsiosis emergentes en nuestro medio, se encuentra la linfadenopatía por picadura de garrapata que ha recibido diferentes nombres desde su identificación: TIBOLA, DEBONEL o SENLAT. Junto a la fiebre botonosa mediterránea (producida por R. conorii) , es la rickettsiosis más frecuente en Europa. Se ha observado en España y en otros países como Hungría, Francia, Portugal, Italia y Bulgaria. Aunque la principal especie causal es R. slovaca , aislada en 1968 e identificada como agente causal por Raoult en 1997, en los últimos años se han descrito otros agentes como R. massiliae , R. sibirica mongolotimonae , R. raoultii y R. rioja6, entre otras.
Esta enfermedad se produce tras la picadura de la garrapata Dermacentor marginatus , que actúa de reservorio de estas rickettsias, aunque también se han encontrado en D. reticulatus . Ambas garrapatas tienen mayor actividad en los meses fríos, por lo que suele haber más casos de octubre a mayo, aunque nuestros casos se diagnostican en verano. De forma característica, es más frecuente que piquen a población pediátrica7.
El periodo de incubación es de unos seis días. La lesión cutánea característica se origina en el lugar de la picadura de la garrapata, y comienza como una costra que se localiza en el cuero cabelludo en más de un 90% de los casos. A los pocos días, aparece una escara necrótica, rodeada de un halo de eritema, que puede confundirse con impetiginización, como en nuestro segundo caso. Otro hecho característico es la aparición de linfoadenopatías regionales dolorosas que, si están localizadas en la región cervical, puede producir cefalea y contracturas musculares. En ambos niños estaban presentes en el momento del diagnóstico. La fiebre y el exantema maculopapular son infrecuentes, a diferencia de otras rickettsiosis. La evolución de la escara es tórpida y en un tercio de los pacientes se desarrolla una alopecia en la zona de la escara que persiste durante meses/años. Las alteraciones de laboratorio son inespecíficas y no existen datos diferenciales con otras rickettsiosis. A veces pueden encontrarse discretamente elevados los niveles de creatinfosfoquinasa, lactato deshidrogenasa, transaminasas y reactantes de fase aguda8.
El diagnóstico se basa en la serología (inmunofluerescencia indirecta [IFI]) y técnicas de PCR para detección de ADN de Rickettsia spp . La IFI es una de las técnicas más sensibles y la más ampliamente utilizada en la actualidad para el diagnóstico de las rickettsiosis exantemáticas. Pero hay que tener en cuenta que la serología está limitada por las reacciones cruzadas entre el grupo de las fiebres manchadas y las del grupo tifus. Se conoce que las técnicas serológicas frente a R. conorii pueden resultar positivas por reactividad cruzada con otras especies de rickettsias, entre ellas R. slovaca . Además la confirmación del diagnóstico requiere detectar una seroconversión, que se produce en la fase de convalecencia, entre la tercera y cuarta semana9. En nuestros casos la positividad por reacción cruzada frente a R. conorii y Borrelia apoyaría el diagnóstico de que se trate de un TIBOLA por reactividad cruzada.
Las técnicas moleculares, como la PCR, permiten un diagnóstico rápido y específico al detectar ADN de rickettsia en tejidos infectados, cultivos y garrapatas. La PCR puede realizarse tanto en sangre o en la biopsia cutánea de la escara necrótica. Esta última nos dará una mayor rentabilidad diagnóstica que la sangre total, debido al bajo porcentaje de diseminación hematógena de las mismas. Por tanto, cuando se notifica un resultado de PCR negativo se debe tener en cuenta que, en ocasiones, la carga bacteriana en algunas muestras suele ser muy baja y por tanto los métodos moleculares pueden no ser suficientemente sensibles, por lo que un resultado negativo no descarta una infección.
El tratamiento de elección es la doxiciclina en dosis de 10 mg/kg/día cada 12 horas (máximo 100 mg/12 h) durante 7-14 días. Pero como la enfermedad se presenta fundamentalmente en pacientes pediátricos, y para no interferir con la odontogénesis, debe emplearse como alternativa los macrólidos, principalmente azitromicina en dosis de 10 mg/kg/día (máximo 500 mg/24 h) durante 5 días, o claritromicina 15 mg/kg/día cada 12 horas (máximo 500 mg/12 h) durante 7-10 días. La evolución con el tratamiento suele ser favorable, con resolución de la sintomatología en 1-2 meses. No existe evidencia de que sea necesario profilaxis antibiótica sin sintomatología tras la picadura de garrapata. Tan solo se recomienda estar vigilante por si aparece fiebre, erupción cutánea o adenopatías10.
Como conclusión, hay que destacar la importancia de tener en cuenta esta rickettsiosis en zonas endémica. Pese a la dificultad que supone la interpretación de los resultados serológicos, el diagnóstico de esta rickettsiosis se puede hacer a la luz de los datos clínicos y epidemiológicos. Debe plantearse la utilización simultánea otras técnicas para aumentar la sensibilidad diagnóstica como pueden ser en la actualidad las técnicas de PCR en biopsia cutánea que nos darán el diagnóstico etiológico de la infección. Aunque mayoritariamente suelen tener un curso benigno la sospecha diagnóstica y el inicio precoz del tratamiento puede ser beneficioso en su evolución.