Introducción
El virus SARS-CoV-2 causante de la enfermedad denominada COVID-19, es un nuevo coronavirus detectado en China a finales de diciembre de 2019, donde causó un brote de neumonía de etiología desconocida1. Este virus ha afectado y modificado el modo de vivir de millones de personas ya que es pandémico2. Ningún país estaba preparado para atender a todos los pacientes que requerían atención médica, ni podían hacer frente a la gravedad que éstos presentaban. En la primera ola no había infraestructuras, ni equipamientos adecuados y tampoco personal suficiente para soportar la gran demanda asistencial3. Todo se vio agravado por las bajas que se produjeron en el personal4, ya sea por estar en aislamiento o en cuarentena por la COVID-19, por ser trabajadores vulnerables, con patología de salud mental entre otros. Esta situación ha ido mejorando con el transcurso del tiempo gracias a las medidas preventivas aplicadas y a la posibilidad de vacunación temprana del personal sanitario.
Tras una época de incertidumbre en la que se han probado diversos tratamientos en un intento de curar la enfermedad, la disponibilidad de vacunas frente al SARS-CoV-2 ha supuesto un gran avance en el control de la infección5. Favorecido porque ya se disponía de una amplia y probada experiencia sobre cómo desarrollar vacunas con garantías de calidad, seguridad y eficacia, y de conocimientos previos basados en la experiencia, del tratamiento del SARS y el MERS-CoV6.
La vacuna de Pfizer-BionTech (BNT162b2) fue la primera aprobada por la Agencia Europea del medicamento (AEM) el 21 de diciembre de 20207. A fecha de hoy otras tres vacunas han sido aprobadas: las de Moderna, Astra Zeneca y Janssen. Todas ellas han mostrado niveles adecuados de eficacia y seguridad, si bien presentan diferentes características en cuanto a su logística, eficacia y perfiles de población en las que han sido ensayadas8. En nuestro centro al inicio de la campaña, se empleó la vacuna de Pfizer-BioNTech9.
Desde el principio de la pandemia también se han ido desarrollando e incorporado diversas técnicas para el diagnóstico serológico del SARS-CoV-2 (ELISA, CLIA, CMIA) cada vez más sensibles y específicas, que son las características que se requiere de una prueba para poder incorporarla al diagnóstico. Estas pruebas están diseñadas para detectar anticuerpos frente a diferentes epítopos del virus, S: Spike (espícula) y N: Nucleocápside. La vacuna genera anticuerpos IgG contra la espícula (S) y algunas pruebas serológicas permiten detectarlos y cuantificarlos10. La infección natural genera una respuesta de anticuerpos tanto frente al epítopo de la nucleocápside como a de la espícula.
El objetivo de nuestro trabajo fue determinar la respuesta de anticuerpos anti SARS-CoV-2, mediante una técnica cuantitativa, en trabajadores sanitarios y no sanitarios tras haber completado la vacunación con Pfizer-BionTech, estimar las variables asociadas a la efectividad de esta vacuna, así como describir los efectos secundarios que produce.
Métodos
Se estudió una muestra representativa y aleatoria de los trabajadores, tanto sanitarios como no sanitarios del Hospital General Universitario de Castellón, que entre el 8 de enero y el 12 de febrero de 2021 completaron la vacunación. Se excluyeron los trabajadores no vacunados y los que no habían completado la pauta de vacunación un mes antes del inicio del estudio. Pasado un mes realizamos un estudio transversal para conocer el estado inmunitario producido por la vacuna de Pfizer-BioNTech y los efectos secundarios que esta había producido.
Los datos de los profesionales vacunados fueron registrados por el Servicio de Medicina Preventiva en una aplicación diseñada por los informáticos del hospital. En ella se introducían datos demográficos, el número SIP (Sistema de Información Poblacional), y fecha en que se administraron las vacunas. A cada vacunado la aplicación le asignaba un número de identificación anonimizado automáticamente.
Tamaño de la muestra estudiada
Se realizó un muestreo aleatorio simple del total del personal que había completado la vacunación (n=2800) hasta el 12 de febrero. Para calcular el tamaño de la muestra se utilizó el programa Epi-Info versión 711. Considerando la eficacia de la vacuna Pfizer-BionTech que se ha estimado es de un 95%12,13, y considerando que hasta un 10-11% de los profesionales sanitarios podían haber sufrido la infección frente SARS-CoV-1914,15, y que otro 10% podían ser posibles pérdidas, el tamaño muestral resultante fue de 284 trabajadores. Con esta muestra se detectaría una tasa de respuesta de la vacunación del 80% con un intervalo de confianza del 95% y una precisión del 5%. Partiendo del censo de trabajadores vacunados, y mediante el programa Open-Epi16) se obtuvo una lista de números aleatorios para configurar la muestra de participantes (n=284).
Se contactó telefónicamente con las personas de la muestra y se les preguntó si aceptaban participar en el estudio. Se repitió un segundo muestreo para reemplazar los participantes que no habían aceptado la primera invitación. La muestra final fue de 275 trabajadores.
Cuestionario post-vacunación
A los trabajadores que dieron su conformidad, se les citó para la extracción de una muestra de sangre. Previamente los participantes auto-cumplimentaron un consentimiento informado, la autorización para que sus muestras se pudiesen almacenar en el biobanco del hospital y un cuestionario post-vacunación (anexo 1). En él se recogían variables demográficas, peso, altura, ocupación, estilos de vida, exposición y/o enfermedad por COVID-19, situación de salud, patologías previas, fecha de la vacunación frente al COVID-19 y potenciales efectos secundarios.
Técnicas de determinación de anticuerpos anti-SARS-CoV-2
Todas las determinaciones de anticuerpos se realizaron con el analizador automatizado Alinity de Abbott10, que utiliza la tecnología de inmunoanálisis quimioluminiscente de micropartículas (CMIA). Los ensayos utilizados fueron: detección cualitativa de anticuerpos IgG (Abbott SARS-CoV-2 IgG assay) frente a la proteína N(IgG-NP), detección semicuantitativa de IgM (Abbott SARS-CoV-2 IgM assay) frente a la proteína S (IgM-S) y detección cuantitativa de IgG (Abbott SARS- CoV-2 IgGII assay) frente a la proteína S (IgG-Quant).
Análisis estadístico de los datos
Se realizó un análisis descriptivo de las características de los participantes, y se estimaron las proporciones de respuesta de la vacunación y los efectos adversos con un intervalo de confianza (IC) del 95% mediante una distribución binomial. Se emplearon pruebas estadísticas como Chi2, prueba exacta de Ficher para comparar variables cualitativas y las pruebas de Mann-Whitney y de Kruscal-Wallis para comparar variables cuantitativas. Se emplearon la regresión lineal simple, la regresión múltiple para analizar los niveles de IgG-Quant como variable cuantitativa y la regresión de Poisson robusta para la respuesta a IgG-NP e IgM-S y para analizar los efectos secundarios de la vacunación. Se comprobó la bondad de ajuste de los modelos de regresión. A modo exploratorio, se utilizó el análisis de la varianza para desarrollar un modelo predictivo de los niveles de IgG-Quant en función de las variables estudiadas, incluyendo la edad por grupos, sexo, índice de masa corporal (Kg/m2) y el hábito tabáquico. Se utilizó el método Directed Acyclic Graphs (DAGs)17 para obtener las variables de ajuste incluidas en los modelos multivariantes. Todos los análisis estadísticos se realizaron con el programa STATA® versión 14.
Resultados
La participación fue del 96,8% (275/284), 205 eran mujeres (75,6%) y 70 varones (25,4%) con una edad media de 44,6 +/- 11,1 años (rango 20-69). La ocupación más frecuente (34,3%) fue enfermería. Los estilos de vida sugieren una menor prevalencia de obesidad y tabaquismo en las ocupaciones sanitarias, siendo similar en cuanto a consumo de alcohol y ejercicio físico en todas. Respecto a la prevalencia de enfermedad, fue más elevada en personal de mantenimiento y administración, siendo las endocrino-metabólicas las más frecuentes. La exposición a la COVID-19 fue del 66,8% e indicaron que habían pasado la enfermedad el 8,5%. En la tabla 1 se recogen las características de la población.
Tabla 1. Características generales de la muestra de estudio.
| Variables | Categorías | Medicina n=63 N (%) | Enfermería n=93 N (%) | Auxiliar n=45 N (%) | Celador n=18 N (%) | Otras n=52 N (%) | Totales n=271a |
|---|---|---|---|---|---|---|---|
| Sexo | Varones | 27 (42,8) | 13 (14) | 2 (4,4) | 7 (38,9) | 18 (34,6) | 205 (75,6) |
| Mujeres | 36 (57,1) | 80 (86) | 43 (95,6) | 11 (61,1) | 34 (65,4) | 70 (25,8) | |
| Edadb (años) | <25 | 1 (1,6) | 4 (4,3) | 0 (0) | 0 (0) | 1 (1,9) | 6 (2,2) |
| 35-34 | 21 (33) | 14 (15,1) | 8 (17,8) | 1 (5,6) | 3 (5,8) | 47 (17,3) | |
| 35-44 | 20 (31,7) | 31 (33,3) | 11 (24,4) | 4 (22,2) | 15 (28,8) | 81 (29,9) | |
| 45-54 | 9 (14,3) | 24 (25,8) | 13 (28,9) | 7 (38,9) | 16 (30,8) | 69 (25,5) | |
| 55-64 | 8 (12,7) | 20 (21,5) | 12 (26,7) | 6 (33,3) | 13 (25,0) | 59 (21,8) | |
| 64 y más años | 4 (6,3) | 0 (0) | 1 (2.2) | 0 (0) | 4 (7,7) | 9 (3,3) | |
| Consumo de alcoholc | Nunca | 24 (38,1) | 38 (40,9) | 20 (44,4) | 10 (55,6) | 22 (42,3) | 114 (42,1) |
| Esporádico | 37 (58,7) | 52 (55,9) | 24 (53,3) | 8 (44,4) | 28 (53,8) | 149 (55) | |
| Habitual | 2 (3,2) | 3 (3,2) | 0 (0) | 0 (0) | 1 (1.9) | 6 (2,2) | |
| Ejercicio físico | Si | 38 (60,3) | 61 (65,6) | 26 (57,8) | 12 (66,7) | 28 (53,8) | 165 (60,9) |
| No | 25 (39,7) | 32 (34,4) | 19 (42,2) | 6 (33,3) | 24 (46,2) | 104 (38,4) | |
| Consumo tabacod | No fumador | 48 (76,2) | 54 (58,1) | 19 (42,2) | 6 (33,3) | 25 (48,1) | 152 (56,1) |
| Ex fumador | 6 (9,5) | 17 (18,3) | 13 (28,9) | 5 (27,8) | 14 (26,9) | 55 (20,3) | |
| Fumador | 9 (14,3) | 20 (21,5) | 11 (24,4) | 7 (38,9) | 12 (23,1) | 59 (21,8) | |
| Índice masa corporale (kg/m2) | <18.5 | 1 (1,6) | 2 (2,2) | 1 (2,2) | 0 (0) | 1 (1,9) | 5 (1,8) |
| 18.5-24.9 | 42 (66,7) | 58 (62,4) | 23 (51,1) | 7 (38,9) | 23 (44,2) | 153 (56,5) | |
| 25.0-29.9 | 15 (23,8) | 24 (25,8) | 1 2(26,7) | 4 (22,2) | 17 (32,7) | 72 (26,6) | |
| ≥30.0 | 4 (6,3) | 9 (9,7) | 7 (15,6) | 5 (27, 8) | 7 (13,5) | 32 (11,8) | |
| Padecer alguna enfermedad | Si | 10(15.9) | 36 (38,7) | 18 (40) | 5 (27,8) | 21 (40,4) | 90 (33,2) |
| No | 53 (84,1) | 57 (61,3) | 27 (60) | 13 (72,2) | 31 (59,6) | 18 1(66,8) | |
| Enf. Endocrino-metabólica | Si | 3 (4,8) | 15 (16,1) | 6 (13,3) | 3 (16,7) | 12 (23,1) | 39 (14,3) |
| No | 60(95,2) | 78(83,9) | 39 (86.7) | 15 (83,3) | 40 (76,9) | 232 (85,7) | |
| Toma algún medicamento | Si | 11(17,5) | 31(33,3) | 17 (37,8) | 5 (27,8) | 21 (40,4) | 85 (31,3) |
| No | 52(82,5) | 62(66,7) | 28 (62,2) | 13 (72,2) | 31 (59,6) | 186 (68,6) | |
| Toma vitaminas | Si | 10(15,9) | 17(18,3) | 7 (15,6) | 4 (22,2) | 4 (7,7) | 42 (15,5) |
| No | 53(84,1) | 76(81,7) | 38 (84,4) | 14 (77,8) | 48 (92,3) | 229 (84,5) | |
| Toma vitamina D | Si | 5 (7,9) | 7 (7,5) | 2 (4,4) | 0 (0) | 3 (5,8) | 17 (6,3) |
| No | 58(92,1) | 86 (92,5) | 43 (95,6) | 18 (100) | 49 (94,2) | 254 (93,7) | |
| Estado de Saludf | Mala | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Regular | 1 (1,6) | 6 (6.5) | 5 (0,11) | 1 (5,6) | 5 (9,6) | 18 (3) | |
| Buena | 16 (25,4) | 50 (53,8) | 29 (64,4) | 12 (66,7) | 33 (63,5) | 140 (51,7) | |
| Muy buena | 45 (71,4) | 37 (39,8) | 11 (24,4) | 5 (27,8) | 14 (26,9) | 112 (41,3) | |
| Exposición COVID-19 | Si | 47 (74,6) | 71 (76,3) | 29 (64,4) | 14 (77,8) | 20 (38,5) | 181 (66,8) |
| No | 16 (25,4) | 22 (23,6) | 16 (35,6) | 4 (22,2) | 32 (61,5) | 90 (33,2) | |
| Enf. COVID-19g | Si | 5 (7,9) | 8 (8,6) | 4 (8,9) | 2 (11,1) | 4 (7,7) | 23 (8,5) |
| No | 58 (92,1) | 85 (91,4) | 40 (88,9) | 16 (88,9) | 47 (90,4) | 248 (91,5) | |
| COVID-19 confirmadoh | Si | 4 (6,3) | 7 (7,5) | 3 (6,7) | 2 (11,1) | 5 (9,6) | 21 (7,6) |
| No | 59 (93,7) | 86 (92,5) | 42 (93,3) | 16 (88,9) | 47 (90,4) | (2,4) |
(a)4 participantes sin información de la ocupación. (b) 4 participantes sin información. (c) 1 participante sin información. (d)5 participantes sin información. (e) 8 participantes sin información. (f) 1 participante sin información. (g) 2 participantes sin información. (h) Confirmación por el laboratorio SARS-COV-2 PCR y/o anti-IgG-NP.
En la tabla 2 se muestra la distribución de los trabajadores según la prevalencia de anticuerpos frente al SARS-CoV-2 (UA/ml) y su relación con las variables estudiadas. El 99.6% (95% IC 97,0-99,9) de los participantes presentaron anticuerpos IgG-Quant (274/275), 14,9% (41/275) (95% IC 10,9-19,7) anticuerpos IgM-S, y 4,4% anticuerpos IgG-NP (12/275) (95% IC 2,3-7,5). Solo una trabajadora no desarrolló inmunidad humoral, posiblemente porque estaba bajo tratamiento inmunosupresor. La media geométrica de los niveles de anticuerpos IgG-Quant era 9.130,7 UA/ml (95% IC 8.175,8-10.197,0). Estos aumentaban significativamente en los jóvenes, los no fumadores, al presentar obesidad (IMC>30.0 kg/m2), sufrir efectos por la segunda dosis de vacuna e historia de infección por COVID-19; destacando que los participantes IgG-NP positivos tenían de media niveles de IgG-Quant 1.96 veces mayor que los negativos (17.366,9 UA/ml versus 8.866,7 UA/ml). El tiempo medio transcurrido entre la segunda dosis y el análisis de anticuerpos fue de 34,2 ± 6,1 días, y no afectó a los títulos de anticuerpos.
De los 23 participantes con historia de COVID-19, 15 tenían PCR positiva y 8 PCR negativas; 10 tenían anticuerpos IgG-NP positivos y 13 fueron negativos. Dos participantes IgG-NP positivos desconocían que hubiesen pasado la enfermedad. De los 21 que tenían confirmación por laboratorio de COVID-19, en 9 no se detectaron IgG-NP (42,9%).
Tabla 2. Media de niveles de IgG-Quant y prevalencia de anticuerpos IgG-Quant, IgM-S, IgG-NP en función de las variables estudiadas.
| Variables | Categorías | IgG-Quant | p-valor | IgM-S | p-valor | IgG-NP n (%) | p-valor | |
|---|---|---|---|---|---|---|---|---|
| Número de personas con anticuerpos n (P) | 274 (99,6) | - | 41 (14,9) | - | 12 (4,4) | - | ||
| Sexo | Varones | 12970,3 ± 9309,3 | 0,472 | 17 (41,5) | 0,11 | 4 (33,3) | 1,000 | |
| Mujeres | 11978,4 ± 8926,6 | 24 (58,5) | 8 (66,7) | |||||
| Edad (años) | <25 | 15539,5 ± 7639,5 | 0,130 | 2 (4,9) | 0,983 | 0 | 1,000 | |
| 25-34 | 14871,4 ± 9246,5 | 0,009 | 6 (14,6) | 3 (25) | ||||
| 35-44 | 10042,6 ± 7612,9 | 0,007 | 14 (34,1) | 3 (25) | ||||
| 45-54 | 12140,5 ± 10081,0 | 0,367 | 9 (22) | 4 (33,3) | ||||
| 55-64 | 13691,3± 9224,8 | 0,063 | 9 (22) | 2 (16,7) | ||||
| 65 y más | 6544,3 ± 2386,8 | 0,043 | 1 (2,4) | 0 | ||||
| Consumo alcohol | Si | 12519,1 ± 8607,0 | 0,220 | 25 (61) | 1,000 | 5 (41,7) | 0,684 | |
| No | 11844,6 ± 9540,8 | 16 (39) | 7 (58,3) | |||||
| Ejercicio físico | Si | 11831,0 ± 8598,2 | 0.459 | 27 (65.9) | 1,000 | 10 (83,3) | 0,371 | |
| No | 12839,8 ± 9632,7 | 14 (34.1) | 2 (16,7) | |||||
| Consumo tabaco | No fumador | 13124,2 ± 8824,8 | 0,004 | 29 (74,4) | 0,280 | 8 (66,7) | 0,648 | |
| Ex fumador | 11313,4 ±8317,0 | 0,382 | 4 (10,3) | 3 (25,0) | ||||
| Fumador | 10493,1 ± 9560,1 | 0,010 | 6 (15,4) | 1 (8,3) | ||||
| Índice masa corporal (kg/m2) | <18.5 | 10484,7 ± 5130,9 | 0,889 | 0 (0) | 9,535 | 0 (0) | 1,000 | |
| 18.5-24.9 | 11466,9 ± 8439,6 | 0,031 | 25 (61) | 8 (66,7) | ||||
| 25.0-29.9 | 12349,7 ± 7885,7 | 0,536 | 8 (19,5) | 3 (25) | ||||
| ≥30.0 | 17517,1 ± 12717,7 | 0,014 | 8 (19,5) | 1 (8,3) | ||||
| Toma algún medicamento | Si | 12440,9 ± 8720,8 | 0,537 | 18 (43,9) | 0,362 | 3 (25) | 1,000 | |
| No | 12132,2 ± 9169,1 | 23 (56,1) | 9 (75) | |||||
| Toma vitaminas | Si | 11971,2 ± 9455,9 | 0,724 | 6 (14,6) | 1,000 | 4 (33,3) | 1,000 | |
| No | 12277,7 ± 8958,1 | 35 (85,4) | 8 (66,7) | |||||
| Toma vitamina D | Si | 13050,9 ± 9360,5 | 0,584 | 2 (4,9) | 1,000 | 3 (25) | 0,590 | |
| No | 12176,8 ±9012,0 | 39 (95,1) | 9 (75) | |||||
| Ocupación | Medicina y Enfermería | 12261,8 ± 8279,0 | 0,291 | 24 (60) | 1,000 | 8 (61,5) | 1,000 | |
| Otras | 12160,6 ± 10001,2 | 16 (40) | 5 (38,5) | |||||
| Padece alguna enfermedad | Si | 12360,2 ± 9189,0 | 0,667 | 21 (51,2) | 0,176 | 3 (25) | 1,000 | |
| No | 12168,0 ± 8707,4 | 20 (48,8) | 9 (75) | |||||
| Enf. Endocrina-metabólica | Si | 13240,8 ± 9340,4 | 0,378 | 29 (70,7) | 0,181 | 2 (16,7) | 1,000 | |
| No | 12064,0 ± 8974,0 | 12 (29,3) | 10 (83,3) | |||||
| Exposición COVID-19 | Si | 12636,1± 9074,6 | 0,284 | 26 (63,4) | 1,000 | 12 (100) | 0,093 | |
| No | 11424,9 ± 8900,7 | 15 (36,6) | 0 (0) | |||||
| Enf. COVID-19 | Si | 22732,7 ±11120,1 | 0,000 | 8 (20) | 0,193 | 10(83,3) | 0,004 | |
| No | 11202,4 ± 8002.1 | 32 (80) | 2 (16,7) | |||||
| IgG-NP | Si | 21933,5±12561,8 | 0,005 | - | - | |||
| No | 11788,2±8598,2 | |||||||
| IgM-S | Si | 17639,5±1042,5 | 0,000 | - | - | |||
| No | 11283,2±8313,9 | |||||||
| Efectos secundarios | Si | 12638,0±9189,4 | 0,044 | 35 (85,4) | 1,000 | 12 (100) | 0,478 | |
| No | 9612,4±7416,3 | 6 (14,6) | 0 (0) | |||||
| Efectos secundarios tras 1ª dosis | Si | 11636,1±9074,6 | 0,417 | 32 (78) | 1,000 | 11 (91,7) | 0,593 | |
| No | 11424,9 ± 8900,7 | 9 (22) | 1 (8,3) | |||||
| Efectos secundarios tras 2ª dosis | Si | 22732,7±11120,1 | 0,024 | 33 (80,5) | 1,000 | 11 (91,7) | 0,593 | |
| No | 11202,4 ± 8002,1 | 8 (19,5) | 1(8,3) | |||||
En el análisis multivariante ajustado para cada variable independiente (Tabla 3), la tasa de IgG-Quant aumentaba de forma significativa a mayor IMC, en la obesidad (IMC ≥30,0 kg/m2), en no fumadores, y en los IgM-S y/o IgG-NP positivos.
Tabla 3. Análisis de las asociaciones entre la prevalencia de anticuerpos anti-SARS-CoV-2 (IgG-Quant) y las diferentes variables independientes.
| Variables | Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|---|
| CR | 95% IC | p-valor | CR | 95% IC | p-valor | ||
| Edad (años) | -30,2 | -528,2-67,8 | 0,545 | -27,2a | -125,6 - 71,2 | 0,587 | |
| Sexo (Varón) | 991,8 | -1467,7-3451,5 | 0,428 | 919,2a | -1589,3 - 3407,9 | 0,474 | |
| Índice masa corporal (IMC) (Kg/m2) | 292,8 | 44,2 -541,5 | 0,021 | 359,5b | 82,7 - 636,4 | 0,011 | |
| IMC (4 grupos)c | 2358,0 | 900,1 -3811,8 | 0,002 | 2780,4b | 1188,4 -4372,3 | 0,001 | |
| IMC≥30 kg/m2 | 5800,0 | 2556,2-9043,7 | 0,001 | 6260,5b | 2807,7-9713,3 | 0,000 | |
| Consumo de tabaco | No fumador | 2231,4 | 84,7 -4378,1 | 0,042 | 2414,3d | 73,2 -4755,4 | 0,043 |
| Exfumador | -1069,6 | -3693,4-1554,2 | 0,423 | -1622,0d | -4525,5-1281,4 | 0,272 | |
| Fumador | -2139,6 | -4705,4-426,2 | 0,102 | -1778,5d | -4480,7- 923,7 | 0,196 | |
| Consumo alcohol | 674,5 | -1510,9-2868,0 | 0,544 | 969,1e | -1300,8- 3239,0 | 0,409 | |
| Ejercicio | -1008,8 | -3198,4- 1180,8 | 0,365 | -1643,4f | -3908,3- 622,2 | 0,154 | |
| Toma algún medicamento | 312,67 | -2008,2 -2633,5 | 0.791 | 439,8g | -2081,2 -2960,9 | 0,731 | |
| Toma vitaminas | -306,5 | -3288,1- 2697,1 | 0,840 | -717,7g | -3773,0- 2337,8 | 0,644 | |
| Toma vitamina D | 840,0 | -3578,7-5326,8 | 0,699 | 1376,4g | -3134,0-5892,5 | 0,549 | |
| Ocupación Medicina + Enfermería | 95,2 | -2094,5-2284,8 | 0,932 | 115,6h | -2392,0-2161,8 | 0,920 | |
| Padecer enfermedad | 192,3 | -2093,6-2478,2 | 0,864 | 84i | -2494,4-2326,4 | 0,945 | |
| Enf. Endocrina-metabólica | 1576,8 | -1894,6- 4248,3 | 0,541 | 2040,8i | -1214,9-5296,5 | 0,218 | |
| IgG-NP | 10145,3 | 5035,7-15258,0 | 0,000 | 10243,9j | 5097,8- 15389,7 | 0,000 | |
| IgM-S | 6356,3 | 3441,6-9271,0 | 0,000 | 5605,9k | 2487,0- 8724,8 | 0,000 | |
CR: Coeficiente de regresión. (a) Ajustado por sexo/ edad. (b) Ajustado por edad, sexo, ocupación, alcohol, tabaco, ejercicio físico, vitamina D. (c) Grupos <18,5, 18,5-24,9, 25-29,9, ≥30 kg/m2. (d-e) Ajustado por edad, sexo, ocupación, alcohol, ejercicio físico, vitamina D. (f) Ajustado por edad, sexo, ocupación, tabaco, alcohol vitamina D. (g) Ajustado por edad, sexo, ocupación, tabaco, alcohol, ejercicio físico. (h) Ajustado por edad, sexo. (i) Ajustado por edad, sexo, alcohol, tabaco, ejercicio físico, vitamina D, IMC. (j-k) Ajustado por edad, sexo, enfermedad, alcohol, tabaco, ejercicio físico, IMC y vitamina D.
La prevalencia de anticuerpos IgM-S (Tabla 4) se asociaba significativamente con ser varón, no-fumador, presentar enfermedad endocrino-metabólica, haber pasado la COVID-19 y tener anticuerpos IgG-NP.
Tabla 4. Análisis de las asociaciones (Riesgo Relativo simple .RR- y ajustado -RRa-)entre presencia de anticuerpos anti-SARS-CoV-2 (IgM-S) y las diferentes variables como variables independientes.
| Variables | Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|---|
| IgM-S (+) N=41(%) | IgM-S (-) N=234(%) | RR (95% IC ) | RRa (95% IC) | p-valor | ||
| Edad (años) ± desviación estándar | 43,6±10,7 | 44,8±11,2 | 0,99 (0,97-1,02) | 0,99 (0,97-1,02)a | 0,696 | |
| Sexo | Varón | 17(41,5) | 53(22,6) | 2,07 (1,18-3,63) | 1,93 (1,08-3,43)b | 0,026 |
| Mujer | 24(58,5) | 181(77,4) | 1,00 | |||
| Índice masa corporal (IMC) | 25,2±4,3 | 24,7±4,4 | 1,02 (0,96-1,08) | 1,03 (0,95-1,11)b | 0,501 | |
| <18.5 kg/m2 | 0 | 6 (2,7) | 1,00 | |||
| 18.5-24.9 | 25(61) | 130(57,5) | 1,38 (0,24-∞) | |||
| 25.0-29.9 | 8 (19,5) | 65(28,8) | 0,91 (0,14-∞) | |||
| ≥30.0 | 8 (19,5) | 25(11,1) | 2,01 (0,31-∞) | 1,61 (0,72-3.63)b | 0,245 | |
| Consumo de tabaco | No fumador | 29(70,7) | 124(53,7) | 2,22 (1,13-4,37) | 2,54 (1,19-5.39)c | 0,016 |
| Exfumador | 4(9,8) | 53(22,9) | 0,43 (0,15-1,15) | 0,48 (0,18-1,30)c | 0,148 | |
| Fumador | 6(14,6) | 54(23,4) | 0,64 (0,28-1,45) | 0,42 (0,16-1,09)c | 0,074 | |
| Consumo alcohol | Si | 25(61) | 133(57,3) | 1,74(0,63-2,03) | 1,10 (0,59-1,90)d | 0,757 |
| No | 16(39) | 99(42,7) | 1,00 | |||
| Ejercicio habitual | Si | 27(65,9) | 139(59,4) | 1,31 (0,70-2,31) | 1,25 (0,66-2,37)e | 0,490 |
| No | 14(34,1) | 95(40,6) | 1,00 | |||
| Toma algún medicamento | Si | 18(43,9) | 67(28,6) | 1,75(0.99-3.07) | 1,60 (0,39-2,92)h | 0,906 |
| No | 23(56,1) | 167 (71,4) | ||||
| Toma vitaminas | Si | 6 (14,6) | 36 (15,4) | 0,95 (0,43-2,12) | 1,03(0.28-3,83)f | 0,957 |
| No | 35(85,4) | 198(84,6) | ||||
| Toma vitamina D | Si | 2(4,9) | 15 (6,4) | 0,78 (0.20-2.96) | 1,06 (0,41-2,52)f | 0,972 |
| No | 39 (95,1) | 219 (93,6) | ||||
| Ocupación | Medicina + Enfermería | 24(60) | 132(57,1) | 1,11(0,62-1,99) | 1,11 (0,60-2,03)g | 0,746 |
| Otras | 16(40) | 99(42,9) | 1,00 | |||
| Padecer alguna enfermedad | Si | 21(51,2) | 71(30,3) | 2,09 (1,19-3,66) | 2,39 (1,28-4,47)h | 0,006 |
| No | 20(48,8) | 163(69,7) | 1,00 | |||
| Enf. Endocrino-metabólica | Si | 12(29,3) | 27(11,5) | 2,50(1,40-4,48) | 3,20 (1,68-6,10)h | 0,000 |
| No | 29(70,7) | 207(88,5) | 1,00 | |||
| Expo. COVID-19 | Si | 26(63,4) | 157(67,1) | 0,87 (0,49-1,56) | ||
| No | 15(36,6) | 77(32,9) | 1,00 | |||
| Enf. COVID-19 | Si | 8(20) | 15(6,4) | 2,72 (1,08-6,92) | 2,95 (1,56-5,60)i | 0,001 |
| No | 32(80) | 218(93,6) | 1,00 | |||
| IgG-NP | 6(14,6) | 7(3,0) | 3,45 (1,78-6,71) | 3,22 (1,76-5,91)j | 0,000 | |
RR= Riesgo Relativo, RRa = Riesgo Relativo ajustado por regresión de Poisson robusta con 95% Intervalo de confianza (IC). (a) Ajustado por sexo, edad. (b) Ajustado por edad, sexo, ocupación, alcohol, tabaco, ejercicio físico, vitamina D. (c) Ajustado por edad, sexo, ocupación, alcohol, ejercicio físico, vitamina D. (d) Ajustado por edad, sexo, ocupación, tabaco, ejercicio físico, vitamina D. (e) Ajustado por edad, sexo, ocupación, tabaco, alcohol, vitamina D. (f) Ajustado por edad, sexo, ocupación, ejercicio físico, alcohol, tabaco. (g) Ajustado por edad sexo. (h-i) Ajustado por edad, sexo, alcohol, tabaco, ejercicio físico, IMC, vitamina D. (j) Ajustado por edad, sexo, enfermedad, alcohol, tabaco, ejercicio físico, IMC, vitamina D.
A partir de los resultados de anticuerpos IgG-Quant, IgM-S, e IgG-NP se compararon cuatro grupos serológicos (Tabla 5): Grupo 1 de participantes con solo IgG-Quant y un participante negativo (n=227), Grupo 2 de participantes con IgG-Quant e IgM-S (n=36), Grupo 3 los que tenían IgG-Quant e IgG-NP (n=7) y Grupo 4 los que tenían IgG-Quant, IgM-S e IgG-NP (n=5). El Grupo 4 alcanzó tasas significativamente más elevadas de IgG-Quant debido a una mayor exposición y enfermedad por COVID-19; así mismo se apreció mayor prevalencia de enfermedad incluyendo la endocrino-metabólica y el tomar vitamina D. Comparando con el Grupo 1, los niveles de IgG-Quant fueron 2,74 veces más elevados (22.837.7 UA/ml versus 8,317,0 UA/ml).
Con estos cuatro grupos se realizó un análisis de la varianza con IgG-Quant como variable dependiente y la edad estratificada en 6 grupos, el sexo, la obesidad (IMC>=30.0 Kg/m2) y no fumador como variables independientes. En el modelo predictivo (Figura 1), el Grupo 4 alcanzó los niveles mayores de IgG-Quant con la obesidad y no fumador, observándose un descenso progresivo hasta el Grupo 1. Este modelo explicaba un 18,43 % (p=0.000) de la varianza de IgG-Quant entre los grupos.
Tabla 5. Comparación de los grupos serológicos según las variables independientes
| Variables | Grupo 1 N=227 N (%) | Grupo 2 N=36 N (%) | Grupo 3 N=7 N (%) | Grupo 4 N=5 N (%) | p-valor | |
|---|---|---|---|---|---|---|
| Sexo Varón | 51 (22,5) | 15 (41,7) | 2 (28,6) | 2 (40) | 0,062 | |
| Edad | 44.8±11.2 | 43.9±10.9 | 43.1±9.8 | 41.4±9.6 | 0,853 | |
| IgG-Quant UA/mla | 8317,0 | 13274,0 | 14281,4 | 22837,7 | 0,001 | |
| 95% IC IgG-Quant UA/mlb | 7357,0-9402,3 | 10333,2-17051,8 | 6271,8-32520,0 | 9686,3-53845,0 | ||
| Exposición-COVID-19 | 150 (66,1) | 21 (58,3) | 7 (100) | 5(100) | 0,002 | |
| Enfermefdad-COVID-19 | 10 (4,4) | 3 (8,6) | 5 (71,4) | 5(100) | 0,000 | |
| Padece alguna enfermedad | 70 (30,8) | 17 (47,7) | 0 (0) | 3 (60) | 0,023 | |
| Enfermedad endocrino-metabólica | 26 (11,5) | 10(27,8) | 0 (0) | 2(40) | 0,017 | |
| Consumo tabaco | No fumador | 120 (53,6) | 25(73,5) | 4 (57,1) | 4 (80) | 0,155 |
| Exfumador | 50 (22,3) | 4 (11,8) | 3 (42,9) | 0 (0) | ||
| Fumador | 54 (24,1) | 5(14,7) | 0 (0) | 1(20) | ||
| Toma fármacos | 65 (20,6) | 16 (44,4) | 2 (28,6) | 2(40) | 0,233 | |
| Toma vitaminas | 34 (15) | 5 (13,9) | 2(28,6) | 1(20) | 0,564 | |
| Toma vitamina D | 13(5,73) | 1 (2,8) | 2(28,6) | 1(20) | 0,042 | |
| Consumo alcohol | 129 (57,3) | 24 (66,7) | 4 (57,1) | 2 (33,3) | 0,249 | |
| Ejercicio habitual | 134 (59) | 22(61,1) | 5 (71,4) | 6(100) | 0,320 | |
| Índice masa corporal (IMC) kg/m2 | 24.7±4.4 | 25.3±4.2 | 24.2±3.4 | 24.5±5.4 | 0,834 | |
| <18.5 | 6 (2,7) | 0 (0) | 0 (0) | 0 (0) | 0,644 | |
| 18.5-24.9 | 126 (57,5) | 21(58,3) | 4(57,1) | 4 (80) | ||
| 25.0-29.9 | 62 (28,3) | 8 (22,2) | 3 (42,9) | 0 (0) | ||
| ≥30.0 | 25 (11,4) | 7 (19,4) | 0 (0) | 1 (20) | ||
Grupo 1 (solo positivos IgG-Quant + 1 negativo) Grupo 2 (solo positivos IgG-Quant + IgM-S) Grupo 3 (solo positivos IgG-Quant + IgG-NP) Grupo 4 (sólo positivos IgG-Quant + IgG-NP + IgM-S).
(a) Media geométrica IgG-Quant
(b) 95% Intervalo confianza (IC).
Respecto a los efectos secundarios, presentaron algún síntoma después de la vacunación el 86,5% (238/275) (95% IC 81,9-90.3) de los participantes; siendo los afectados con la primera dosis 211 (76,7%) (95% IC 71,3-81,5), y en la segunda 217 (95% IC 73,6-83,6). Los más frecuentes tras la primera dosis fueron: dolor en el brazo (92,9%), hinchazón (16,6%), cefaleas (16,6%), mialgias (12,3%), fatiga (11.9%), enrojecimiento (10,4%) y fiebre (4,3%). Sólo los dos últimos se asociaban con mayores niveles de anticuerpos IgG-Quant.
Tras la segunda dosis, los predominantes fueron dolor en el brazo (79,9%), cefaleas (35,5%), mialgias (31,8%), fatiga (25,8%), fiebre (21,2%), artralgias (18,4%) y mareos (11,5%). Se asociaban a mayores niveles de anticuerpos IgG-Quant la presencia de mialgias, artralgias, fiebre y mareos. Ningún trabajador requirió atención médica.
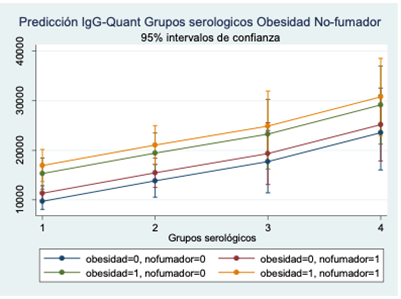
Figura 1. Predicción de los niveles de IgG-Quant en función de los 4 grupos serológicos, obesidad (IMC≥30.0 kg/m2), no fumador, ajustado por edad y sexo. Los grupos serológicos son: Grupo 1 (solo positivos IgG-Quant + un negativo) Grupo 2 (solo positivos IgG-Quant + IgM-S) Grupo 3 (solo positivos IgG-Quant + IgG-NP) Grupo 4 (sólo positivos IgG-Quant + IgG-NP + IgM-S).
Mediante un análisis de regresión de Poisson se compararon los participantes con síntomas de aquellos que no los sufrieron. Los efectos secundarios fueron significativamente mayores en jóvenes, mujeres, los que tenían IgG-NP positivos, y a mayores niveles de IgG-Quant. Considerando los 4 grupos serológicos, se apreció un incremento significativo de IgG-Quant desde el primer grupo al cuarto, ajustado por edad y sexo (datos no mostrados).
Discusión
Los resultados obtenidos muestran que el 99.6% de los participantes presentaron anticuerpos IgG-Quant, estos datos sugieren que la vacuna ofrece una protección muy elevada en personal de alto riesgo. La única persona que no creó anticuerpos estaba bajo tratamiento inmunosupresor.
En relación a los niveles de anticuerpos, en el análisis univariante, nuestros resultados concuerdan con los de otros autores, cómo Müller et al18 que detectan una respuesta de anticuerpos menor en el grupo de pacientes de mayor edad. Así mismo, un estudio en Israel19), concluye que también tienen menos anticuerpos los de mayor edad. Estudios en fase II de las vacunas ya sugerían una menor respuesta en gente mayor en comparación con los más jóvenes 20.
Se había descrito21,22 que el tabaquismo podría ser un factor de severidad de la COVID-19, pero se han publicado pocos trabajos que relacionen al tabaquismo con una menor respuesta a la vacuna. En este estudio los no fumadores generaron más anticuerpos, que los fumadores. Estos resultados coinciden con los de Watanabe y co-autores 23.
En general, en enfermos de COVID-19 se ha observado que a mayor IMC corresponde un nivel más elevado de anticuerpos-SARS-CoV-2 24,25. Pellini y co-autores26 estudiando personas sólo vacunadas no hallaron asociación entre el IMC y los niveles de IgG-Quant y Watanabe y co-autores 23 encontraron que a mayor obesidad abdominal había menores niveles de IgG-Quant. En nuestro estudio excluyendo los participantes con historia previa de COVID-19 y mediante análisis multivariante, la obesidad, y el IMC distribuido en 4 grupos incrementaban significativamente los niveles de IgG-Quant. No obstante, en pacientes obesos este incremento de IgG-Quant se precisaría determinar si protege adecuadamente contra la enfermedad27). Estudios con muestras más amplias serían necesarios para confirmar estos resultados.
Los niveles de IgG-Quant alcanzados por los participantes previamente infectados por SARS-CoV-2, fueron significativamente más elevados que los no-infectados en línea con otras publicaciones28,29. Algunos estudios encontraron qué con la primera dosis de vacunación, se alcanzaban los niveles de los no-infectados vacunados con dos dosis, y que la segunda dosis en infectados no producía un aumento sustancial de IgG-Quant. Se sugería que una sola dosis podría ser suficiente para obtener inmunidad frente al virus en una situación de escasez de vacuna y de pandemia19,30,31.
Se detectó IgM-S, como en otros estudios, en algunas personas vacunadas que no habían sufrido la enfermedad10). En nuestro caso encontramos varias variables asociadas a su presencia. Sin embargo, no hemos encontrado otras referencias respecto a estas variables, salvo en un estudio en pacientes de COVID-19 en que observaron mayores niveles de anticuerpos totales S (IgG+IgM) en no fumadores32). Pensamos que la determinación de IgM-S no se debe utilizar en vacunados para diagnosticar enfermedad aguda porque podría llevar a confusión.
La prevalencia de IgG-NP fue más baja que en otros estudios sobre personal sanitario en España14,15, y se apreció que en casi la mitad de los casos COVID-19 confirmados no se detectaron IgG-NP, probablemente relacionado con el declive de la inmunidad humoral y con las técnicas utilizadas33.
Como ya se ha descrito12,13, los efectos secundarios son más frecuentes tras la segunda dosis de la vacuna y se asocian con niveles más altos de IgG-Quant 34.
Dada la eficacia de las vacunas que se han utilizado, en el momento actual no se recomienda comprobar la respuesta inmunitaria mediante la medición de anticuerpos35, nuestros datos también lo avalan. La determinación de personas vulnerables frente a la infección una vez vacunados y en un medio laboral con inmunización postvacunal masiva, ha de ser estudiada de forma individual sin poder aplicar normas generales. Si bien se considerará la edad, la presencia de enfermedades crónicas, mujeres en edad gestacional y trabajadores de sectores laborales que impliquen mayores riesgos, como ocurre con el personal sanitario o dedicado a la atención de mayores o discapacitados.
El estudio presenta las siguientes fortalezas: 1) se ha basado en una muestra representativa de todo el personal del hospital con una participación muy elevada, 2) las pruebas serológicas utilizadas tienen una alta sensibilidad y especificidad y 3) Se emplearon análisis multivariantes para controlar factores de confusión.
Entre las limitaciones se pueden indicar las siguientes: 1) no evaluamos la inmunidad celular que también participa en la respuesta inmunitaria ni realizamos ensayos de anticuerpos neutralizantes, 2) el tamaño de la muestra es limitado para obtener conclusiones definitivas de los anticuerpos IgG-NP y IgM-S, 3) nuestros resultados no serían extrapolables a la población general tanto por la edad como por el mayor riesgo de exposición que presenta el colectivo estudiado a la enfermedad y 4) al tratarse de un nuevo virus hay muchos aspectos de este que todavía desconocemos y por tanto podrían existir otros factores que podrían estar influyendo nuestros resultados sin que hayan sido analizados.
Sería conveniente considerar el seguimiento de esta cohorte de trabajadores vacunados, para conocer con mayor precisión la dinámica de la inmunidad que confiere la vacuna y su permanencia en el tiempo con vistas a posteriores revacunaciones. Así mismo sería crucial determinar el nivel de anticuerpos IgG que protegen frente a la enfermedad, su duración y factores asociados.
Conclusiones
Todos los participantes desarrollaron una respuesta de inmunidad humoral, excepto uno. Las variables relacionadas con presentar niveles de anticuerpos elevados fueron: haber padecido la enfermedad previamente, IMC>30, ser no fumador, y la positividad a IgM-S y/o IgG-NP. Un porcentaje alto desarrolló efectos secundarios leves, y eran más frecuentes en los que habían padecido la enfermedad.














