INTRODUCCIÓN
El término ginecomastia define un aumento del tejido glandular mamario en el varón, expresión de cierto disbalance en la acción de estrógenos y andrógenos en la glándula. En general, se trata de un proceso benigno, habitualmente de factor etiológico desconocido y, de forma ocasional, expresión de una alteración endocrinológica o tumoral subyacente.
Es una de las principales manifestaciones clínicas del tumor de células de Leydig en la edad adulta pero no la única. Impotencia, disminución de la libido, atrofia testicular y alteraciones en la espermatogénesis con infertilidad son algunas otras.
El tumor testicular tiene un gran impacto debido a que afecta fundamentalmente a población joven. El de células de Leydig pertenece al grupo de tumores del estroma gonadal especializado, siendo el más frecuente de los no germinales. El diagnóstico de sospecha se establece ante una masa testicular y un cuadro de androgenización o feminización con marcadores tumorales negativos1,2. Entre los marcadores inmunohistoquímicos, la inhibina se perfila como excelente por su sensibilidad y especificidad. La calretinina es también considerada un interesante marcador, aunque menos específico. El anticuerpo melan A ha demostrado su utilidad como marcador complementario. El tratamiento de elección es la orquiectomía radical y el seguimiento postoperatorio debe ser prolongado.
CASO CLÍNICO
Varón de 21 años. Consulta por aumento de ambas glándulas mamarias con dolor leve-moderado refractario a analgésicos habituales de 4 meses de evolución. Niega ingesta de anabolizantes o sustancias tóxicas. No refiere disfunción eréctil y presenta libido normal. A la exploración física se palpa endurecimiento en teste derecho.
Ecografía testicular: se objetiva masa testicular derecha bien delimitada de 2,2 cm sugestiva de seminoma. Varicocele izquierdo de grado I. Cordones espermáticos y epidídimos normales. Sin otros hallazgos significativos en la bolsa escrotal. Ecografía mamaria: desarrollo glandular mamario bilateral compatible con ginecomastia vera, sin nódulos ni imágenes quísticas. Resonancia magnética nuclear cerebral: hipófisis de tamaño, morfología e intensidad normales. Formación quística (17x10 mm) con tabicación en su interior, en región pineal. Se amplía el estudio para una mejor caracterización.
Estudio de marcadores tumorales y hormonales: beta-HCG: <0,1 mUI/ml (0-5); AFP: 2,34 ng/ml (0,4-15,0); CEA: 0,94 ng/ml (0,5-5); SCC: 0,9 ng/ml (0-1,5); CA-15.3: 13,0 U/ml (0,5-31,3); PSA total: 0,337 ng/ml (0-4); LH: 0,54 mUI/ml (1,14-8,75); FSH: 0,07 mUI/ml (0,95-11,95); estradiol: 39 pg/ml (11-44); DHEA-S: 3,35 µg/ml; testosterona: 2,16 ng/ml (2,80-11,0); testosterona libre: 4,1 pg/ml (5,6-27); prolactina: 21,43 ng/ml (3,46-19,4); prolactina tras reposo: 33,62 ng/ml (3,46-19,4); cortisol basal: 1,0 µg/dl (3,7-19,4); TSH: 2,261 mUI/l (0,35-4,94); ACTH: 40 pg/ml (9-52); subunidad alfa libre: 0,3 mUI/ml (hasta 1,6), somatomedina C basal: 283 ng/ml (varón 18-21 años: 147-404).
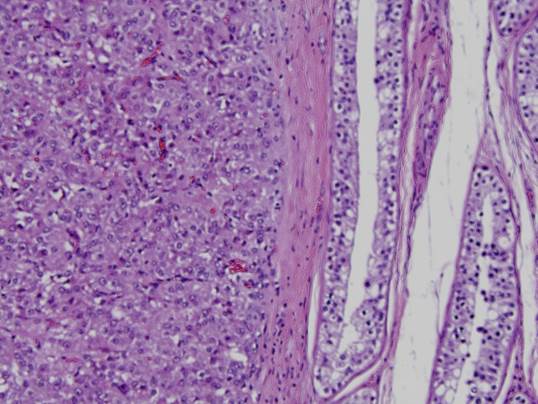
Dado los hallazgos se propone orquiectomía inguinal derecha. Pieza quirúrgica de 40 g, testículo (4,5 x 3,2 x 2,4 cm), epidídimo (4,5 x 1 x 0,5 cm), pedículo (3 x 1,5 cm), recubierto por la vaginalis de color grisáceo, lisa y sin alteraciones macroscópicas. En sección se identifica un tumor (1,4 x 1,4 x 1,5 cm) de color amarillo grisáceo, de bordes bien circunscritos, esférico, localizado en su mitad inferior y sin infiltración de la albugínea. Técnicas de inmunohistoquímica: Inhibina (+); Melan A (+) y negatividad para el resto: CD117 (-); citoqueratina AE1/AE3 (-); EMA (-); CD30 (-); CK19 (-); AFP (-); PSA (-). Borde de resección quirúrgico sin afectación tumoral. Resultado anatomopatológico: tumor de células de Leydig con criterios histopatológicos de benignidad.
Seis meses después de la intervención, el paciente presenta normalización del eje hipotalamo-hipofisario (LH: 1,91 mUI/ml; FSH: 2,14 mUI/ml; DHEA-S: 4,12 µg/ml; testosterona: 5,22 ng/ml; prolactina: 18,44 ng/ml; prolactina tras reposo: 13,92 ng/ml. El seguimiento hormonal a los 12 meses (LH: 3,44 mUI/ml; FSH: 2,22 mUI/ml; testosterona: 6,22 ng/ml; prolactina 14,20 ng/ml; prolactina tras reposo: 13,92 ng/ml) y 36 meses (LH: 3,81 mUI/ml; FSH: 2,84 mUI/ml; testosterona: 6,84 ng/ml; prolactina 17,81 ng/ml; prolactina tras reposo: 12,74 ng/ml) de la intervención confirma una completa recuperación del eje hipofisario.
DISCUSIÓN
Los tumores testiculares representan el 1 % de las neoplasias malignas en el hombre3,4, siendo la causa más frecuente de tumor maligno entre los 15 y los 35 años5. El 93 % derivan de células germinales y el 7 % restante de células del estroma gonadal. Los tumores de células de Leydig suponen del 1 al 3 % del total de los tumores testiculares, presentando dos picos de máxima incidencia (5-10 y 30-60 años)6. La mayoría son unilaterales aunque entre un 3 y un 9 %, según las series, pueden ser bilaterales2.
La forma más frecuente de presentación es una masa testicular palpable, indolora y unilateral4. Cuando no es palpable, el diagnóstico suele ser por hallazgo ecográfico de una masa intraescrotal o por clínica endocrina2. Los tumores de células de Leydig son hormonalmente activos (elevación de estradiol, disminución de testosterona y gonadotropinas) aunque pueden presentarse sin manifestaciones endocrinas; hasta el 40 % de los adultos evidencia clínica endocrina en forma de feminización con ginecomastia, disfunción eréctil, disminución de la libido, oligozoospermia y atrofia del otro testículo1. Concentraciones de estradiol de manera sostenida son responsables de la ginecomastia y de la reducción de la respuesta de testosterona a la LH. Valores disminuidos de testosterona conllevan un incremento del cociente estradiol/testosterona y la ginecomastia.
Se trata de una patología benigna en niños y hasta en el 90 % de los adultos. Es difícil diagnosticar histológicamente los tumores de células de Leydig malignos, ya que el único criterio fiable de malignidad es la presencia de metástasis2,3. Por ello, se han propuesto criterios orientativos de posible malignidad: tumores grandes (> 5 cm), displasia celular severa, actividad mitótica superior a 5 por 10 campos de gran aumento, márgenes infiltrados, áreas de necrosis, invasión linfática o vascular, alto índice MBI-1, alta expresión p53 y aneuploidía del ADN1. La positividad en el estudio inmunohistoquímico a la alfa inhibina es considerado el mejor marcador para diferenciar los tumores estromales de los de células germinativas6. Se debe establecer diagnóstico diferencial con tumores de restos adrenales, hiperplasia de células de Leydig, tumor de células de Sertoli variante calcificante, linfomas y metástasis testiculares, malacoplaquia testicular, plasmocitomas, microlitiasis, quistes dermoides, carcinomas indiferenciados o ginecomastia idiopática1,7.
El tratamiento de elección de estos tumores es quirúrgico, debido a la dificultad de diferenciar de forma inequívoca entre tumor germinal y de células de Leydig1,7. Comprende orquiectomía radical por vía inguinal asociada o no a linfadenectomía retroperitoneal permitiendo la regresión de la endocrinopatía, no así el daño de la línea germinal. El seguimiento post-quirúrgico de estos pacientes debe ser prolongado debido a un curso clínico impredecible. De forma periódica se solicitará: estudio hormonal, marcadores tumorales testiculares, TAC abdominopélvico, radiografía de tórax y ecografía testicular1.
En el caso presentado, la presencia de masa testicular y clínica endocrina (ginecomastia), el patrón hormonal (descenso de gonadotropinas y testosterona) y la negatividad de marcadores tumorales hicieron sospechar el diagnóstico. El nivel de estradiol fue normal. Se ha descrito en la bibliografía que los niveles de estrógenos en estos pacientes son muy variables incluso en el mismo sujeto, pueden ser, en algunos momentos, incluso normales, lo que sugiere secreción estrogénica tumoral intermitente. La ecografía evidenció masa testicular y el estudio anatomopatológico e inmunohistoquímico (inhibina (+) y melan A (+)) confirmaron el diagnóstico presuntivo.
Tras extirpación tumoral, la ginecomastia remite en el 80 % de los casos, al tiempo que se normalizan las alteraciones hormonales. Es el caso de nuestro paciente que tras 12 meses de seguimiento presenta normalización del eje hipotálamo-hipófiso-gonadal (LH: 3,44 mUI/ml; FSH: 2,22 mUI/ml; testosterona: 6,22 ng/ml; prolactina 14,20 ng/ml; prolactina tras reposo: 13,92 ng/ml) y sigue libre de recidiva. Se han descrito casos de recidivas varios años después de la intervención, de modo que el seguimiento de estos pacientes es prolongado, necesitando vigilancia periódica.