INTRODUCCIÓN
Hablamos de preexcitación ventricular cuando el impulso eléctrico pasa a los ventrículos por una vía distinta a la normal (vía accesoria) despolarizándolo antes de lo habitual. A nivel electrocardiográfico queda reflejado por la aparición característica de la «onda delta» con un intervalo PR habitualmente corto1 (Figura 1). La preexcitación ventricular tiene una prevalencia del 1-3 por 1000 pacientes y se identifica en más de la mitad de los casos como un hallazgo casual en el electrocardiograma (ECG)1,2; de estos, un 3 % tienen historia familiar de primer grado de preexcitación1. Los pacientes pueden estar asintomáticos o presentar una amplia variedad de síndromes arrítmicos, incluso la muerte súbita. En las consultas de pediatría y medicina de familia en el ámbito de Atención Primaria se caracterizan por su accesibilidad, por lo que los pacientes acuden para solicitar ciertos certificados ante el desconocimiento de los protocolos a seguir.
CASO CLÍNICO
Presentamos el caso clínico de un varón de 15 años, deportista de alto rendimiento y federado. El paciente realizaba triatlón y natación, habitualmente en piscina. Había participado en travesías marítimas, con una alta carga de entrenamiento diaria de aproximadamente una hora y media añadido a competiciones durante el fin de semana. Considerando esta exigencia deportiva, sus familiares insistieron en la necesidad de un estudio cardiológico completo, pues no disponía de ningún tipo de revisiones específicas previas para la realización de esta actividad física. Ante esta situación fueron atendidos en la consulta de Cardiología.
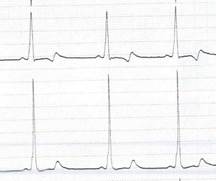
El paciente no presentaba antecedentes de cardiopatía ni historia familiar de muerte súbita o cardiopatía hereditaria. Se encontraba asintomático, con adecuado rendimiento deportivo respecto al resto de sus compañeros. Nunca había presentado síntomas cardiológicos ni en reposo ni con ejercicio físico intenso, preguntando específicamente por palpitaciones, historia de síncopes o clínica de dolor torácico. La exploración física fue normal sin alteraciones. De forma rutinaria, se realizó un electrocardiograma (ECG), donde se objetivó un PR corto con onda delta positiva en cara inferior y V3 y V6; y negativa en I y aVF (Figura 2).

Figura 2. Electrocardiograma del paciente donde se objetiva un PR corto con una onda delta positiva en la cara inferior, negativa en I y aVF y derivaciones precordiales.
En la consulta de Cardiología se solicitó un ecocardiograma doppler que no mostró cardiopatía estructural y los parámetros estudiados fueron normales para su edad y superficie corporal, observando las adaptaciones fisiológicas correspondientes con un corazón de atleta. Con intención de evaluar las propiedades de la vía y la presencia de arritmias durante el ejercicio se realizó una ergometría convencional. A pesar de alcanzar una frecuencia cardiaca elevada, no desapareció la preexcitación, lo que traduce la posibilidad de la vía de conducir impulso a los ventrículos a pesar de frecuencias cardiacas altas. Se completó el protocolo de Bruce sin alteraciones y sin arritmias. Tras los estudios realizados, el diagnóstico final fue de preexcitación cardiaca sin taquicardias por vía anterior izquierda.
A pesar de que el paciente nunca había tenido una taquicardia, al tratarse de un deportista de alto rendimiento, se comentó con la Unidad de Arritmias, y de forma conjunta se decidió llevar a cabo un estudio electrofisiológico de la vía, estudiar sus propiedades y realizar la ablación de la misma. Se realizó el procedimiento de ablación de forma programada, logrando el bloqueo de la vía tras múltiples aplicaciones de radiofrecuencia en la zona de la vía accesoria. No obstante, tras mantener al paciente monitorizado durante 25 minutos siguientes, se objetiva la recurrencia de la preexcitación en el ECG. Dado lo prolongado del procedimiento y su dificultad por la localización y profundidad de la vía, se decide concluir el procedimiento y repetirlo posteriormente con navegador.
A la mañana siguiente, en el ECG previo al alta no presentaba preexcitación (se sospecha inflamación de los tejidos colindantes por la aplicación de radiofrecuencia y el bloqueo secundario de la vía). Se recomendó reposo durante un mes, antiagregación por el riesgo trombótico tras la ablación y repetir un ECG una vez pasado el proceso de inflamación. Al mes, el paciente continuaba asintomático con un ECG que no mostraba preexcitación, y con ausencia de complicaciones, por lo que se recomendó reanudar de forma progresiva su actividad deportiva habitual. Actualmente, el paciente ha reanudado su actividad deportiva, alcanzando similar rendimiento deportivo al que tenía previo al procedimiento de ablación.
DISCUSIÓN
El sustrato anatómico del síndrome de preexcitación es la presencia de una vía accesoria (haz de Kent) que comunica eléctricamente las aurículas con los ventrículos propiciando una segunda vía de propagación del impulso eléctrico. El haz de Kent suele estar formado por fibras de miocardio normales y no presenta el retraso fisiológico del nodo AV, por lo que parte del miocardio ventricular se despolariza por ella antes que por el sistema de conducción. A través de este circuito se pueden generar taquicardias por reentrada aurículo-ventricular que suelen ser de carácter benigno. El estímulo eléctrico pasa de aurículas a ventrículos por el sistema de conducción normal y regresa a las aurículas por la vía accesoria4,5. Su morfología es de taquicardia de QRS estrecho (si no hay otras alteraciones). No se observan signos de preexcitación durante la taquicardia.
La taquicardia por reentrada es la más frecuente. La segunda taquicardia en cuanto a frecuencia de presentación es la fibrilación auricular (FA). La presentan entre un 12 % y un 35 % de los pacientes con síndrome de Wolff-Parkison-White (WPW)2-4, diagnosticando así a los pacientes con preexcitación en el electrocardiograma e historia clínica de palpitaciones. La presencia de arritmias, como la FA, donde las aurículas se despolarizan a una velocidad muy alta, pueden desencadenar arritmias ventriculares rápidas como la fibrilación ventricular si la actividad eléctrica es conducida a los ventrículos por la vía accesoria en lugar de por el nodo AV. De ahí que los pacientes con preexcitación tengan riesgo aumentado de muerte súbita y la necesidad de ablación en individuos sintomáticos (WPW) más allá del tratamiento de las arritmias por reentrada, que son generalmente benignas. No obstante, el riesgo de muerte súbita vendrá condicionado por las propiedades electrofisiológicas de la vía, es decir, si es o no buena conductora, siendo las vías accesorias en pacientes que nunca han tenido taquicardias, vías de bajo riesgo (o malas conductoras).
El 95 % de los casos no presentan cardiopatías asociadas, aunque el WPW o la preexcitación asintomática están presentes con mayor frecuencia en algunas cardiopatías congénitas como la enfermedad de Ebstein y la transposición corregida de los grandes vasos. En pacientes con esclerosis tuberosa el síndrome de WPW también es usual2. Por este motivo es recomendable derivar a Cardiología a todo paciente en el que objetive la presencia de preexcitación en el ECG.
De cara a valorar el tratamiento debemos tener en cuenta varias situaciones clínicas. El tratamiento agudo de los episodios de taquiarritmia lo realizaremos con maniobras vagales o fármacos antiarrítmicos. El tratamiento definitivo para la prevención de las taquiarritmias y de la muerte súbita será la ablación con catéter. La ablación con radiofrecuencia supera hoy en día una eficacia del 93 %2. Los pacientes asintomáticos con ECG compatibles y sin taquiarrítmias no suelen necesitar ningún tratamiento, manteniendo una actitud expectante, pues existe escaso riesgo de muerte súbita (menor del 1/1000)3.
Aunque las guías de práctica clínica3,4 únicamente recomiendan la ablación de la vía accesoria en los pacientes con síndrome de Wolff-Parkinson-White, es decir, aquellos que tienen taquicardias, existen situaciones especiales. En pacientes con «profesiones de riesgo para una colectividad», como son los conductores, existe una normativa vigente modificada recientemente6 que expone que la preexcitación cardíaca no condiciona la renovación del permiso de conducción o acceder a él, si el paciente está asintomático. No obstante, la presencia de un síncope en la historia clínica del paciente sí lo es, por lo que precisarán tratamiento definitivo. En deportistas de élite, si bien el riesgo de muerte súbita es excepcional, no así el de una taquicardia paroxística, a veces con un cortejo sintomático considerable y síncope secundario, lo que, en determinadas circunstancias profesionales y en el ámbito deportivo, como en el caso de nuestro paciente, puede representar riesgos añadidos, como un ahogamiento como consecuencia de un síncope nadando1.
Un importante porcentaje de la población joven practica deporte de alta intensidad sin ningún tipo de valoración específica más allá de las revisiones estipuladas para la población general por su pediatra o médico de familia habitual. Incluso desde las asociaciones y federaciones deportivas no se estructuran los mecanismos oportunos que permitan la realización de este tipo de actividad física exigente de manera segura.
Aunque la prevalencia de cardiopatía sin diagnosticar en pacientes asintomáticos en la edad pediátrica es extremadamente baja, las consecuencias fatales que pueden desencadenar y el impacto mediático que conllevan hace que se abra con frecuencia el debate sobre la necesidad de programas específicos de detección de cardiopatías en todos los niños que practiquen deporte de alto rendimiento, aunque sea de forma recreacional y no profesional. Los médicos encargados de realizar estos exámenes específicos deberían estar formados para ello, y ser, por tanto, los responsables de firmar los certificados médicos deportivos, que en muchas ocasiones se solicitan de forma injustificada en las consultas de Pediatría y de Medicina de Familia sin ningún tipo de estudio previo. Los médicos de familia no son los responsables de la realización de certificados médicos deportivos; deben informar a los pacientes de los pasos a seguir si consultan por dicho motivo. Así mismo, las organizaciones deportivas deben realizar dichos reconocimientos oficiales y firmar sus certificados correspondientes.