INTRODUCCIÓN
La morbilidad, mortalidad y costes tras la cirugía se hallan influenciados en gran medida por la pérdida hemática o hemorragia y las consecuencias derivadas de la misma. Prevenir la hemorragia es fundamental para conseguir el éxito de la cirugía y resultados beneficiosos en el paciente. Un manejo inadecuado del sangrado puede derivar en un aumento del tiempo quirúrgico y la necesidad de transfusiones sanguíneas. Además, el sangrado incontrolado puede influir en la curación de la herida quirúrgica y aumentar el riesgo de infección, y está asociado con un incremento en las tasas de mortalidad, así como de los costes asociados1,2.
Para controlar la hemorragia, es frecuente el uso de agentes hemostáticos tópicos en combinación o en adyuvancia a otras técnicas hemostáticas cuando éstas resultan impracticables o ineficaces3. Se aplican directamente en el lugar del sangrado en presencia de sangre circulante.
Aunque algunos agentes hemóstáticos tópicos como Tachosil® y trombina se consideran medicamentos, la mayoría son productos sanitarios (PS) incluidos principalmente dentro de los PS de clase III que engloban; algunos productos implantables, los productos destinados a entrar en contacto con el sistema nervioso central o con el sistema circulatorio central con fines de terapia o diagnóstico, los productos que contienen sustancias medicinales, los productos que se absorben totalmente y los productos que contienen derivados animales. Se consideran PS frontera, puesto que por su composición, propiedades, estructura, aplicación y uso, su comportamiento es muy similar al de los medicamentos.
Para su comercialización y puesta en el mercado, deben disponer de: marcado CE en el etiquetado (acompañado del número de organismo notificado que ha intervenido en su evaluación), Declaración de Conformidad del fabricante y anotación en el registro de la Agencia Española de Medicamentos y PS.
Se dividen en tres grandes grupos: agentes hemostáticos pasivos, agentes hemostáticos activos y sellantes de fibrina.
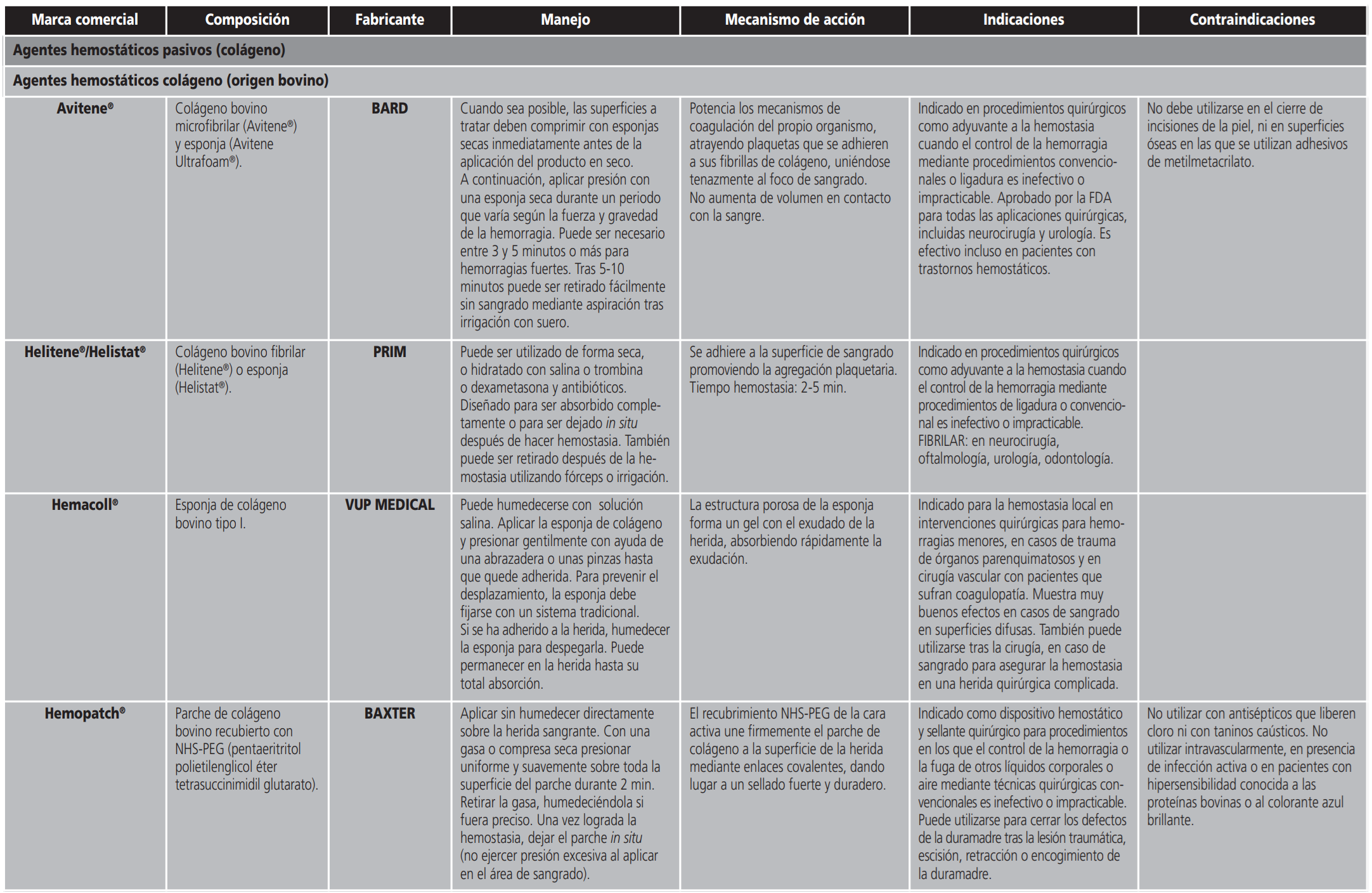
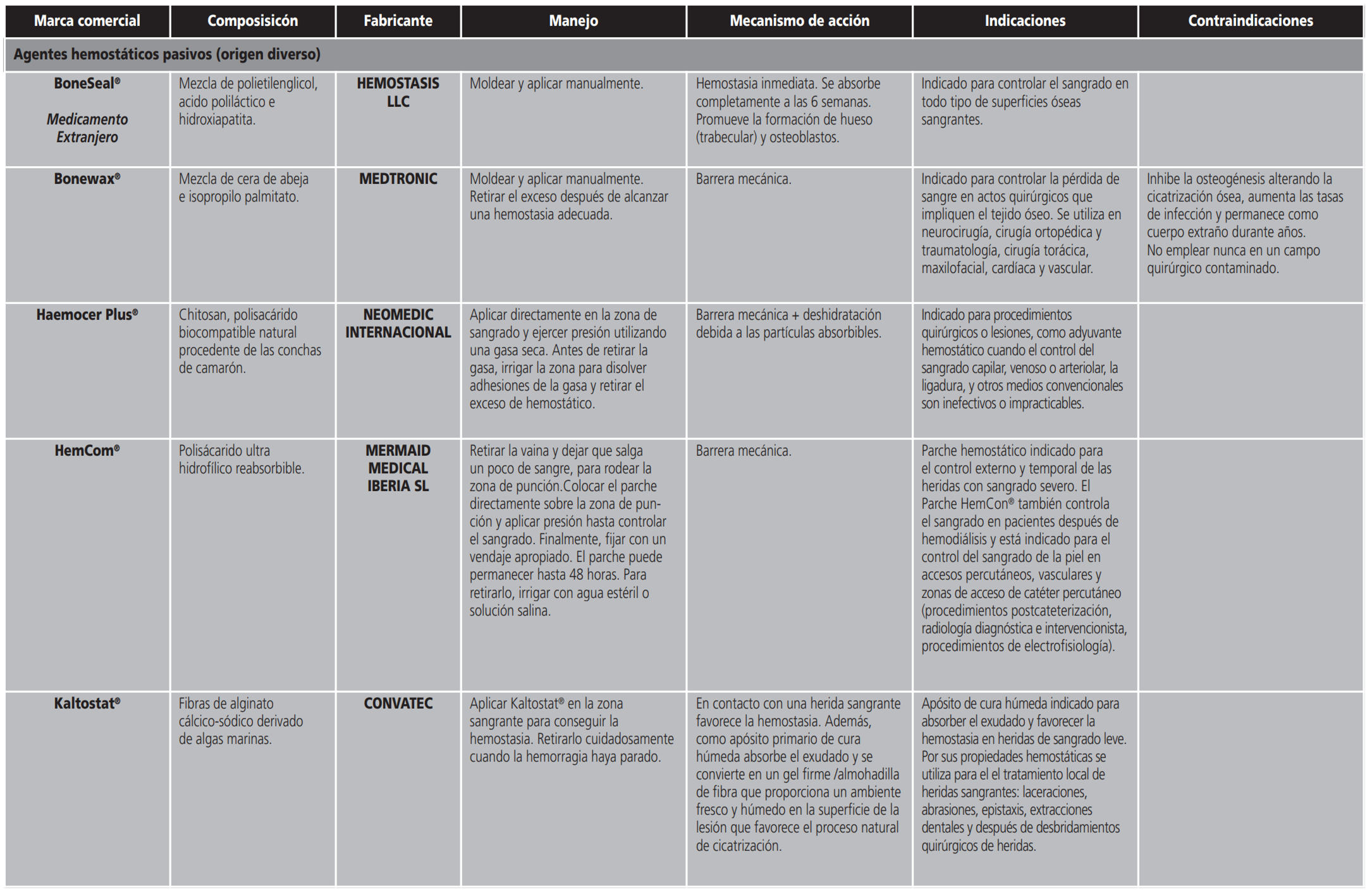
- Los agentes hemostáticos pasivos o mecánicos (ej. esponjas de gelatina, colágeno o apósitos de celulosa oxidada regenerada entre otros) intervienen en la hemostasia primaria, ayudando a la formación del coágulo de plaquetas. Crean una matriz tridimensional donde las plaquetas se agregan para formar el coágulo. Son altamente higroscópicos, pudiendo absorber varias veces su peso4. Son efectivos en el control de hemorragias menores, y son los hemostáticos de menor coste.
- Los agentes hemostáticos activos (ej. trombina) intervienen en la hemostasia secundaria ayudando a la formación del coágulo. Requieren de la presencia de fibrinógeno para producir fibrina, por lo que no son efectivos en pacientes con hipofibrinogenemia o afibrinogenemia5,6. Están indicados como soporte para controlar hemorragias menores de capilares y pequeñas vénulas.
- Los sellantes de fibrina son concentrados de trombina y fibrinógeno. El fibrinógeno, al reaccionar con la trombina se convierte en monómeros de fibrina, que polimerizan para formar el coágulo de fibrina. La fuerza mecánica del coágulo, dependiente del número de entrecruzamientos de fibrina, se relaciona principalmente con la concentración de fibrinógeno. Sin embargo, no es la fuerza mecánica del coágulo sino la velocidad con la que se forma, la que determina la eficacia hemostática y, esta velocidad, la proporciona la concentración de trombina5,7,8,9,10.
Los sellantes de fibrina están indicados para evitar la pérdida de líquidos, sólidos o gases. Disponen de autorización de uso como hemostáticos, sellantes y adhesivos, lo que los hace útiles en una gran variedad de procedimientos, incluyendo aquellos con sustanciales pérdidas de sangre11. Además, pueden ser utilizados en pacientes con coagulopatía, déficit de fibrinógeno y anticoagulados, incluyendo heparina, ya que actúan de manera independiente a la cascada de la coagulación8,12,13. Pueden presentarse en forma líquida o en parche. Su forma líquida permite la aplicación en spray sobre áreas con sangrado difuso, puesto que la misma cantidad permite cubrir áreas de sangrado mayores. Sin embargo, a diferencia de los parches, su aplicación en spray conlleva un riesgo potencial de embolia gaseosa, debiendo aplicarse a la presión y distancia al tejido recomendadas por el fabricante.
La combinación de agentes pasivos (ej. esponja de gelatina o colágeno) con activos (ej. trombina), a los que denominamos agentes hemostáticos mixtos en esta revisión, pueden utilizarse como sellantes, pero a diferencia de estos, precisan de contacto directo con la sangre como fuente de fibrinógeno5. La evidencia sugiere que el efecto mecánico del agente pasivo les confiere mayor eficacia que a los sellantes de fibrina en la consecución de la hemostasia en sangrado arterial5,14.
Aunque en la bibliografía consultada se menciona el uso combinado de trombina tópica y esponja de gelatina, actualmente la trombina tópica no está comercializada en España ni tampoco disponible como Medicamento Extranjero, con lo que no es posible su uso. Consideración especial en este grupo de agentes hemostáticos merecen los agentes hemostáticos mixtos que se presentan en kits cuya composición incluye la gelatina, en forma de matriz fluida (no esponja) y la trombina. Se conocen como hemostáticos de matriz fluida o "flowables".
En la última década, los avances en biotecnología han resultado en un crecimiento explosivo de los agentes hemostáticos tópicos disponibles (Anexo I). El uso adecuado de estos agentes es vital para lograr los mejores resultados clínicos. Así mismo, el conocimiento de las contraindicaciones y los eventos adversos potenciales asociados a los hemostáticos tópicos pueden ser pieza clave en la prevención de resultados no deseados.
En este marco, entender los beneficios y riesgos potenciales asociados a estos agentes permitirá a los farmacéuticos de hospital intervenir en la selección de los mismos y desarrollar e implementar políticas institucionales que aseguren el uso seguro y efectivo de estos agentes15.
MATERIAL Y MÉTODOS
Se realizó una revisión sistemática de la literatura en la biblioteca Cochrane y en MEDLINE desde el año 2000 a 2017 para identificar las publicaciones relacionadas con el uso de hemostáticos pasivos, activos y sellantes en todos los tipos de intervenciones quirúrgicas. Se incluyeron únicamente ensayos clínicos controlados aleatorizados. Se realizó una segunda búsqueda de las citas de las revisiones sistemáticas identificadas para asegurar la selección de todos los artículos relevantes.
Como palabras clave se utilizaron: "topical haemostatic agents", "haemostasis", "surgical bleeding".
Los artículos identificados en la estrategia de búsqueda se seleccionaron si cumplían los siguientes criterios de inclusión: a) ensayos clínicos controlados aleatorizados, b) idioma de publicación: inglés o español, c) en humanos, d) en el ámbito de una intervención quirúrgica, e) tratamiento con agentes hemostáticos tópicos pasivos y/o activos y sellantes en comparación con otros agentes hemostáticos tópicos, f) variable primaria de eficacia: tiempo hasta la hemostasia y/o disminución del sangrado. Se excluyeron todos los estudios que no cumplían los criterios de inclusión anteriores.
La búsqueda se realizó entre 3 revisores (R1, R2 y R3). Los revisores R1 y R2 realizaron la búsqueda en PubMed y el revisor R3 en Cochrane. Durante el proceso de selección, los revisores se intercambiaron los artículos identificados y discutieron las discrepancias encontradas.
En la figura 1se muestra el diagrama de flujo de la estrategia de búsqueda. Una vez descartados los artículos duplicados, se rechazaron un total de 126 artículos tras revisar título y abstract, y 56 estudios tras revisar el texto completo. Estos 182 artículos excluidos, se rechazaron por no cumplir con los criterios de inclusión predefinidos y por no tener acceso al texto completo.
RESULTADOS
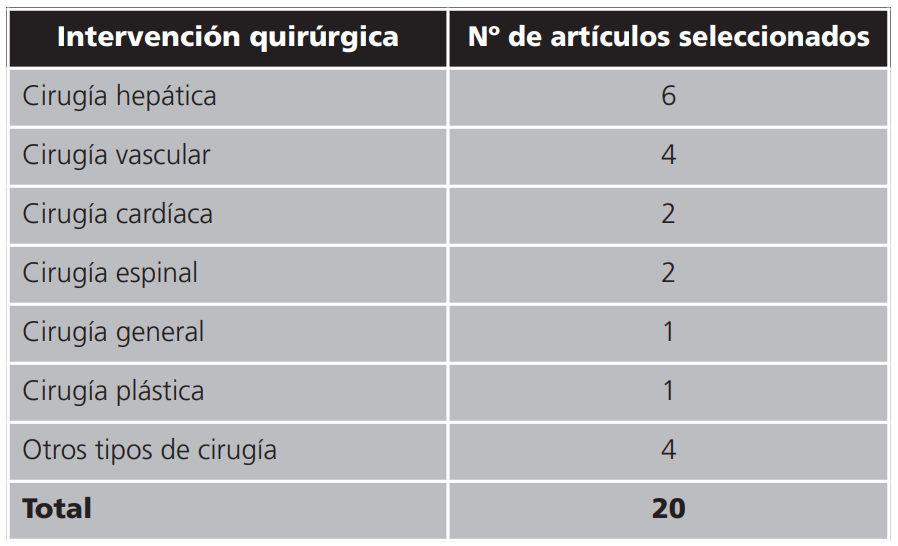
Los artículos seleccionados en base a los criterios de inclusión definidos se clasificaron por intervención quirúrgica, obteniéndose los 7 grupos que se detallan en la tabla 1.
La variable primaria estudiada en el 95% (19/20) de los artículos seleccionados fue el tiempo hasta conseguir la hemostasia, y la reducción del sangrado en el 5% (1/20).
Los resultados de los estudios seleccionados se detallan en laAnexo II, divididos en 7 grupos: A) hemostáticos mixtos versus pasivos, B) sellantes de fibrina versus hemostáticos activos, C) sellantes de fibrina versus hemostáticos pasivos, D) hemostáticos mixtos de matriz fluida versus hemostáticos mixtos, E) sellantes de fibrina versus sellantes de fibrina, F) hemostáticos pasivos versus pasivos, G) hemostáticos activos versus activos.
A) Hemostáticos mixtos de matriz fluida versus hemostáticos pasivos (n=2)
Se seleccionaron 2 estudios que comparaban la eficacia hemostática y las complicaciones de 2 agentes hemostáticos de matriz fluida versus hemostáticos pasivos: Costasis® (matriz fluida de colágeno bovino + trombina) versus hemostático de colágeno Instat® en cirugía hepática22, y Floseal® (matriz fluida de gelatina bovina + trombina) versus hemostático de gelatina (Gelfoam®) y de celulosa oxidada regenerada (Surgicel®) en cirugía cardíaca17.
- Resultados de eficacia
En ambos estudios, la proporción de pacientes que alcanzó la hemostasia en ≤10 min resultó significativamente superior en el grupo tratado con el hemostático mixto; 100% versus 69% (p<0,001) en el estudio de Chapman y cols.22, y 92% versus 61% (p<0,001) en el estudio de Nasso y cols.17. Respecto al tiempo hasta conseguir la hemostasia, fue significativamente inferior en el grupo tratado con el hemostático mixto; 1,0 versus 4,2 min (p<0,001) en el estudio de Chapman y cols.22, y 3,8 versus 6,8 min (p<0,001) en el estudio de Nasso y cols.17
- Resultados de seguridad
No se observaron diferencias significativas en el perfil de reacciones adversas entre los grupos tratados con hemostáticos mixtos y los tratados con hemostáticos pasivos.
B) Sellantes de fibrina versus hemostáticos activos (n=1)
- Resultados de eficacia
Drake y cols.29 estudiaron el efecto hemostático del sellante de fibrina Vivostat® versus una solución de trombina (spray) en injertos de piel, observando una mediana del tiempo hasta la hemostasia significativamente inferior en las heridas tratadas con Vivostat® versus las tratadas con trombina (31 versus 58 segundos, p=0,0012).
- Resultados de seguridad
No se observaron anomalías en la curación de las heridas para ninguno de los sitios tratados 1 semana tras la intervención.
C) Sellantes de fibrina versus hemostáticos pasivos (n=10)
Se han seleccionado 10 estudios que comparan la actividad hemostática y las complicaciones entre sellantes de fibrina y agentes hemostáticos pasivos. En 4 estudios los pacientes fueron intervenidos de cirugía hepática20,21,25,35, en 3 de cirugía vascular16,23,27y en 3 estudios se incluyeron pacientes sometidos a varias intervenciones quirúrgicas (cardiovascular, obstetricia, vascular, espinal, hepática y tejidos blandos)24,32,33.
En lo que se refiere a la composición de los hemostáticos pasivos con los que se comparan los sellantes de fibrina; en 5 ensayos se comparan con hemostáticos de celulosa oxidada regenerada23,24,25,33,35, en 3 ensayos con hemostáticos de gelatina21,27,32, en 1 ensayo con hemostático de colágeno20 y en 1 ensayo con alginato cálcico16.
- Resultados de eficacia
Las variables principales de los ensayos seleccionados fueron: proporción de pacientes que alcanzan la hemostasia en un tiempo determinado y tiempo medio en conseguir la hemostasia.
La eficacia en el control de sangrado en todos los estudios, salvo el de Moench y cols.20 (estudio de no inferioridad que comparaba el sellante de fibrina con un apósito de colágeno) fue significativamente superior en el grupo tratado con sellante de fibrina. A continuación, se resumen los resultados por grupo de comparación:
- Sellante de fibrina versus apósito de celulosa oxidada regenerada (n=5): Schenk y cols.23 observaron un menor tiempo de hemostasia al comparar un sellante de fibrina con Surgicel® en cirugía vascular (media ± desviación estándar: 0,9±0,2 min versus 12,0±1,9 min p≤0,0001). En la misma línea, Hanks y cols.24 observaron menores tiempos de hemostasia (1,6 versus 3,3 min, p<0,0001) al comparar un sellante de fibrina (Vivostat®) con Surgicel® en pacientes sometidos a cirugía cardiotorácica, general, ginecológica y vascular.
Dos estudios25,33compararon la eficacia hemostática en ≤4 min del sellante de fibrina Evarrest® versus Surgicel®. En el estudio de Fischer y cols.25, en pacientes sometidos a cirugía abdominal, retroperitoneal, pelvica y torácica, el 98,3% de los pacientes tratados con Evarrest® consiguió la hemostasia en ≤4 min versus el 53% en los tratados con Surgicel® (p<0,001). Resultados similares encontraron Koea y cols.33 al estudiar ambos agentes hemostáticos en cirugía hepática (82,5% versus 29,5%, p<0,001).
Finalmente, en el estudio de Genyk y cols.35 el 80,7% de pacientes tratados con el sellante de fibrina Tachosil® consiguió la hemostasia en ≤3 min versus el 50,0% (p<0,001) de pacientes tratados con Surgicel®.
- Sellante de fibrina versus apósito de colágeno (n=1): en cuanto a la variable principal a estudio (consecución de la hemostasia en ≤3 minutos), Moench y cols.20 demostraron la no inferioridad del apósito de colágeno (Sangustop®) respecto al sellante de fibrina (Tachosil®); 86,9% versus 80,0% (p=0,3453) tras resección hepática.
- Sellante de fibrina versus apósito de gelatina (n=3): dos estudios compararon la aplicación de Fibrocaps® (sellante de fibrina) en combinación con un apósito de gelatina con la aplicación de un apósito de gelatina sólo en 4 tipos de intervenciones quirúrgicas distintas (cirugía espinal, hepática, vascular y de tejidos blandos)21,27. El tiempo hasta alcanzar la hemostasia fue significativamente menor en el grupo tratado con el sellante de fibrina más apósito de gelatina que en el grupo tratado con apósito de gelatina sólo (media ± desviación estándar); 1,9±1,3 min versus 4,8±3,1 min (p<0,001) en el estudio de Verhoef y cols.21 y de 2,0 versus 4 min (p<0,002) en el estudio de Gupta y cols.27 En las mismas 4 indicaciones, Bochichio y cols.32 compararon la eficacia del sellante de fibrina sólo frente a la aplicación de un apósito de gelatina. La proporción de pacientes que alcanzó la hemostasia a los 5 minutos también resultó significativamente superior (p<0,001) en las 4 indicaciones a estudio en los pacientes tratados con Fibrocaps®.
- Sellante de fibrina versus alginato cálcico-sodico (n=1): en el estudio de Sintler y cols.16 la mediana de tiempo hasta la hemostasia y la mediana de pérdida de sangre fueron significativamente inferiores en el grupo tratado con sellante de fibrina (Quixil®); 2,5 minutos (1-4 min) versus 17 min (7-59 min) p<0,001, y 24,5 ml (5,5-105,0 ml) versus 203 ml (54,5-817,0) p<0,001, respectivamente.
- Resultados de seguridad
No se observaron diferencias significativas en el perfil de reacciones adversas entre los grupos tratados con sellante de fibrina y los tratados con agente hemostático pasivo.
D) Hemostáticos mixtos de matriz fluida versus hemostáticos mixtos (n=3)
Se han seleccionado 3 estudios que comparan la actividad hemostática y las complicaciones de agentes hemostáticos de matriz fluida de gelatina + trombina, versus la combinación de esponja de gelatina bovina y trombina: Floseal® versus Gelfoam® + trombina, en cirugía cardiaca31, cirugía vascular34 y cirugía espinal (Proceed®, presentación de Floseal® para aplicaciones espinales)28.
- Resultados de eficacia
La variable principal fue el tiempo hasta conseguir la hemostasia en ≤10 minutos.
En el estudio de Oz y cols.31, el 94% de los pacientes con Floseal® consiguió completar la hemostasia en ≤10 minutos versus 60% en el grupo control (p<0,001). Resultados similares observaron Weaver y cols.34 en cirugía vascular, resultando un efecto hemostático más rápido y efectivo de Floseal® versus el grupo control (Gelfoam® + trombina); el tiempo medio hasta la hemostasia con Floseal® fue de 2,5 min (IC 95% 2 y 4) versus 6,5 minutos (IC 95% 4,5 y 8) para el grupo control (p=0,001).
Así mismo, el estudio prospectivo multicéntrico de Renkens28 en 127 pacientes sometidos a cirugía espinal, observó mayor eficacia clínica en los pacientes tratados con Proceed® en términos de tiempo y tasa de éxito hasta la hemostasia, así como reducción del tiempo quirúrgico en comparación con Gelfoam® + trombina. Proceed® consiguió el cese del sangrado en el 98% de los pacientes en ≤10 min versus el 90% en el grupo control (p=0,001). A los 3 min, Proceed® consiguió la hemostasia en el 97% de los pacientes (p=0,001) versus el 71% en el grupo control (p=0,0001).
- Resultados de seguridad
No se observaron diferencias significativas en el perfil de reacciones adversas entre ambos grupos.
E) Sellantes de fibrina versus sellantes de fibrina (n=1)
- Resultados de eficacia
En el estudio de Ollinger y cols.26en pacientes sometidos a cirugía hepática, el tiempo medio hasta conseguir la hemostasia con Veriset® fue significativamente inferior (p<0,001) a Tachosil® (1 versus 3 min, p<0,001).
No se observaron diferencias significativas en ninguna de las variables secundarias estudiadas; tiempo medio quirúrgico (p=0,899), duración de la estancia en UCI (p=0,67) y duración del ingreso hospitalario (p=0,301).
- Resultados de seguridad
No se encontraron diferencias significativas en el número, severidad y tipo de efectos adversos entre ambos grupos de tratamiento, los parámetros de laboratorio fueron similares en ambos grupos y tampoco se observaron diferencias significativas en el número y volumen de las transfusiones requeridas.
Se observaron 131 efectos adversos en el 76% de los pacientes (37/49), 3 de los cuales se relacionaron con el agente hemostático; fuga biliar y hematoma con Veriset® y hemorragia postoperatoria con Tachosil®.
Se notificaron efectos adversos graves en 10 (31%) y 8 (47%) pacientes tratados con Veriset® versus grupo control, respectivamente. La mayoría fueron de intensidad leve; 36 (47%) pacientes tratados con Veriset® versus 29 (51%) pacientes en el grupo control, o moderada; 29 (39%) pacientes tratados con Veriset® versus 20 (35%) pacientes en el grupo control, siendo los más frecuentes: ascitis, derrame pleural, alteración de la función hepática, fiebre y dehiscencia de la herida.
F) Hemostáticos pasivos versus hemostáticos pasivos (n=1)
- Resultados de eficacia
Pingsmann y cols.19 demostraron la eficacia hemostática equivalente de dos agentes hemostáticos pasivos (Bone Seal® versus Lyostypt®) a través de un sistema de puntuación de sangrado (media ± desviación estándar) que resultó de 4,5±1,3 en el grupo tratado con Bone Seal® versus 4,3±1,3 en el grupo tratado con Lyostypt® (p<0,005).
- Resultados de seguridad
La curación de la herida e incidencia de efectos adversos resultó similiar en ambos grupos.
Un 12,72% (7/55) de los pacientes en el grupo Bone Seal® presentó un total de 10 eventos adversos y un 22,41% (13/58) en el grupo Lyostypt®, siendo los más frecuentes; hematoma y anemia postoperatoria.
G) Hemostáticos activos versus hemostáticos activos (n=2)
- Resultados de eficacia
Se han seleccionado dos artículos que comparan la actividad hemostática y las complicaciones entre hemostáticos activos. Chapman y cols.18 estudiaron el tiempo hasta hemostasia en 401 pacientes tratados con trombina recombinante humana versus trombina bovina. La hemostasia se consiguió en ≤10 minutos en el 95% de los pacientes en ambos grupos de tratamiento. Resultados similares publicaron Doria y cols.30 al comparar el tiempo hasta la hemostasia en pacientes tratados con trombina humana versus trombina bovina, resultando equivalente en ambos grupos; 97,4% versus 97,4% (ratio humana/bovina, 1,00; IC95% 0,96-1,05).
- Resultados de seguridad
En el estudio de Chapman y cols.18 los efectos adversos (resultados anormales de coagulación o sangrado, eventos tromboembólicos o de hipersensibilidad) resultaron similares en ambos grupos. Sin embargo, 43 pacientes (21,5%) en el grupo de trombina bovina desarrollaron anticuerpos versus 3 pacientes (1,5%), en el grupo de trombina recombinante (p<0,0001). En el estudio de Doria y cols.30, el 12,3% de los pacientes con trombina bovina presentó seroconversión versus 3,3% con trombina humana para ≥1 de los 4 anticuerpos ensayados. Ningún paciente con trombina humana mostró serocoversión para antígenos humanos.
CONCLUSIONES
Aunque la gran diversidad de agentes hemostáticos ofrece variedad de opciones a los clínicos, la elección del agente más adecuado para cada situación se ve dificultada por el número creciente de productos disponibles.
La validez interna de los estudios publicados no es la más óptima, sólo dos de los ensayos clínicos controlados aleatorizados seleccionados en esta revisión son doble ciego, y como se puede observar en laAnexo II, muy pocos comparan con un alto grado de calidad metodológica los agentes hemostáticos disponibles.
Los dos estudios seleccionados del grupo de hemostáticos mixtos demuestran la mayor eficacia de este grupo de hemostáticos de matriz fluida, en términos de reducción del tiempo hasta conseguir la hemostasia, respecto a los hemostáticos pasivos de celulosa oxidada regenerada, gelatina y colágeno, con un perfil de efectos adversos similar, en dos tipos de intervenciones quirúrgicas; cirugía hepática y cardíaca17,22.
Además, tres ensayos clínicos aleatorizados prospectivos demostraron que los hemostáticos mixtos de matriz fluida (Floseal® en cirugía cardíaca y vascular y Proceed® en cirugía espinal), son más eficaces que la combinación de esponja de gelatina con trombina (Gelfoam® + trombina), con una reducción significativa en el tiempo hasta la hemostasia y un mayor control del sangrado28,31,34.
En el caso de los sellantes de fibrina, los estudios seleccionados demuestran una eficacia hemostática superior al comparar con hemostáticos pasivos de celulosa oxidada regenerada, gelatina y alginato cálcico en todas las intervenciones quirúrgicas estudiadas. Sin embargo, Moench y cols.20 no encontraron resultados de superioridad concluyentes al comparar con un hemostático pasivo de colágeno en cirugía hepática, ni tampoco diferencias significativas en el número de unidades transfundidas una semana tras la intervención quirúrgica.
Según indica el fabricante, este hemostático de colágeno tiene mayor capacidad de absorción que otros hemostáticos del mismo tipo. Serían necesarios más estudios para afirmar que este tipo de agentes hemostáticos pasivos tiene la misma eficacia hemostática que los sellantes de fibrina.
En cirugía hepática, Ollinger y cols.26, compararon dos sellantes de fibrina entre sí (Veriset® versus Tachosil®), demostrando la superioridad de Veriset® en términos de tiempo hasta conseguir la hemostasia, con un perfil de efectos adversos similar en número, severidad y tipo. Sin embargo, no observaron diferencias significativas relativas a la prolongación del tiempo quirúrgico, aumento de la estancia en UCI o del ingreso hospitalario.
Los dos estudios doble ciego seleccionados, compararon hemostáticos activos entre sí, demostrando eficacia equivalente y un perfil de efectos adversos similar entre los tres tipos de trombina; humana, bovina y recombinante. Sin embargo, tanto la trombina recombinante como la trombina humana resultaron menos inmunogénicas que la trombina bovina18,30.
Únicamente un estudio comparó la eficacia hemostática de un sellante de fibrina respecto a una solución de trombina. El sellante de fibrina consiguió la hemostasia en un tiempo significativamente inferior a la trombina, sin presencia de efectos adversos una semana tras la intervención29. En definitiva, los estudios seleccionados demuestran que los hemostáticos activos, mixtos y sellantes de fibrina son más eficaces que los hemostáticos pasivos, reduciendo el tiempo hasta conseguir la hemostasia, con un perfil de efectos adversos similar. Sin embargo, debido a la escasez de ensayos que comparan la eficacia y seguridad de los hemostáticos mixtos y/o activos frente a los sellantes de fibrina, no es posible extraer conclusiones entre estos grupos. Son necesarios estudios aleatorizados y controlados de alta calidad metodológica que comparen la eficacia hemostática y perfil de efectos adversos de estos agentes hemostáticos entre sí. Mientras tanto, la decisión de utilizar este tipo de agentes hemostáticos debería basarse en términos de coste efectividad.