Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Sanidad Militar
versión impresa ISSN 1887-8571
Sanid. Mil. vol.68 no.3 Madrid jul./sep. 2012
https://dx.doi.org/10.4321/S1887-85712012000300003
Kill the Killers: terapia con células Natural Killer en pacientes pediátricos con cáncer refractario
Kill the Killers: Natural Killer cells therapy against paediatric refractory solid tumours
Valentín Quiroga J.1, Fernández Casanova L. 1, Génesis Martín I.2, Nuñez Martín F.2, Pérez Martínez A.1
1 Hospital Infantil Universitario Niño Jesús. Servicio de Hemato-Oncología y Transplante Hematopoyético.
2 Instituto de Investigaciones Biomédicas "Alberto Sols". Servicio de experimentación animal.
Premio Fidel Pagés Miravé 2011
Dirección para correspondencia
RESUMEN
Introducción: En el momento actual, los tumores sólidos refractarios al tratamiento convencional constituyen la principal causa de muerte en la edad pediátrica. Por tanto, es necesario desarrollar y consolidar nuevos tratamientos. Las células Natural Killer (NK) constituyen la primera línea de defensa del sistema inmune frente al desarrollo de células tumorales. Planteamos una nueva estrategia de terapia celular antitumoral en niños con cánceres refractarios, inmunoterapia con células NK estimuladas con interleucina 15 (IL-15).
Pacientes y Métodos: En 22 pacientes pediátricos con tumores sólidos refractarios y en controles sanos determinamos mediante citometría de flujo multiparamétrica y fluorescencia resuelta en el tiempo, el fenotipo y la actividad citotóxica de las células NK, respectivamente. En ratones inmunodeficientes desarrollamos un modelo de neuroblastoma metastático muy agresivo y terapia de rescate con células Natural Killer estimuladas con IL-15.
Resultados: Los pacientes pediátricos con cáncer refractario tienen un mayor porcentaje de células NK bright y una menor actividad citotóxica. La estimulación con IL-15 mejora la citotoxicidad in vitro y disminuye la carga tumoral in vivo.
Conclusiones: Las células NK estimuladas con IL-15 constituyen una prometedora estrategia antitumoral.
Palabras clave: Células Natural Killer (NK), Interleucina 15 (IL-15), tumores sólidos refractarios.
SUMMARY
Introduction: Refractory solid tumours lead children deaths. To change this statement, new treatments should be developed. Natural Killer cells constitute the first line of defence against tumour cells. We propose a new strategy for antitumor cell therapy in children with refractory solid malignancies: IL-15 stimulated NK cells.
Patients and methods: 22 paediatric patients suffering refractory solid tumours participate in this study. We compare NK cell subsets and K562 cytotoxicity in patients and sex-age pair's healthy controls. We use multiparametric flow and time-resolved fluorescent, respectively. In immunocompromised mice we developed an aggressive human metastatic neuroblastoma model and IL-15 stimulated NK cells rescue.
Results: Patients had higher NK bright cells subset and lower NK cytotoxicity than healthy controls. IL-15 stimulated NK cells improved NK cell cytotoxicity in vitro and decreased tumour burden in vivo.
Conclusions: IL-15 stimulated NK cells may constitute a new cell therapy tool for paediatric refractory tumours.
Key words: Natural Killer cells (NK), interleucina 15 (IL-15), refractory solid tumours.
Introducción
Los tumores sólidos en su totalidad constituyen el cáncer infantil más frecuente en la edad pediátrica1. Aproximadamente más de la mitad de los pacientes pediátricos con tumores sólidos tienen enfermedad avanzada a su diagnóstico2. Siendo el pronóstico muy desfavorable en los pacientes con enfermedad metastásica3. El pronóstico es particularmente pobre en los pacientes con enfermedad metastásica en hueso, médula ósea, y en las recaídas, donde prácticamente todos los pacientes fallecen por progresión de la enfermedad. Por ejemplo, para pacientes con Sarcoma de Ewing refractario la tasa de supervivencia a largo plazo es actualmente menor del 20% y menor del 10% si la recaída sucede dentro de los 2 primeros años4,5. Las estrategias de quimioterapia de segunda línea en este tipo de pacientes son realmente poco exitosas, habiéndose alcanzado el techo terapéutico. Es por esto que son necesarias nuevas aproximaciones terapéuticas que supongan una alternativa a la quimioresistencia de estos tumores.
El papel del sistema inmune en el reconocimiento tumoral y en su eliminación es conocido desde hace décadas. Su potencial es tal, que la mayoría de las personas sanas eliminan células tumorales a diario gracias a un eficaz sistema inmune6. Se han descrito en pacientes con cáncer, alteraciones del sistema inmune adaptativo como aumento de células T reguladoras, disminución de células T CD8 efectoras, aumento de citocinas reguladoras como IL-107. Sin embargo el papel del sistema inmune innato no ha sido estudiado sistemáticamente. En los últimos años el conocimiento en la inmunobiología del cáncer ha identificado a las células Natural Killers (NK) como unas auténticas armas asesinas "killers" contra el cáncer8. Las experiencias clínicas más evidentes de este efecto antitumoral están basadas en el efecto inmunológico mediado por las células NK en el trasplante de progenitores hematopoyéticos de donante haploidéntico en los pacientes con leucemia mieloide aguda (LMA)9. En estos pacientes la ausencia del ligando HLA-I en el paciente y la presencia de los receptores KIR inhibitorios en el donante desencadena un efecto antileucemia muy potente, incluso mayor que la propia quimioterapia10. Estudios preclínicos con líneas celulares han demostrado la capacidad citotóxica de las células NK frente a líneas celulares de sarcoma de Ewing, neuroblastoma, rabdomiosarcoma y osteosarcoma11-15. La inmediatez de la respuesta citotóxica de las células NK, la posibilidad de expandir y manipular estas células, incluso en condiciones para uso humano (GMP), y la posibilidad de poder combinarse con otros esquemas de tratamiento como radioterapia o quimioterapia, hacen de las células NK un arma inmunoterápico de terapia avanzada a desarrollar en los próximos años. Nuestros objetivos con este trabajo es describir el sistema inmune innato, a través de uno de sus elementos las células NK, en pacientes pediátricos con cáncer refractario, similar a lo descrito en pacientes adultos con hemopatías malignas16, Y desarrollar un modelo in vivo de terapia celular con NKs, que pueda poner las bases para posteriores ensayos clínicos, un nuevo batallón contra el cáncer refractario infantil.
Material y métodos
Pacientes y controles
El estudio fue aprobado por el Comité de Investigación Clínica del Hospital Niño Jesús. En 22 pacientes pediátricos con tumores sólidos refractarios, cuya distribución se muestra en la tabla 1, se ha estudiado su sistema inmune innato y células NK. Utilizamos como controles donantes sanos para trasplante de progenitores hematopoyéticos.
Tabla 1. Distribución de los tumores refractarios en nuestra población pediátrica de estudio.
Todos son pacientes con enfermedad en progresión, y refractaria a más de dos líneas de tratamiento. 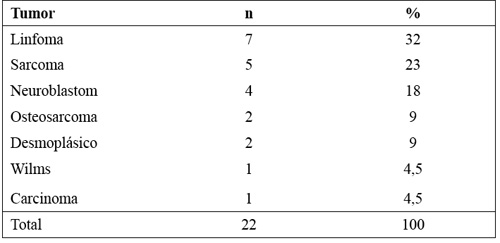
Anticuerpos y citometría de flujo multiparamétrica
Mediante citometría de flujo multiparamétrica, utilizando el citómetro Becton Dickinson FACS CANTO II, se ha determinado el fenotipo de sus células NK utilizando los siguientes anticuerpos: CD3 PE-Cy7, CD 16 APC-Cy7, CD45-FITC, CD81-PE, CD9-FITC de Becton Dickinson y CD56-APC de Beckman Coulter. Las células NK se definen mediante citometría de flujo como CD45+ CD56+ CD3-. Dentro de esta población se han identificado 2 subpoblaciones: NK dim y NK bright. Las células NK dim, caracterizadas por expresión normal de CD56 y por la expresión del receptor de la fracción Fc de las inmunoglobulinas, el CD16. Las células NK bright se caracterizan por la expresión elevada de CD56 y la ausencia de expresión del CD16. Las células de neuroblastoma se caracterizan por la nula expresión de CD45 y la expresión de CD56, CD81 Y CD9.
Aislamiento de células NK y estimulación con IL-15
Las células NK fueron aisladas mediante tecnología inmunomagnética MACS, de la sangre periférica de los pacientes y controles sanos. Utilizamos el kit NK cell isolation de Miltenyi Biotech, siguiendo estrictamente las especificaciones del fabricante7. En todos los casos la pureza del aislamiento fue superior al 90%. Se incubaron las células NK purificadas en medio RPMI 37oC, 5% CO2 con interleucina 15 (Cellgenix) a una concentración de 10 ng/ml overnight.
Ensayo de citotoxicidad in vitro
Para determinar la capacidad citotóxica de las células NK de los pacientes comparada con los controles, realizamos cocultivo celular de las células NK con la línea celular K562, diana de las células NK por carecer de HLA-I, marcada con BATDA, y posteriormente lectura de la fluorescencia resuelta TDA-Europium (Tecan, Infinite 200)17. Se establecieron 4 ratios Effector/Target, 8:1, 4:1, 2:1 y 1:1. Se emplearon las siguientes formulas para calcular la citotoxicidad específica y espontánea: % lisis especifica= (lisis experimental-lisis espontánea)/(máxima lisis-lisis espontánea) x100% lisis espontánea=(lisis espontánea-señal de fondo)/(máxima lisis-señal de fondo) x100.
Ensayo de citotoxicidad in vivo: "modelo murino de neuroblastoma refractario"
Un total de 16 ratones de 6 a 8 semanas de edad del tipo NODSCID IL2Rgnull fueron subletalmente irradiados con 200cGy e inoculados 24 horas después mediante inyección intravenosa con 5x105 células de neuroblastoma de la línea NB-1691luc. La terapia con NK comenzó 7 días después de la inoculación de la línea tumoral, día 8, tras comprobar mediante bioluminiscencia el injerto tumoral. Se realizaron infusiones semanales durante 3 semanas. Se realizaron 2 grupos de 4 animales cada uno, El primer grupo recibió tratamiento con 200 mcl de PBS y el segundo grupo recibió tratamiento con 1x106 células NK estimuladas overnight con 10 ng/ml de IL-15. Este experimento se realizó por duplicado. La carga tumoral se determinó en los dos grupos mediante bioluminiscencia los días 7, 28, 35 y 42 en el sistema de visualización XENOGEN IVIS-200 Imaging System (Xenogen Corporation, Hopkinton, MA). Las imágenes obtenidas fueron procesadas mediante Xenogen Living Imagen software (V.O 2.50). La medición de la intensidad lumínica (fotones/segundo) se realizó en posición ventral a diferentes tiempos de exposición. El valor obtenido fue comparado con el grupo control, inóculo de PBS (figura 1).

Figura 1. Modelo metastático de neuroblastoma.
Análisis estadístico
Las variables categóricas se describieron mediante frecuencias absolutas y las variables cuantitativas mediante la media y el error típico. El análisis se realizó con el paquete estadístico SPSS versión 15.0. Para comparar las medias entre grupos se realizó test T de Student cuando las variables presentaban distribución normal y en su ausencia test no paramétricos.
Resultados
Inmunofenotipo de las células NK en los pacientes pediátricos con cáncer refractario
Mediante citometría de flujo se determinaron las subpoblaciones NK dim y NK bright. Observamos como el ratio NK dim/NK bright en los pacientes con tumores sólidos refractarios estaba disminuido significativamente respecto a los controles sanos (40/60% vs 91/9%, p<0,05) (figura 2). La prevalencia de la subpoblación NK bright (CD56+,CD16-) en los pacientes con tumores refractarios sugiere una menor actividad citotóxica frente a los controles sanos, ya que esta subpoblación carece de receptores KIR, fundamentales para el reconocimiento de las células tumorales que expresan cantidades disminuidas de HLA-I.
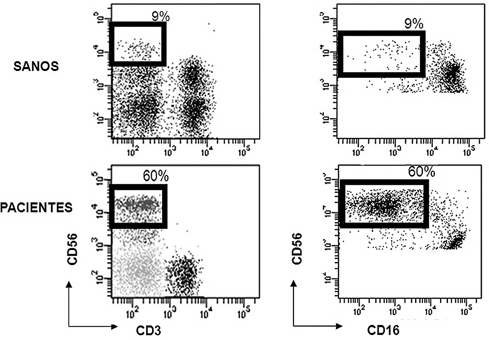
Figura 2. Subpoblaciones de células NK en los pacientes en comparación con
sus controles sanos. Se puede observar como los ratios NKdim/NKbright están
invertidos en los pacientes respecto a los controles sanos.
Actividad citotóxica de las células NK in vitro
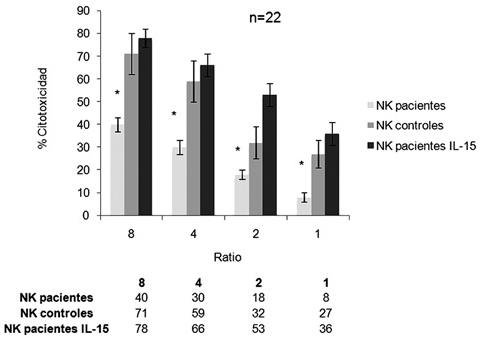
El estudio de la capacidad citotóxica de las células NK a la línea celular K562 en los pacientes frente a la citotoxicidad de los controles sanos estaba significativamente disminuida (40±3 vs 71±9, 30±3 vs 59±9, 18±2 vs 32±7, 8±2 vs 27±6, en los ratios 8, 4, 2 y 1 respectivamente, p<0.05). Sin embargo, tras estimulación "overnight" con IL -15 la actividad citotóxica se normalizaba (78±4, 66±5, 53±5 y 36±5), (figura 3).
Figura 3. Actividad citotóxica de las células NK de los pacientes con tumores
sólidos refractarios "resting", controles sanos y tras incubación overnight con IL-15
Actividad citotóxica in vivo, modelo neuroblastoma metastático
Los resultados obtenidos en los estudios in vitro, nos ayudaron a determinar el rol de las células NK-IL-15 en un modelo metastásico muy agresivo de cáncer infantil (neuroblastoma), tanto a nivel macroscópico (figura 4), como por citometría de flujo, (figura 5). Observamos cómo la carga tumoral medida por intensidad de luminiscencia, en los diferentes momentos de monitorización, fue significativamente menor (32, 41 y 669 veces menor en los días 28, 35 y 42, p<0,05) en los ratones tratados con NK-IL15 (figuras 6a y 6b).
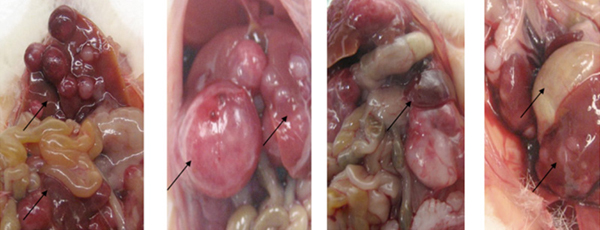
Figura 4. Imágenes macroscópicas de las metástasis del modelo de neuroblastoma.
Se puede observar la gran carga tumoral de este modelo.
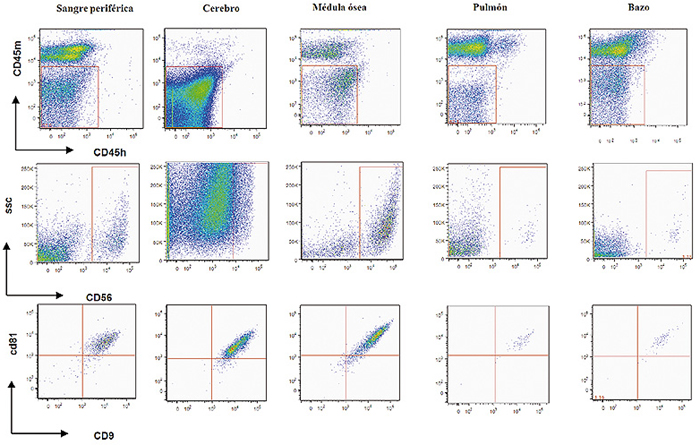
Figura 5. Citometría de células NB1691 en sangre periférica, cerebro, médula ósea, pulmón y bazo.
Se trata por tanto de un modelo metastático muy agresivo.
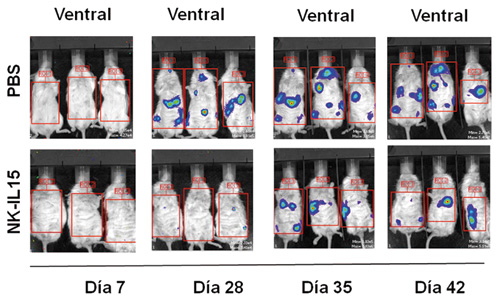
Figura 6 a). Bioluminiscencia en diferentes momentos de la carga tumoral en los dos grupos de tratamiento.
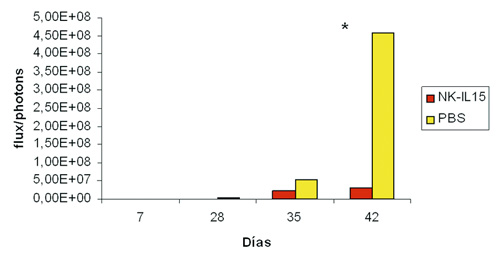
Figura 6 b). Carga tumoral expresada en fotones/segundo. Se pone de manifiesto
la menor carga tumoral en los animales tratados con NK-IL15.
Discusión
Conscientes de las limitaciones de nuestro trabajo, el escaso número de pacientes y la heterogeneidad de los diagnósticos histológicos, nuestros resultados preliminares ponen de manifiesto el papel tan importante del sistema inmune innato a través de sus células NK en el control de la tumorogénesis en pacientes pediátricos refractarios. De hecho con nuestro trabajo ponemos al descubierto una disfunción de las células NK, expresada como alteración del fenotipo celular así como una disminución de su actividad citotóxica antitumoral. En nuestra opinión uno de los mecanismos que explican esta disfunción reside en la inversión del ratio NK dim/NK bright observada en los pacientes18. Este hallazgo es importante porque la población NK bright carece de receptores KIR, que son los encargados de reconocer la ausencia de HLA-I en las células tumorales, y por tanto de su eliminación inmediata18,19. Por tanto este mecanismo supondría un mecanismo de escape de las células tumorales al reconocimiento inmunológico. La expresión de HLAI en las células tumorales hace que los linfocitos CD8 citotóxicos eliminen el tumor, por lo que las células tumorales para sobrevivir, tienen que disminuir su expresión de HLA-I. Este es un mecanismo frecuente observado en los tumores cuando se hacen metastáticos20,21. Sin embargo, la disminución de la expresión de HLA-I, aunque escapa al control de los linfocitos CD8 citotóxicos, estimula inmediatamente a las células NK22. Por el contrario si las células NK son disfuncionales, tal como estudiamos en nuestra muestra, y/o carece de los receptores para el reconocimiento de esta disminución en la expresión de HLA-I en las células tumorales, el tumor progresará escapando tanto al sistema inmune innato como al adaptativo. Sin embargo, es relevante como la estimulación con IL-15, una citocina fundamental en la homeostasis de las células linfoides, para su maduración y expansión, consigue revertir el estado de inmunotolerancia tal y como hemos demostrado en nuestros experimentos in vitro e in vivo23. Desafortunadamente la IL-15, en el momento actual, no se dispone para su uso clínico, tan solo a nivel de experimentación, o para estimulaciones en condiciones GMP, ex-vivo24. En este sentido nuestro grupo está desarrollando en el momento actual un ensayo clínico utilizando el trasplante alogénico de donante haploidéntico como plataforma para inmunoterapia con NK-IL15 ex vivo, en tumores sólidos refractarios (N.o EudraCT: 2009-010186-23)25. Con esta estrategia perseguimos conseguir un efecto inmunológico mediado por las células NK, a través de la reconstitución inmune y del "boost" post trasplante de células NK estimuladas ex vivo con IL15, de manera similar al objetivado en hemopatías malignas26,27. Sin embargo, y en vista de los resultados obtenidos con este trabajo, planteamos la inmunoterapia con células NK-IL15 como un procedimiento muy alentador en el tratamiento de tumores refractarios, incluso fuera del trasplante alogénico de donante haploidéntico28-35.
Conclusiones
El Con nuestro trabajo ponemos de manifiesto dos hallazgos fundamentales:
1.o La inmunodeficiencia en el sistema inmune innato mediado por células NK en los pacientes pediátricos con tumores sólidos refractarios, caracterizado por un desequilibrio entre la población NK dim y NK bright y una disminución de la actividad citotóxica que favorece la progresión de las células tumorales.
2.o La reversión de esta inmunodeficiencia mediante la infusión de células NK-IL15. Por lo tanto, creemos tener evidencia preclínica para considerar en un futuro cercano el desarrollo de ensayos clínicos con esta estrategia en pacientes pediátricos con tumores refractarios, al igual que recientemente se está realizando en tumores sólidos de adultos incurables en el momento actual con los tratamientos convencionales.
Agradecimiento
Los autores quieren agradecer a la Fundación CRIS por su apoyo en este trabajo y en el desarrollo del "NK cell team".
Bibliografía
1. Van den Berg H. Biology and therapy of malignant solid tumors in childhood. Cancer Chemother Biol Response Modif. 2005;22:643-76. [ Links ]
2. Kurmasheva RT, Houghton PJ. Pediatric oncology. Curr Opin Chem Biol. 2007;11:424-32. [ Links ]
3. Bien E, Maciejka-Kapuscinska L, Niedzwiecki M, Stefanowicz J, Szolkiewicz A, Krawczyk M, Maldyk J, Izycka-Swieszewska E, Tokarska B, Balcerska A. Childhood rhabdomyosarcoma metastatic to bone marrow presenting with disseminated intravascular coagulation and acute tumour lysis syndrome: review of the literature apropos of two cases. Clin Exp Metastasis. 2010;27:399-407. [ Links ]
4. Potratz J, Dirksen U, Jürgens H, Craft A. Ewing sarcoma: clinical stateof- the-art. Pediatr Hematol Oncol. 2012;29(1):1-11. [ Links ]
5. Diaz MA, Lassaletta A, Perez A, Sevilla J, Madero L, Gonzalez-Vicent M. High-dose busulfan and melphalan as conditioning regimen for autologous peripheral blood progenitor cell transplantation in high-risk ewing sarcoma patients: a longterm follow-up single-center study. Pediatr Hematol Oncol. 2010;27(4):272-82. [ Links ]
6. Francescutti V, Skitzki JJ. Sarcomas and the immune system: implications for therapeutic strategies. Surg Oncol Clin N Am. 2012;21(2):341-55. [ Links ]
7. Perez-Martinez A, Iyengar R, Gan K, Chotsampancharoen T, Rooney B, Holladay M, Ramírez M, Leung W. Blood dendritic cells suppress NK cell function and increase the risk of leukemia relapse alter hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2011;17(5):598-607. [ Links ]
8. Leung W. Use of NK cell activity in cure by transplant. Br J Haematol. 2011;155(1):14-29. [ Links ]
9. Rubnitz JE, Inaba H, Ribeiro RC, Pounds S, Rooney B, Bell T, Pui CH, Leung W. NKAML: a pilot study to determine the safety and feasibility of haploidentical natural killer cell transplantation in childhood acute myeloid leukemia. J Clin Oncol. 2010;28(6):955-9. [ Links ]
10. Ruggeri L, Capanni M, Urbani E, Perruccio K, Shlomchik WD, Tosti A, Posati S, Rogaia D, Frassoni F, Aversa F, Martelli MF, Velardi A. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science. 2002;295(5562):2097-100. [ Links ]
11. Cho D, Shook DR, Shimasaki N, Chang YH, Fujisaki H, Campana D. Cytotoxicity of activated natural killer cells against pediatric solid tumors. Clin Cancer Res. 2010;16(15):3901-9. [ Links ]
12. Arai S, Meagher R, Swearingen M, Myint H, Rich E, Martinson J, Klingemann H. Infusion of the allogeneic cell line NK-92 in patients with advanced renal cell cancer or melanoma: a phase I trial. Cytotherapy 2008;10(6):625-32. [ Links ]
13. Ishikawa E, Tsuboi K, Saijo K, Harada H, Takano S, Nose T, Ohno T. Autologous natural killer cell therapy for human recurrent malignant glioma. Anticancer Res. 2004;24(3b):1861-71. [ Links ]
14. Iliopoulou EG, Kountourakis P, Karamouzis MV, Doufexis D, Ardavanis A, Baxevanis CN, Rigatos G, Papamichail M, Perez SA. A phase I trial of adoptive transfer of allogeneic natural killer cells in patients with advanced non-small cell lung cancer. Cancer Immunol Immunother. 2010;59(12):1781-9. [ Links ]
15. Alici E, Sutlu T, Björkstrand B, Gilljam M, Stellan B, Nahi H, Quezada HC, Gahrton G, Ljunggren HG, Dilber MS. Autologous antitumor activity by NK cells expanded from myeloma patients using GMPcompliant components. Blood. 2008;111(6):3155-62. [ Links ]
16. Costello RT, Sivori S, Marcenaro E, Lafage-Pochitaloff M, Mozziconacci MJ, Reviron D, Gastaut JA, Pende D, Olive D, Moretta A. Defective expression and function of natural killer cell-triggering receptors in patients with acute myeloid leukemia. Blood. 2002 May 15;99(10):3661-7. [ Links ]
17. Blomberg K, Ulfstedt AC. Fluorescent europium chelates as target cell markers in the assessment of natural killer cell cytotoxicity. J Immunol Methods. 1993;160(1):27-34. [ Links ]
18. Di Santo JP. Functionally distinct NK-cell subsets: developmental origins and biological implications. Eur J Immunol. 2008;38(11):2948-51. [ Links ]
19. Maroof A, Beattie L, Zubairi S, Svensson M, Stager S, Kaye PM. Posttranscriptional regulation of II10 gene expression allows natural killer cells to express immunoregulatory function. Immunity. 2008;29(2):295-305. [ Links ]
20. Garrido F, Ruiz-Cabello F, Cabrera T, Pérez-Villar JJ, López-Botet M, Duggan-Keen M, Stern PL Implications for immunosurveillance of altered HLA class I phenotypes in human tumours. Immunol Today. 1997;18(2):89-95. [ Links ]
21. Kidd P. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease. Altern Med Rev. 2003;8(3):223-46. [ Links ]
22. Garcia-Lora A, Algarra I, Garrido F. MHC class I antigens, immune surveillance, and tumor immune escape. J Cell Physiol. 2003;195(3):346-55. [ Links ]
23. Zamai L, Ponti C, Mirandola P, Gobbi G, Papa S, Galeotti L, Cocco L, Vitale M. NK cells and cancer. J Immunol. 2007;178(7):4011-6. [ Links ]
24. Jakobisiak M, Golab J, Lasek W. Interleukin 15 as a promising candidate for tumor immunotherapy. Cytokine Growth Factor Rev. 2011;22(2):99-108. [ Links ]
25. Pérez-Martínez A, Leung W, Muñoz E, Iyengar R, Ramírez M, Vicario JL, Lassaletta A, Sevilla J, González-Vicent M, Madero L, Díaz-Pérez MA. KIR-HLA receptor-ligand mismatch associated with a graft-versustumor effect in haploidentical stem cell transplantation for pediatric metastatic solid tumors. Pediatr Blood Cancer. 2009;53(1):120-4. [ Links ]
26. Triplett BM, Horwitz EM, Iyengar R, Turner V, Holladay MS, Gan K, Behm FG, Leung W. Effects of activating NK cell receptor expresión and NK cell reconstitution on the outcomes of unrelated donor hematopoietic cell transplantation for hematologic malignancies. Leukemia. 2009;23(7):1278-87. [ Links ]
27. Carbone E, Neri P, Mesuraca M, Fulciniti MT, Otsuki T, Pende D, Groh V, Spies T, Pollio G, Cosman D, Catalano L, Tassone P, Rotoli B, Venuta S. HLA class I, NKG2D, and natural cytotoxicity receptors regulate multiple myeloma cell recognition by natural killer cells. Blood. 2005;105(1):251-8. [ Links ]
28. Bakker AB, Wu J, Phillips JH, Lanier LL. NK cell activation: distinct stimulatory pathways counterbalancing inhibitory signals. Hum Immunol. 2000;61(1):18-27. [ Links ]
29. Smyth MJ, Swann J, Kelly JM, Cretney E, Yokoyama WM, Diefenbach A, Sayers TJ, Hayakawa Y. NKG2D recognition and perforin effector function mediate effective cytokine immunotherapy of cancer. J Exp Med. 2004;200(10):1325-35. [ Links ]
30. Pende D, Bottino C, Castriconi R, Cantoni C, Marcenaro S, Rivera P, Spaggiari GM, Dondero A, Carnemolla B, Reymond N, Mingari MC, Lopez M, Moretta L, Moretta A. PVR (CD155) and Nectin-2 (CD112) as ligands of the human DNAM-1 (CD226) activating receptor: involvement in tumor cell lysis. Mol Immunol. 2005;42(4):463-9. [ Links ]
31. Moretta L, Bottino C, Pende D, Castriconi R, Mingari MC, Moretta A. Surface NK receptors and their ligands on tumor cells. Semin Immunol. 2006;18(3):151-8. [ Links ]
32. Barkholt L, Alici E, Conrad R, Sutlu T, Gilljam M, Stellan B, Christensson B, Guven H, Björkström NK, Söderdahl G, Cederlund K, Kimby E, Aschan J, Ringdén O, Ljunggren HG, Dilber MS. Safety analysis of ex vivo-expanded NK and NK-like T cells administered to cancer patients: a phase I clinical study. Immunotherapy 2009;1(5):753-64. [ Links ]
33. Frankel TL, Burns W, Riley J, Morgan RA, Davis JL, Hanada K, Quezado M, Rosenberg SA, Royal RE. Identification and characterization of a tumor infiltrating CD56(+)/CD16 (-) NK cell subset with specificity for pancreatic and prostate cancer cell lines. Cancer Immunol Immunother. 2010;59(12):1757-69. [ Links ]
34. Voskens CJ, Watanabe R, Rollins S, Campana D, Hasumi K, Mann DL. Ex-vivo expanded human NK cells express activating receptors that mediate cytotoxicity of allogeneic and autologous cancer cell lines by direct recognition and antibody directed cellular cytotoxicity. J Exp Clin Cancer Res. 2010;29:134. [ Links ]
35. Niu Q, Wang W, Li Y, Qin S, Wang Y, Wan G, Guan J, Zhu W. Cord blood-derived cytokine-induced killer cells biotherapy combined with second-line chemotherapy in the treatment of advanced solid malignancies. Int Immunopharmacol. 2011;11(4):449-56. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
aperezm.hnjs@salud.madrid.org
Recibido: 28 de junio de 2012
Aceptado: 6 de julio de 2012