Introducción
La hemodiálisis (HD) es la modalidad de tratamiento renal sustitutivo más común1 siendo uno de sus principales objetivos la eliminación de toxinas urémicas, cuyo acúmulo se relaciona con el desarrollo de enfermedades cardiovasculares, inflamatorias, trastornos óseos, inmunodeficiencias secundarias o amiloidosis entre otras1)-(4.
Las técnicas de diálisis actuales tienen limitaciones para eliminar de forma adecuada los solutos urémicos de gran peso molecular5)-(7. Moléculas de hasta 25 kDa pueden ser eliminadas por difusión, mientras que las moléculas medias superiores a los 25 kDa precisan de un trasporte convectivo o el uso de membranas altamente permeables para ser eliminadas1), (8.
La reciente aparición de las membranas de corte medio (MCM) ofrece una alternativa para la eliminación de moléculas medianas grandes de hasta 45 kDa1), (2), (4), (9. Esta nueva membrana se caracteriza por una distribución más uniforme y un mayor tamaño del poro, lo que le confiere mayor permeabilidad, aumentando, por lo tanto, el transporte convectivo10. El uso de estas MCM da lugar a una nueva técnica dialítica, denominada Hemodiálisis expandida (HDx), en la que la difusión y la convección se combinan en un mismo dializador sin necesidad de tecnologías complejas adicionales, líquidos de diálisis ultrapuros ni flujos sanguíneos muy altos11), (12.
Sin embargo, este mayor tamaño del poro podría afectar a la eliminación de ciertos medicamentos utilizados habitualmente durante las sesiones de HD, como es el caso de la heparina, necesaria para evitar la coagulación prematura del circuito13. El peso molecular de la heparina no fraccionada (HNF) oscila entre los 12000-15000 Da mientras que el de la heparina de bajo peso molecular (HBPM) alcanza los 4000-8000 Da14, tamaño muy inferior al poro de la MCM, lo que podría condicionar una mayor eliminación de esta sustancia a través de la membrana, afectando al estado final de coagulación del circuito, por lo que algunos autores recomiendan adaptar la dosis de anticoagulante a la superficie de estas membranas15.
El objetivo que nos planteamos fue determinar si existen diferencias en la necesidad de heparina y el estado final de coagulación del sistema extracorpóreo según la técnica dialítica realizada, hemodiálisis expandida, hemodiálisis convencional con membrana de alto flujo o hemodiafiltración-on line (HDFOL).
Material y método
Se realizó un estudio cuasiexperimental pre y post intervención en pacientes en tratamiento con hemodiálisis crónica del Servicio de Nefrología del Hospital Universitario Marqués de Valdecilla, Santander. Como criterios de inclusión se establecieron, ser mayor de 18 años, llevar en programa de HD crónica al menos 6 meses y utilizar HNF como anticoagulante durante la sesión de HD. Los criterios de exclusión fueron tener una condición clínica inestable y un acceso vascular disfuncionante. Todos los participantes, aceptaron participar en el estudio mediante la firma del consentimiento informado previa al inicio del estudio.
Se establecieron dos periodos de estudio, de una duración de 3 meses para cada uno de ellos. En el primer periodo, los pacientes realizaron HD o HDFOL con membranas de Helixona Plus (HP) o Polietersulfona con Heparina (PH) según pauta médica. En el segundo periodo, los pacientes realizaron HDx con una MCM de poliariletersulfona y polivinilpirrolidona. No hubo cambios en cuanto a la duración de la sesión, pauta de flujo sanguíneo, flujo de baño ni cambio en el acceso vascular.
La prescripción de heparina se hizo siguiendo el protocolo del centro: HNF en una dosis inicial de 50 Ui/kg de peso seguido de administración intermitente horaria o cada 2 horas de 1000 Ui según necesidad. El ajuste de dosis se realizó en función del estado final del circuito y del dializador en sesiones previas.
Se recogieron datos sociodemográficos y clínicos, incluyendo edad, sexo, acceso vascular, duración de la sesión, dosis de heparina empleada y tratamiento domiciliario anticoagulante del paciente. El estado final de coagulación del circuito y dializador se valoró mediante inspección visual, una vez finalizada la sesión de HD, en función de la siguiente escala: "limpio" -sin coagulación o cierta decoloración del circuito o dializador; "parciamente coagulado" -fibras visiblemente coloreadas o coagulación parcial del circuito; "cambio del circuito/dializador" -es preciso cambiar el circuito o dializador por coagulación.
A partir de las variables recogidas se elaboró una base de datos tipo Excel anonimizada. Para el análisis de los datos se utilizó el paquete estadístico PSPP v1.2. Se realizó un análisis descriptivo utilizando medidas de tendencia central para las variables cuantitativas; y frecuencias y porcentajes para las variables cualitativas. Se utilizaron los test Chi2, test exacto de Fischer y ANOVA de un factor para la inferencia estadística, considerándose un valor p<0,05 como estadísticamente significativo.
El estudio se llevó a cabo cumpliendo la Ley Orgánica 3/2018 de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
Resultados
Se incluyeron 14 pacientes, con una edad media de 71,6±10,5 años, siendo el 50% mujeres. El 78,6% se dializaba a través de un catéter venoso central tunelizado. Se analizaron un total de 977 sesiones de hemodiálisis: 512 en el periodo 1 (HD o HDFOL) y 465 en el periodo 2 (HDx). Las características clínicas de la muestra se pueden ver en la tabla 1.
Tabla 1. Características clínicas de la muestra.
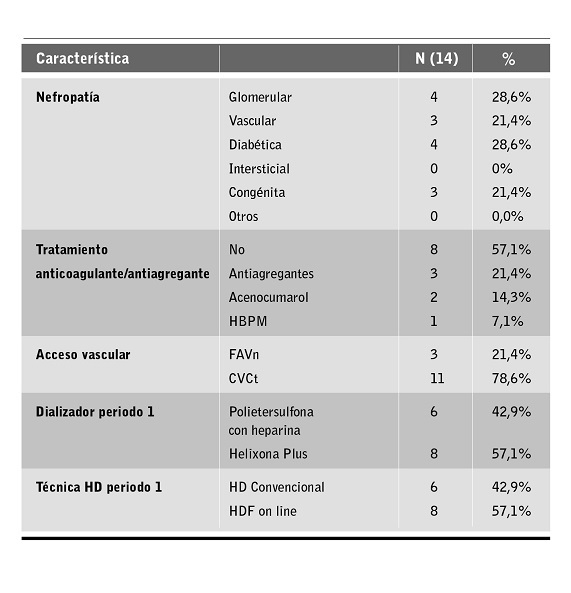
HBPM: heparina de bajo peso molecular; FAVn: fístula arteriovenosa nativa; CVCt: catéter venoso central tunelizado; HDF: hemodiafiltración.
La dosis media de HNF necesaria según el dializador, fue de 33 mg para el PH, 37 mg para el HP y de 34 mg para el MCM (p<0,001).
En la tabla 2 se muestra la comparación de las sesiones de hemodiálisis estudiadas, por grupos según el tipo de dializador.
Tabla 2. Comparación de las sesiones de hemodiálisis estudiadas, por grupos según el tipo de dializador.

MCM: Membrana de corte medio de poliariletersulfona y polivinilpirrolidona, HBPM: heparina de bajo peso molecular; FAVn: fístula arteriovenosa nativa; CVCt: catéter venoso central tunelizado. †Test chi cuadrado o test exacto de Fisher para frecuencias inferiores a 5, en la comparación por tipo de dializador frente al resto de variables.
La distribución de sesiones según dializador y técnica realizada durante el primer periodo fue 57,1% HP y 42,9% PH.
El circuito quedó parcialmente coagulado en el 12,4% de las sesiones realizadas con PH, en el 5,5% de las sesiones realizadas con HP y en el 6,2% de las realizadas con MCM, siendo estadísticamente significativo (p=0,015).
Así mismo, el dializador quedó parcialmente coagulado en el 17,2% de las sesiones realizadas con PH, en el 12,5% de las realizadas con HP y el 10,3 de las llevadas a cabo con MCM (p=0,054).
Sólo en una sesión del total analizado, fue necesario cambiar el circuito y dializador, con la membrana PH.
Al analizar por técnica, el dializador quedó sucio en el 10,3% de las sesiones de HDx frente al 19,1% de las sesiones de HD y al 11,4% de las sesiones de HDFOL, siendo estadísticamente significativo (p=0,011).
Discusión
La HDx ha surgido como una nueva alternativa para mejorar la eficacia de la HD1), (9), (11. Sin embargo, aún se conoce poco sobre las posibles indicaciones de esta nueva terapia, así como el manejo de las MCM utilizadas16.
Voigt et al. (17 en su estudio se plantearon, mediante un modelo in vitro, la posible retención de diferentes medicamentos usados en la práctica clínica durante una sesión de hemodiálisis, entre ellos la HPBM. Observaron un descenso de la HBPM a los 60 minutos de la administración similar en todas las membranas estudiadas, independientemente de la técnica realizada, lo que hace pensar que el mayor tamaño de los poros de la MCM no supone una mayor pérdida de heparina durante la HD. Esta tendencia también se ve reflejada en nuestros datos pese a las diferencias en el planteamiento del estudio, ya que, en nuestro caso, hemos valorado el estado final tanto del circuito como del dializador. El 10,3% de las sesiones realizadas con MCM mostró el dializador parcialmente coagulado, frente al 17,2% y 12,5% de las sesiones en las que se utilizaron otras membranas. Otra diferencia radica en que en nuestro estudio se utilizó HNF, que tiene mayor peso molecular que la HBPM y mayor poder de unión a proteínas plasmáticas lo que puede influir en la dificultad para ser eliminado a través del dializador.
Al analizar por técnica realizada, en nuestro caso, el dializador quedó sucio en el 19,1% de las sesiones de HD frente al 10,3% de las sesiones de HDx y el 11,4% de las sesiones de HDFOL. Esta misma situación es compartida por el estudio de Santos et al. (18, aunque en este caso, nuevamente utilizan HBPM como anticoagulante.
De las tres membranas utilizadas en nuestro estudio, la PH fue la que menos heparina precisó, tan sólo 33 mg, misma situación que reflejan otras investigaciones19)-(21 publicadas. Esta membrana se caracteriza por estar recubierta por heparina, por lo que estaría justificado dicho comportamiento.
No hay consenso sobre qué tipo de heparina es la más adecuada para su uso en diálisis como refleja el Estudio de Anticoagulación en Hemodiálisis en España22, el 44,1% de los pacientes utiliza HNF y el 51,5% utiliza HBPM. Mientras que las guías europeas recomiendan el empleo de HBPM como anticoagulante de elección, en la práctica real no hay acuerdo14. En nuestro centro se utiliza la HNF con dosificación según el peso del paciente y ajuste en función del estado de coagulación del circuito y dializador tras las sesiones de hemodiálisis, al igual que han documentado otros centros14), (22.
Además de la individualización de la dosis y del tipo de heparina a utilizar, o de la técnica dialítica empleada14 hay otros factores que son necesarios tener en cuenta a lo hora de establecer la anticoagulación de los pacientes15), (21. Existe un porcentaje de pacientes en programa de HD que están en tratamiento domiciliario con anticoagulantes y/o antiagregantes orales, aspecto que puede influir en el estado final de coagulación del circuito o dializador. En nuestro caso, este aspecto no fue un criterio de exclusión, y en aquellos pacientes que seguían este tratamiento, fue una variable común en ambos periodos de estudio.
Debemos reconocer varias limitaciones a nuestro estudio. En primer lugar, el pequeño tamaño de la muestra, que limitó la potencia estadística. En segundo lugar, el corto periodo de estudio, que limitó la posibilidad de recabar más información sobre la seguridad a largo plazo y la evolución en el tiempo de la dosificación de la heparina.
Según nuestros datos, el consumo de heparina varía según la membrana de diálisis y la técnica dialítica realizada. La MCM ofrece un mejor estado de coagulación final tanto del circuito extracorpóreo como del dializador que otras membranas además de permitir una menor dosis de heparina que la HP, con dosis similares a la PH.
Pese a un mayor tamaño del poro, la heparina no fraccionada parece no ser eliminada en mayor medida a través de la MCM en la hemodiálisis expandida, aspecto que debe ser tenido en cuenta a la hora de ajustar la dosis de heparina con el fin de evitar complicaciones.














