Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.23 supl.2 Madrid may. 2008
Manejo nutricional del paciente postcirugía de vías biliares y páncreas
Nutritional management of the patient after surgery of the biliary tract and pancreas
C. Loinaz Segurola1,2 y F. Ochando Cerdán1
1Fundación Hospital Alcorcón. 2Hospital Madrid Norte Sanchinarro. España.
Dirección para correspondencia
RESUMEN
Gran parte de los pacientes con cirugía biliopancreática mayor sufren desnutrición preoperatoria, agravada por el ayuno perioperatorio y los tratamientos posteriores.
La cirugía de páncreas y vías biliares puede ocasionar trastornos digestivos, fundamentalmente absortivos, sobre todo con malabsorción grasa.
El soporte nutricional se ha demostrado útil en cirugía gastrointestinal en múltiples trabajos. En los últimos años ha habido un importante esfuerzo para comprobar cuáles son las mejores pautas en la nutrición perioperatoria en cirugía pancreatobiliar, sobre todo en el contexto de la duodenopancreatectomía. En líneas generales, la nutrición parenteral (NPT) rutinaria parece desaconsejada, salvo en pacientes con desnutrición moderada-grave, siendo de elección la nutrición enteral. La inmunonutrición parece mejorar los resultados, y la infusión óptima podría ser la cíclica.
De acuerdo con una encuesta enviada a Unidades de Cirugía Hepatopancreatobiliar de España, la pauta mayoritariamente utilizada de soporte en cirugía pancreatobiliar mayor es en la actualidad la NPT, con inicio de dieta oral a los 4-6 días. El uso de nutrición enteral es minoritario, y la alimentación oral precoz es excepcional.
Palabras clave: Cirugía biliopancreática. Manejo nutricional. Nutrición enteral.
ABSTRACT
A big proportion of patients with biliary and pancreatic surgery present preoperative malnourishment aggravated by perioperative fasting and additional therapies. Surgery of the pancreas and the biliary tract may cause digestive impairments, mainly absorptive, especially with fat malabsorption.
Many studies have shown the usefulness of nutritional support in gastrointestinal surgery. In the last years, there has been a remarkable effort in order to determine which are the best perioperative nutrition regimens in biliary and pancreatic surgery, particularly in the setting of duodenopancreatectomy. Generally, routinary parenteral nutrition (PNT) is not recommended, excepting in moderate-severe hyponutrition, the first choice therapy being enteral nutrition. Immunonutrition seems to improve the outcomes, and the best infusion might be cyclic.
According to a survey carried out among the Hepatopancreatobiliary Surgery units in Spain, nowadays the most frequently used support regimen in biliary and pancreatic surgery is PNT, switching to oral feeding within 4-6 days. Enteral nutrition is seldom used.
Key words: Biliary and pancreatic surgery. Nutritional management. Enteral nutrition.
Introducción
Una importante proporción de los pacientes con patología quirúrgica de las vías biliares y páncreassufren desnutrición. Esta se produce en muchos casos desde antes de la intervención, por la propia enfermedad. Además, en muchos casos la cirugía comporta la imposibilidad de utilización de la vía oral durante días. Y en ocasiones, la necesidad de un tratamiento adyuvante postoperatorio hace que los pacientes no sean capaces de mantener una ingesta adecuada.
A lo largo del siglo XX se ha ido demostrando la importancia del soporte nutricional perioperatorio y la influencia de la desnutrición en el desarrollo de complicaciones. Ya en los años 30 se comprobó la importancia de la hipoproteinemia como factor de riesgo1 de pobres resultados, y en los 40 la obtención de un balance nitrogenado positivo y ganancia ponderal con la nutrición enteral postoperatoria2.
La mayoría de los estudios se han efectuado en grupos de pacientes con cirugía gastrointestinal de diversos tipos. Sin embargo, a partir de los años 80 se han especializado los trabajos, de manera que se ha podido comprobar ya la importancia de la evaluación nutricional preoperatoria y del manejo nutricional en el tratamiento del carcinoma de páncreas3, y los factores de riesgo nutricionales en la cirugía hepatobiliar mayor4. La malnutrición y el riesgo operatorio pueden identificarse en el preoperatorio de pacientes con enfermedad pancreática y hepatobiliar maligna4. En este contexto, una situación nutricional preoperatoria mejor posibilitaría una cirugía de mayor envergadura y la nutrición postoperatoria produce mejores resultados con reducción de complicaciones3. Por otro lado, el soporte nutricional óptimo tras una hepatectomía no está establecido. En un estudio japonés reciente, aunque con pocos pacientes, la utilización o no de nutrición parenteral postoperatoria no varió significativamente la incidencia de complicaciones postoperatorias, los datos de función hepática ni los parámetros nutricionales5.
En los próximos apartados veremos qué influencia tienen en la situación nutricional la patología pancreatobiliar más frecuente, las técnicas quirúrgicas empleadas y la situación anatómica resultante, los cambios fisiopatológicos que acontecen a corto y largo plazo, y las posibilidades de actuación desde el punto de vista nutricional.
Comprobaremos también cuál es el manejo nutricional actual de estos pacientes en nuestro país, a través de una pequeña encuesta que ha sido remitida a Servicios de Cirugía con experiencia en patología hepatobiliopancreática.
Trastornos nutricionales preoperatorios en patología biliopancreática
En este apartado nos referiremos fundamentalmente a la patología tumoral y las consecuencias de la obstrucción biliar, ya que la pancreatitis aguda y crónica y sus repercusiones nutricionales se van a revisar en los dos capítulos siguientes.
Una importante proporción de los pacientes quirúrgicos biliopancreáticos presentan un tumor maligno. Aún hoy en día, muchos de ellos llegan al quirófano afectados por anorexia, pérdida de peso, y caquexia tumoral. Esta caquexia parece estar producida por un exceso de citoquinas6, con aumento del factor liberador de corticotropina, un potente anorexígeno, que junto con las prostaglandinas suprime la producción del neuropéptido Y, agente orexígeno. Periféricamente hay proteólisis, retraso del vaciamiento gástrico, aumento de lipólisis7, y excesiva producción de lactato con pérdida de energía por inducción del ciclo de Cori hepático y periférico8.
La obstrucción biliar se asocia con importante reducción de la ingesta calórica, tanto en patología benigna como en tumoral9. Esto se comprobó tanto mediante evaluación subjetiva (test de Welch, alterado en 96% de los pacientes) como por cuantificación de la ingesta calórica (por debajo de las necesidades estimadas en 72%), y ambos se correlacionaron inversamente con la bilirrubina sérica. Los mismos autores demostraron un aumento de la ingesta espontánea tras drenaje biliar interno10. La bilirrubina, fosfatasa alcalina y colecistoquinina séricas fueron factores predictivos independientes de ingesta calórica, con disminución significativa de sus cifras tras el drenaje. Las alteraciones nutricionales en estos pacientes estaban determinadas por la intensidad de la obstrucción, correlacionándose con elevación de CCK plasmática, disfunción hepática y edad11. También otros autores han usado el índice de riesgo nutricional (NRI), fácil de utilizar, en pacientes con ictericia obstructiva12. Un NRI < 83,5 se asoció significativamente con una mayor mortalidad y duración de hospitalización, aunque no con la tasa de complicaciones.
Cirugía y cambios anatómicos
Comentaremos en este apartado tan solo aquellos procedimientos que por su complejidad ocasionan cambios reseñables en la anatomía intraabdominal, y que son precisamente los utilizados en la patología más grave. Obviaremos por tanto los procedimientos más sencillos, como la colecistectomía, cirugía sobre la vía biliar sin derivación o derivaciones biliares sin utilización de yeyuno (ej. colédoco-duodenostomía), que no suelen precisar además, habitualmente, de ayunas prolongadas y soporte nutricional.
Entre las técnicas utilizadas en el páncreas las hay que comportan una resección total o parcial de la glándula, otras derivativas, y finalmente, algunas combinan resección y derivación.
La cirugía extensa de las vías biliares, en su porción distal es similar a la afectación de la cabeza del páncreas, es decir, duodenopancreatectomía (DP), y en su porción media y proximal comporta derivación bilioyeyunal (asociada o no a hepatectomía en vía biliar proximal).
Técnicas de cirugía pancreática
- Pancreatectomía distal (caudal o corporocaudal). La pancreatectomía de la cola o cuerpo-cola de páncreas se utiliza en patología tumoral. La mayoría de los tumores malignos, adenocarcinomas ductales, están muy evolucionados cuando se diagnostican por dolor, siendo hasta ese momento silentes o dando muy pocos síntomas. Por tanto, la resección con intención curativa no es frecuente en ellos. Más frecuente es la pancreatectomía en tumores de dudosa estirpe o en neuroendocrinos. Cada vez es más frecuente el abordaje laparoscópico en estos tumores.
- Pancreatectomía cefálica (con o sin duodenectomía) y total. La pancreatectomía cefálica se describió en 1912 y 1935 por Kausch13 y Whipple14, inicialmente como un procedimiento en dos etapas. La duodenopancreatectomía cefálica comporta la exéresis de la cabeza pancreática junto con el duodeno y primeros centímetros de yeyuno, incluyendo el antro gástrico y la vesícula biliar con la vía biliar principal por encima de la desembocadura del cístico (fig. 1). Habitualmente, la reconstrucción se realiza con una sutura del remanente pancreático a un asa de yeyuno, y en la misma asa se suturan también la vía biliar y el estómago. Se pueden utilizar dos asas de yeyuno para la reconstrucción. Existe también la opción de la pancreatogastrostomía, donde el páncreas se sutura al estómago. La modificación publicada por Traverso y Longmire en 197815 consiste en la preservación pilórica, con anastomosis duodeno-yeyunal.
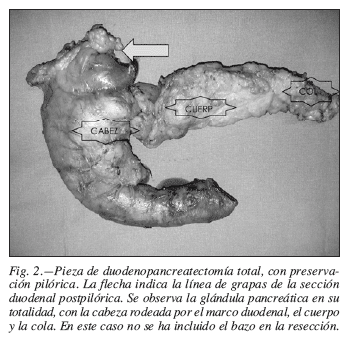
En la pancreatectomía total, toda la glándula se extirpa, generalmente con el duodeno y también el antro gástrico y la vía biliar con la vesícula (fig. 2).
- Derivaciones pancreáticas y técnicas mixtas. Se utilizan fundamentalmente en pancreatitis crónica (PC), para tratar el dolor. Cada vez es mayor la evidencia de neuropatía pancreática como origen del dolor en la PC y cáncer pancreático16. Un conjunto de factores bioquímicos, inflamatorios, neurales y genéticos permiten el desarrollo de la enfermedad17. La teoría alternativa de hipertensión intraductal/intraparenquimatosa sugiere que el dolor se genera como resultado de presiones aumentadas en el sistema ductal y/o en el parénquima, y está fuertemente apoyada en los buenos resultados de los procedimientos de drenaje o derivaciones en el tratamiento quirúrgico de la PC18.
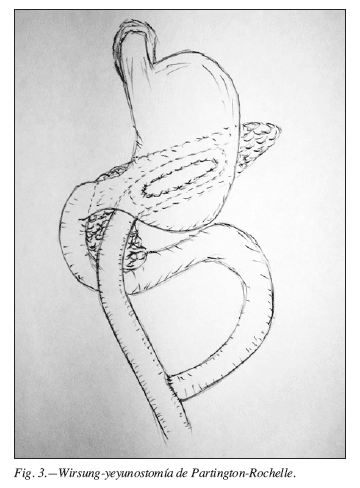
Están derivaciones pancreáticas sólo se pueden realizar cuando el sistema excretor principal (conducto de Wirsung) está suficientemente dilatado. Se desarrollaron fundamentalmente a partir de los años 50 del siglo pasado. Hay muy diversas técnicas, con pancreatectomía caudal (Puestow19, Lagrot20), o sin ella (Partington-Rochelle21, Thal22) (fig. 3).
También se han desarrollado técnicas cuya primera intención es la resección cefalopancreática en procesos inflamatorios y/o dolor por afectación de esta zona en PC, con derivación del resto de la glándula, y conservando el marco duodenal. Las más conocidas son las técnicas de Frey23 y Beger24.
Técnicas en cirugía biliar
- Duodenopancreatectomía cefálica (DPC). El procedimiento es el mismo que el descrito en patología pancreática maligna. Se utiliza en patología tumoral con afectación de tercio distal de vía biliar. En ocasiones puede haber afectación tumoral difusa del árbol biliar que obliga a hepatectomía, resección de vía biliar y DPC, pero esta indicación es excepcional (fig. 4).
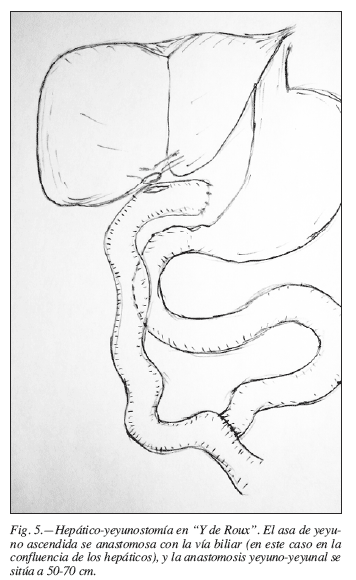
- Hepático-yeyunostomía. Consiste en la derivación de la confluencia biliar o de radicales biliares intrahepáticos (colangio-yeyunostomía) para drenar la bilis al intestino tras una cirugía resectiva de la vía biliar principal. Determina la desfuncionalización de 50-70 cm de yeyuno para la creación de un sergmento de derivación generalmente en Y ("Y de Roux") (fig. 5).
Cambios fisiopatológicos a corto y largo plazo
Las implicaciones de las pequeñas resecciones intestinales acompañantes en las técnicas descritas son despreciables en la inmensa mayoría de pacientes. En resecciones intestinales masivas, un remanente de un metro de intestino delgado no suele necesitar habitualmente soporte nutricional, y longitudes mucho menores pueden tener un proceso de adaptación hasta la autosuficiencia sin precisar nutrición parenteral con un protocolo de soporte adecuado25. Asimismo, la desfuncionalización de asas de yeyuno de la longitud utilizada (50-70 cm) no comporta alteraciones absortivas en pacientes sin insuficiencia intestinal previa.
Sin embargo, las resecciones pancreáticas pueden ocasionar trastornos tanto por su componente exocrino como por el endocrino. Y estas alteraciones se hacen, lógicamente más evidentes, si hay predisposición previa como ocurre en la pancreatitis crónica, predisposición a la diabetes o enfermedad celíaca26-29. La insuficiencia exocrina podría estar influida en algunos casos por una pancreaticoyeyunostomía obstruida, como se ha publicado recientemente30. Algunos autores han realizado reanastomosis en este contexto, con buenos resultados funcionales, sin necesidad de enzimas sustitutivas y con frecuencia deposicional de 1-2/día31.
En un estudio francés reciente32 sobre 52 pacientes con DP, con un seguimiento medio de 75 meses se observa esteatorrea en 42% de ellos, con un 14,6% de diabetes. La asociación de esteatorrea fue mucho mayor con pancreatogastrostomía que con pancreatoyeyunostomía. En otro estudio más reciente aún33, de Taiwan, no se observaron estas diferencias. Un total de 52,4% de los pacientes (sobre 42) desarrollaron insuficiencia exocrina, and 11,9% diabetes, sin diferencias entre ambos tipos de montaje. Tampoco hubo diferencias en tiempo de vaciamiento gástrico, hallazgos endoscópicos y cambios de diámetro del conducto pancreático. La reconstrucción pancreaticoyeyunal se asoció a un mayor número de reintervenciones postoperatorias (17,4% vs 0%).
La preservación pilórica teóricamente es más fisiológica. Aunque la propia resección plantea alteraciones digestivas, podría mantener mejor la situación nutricional. En un estudio italiano34, con un número bajo de pacientes, 13 con resección clásica (grupo A) y 13 con preservación (grupo B), se observó una frecuencia de trastornos subclínicos y alteración de la absorción en 61,5% y 69,2% de los pacientes respectivamente. Pero en cuatro pacientes del grupo A había un estado nutricional pobre, contra un estado satisfactorio en todos los del grupo B.
La pancreatitis crónica supone un escenario especial. Gran parte del resultado en estos pacientes depende de la afectación parenquimatosa previa a la cirugía y de si el origen es enólico y vuelven a beber. Así, el grupo de la Universidad de Ginebra35 comprueba que la supervivencia de pacientes alcohólicos es de 51% a 10 años, contra 82% en no alcohólicos. La resección se acompañó de un 56% de diabetes, pero el estado nutricional a largo plazo fue similar en derivación y resección. Se observó ganancia ponderal en 47% de pacientes y la calidad de vida era de buena a excelente en 74%. Conclusiones similares extraen en la Clínica Mayo, con 484 pacientes tratados de 1976 a 199736. La supervivencia mayor se observó en derivación y la menor en pancreatectomía total. Los procedimientos de resección se acompañaron de mayor morbilidad temprana y tardía, más mortalidad preoperatoria y menor supervivencia. El alcohol supuso menor supervivencia.
Pero la resección cefalopancreática no necesariamente supone un deterioro de la situación clínica. Así en una publicación reciente de Taiwan37, con 15 pacientes con resección de Whipple y montaje clásico de Child (un asa) por masa cefalopancreática, la función pancreática no se afectó, con una mejoría significativa de la calidad de vida.
Izbicki38 compara las técnicas de Frey y Beger, ambas con preservación duodenal, con 22 pacientes en el primer grupo y 20 en el segundo. La mortalidad fue 0 y la morbilidad del 9 y 20% respectivamente. Hubo una disminución del dolor del 94% y del 95% respectivamente, y un incremento global del índice de calidad de vida global en ambos grupos. Las conclusiones en 1995 eran que ambos procedimientos eran igualmente seguros, y efectivos en relación con el dolor, mejoría de calidad de vida y control de complicaciones que afectan a órganos vecinos. No se vio deterioro de las funciones exo- y endocrinas. En un análisis posterior con 74 pacientes39, y 104 meses de seguimiento medio, no se vieron diferencias en mortalidad tardía (32 vs 31%), calidad de vida global, dolor o insuficiencia exo- (78 vs 88%) o endocrina (60 vs 56%). La decisión de elegir una u otra técnica debería basarse en la experiencia del cirujano. Como el propio Frey40 dice: el procedimiento ideal debería ser fácil de realizar, con baja morbi-mortalidad, liberación del dolor duradera y sin aumentar la insuficiencia endo- y exocrina. Y reconoce que tal intervención no existe.
También se ha comparado a largo plazo la intervención de Beger con la pancreaticoduodenectomía con preservación pilórica41. No se encontraron diferencias en cuanto al control del dolor ni la función exocrina. Hubo más pérdida de apetito en los pacientes con preservación pilórica, pero no otras diferencias en calidad de vida. Hubo diabetes en 7/15 pacientes con intervención de Beger y 11/14 del grupo de PD. La conclusión era que tras 14 años, las ventajas iniciales de la intervención de Beger no eran ya evidentes.
La mayoría de los pacientes presentan pérdida de peso y trastornos digestivos, fundamentalmente diarrea, tras una DPC. Pero gran parte de estos síntomas van mejorando hasta desaparecer en unos meses. McLeod y cols., compararon 25 pacientes con PD con 25 pacientes con colecistectomía utilizando 6 instrumentos de medida de calidad de vida (CV)42. No hubo diferencias significativas, con un estado de bienestar cercano a la normalidad. Melvin y cols.43 estudiaran la CV con el SF-36 en 45 pacientes con PD con preservación pilórica o gastrectomía, sin encontrar diferencias en el área mental, pero sí en las demás en beneficio de la preservación. Wenger y cols.44 utilizaron el EORTC QLQ-30 para estudiar 48 pacientes con preservación24 o gastrectomía24. No hubo diferencias significativas globales, pero sí se vio una CV gastrointestinal mejor en las primera semanas (6 a 36) en los pacientes con preservación. Huang y cols.45, utilizaron una modificación del City of Hope Medical Center QOL Survey en 192 supervivientes de PD. La puntuación global en los 3 dominios (físico, psicológico y social) fue equivalente a pacientes con colecistectomía laparoscópica y controles. Pero fue menor en los dominios físico y psicológico en pacientes con PD (77% y 78%) comparados con pacientes colecistectomizados (83% y 82%; p < 0,05). Nguyen y cols.46 utilizan el Functional Assessment of Cancer Therapy-Hepatobiliary QOL survey (FACT-Hep) en 105 pacientes de PD estándar y radical, sin encontrar diferencias significativas globales. Dada la mayor frecuencia de complicaciones en la cirugía radical y similar supervivencia en su experiencia, abogan por la PD con preservación pilórica y linfadenectomía estándar.
La ingesta puede verse afectada tras una pancreatectomía. En un estudio inglés47 sobre 15 pacientes tras 1 a 30 meses (mediana de 4) tras la intervención, se comprobó que la ingesta calórica mediana (estudiada durante una semana) era de 1.914 kcal/día (rango 1.154-2.804), un 88% (rango 56-154) de los requerimientos medios estimados (RME). La ingesta de grasa era baja (72 (60-123) g/día), la de proteínas adecuada [139% (99-219) RME]. Se observaron deficiencias de ingesta de vitamina D [17% (6-56) RME] y, en algunos pacientes de selenio [107% (19-203) RME]. Concluyen los autores que podría mejorarse la situación incrementando la ingesta de grasa, con suplementos enzimáticos si son necesarios. Podrían además necesitar vitamina D, y algunos, selenio.
La malabsorción produce dolor abdominal, esteatorrea y pérdida de peso que puede ser muy debilitante. El uso de dosis efectivas de suplementos de enzimas pancreáticas es esencial en pacientes sintomáticos. Sin embargo, aún así un 30% de pacientes tienen evidencia de esteatorrea48. La completa erradicación de la misma no es posible actualmente, incluso con los mejores agentes48. Sin embargo, en la mayoría de los casos no es necesario limitar la ingesta de grasas49. La liberación de 20.000-30.000 U de lipasas en el duodeno parece una dosis óptima para corregir la esteatorrea. La acidez es un factor importante, por lo que se utilizan preparacionesácido-resistentes e inhibidores de la bomba de protones o anti-H2. Se ha comprobado en estudios aleatorizados la utilidad de los preparados enzimáticos para mejorar la malabsorción50, 51. No obstante, es importante descartar sobrecrecimiento bacteriano en no respondedores al tratamiento enzimático52, 53.
Se ha comprobado una reducción significativa de la capacidad secretora de colecistoquinina (CCK) y secreción postpandrial de CCK tras intervención de Whipple54. En el mismo estudio, se vio que tras DP con preservación pilórica esta capacidad secretora no estaba afectada, aunque la respuesta postpandrial estaba significativamente reducida. En estos pacientes, los niveles plasmáticos de CCK en ayunas estaban significativamente elevados, apuntando a la ausencia de inhibición de la secreción de CCK por enzimas intraluminales. Sin embargo, tras pancreatectomía distal la capacidad secretora de CCK no se vio afectada.
También se ha estudiado el polipéptido pancreático (PP) en la pancreatitis crónica (PC) y tras cirugía pancreática55. En la PC los niveles basales y tras estimulación con bombesina estaban reducidos si había insuficiencia exocrina. La secreción de PP estimulada por ingesta estaba significativamente reducida en presencia o no de insuficiencia exocrina. En los pacientes con resección cefalopancreática los niveles de PP basales y estimulados estaban significativamente reducidos.
Complicaciones en cirugía biliopancreática y estado nutricional
Las dos complicaciones más temidas tras cirugía pancreática son la hemorragia y la fístula pancreática56. La mayoría de pacientes con hemorragia tienen complicaciones sépticas. Infección y fistulización tienen relación con el estado nutricional. En un análisis multivariante reciente sobre factores de riesgo de fístula pancreática tras pancreatectomía distal en 132 pacientes, el único factor significativo fue la malnutrición caracterizada como un IRN (índice de riesgo nutricional) ≤ 10057. En otro estudio con un número parecido de pacientes (175), los dos factores predictivos en el análisis multivariante fueron la no ligadura electiva del conducto pancreático y la sección en el cuerpo del páncreas58. El tratamiento fue conservador en 95% (38/40), reinterviniéndose sólo 2 pacientes. Este estudio, retrospectivo, no tuvo en cuenta la situación nutricional ni el IMC, que en un estudio previo sí tuvo relación con la incidencia de fístula pancreática (IMC > 25 kg/m2 como factor de riesgo de complicación intraabdominal en análisis univariante)59.
En una publicación reciente se analizan los factores de riesgo de fístula pancreática postoperatoria en pancreatectomía distal en pancreatitis crónica, en 91 pacientes intervenidos entre 1995 y 200360. El volumen de drenado se asoció en análisis multivariante a la creatinina sérica, historia de intervención intraabdominal, dilatación del conducto pancreático en el lado derecho, colecistectomía sincrónica y albúmina sérica. La concentración de amilasa del drenaje se relacionó con la creatinina, nitrógeno ureico sanguíneo, nutrición parenteral preoperatoria y fosfatasa alcalina sérica.
El mismo grupo de trabajo tiene una publicación específicamente sobre el efecto de la malnutrición en la mortalidad tras cirugía por pancreatitis crónica61. Para ello estudiaron 313 pacientes con pancreatoyeyunostomía (PY) (152), duodenopancreatectomía (78) o pancreatectomía distal (PD) (83). Se utilizaron el Subjetive Global Assessment, Nutritional Risk Index e Instant Nutritional Assessment para evaluar el estado nutricional. Estableciendo una media de los 3 índices clasificaron los pacientes en bien nutridos (101), leve (91), moderada (94) y gravemente desnutridos (27). La desnutrición se acompañó de un aumento de frecuencia de las complicaciones postoperatorias: PY(bien nutridos 14%, leve 25%, moderada 31%*, grave 50%*), DP (bien nutridos 44%, leve 44%, moderada 60%, grave 88%*), PD (bien nutridos 17%, leve 13%, moderada 30%, grave 55%*) (*p < 0,045 vs bien nutridos). Una albúmina sérica baja también aumentó la morbilidad operatoria, y ésta se manifestó por una mayor frecuencia de infecciones y estancia en UCI. El índice de masa corporal y la pérdida de peso no contribuyeron al resultado.
Un trabajo californiano estudia específicamente la influencia de la edad ≥ 75 años en relación con pancreatectomía62. Los pacientes mayores requirieron con mayor probabilidad ingreso en UCI, tuvieron más complicaciones cardíacas y mayor compromiso nutricional y funcional. En un 48% fueron dados de alta con yeyunostomía y reingresaron malnutridos en un 17% de casos.
Manejo nutricional perioperatorio en cirugía de vía biliar y páncreas
En líneas generales, de la experiencia acumulada en los últimos decenios en el manejo perioperatorio de los pacientes con cirugía gastrointestinal extensa se desprende la conveniencia del soporte nutricional en cirugía pancreatobiliar. Trataremos de ver sin embargo en qué pacientes está indicado, en relación con su situación nutricional previa y cuál puede ser el tipo de nutrición más aconsejable.
Se han llevado a cabo pocos estudios metabólicos en pacientes con trastornos pancreáticos, y se utiliza poco tiempo en corregir la malnutrición preoperatoria63. No hay gran cantidad de publicaciones sobre el soporte nutricional en el tratamiento de las neoplasias pancreatobiliares, y las conclusiones que se extraen pueden resultar conflictivas. El campo de la pancreatitis aguda, más específico, se ve en otro capítulo de este mismo número.
Se ha comprobado que el gasto energético basal en pacientes con cáncer pancreático es un 33% mayor del normal64. En el cáncer hay trastornos del metabolismo graso y de carbohidratos, difíciles de corregir a menos que se controle el tumor63. La administración de calorías por sí sola no corrige la situación65. Sin embargo, la nutrición perioperatoria parece recomendable para prevenir complicaciones66, como la translocación bacteriana67y las infecciones68, y existe cierto consenso sobre su conveniencia69.
En nuestro país, ya en 1990 encontramos un estudio retrospectivo sobre 33 pacientes70 en relación con el uso de nutrición parenteral tras DP, comparando su uso rutinario con el de necesidad. Hubo menor morbilidad (38 vs 75%), mortalidad (0 vs 7) y estancia hospitalaria en el grupo de uso rutinario. Los autores concluían que el uso de NPT es necesario para mejorar la morbi-mortalidad y disminuir la estancia. Un trabajo posterior retrospectivo de Crucitti y cols., en Italia71 sobre 101 pacientes con resección pancreática en los que se estudiaron factores pronósticos, no pudo demostrar relación entre estado nutricional preoperatorio y resultados. Por la misma época, Di Carlo y cols.72 publican un trabajo en el que comparan 3 pautas de nutrición postoperatoria en 100 pacientes: enteral estándar, inmunonutrición enteral (enriquecida con arginina, ácidos grasos omega-3 y RNA) y parenteral. Hubo complicaciones en 40%, 33% y 59% de pacientes respectivamente. La gravedad de las complicaciones infecciosas fue significativamente mayor en el grupo de parenteral. La estancia hospitalaria fue de 17,8/16,3/19,3 días, también con diferencia estadísticamente significativa. Los autores concluían que con nutrición enteral se podía conseguir el objetivo nutricional en pacientes con duodenopancreatectomía, y que la inmunonutrición parecía mejorar los resultados.
De un modo similar, Shirabe y cols.73, en 1997, compararon tras aleatorización NE y NP en pacientes con resección hepática, sin encontrar diferencias en parámetros nutricionales (RBP, transferrina, prealbúmina, 3-metilhistidina). Pero sí las hubo en parámetros inmunológicos como el recuento linfocitario, respuesta a PHA y actividad "natural-killer". Y la incidencia de complicaciones infecciosas fue del 3% en el grupo de NE y 31% en el de NP.
Un estudio canadiense74 posterior compara mediante un modelo de pancreatectomía parcial los efectos de la nutrición yeyunal con una fórmula elemental y otra polimérica inmuno-mejorada sobre la función pancreática exocrina. Para ello se utilizó un catéter de nutrición yeyunal y un stent pancreático exteriorizado para extraer las secreciones pancreáticas en los pacientes pancreatectomizados, que fueron aleatorizados. El test de estimulación con secretina demostró reserva pancreática significativa en todos los pacientes. Hubo un ligero aumento de la secreción con ambos tipos de nutrición en comparación con el estado basal e infusión de dextrosa. Pero no hubo diferencias significativas en la secreción con ambos tipos de nutrición.
En los últimos años también se está estudiando el papel de los probióticos y simbióticos en la nutrición perioperatoria. Asumiendo que la fibra y los probióticos son efectivos en prevenir la translocación bacteriana66,75, se espera un efecto protector contra las infecciones bacterianas postoperatorias. En un ensayo prospectivo aleatorizado sobre 172 pacientes con cirugía abdominal mayor o trasplante hepático75, se estudió la incidencia de infecciones bacterianas según recibieran nutrición enteral o parenteral convencional, enteral con fibra y Lactobacillus plantarum 299 y enteral con fibra y lactobacilos inactivados por calor (placebo). La incidencia de infección bacteriana fue de 31%, 4% y 13% respectivamente, en pacientes con cirugía hepática, gástrica o pancreática. La diferencia entre el primer y segundo grupo fue significativa, como también lo fue el tiempo de tratamiento antibiótico. Un estudio japonés posterior compara la nutrición enteral estándar con la enriquecida con simbióticos en pacientes con cáncer biliar sometidos a hepatectomía76. La incidencia de complicaciones infecciosas fue de 19% (4/21) en el grupo de simbióticos y de 52% (12/23) en el control (p < 0,05).
En opinión de S. Bengmark66, hay 5 principios que se deben respetar si se quiere que la NE sea inmunoestimuladora: institución inmediata (si es posible preoperatoria), inclusión de fibra, evitar grasas saturadas, preservación de flora comensal y considerar los antioxidantes (vitamina C, glutatión…).
Las guías clínicas de la ESPEN (European Society of Parenteral and Enteral Nutrition) sobre NE en Cirugía incluyendo Trasplante de Organos77 intentan dar recomendaciones basadas en evidencia y están desarrolladas por un grupo de expertos interdisciplinario sobre estándares oficiales aceptados y se basan en las publicaciones relevantes desde 1980. Se discutieron y aceptaron en una conferencia de consenso, y se basan en la "recuperación facilitada postoperatoria" o ERAS (enhanced recovery of patients after surgery): evitar períodos prolongados de ayunas preoperatorios, reinstauración de alimentación oral temprana, integración de la nutrición en el manejo general del paciente, control metabólico, corrección de factores que exacerban el catabolismo relacionado con el estrés o que afectan a la función gastrointestinal y movilización precoz. La NE estaría indicada incluso en pacientes sin evidente desnutrición, si se prevé que no podrá comer durante más de 7 días, también si no pueden mantener una ingesta por encima del 60% de la ingesta recomendada durante más de 10 días. En estas circunstancias el soporte nutricional debería empezar sin retraso. El retraso de la cirugía por NE preoperatoria es recomendable en pacientes con riesgo nutricional grave, definido como al menos uno de los siguientes criterios: pérdida de peso > 10-15% en 6 meses, IMC < 18,5 kg/m2, grado C de evaluación global subjetiva, albúmina sérica < 30 g/l (sin evidencia de disfunción hepática o renal).
La variabilidad de protocolos nutricionales, objetivos y resultados, y el escaso número de estudios hacen inviable un meta-análisis formal sobre la nutrición perioperatoria en cirugía pancreatobiliar. Sin embargo, tomando como paradigma de intervención mayor en este campo la DP sí se puede efectuar una revisión sistemática como recientemente han hecho Goonetilleke y Siriwardena78. Para ello revisaron las bases de datos de MEDLINE y EMBASE, obteniendo 10 publicaciones que estudiaban el soporte nutricional en pacientes con PD. Obtuvieron 4 estudios sobre soporte nutricional en pacientes con DP y neoplasia, dos de ellos controlados-aleatorizados79, 80, uno prospectivo observacional81 y otro retrospectivo82. En total agrupaban 571 pacientes, 22,4% con NPT, 35,2% con NE, 12,4% con inmuno NE, y 29,9% controles. La pérdida de peso previa a la cirugía fue de 3,9-7,1%, y casi dos tercios de los pacientes presentaron ictericia preoperatoria. La duración del soporte nutricional fue de 10,5-12,7 días. No había uniformidad en la descripción de morbilidad pero la NPT se asoció a una mayor mortalidad y estancia hospitalaria. En un estudio81, la NE postoperatoria retrasó significativamente el vaciamiento gástrico en comparación con los controles.
Se estudiaron también 5 publicaciones sobre soporte nutricional en pacientes con resección de tumores gastrointestinales que incluían neoplasias pancreáticas, todas ellas estudios controlados aleatorizados83-87, 3 de ellos procedentes del mismo centro85-87. Incluían 671 pacientes, 217 (32,3%) con resección pancreática. El estudio de Heslin y cols.83, que incluía 86 pacientes con neoplasias pancreáticas y 11 de vía biliar, no encontró diferencias en morbilidad o estancia hospitalaria entre el grupo control y el tratado con inmunoEN. Daly y cols.84 comprobaron una disminución de las complicaciones infecciosas con inmunoNE en relación con NE estándar. El primer estudio de Braga y cols.85, de 1996, con 28 pancreatectomías de 60 pacientes tumorales, encontró mejoría de parámetros inmunológicos sin diferencias en complicaciones infecciosas, utilizando 3 brazos de estudio (NPT, NE, inmunoNE). En el segundo estudio86, 1999, con 22 neoplasias pancreáticas de 171 casos, hubo una reducción del 16% de complicaciones infecciosas, con menor estancia hospitalaria (inmunoNE pre- y postoperatoria, NE pre- y postoperatoria). Por último, en el estudio de 200287, con 3 brazos de estudio (pre- y post inmunoNE, pre- inmuno NE y postNE, y postop NE), hubo reducción de complicaciones infecciosas y estancia en el primer brazo del estudio. Un último estudio controlado88 comparaba la NE postoperatoria con NE cíclica, con parada de infusión de medianoche a las 6 de la mañana. El número de días hasta una dieta normal fue significativamente menor en la NE cíclica, demostrándose que ésta interfiere menos con el vaciamiento gástrico.
Los resultados generales obtenidos fueron que el porcentaje de pérdida de peso preoperatorio fue similar en todos los estudios, que la NPT postoperatoria rutinaria se asoció a mayor incidencia de complicaciones, mientras que la NE redujo las infecciosas, y que la NE cíclica se asoció a menor incidencia de retraso de vaciamiento gástrico. Las conclusiones de los autores eran que los pacientes sometidos a DP están desnutridos al intervenirse, por lo que presentan una ventana terapéutica preoperatoria, que la NPT rutinaria no es beneficiosa y que la NE postoperatoria, de administración cíclica parece ser la pauta óptima.
Un trabajo posterior no recogido en esta revisión es un ensayo aleatorizado sobre el uso de sonda de doble luz de gastroyeyunostomía en pacientes con PD89. En él se comprobó su seguridad, disminución de la estancia media y también de los gastos de hospitalización. Sobre 36 pacientes, 12 de ellos controles, hubo gastroparesia en 25% de los controles y ninguno de los pacientes con sonda de doble luz.
Encuesta sobre nutrición postoperatoria en cirugía pancreatobiliar
Se envió una sencilla encuesta con 18 preguntas en relación con hábitos en el soporte nutricional perioperatorio en cirugía pancreatobiliar y casuística, a 33 unidades en España. Contestaron 25 de ellas (ver lista en agradecimientos), siendo los resultados más apreciables los siguientes:
La mediana de cirugías pancreáticas realizadas en un año por los diferentes servicios de cirugía encuestados fue de 20 (IC 95%: 19,2-30,7), de cirugías biliares malignas fue de 12 (IC 95%: 10,28-15,99) y de cirugías biliares benignas fue 30,64 (IC 95%: 6,3-54,9).
En un 69,6% no utilizaban ningún soporte nutricional previo a la cirugía. Un 26,1% sí lo utilizaban a veces (pacientes muy desnutridos,…) y sólo un 4,3% utilizaban la nutrición preoperatoria de forma habitual.
El tiempo medio de ayuno preoperatorio era de 8,35 horas (DE: 3,89) con un rango entre 6 y 24 horas.
Respecto a la nutrición postoperatoria tras cirugía pancreática el 78,3% de los encuestados utilizaban algún tipo de soporte nutricional postoperatorio, siendo la NPT la más empleada (82,6%). Por el contrario, la nutrición enteral postoperatoria, bien mediante sonda nasoyeyunal o yeyunostomía, fue utilizada tan sólo por el 21,7% de los servicios quirúrgicos.
Similar situación encontramos en relación con el uso de soporte nutricional postoperatorio tras cirugía biliar maligna (el 52,2% de los encuestados utilizaban algún tipo de soporte nutricional postoperatorio, siendo la NPT la más empleada (81%). Por el contrario, la nutrición enteral postoperatoria, bien mediante sonda nasoyeyunal o yeyunostomía, fue utilizada tan sólo por el 20% de los servicios quirúrgicos).
Por el contrario, tras la cirugía biliar benigna sólo el 18,2% de los encuestados utilizaban algún tipo de soporte nutricional postoperatorio siendo la NPT la más empleada (50%). La nutrición enteral postoperatoria, bien mediante sonda nasoyeyunal o yeyunostomía, fue utilizada tan sólo por el 5,4% de los servicios quirúrgicos.
En la tabla I se recoge el tiempo de administración de NE y NPT en las distintas indicaciones. En la tabla II se expresa el tiempo de inicio de la tolerancia a líquidos y sólidos tras las cirugía.
Conclusiones
- Un alto porcentaje de pacientes con cirugía pancreatobiliar grave están desnutridos, por lo que se beneficiarán de soporte nutricional.
- Las alteraciones anatomo-fisiológicas derivadas de la cirugía pueden ocasionar una malabsorción, fundamentalmente de grasas. En estos casos, habrá que utilizar enzimas pancreáticas para mejorar la situación.
- Los trabajos publicados muestran un mayor número de complicaciones con el uso de NPT rutinaria en duodenopancreatectomía.
- La experiencia reciente con NE apunta a una reducción de las complicaciones infecciosas. La NE cíclica parece asociarse a menor incidencia de retraso de vaciamiento gástrico.
- En España, en este momento, la NPT es el soporte más utilizado en cirugía pancreatobiliar. La nutriciónenteral sólo se utiliza en la cuarta parte de los centros.
Agradecimientos
Queremos agradecer su colaboración a los siguientes cirujanos y centros que han contestado a la encuesta sobre nutrición perioperatoria en cirugía pancreatobiliar: A. Barrera (Hospital del Río Hortega, Valladolid), D. Casanova (Hospital Marqués de Valdecilla, Santander), E. Cugat (Hospital Mutua de Terrassa), J. Fabregat (Hospital de Bellvitge, Barcelona), D. Garrote (Hospital Virgen de las Nieves, Granada), M. A. Gómez (Hospital Virgen del Rocío, Sevilla), I. González-Pinto (Hospital Central de Asturias, Oviedo), L. Grande (Hospital del Mar, Barcelona), J. Herrera (Hospital de Navarra, Pamplona), S. López Ben (Hospital Trueta, Gerona), P. López Cillero (Hospital Reina Sofía, Córdoba), J. L. García Sabrido (Hospital Gregorio Marañón, Madrid), E. Marqués (Hospital Virgen de la Luz, Cuenca), E. Martín (Hospital de La Princesa, Madrid), J. C. Meneu (Hospital Doce de Octubre, Madrid), J. Ortiz de Urbina (Hospital de Cruces, Bilbao), F. Pardo (Clínica Universitaria de Navarra, Pamplona), F. Pereira (Hospital de Fuenlabrada, Madrid), V. Sánchez Turrión (Hospital Puerta de Hierro, Madrid), J. Santoyo (Hospital Carlos Haya, Málaga), A. Soriano (Hospital Virgen de la Candelaria, Sta. Cruz de Tenerife), E. Tejero (Hospital Clínico, Zaragoza), E. Varo (Hospital de Santiago, Santiago de Compostela), E. Vicente (Hospital Madrid Norte Sanchinarro).
Referencias
1. Thompson W, Ravdin IS, Frank IL. Effect of hypoproteinemia on wound disruption. Arch Surg 1938; 36:500-8. [ Links ]
2. Mulholland JH, Tui C, Wright AM, Vinci VJ. Nitrogen metabolism, caloric intake and weight loss in postoperative convalescence. Ann Surg 1943; 117:512-34. [ Links ]
3. Higashiguchi T, Kita T, Noguchi T, Kawarada Y, Mizumoto R. Importance of nutritional management for the treatment of carcinoma of the pancreas. Gan To Kagaku Ryoho 1988; 15:847-53. [ Links ]
4. Halliday AW, Benjamin IS, Blumgart LH. Nutritional risk factors in major hepatobiliary surgery. J Parent Enteral Nutr. 1988; 12:43-8. [ Links ]
5. Hotta T, Kobayashi Y, Taniguchi K y cols. Evaluation of postoperative nutritional state after hepatectomy for hepatocellular carcinoma. Hepatogastroenterol 2003; 50:1511-6. [ Links ]
6. Morley JE, Thomas DR, Wilson M-M G. Cachexia: pathophysiology and clinical relevance. Am J Clin Nutr 2006; 83:735-43. [ Links ]
7. Ramos EJ, Suzuki S, Marks D, Inui A, Asakawa A, Meguid MM. Cancer anorexia-cachexia syndrome: cytokine and neuropeptides. Curr Opini Clin Nutr Metab Care 2004: 7:427-34. [ Links ]
8. Inui A. Cancer anorexia-cachexia syndrome: current issues in research management. CA Cancer J Clin 2002; 52:72-91. [ Links ]
9. Andicoberry B, Padillo FJ, Gómez-Álvarez M y cols. Evaluación de la anorexia en enfermos con obstrucción de la vía biliar. Nutr Hosp 1999; 14:38-43. [ Links ]
10. Padillo FJ, Andicoberry B, Naranjo A, Miño G, Pera C, Sitges-Serra A. Anorexia and the effect of internal biliary drainage on food intake in patients with obstructive jaundice. J Am Coll Surg 2001; 192:584-90. [ Links ]
11. Padillo FJ, Andicoberry B, Muntane J y cols. Factors predicting nutritional derangements in patients with obstructive jaundice: multivariate analysis. World J Surg 2001; 25:413-8. [ Links ]
12. Clugston A, Paterson HM, Yuill K, Garden OJ, Parks RW. Nutritional risk index predicts a high-risk population in patients with obstructive jaundice. Clin Nutr 2006; 25:949-54. [ Links ]
13. Kausch W. Das Carcinom der papilla duodeni und seine radikale Entfernung. Beitr Z Clin Chir 1912; 78:439-486. [ Links ]
14. Whipple AO y cols. Treatment of carcinoma of the ampulla of Vater. Ann Surg 1935; 102:763-779. [ Links ]
15. Traverso LW, Longmire WP Jr. Preservation of the pylorus in pancreaticoduodenectomy. Surg Gynecol Obstet 1978; 146:959-62. [ Links ]
16. Ceyhan GO, Michalski CW, Demir IE, Müller MW, Friess H. Pancreatic pain. Best Pract Res Clin Gastroenterol 2008; 22: 31-44. [ Links ]
17. Behrman SW, Fowler ES. Pathophysiology of chronic pancreatitis. Surg Clin North Am 2007; 87:1309-24. [ Links ]
18. Sakorafas GH, Tsiotou AG, Peros G. Mechanisms and natural history of pain in chronic pancreatitis: a surgical perspective. J Clin Gastroenterol 2007; 41:689-99. [ Links ]
19. Puestow CB, Gillesby WJ. Retrograde surgical drainage of pancreas for chronic relapsong pancreatitis. Arch Surg 1958; 76:898-907. [ Links ]
20. Lagrot M. Pancreatico-jejunostomie après pancreatectomie distal pour lithiase du canal de Wirsung. Arch F Mal App Dig 1957; 46:487-9. [ Links ]
21. Partington PF, Rochelle REL. Modified Puestow procedure for retrograde drainage of the pancreatic duct. Ann Surg 1960; 152: 1037-43. [ Links ]
22. Thal AP. A technique for drainage of the obstructed pancreatic duct. Surgery 1962; 51:313-6. [ Links ]
23. Beger H, Krautzberger W, Gogler H. Resection de la tête du pancréas (pancréatectomie céphalique) avec conservation du duodénum dans les pancreatites chroniques, tumeurs de la tête du pancreas et decompression de la voie biliare. Chirurgie 1981; 107:597-604. [ Links ]
24. Frey CF, Smith GJ. Description and rationale of a new operation for chronic pancreatitis. Páncreas 1987; 2:701-7. [ Links ]
25. Leyva-Martínez S, Fernández-Lloret S, Martín-Ruiz JL. Massive intestinal resection. Nutritional adaptation process. Nutr Hosp 2007; 22:616-20. [ Links ]
26. MacGowan DJL, Hourihane DO, Tanner WA, O'Morain C. Duodeno-jejunal adenocarcinoma as a first presentation of celiac disease. J Clin Pathol 1996; 49:602-604. [ Links ]
27. Gebrayel N, Conlon K, Shike M. Coeliac disease diagnosed after pancreaticoduodenectomy. Eur J Surg 2000; 166:742-3. [ Links ]
28. Stone CD, Klein S, McDoniel K, Davidson NO, Prakash C, Strasberg SM. Celiac disease unmasked after pancreaticoduodenectomy. J Parent Enteral Nutr. 2005; 29:270-1. [ Links ]
29. Maple JT, Pearson RK, Murray JA, Kelly DG, Lara F, Fan AC. Silent celiac disease activated by pancreaticoduodenectomy. Dig Dis Sci 2007; 52:2140-4. [ Links ]
30. Nordback I, Parviainen M, Piironen A, Räty S, Sand J. Obstructed pancreaticojejunostomy partly explains exocrine insufficiency after pancreatic head resections. Scand J Gastroenterol 2007; 42:263-70. [ Links ]
31. Miura F, Takada T, Amano H y cols. Repeated pancreatectomy after pancreatoduodenectomy. J Gastrointest Surg 2007; 11: 179-86. [ Links ]
32. Rault A, SaCunhaA, Klopfenstein D y cols. Pancreaticojejunal anastomosis is preferable to pancreaticogastrostomy after pancreaticoduodenectomy for longterm outcomes of pancreatic exocrine function. J Am Coll Surg 2005; 201:239-44. [ Links ]
33. Fang WL, Su CH, Shyr YM y cols. functional and morphological changes in pancreatic remnant after pancreaticoduodenectomy. Páncreas 2007; 35:361-5. [ Links ]
34. Crucitti F, Doglietto G, Bellantone R y cols. Digestive and nutritional consequences of pancreatic resections. The classical vs the pylorus-sparing procedure. Int J Pancreatol 1995; 17:37-45. [ Links ]
35. Bühler L, Schmidlin F, De Perrot M, Borst F, Mentha G, Morel P. Long-term results after surgical management of chronic pancreatitis. Hepatogastroenterol 1999; 46:1986-9. [ Links ]
36. Sakorafas GH, Farnell MB, Farley DR, Rowland CM, Sarr MG. Long-term results after surgery for chronic pancreatitis. Int J Pancreatol 2000; 27:131-42. [ Links ]
37. Chen HM, Jan YY, Chao TC, Hwang TL, Chen MF. Pancreatoduodenectomy for chronic pancreatitis with an inflammatory mass of pancreatic head: preoperative and postoperative functional assessment. Hepatogastroenterol 2003: 50:2213-7. [ Links ]
38. Izbicki JR, Bloechle C, Knoefel WT, Kuechler T, Binmoeller KF, Broelsch CE. Duodenum-preserving resection of the head of the pancreas in chronic pancreatitis. A prospective, randomized trial. Ann Surg 1995; 221:350-8. [ Links ]
39. Strate T, Taherpour Z, Bloechle C y cols. Long-term follow-up of a randomized trial comparing the Beger and Frey procedures for patients suffering from chronic pancreatitis. Ann Surg 2005; 241:591-8. [ Links ]
40. Frey CF, Mayer KL. Comparison of local resection of the head of the pancreas combined with longitudinal pancreaticojejunostomy (Frey procedure) and duodenum-preserving resection of the pancreatic head (Beger procedure). World J Surg 2003; 27:1217-30. [ Links ]
41. Müller MW, Friess H, Martin DJ, Hinz U, Dahmen R, Büchler MW. Long-term follow-up of a randomized clinical trial comparing Beger with pylorus-preserving Whipple procedure for chronic pancreatitis. Br J Surg 2007; Oct 12. [ Links ]
42. McLeod RS, Taylor BR, O'Connor BI y cols. Quality of life, nutritional status, and gastrointestinal hormone profile following the Whipple procedure. Am J Surg 1995; 169:179-85. [ Links ]
43. Melvin WS, Buckers KS, Muscarella P y cols. Outcome analysis of long-term survivors following pancreaticoduodenectomy. J Gastrointest Surg 1998; 2:72-8. [ Links ]
44. Wenger FA, Jacobi CA, Haubold K y cols. Gastrointestinal quality of life after duodenospancreatectomy in pancreatic cancer. Preliminary results of a prospective-randomized trial: PD vs PPPD. Chirurg 1999; 70:1454-9. [ Links ]
45. Huang JJ, Yeo CJ, Sohn TA y cols. Quality of life and outcomes after pancreaticoduodenectomy. Ann Surg 2000; 231:890-8. [ Links ]
46. Nguyen TC, Sohn TA, Cameron JL y cols. Standard vs radical pancreaticoduodenectomy for periampullary adenocarcinoma: a prospective, randomized trial evaluating quality of life in pancreaticoduodenectomy survivors. J Gastrointest Surg 2003; 7:1-11. [ Links ]
47. Maskell C, Daniels P, Johnson CD. Dietary intake after pancreatectomy. Br J Surg 1999; 86:323-6. [ Links ]
48. Ghaneh P, Neoptolemos JP. Pancreatic exocrine insufficiency following pancreatic resection. Digestion 1999; 60(Supl. 1): 104-10. [ Links ]
49. Bini L, Fantini L, Pezzilli R y cols. Medical therapy of malabsorption in patients with head pancreatic resection. JOP 2007; 8:151-5. [ Links ]
50. Van Hoozen CM, Peeke PG, Taubeneck M, Frey CF, Halsted CH. Efficacy of enzyme supplementation after surgery for chronic pancreatitis. Páncreas 1997; 14:174-80. [ Links ]
51. Neoptolemos JP, Ghaneh P, Andren-Sandberg A y cols. Treatment of pancreatic exocrine insufficiency after pancreatic resection. Results of a randomized, doubleblind, placebo-controlled, crossover study of high vs standard dose pancreatin. Int J Pancreatol 1999; 25:171-80. [ Links ]
52. Casellas F, Guarner L, Vaquero E, Antolín M, De Gracia X, Malagelada JR. Hydrogen breath test with glucose in exocrine pancreatic insufficiency. Páncreas 1998; 16:481-6. [ Links ]
53. Trespi E, Ferrieri A. Intestinal bacterial overgrowth during chronic pancreatitis. Curr Med Res Opin 1999; 15:47-52. [ Links ]
54. Eddes EH, Masclee AA, Gielkens HA y cols. Cholecystokinin secretion in patients with chronic pancreatitis and after different types of pancreatic surgery. Pancreas 1999; 19:119-25. [ Links ]
55. Eddes EH, Verkijk M, Gielkens HA y cols. Pancreatic polypeptide secretion in patients with chronic pancreatitis and after pancreatic surgery. Int J Pancreatol 2001; 29:173-80. [ Links ]
56. De Castro SM, Busch OR, Gouma DJ. Management of bleeding and leakage after pancreatic surgery. Best Pract Res Clin Gastroenterol 2004; 18:847-64. [ Links ]
57. Sierzega M, Niekowal B, Kulig J, Popiela T. Nutritional status affects the rate of pancreatic fistula after distal pancreatectomy: a multivariate analysis of 132 patients. J Am Coll Surg 2007; 205:52-9. [ Links ]
58. Pannegeon V, Pessaux P, Sauvanet A, Vullierme MP, Kianmanesh R, Belghiti J. Pancreatic fistula after distal pancreatectomy: predictive risk factors and value of conservative treatment. Arch Surg 2006; 141:1071-6. [ Links ]
59. Sledzianowski JF, Duffas JP, Muscari F, Suc B, Fourtanier F. Risk factors for mortality and intra-abdominal morbidity after distal pancreatectomy. Surgery 2005; 137:180-5. [ Links ]
60. Schnelldorfer T, Mauldin PD, Lewin DN, Adams DB. Distal pancreatectomy for chronic pancreatitis: risk factors for postoperative pancreatic fistula. J Gastrointest Surg 2007; 11:991-7. [ Links ]
61. Schnelldorfer T, Adams DB. The effect of malnutrition on morbidity after surgery for chronic pancreatitis. Am Surg 2005; 71: 466-72. [ Links ]
62. Lightner AM, Glasgow RE, Jordan TH y cols. Pancreatic resection in the elderly. J Am Coll Surg 2004; 198:697-706. [ Links ]
63. Cooperman AM, Chivati J, Chamberlain RS. Nutritional and metabolic aspects of pancreatic cancer. Cuu Opin Clin Nutr Metab Care 2000; 3:17-21. [ Links ]
64. Falconer JS, Fearon KCH, Plester CE, Ross JA, Carter DC. Cytokines, the acute-phase response, and resting energy expenditure in cachectic patients with pancreatic cancer. Ann Surg 1994; 219:325-31. [ Links ]
65. Herber D, Byerly LO, Chi J y cols. Pathophysiology of malnutrition in the adult cancer patient. Cáncer 1986; 55:1867-73. [ Links ]
66. Bengmark S. Enteral nutrition in HPB surgery: past and future. J Hepatobiliary Pancreat Surg 2002; 9:448-58. [ Links ]
67. Carr CS, Ling KD, Boulos P, Singer M. Randomised trial of safety and efficacy of immediate postoperative enteral feeding in patients undergoing gastrointestinal resection. BMJ 1996; 312:869-71. [ Links ]
68. Beier-Holgersen R, Boesby S. Influence of postoperative enteral nutrition on postsurgical infections. Gut 1996; 39:833-5. [ Links ]
69. Windsor A, Braga M, Martindale R y cols. Fit for surgery: an expert panel review on optimising patients prior to surgery, with a particular focus on nutrition. Surgeon 2004; 2:315-9. [ Links ]
70. Capellá G, Hidalgo LA, Cardona D, Ruiz JM, Garriga J. Nutritional status and cephalic duodenopancreatectomy in neoplasm treatment. Rev Esp Enferm Dig 1990; 77:341-4. [ Links ]
71. Crucitti F, Doglietto GB, Viola G y cols. Assessment of risk factores for pancreatic resection in cancer. World J Surg 1998, 22:241-7. [ Links ]
72. DiCarlo V, Gianotti L, Balzano G, Zerbi A, Braga M. Complications of pancreatic surgery and the role of perioperative nutrition. Dig Surg 1999; 16:320-6. [ Links ]
73. Shirabe K, Matsumata T, Shimada M y cols. A comparison of parenteral hyperalimentation and early enteral feeding regarding systemic immunity after major hepatic resection- the result of a randomized prospective study. Hepato-gastroenterol 1997; 44:205-9. [ Links ]
74. Duerksen DR, Bector S, Paarry D, Yaffe C, Vajcner A, Lipschitz J. A comparison of the effect of elemental and immuneenhancing polymeric jejuna feeding on exocrine pancreatic function. J Parent Enteral Nutr. 2002; 26:205-8. [ Links ]
75. Reyes N, Seehofer D, Müller AR, Hansen S, Bengmark S, Neuhaus P. Influence of probiotics and fibre on the incidence of bacterial infections following major abdominal surgery- results of a prospective trial. Z Gastroenterol 2002; 40:869-76. [ Links ]
76. Kanazawa H, Nagino M, Kamiya S y cols. Synbiotics reduce postoperative infectious complications: a randomized controlled trial in biliary cancer patients undergoing hepatectomy. Langenbecks Arch Surg 2005; 390:104-13. [ Links ]
77. Weimann A, Braga M, Harsanyi L y cols. ESPEN guidelines on enteral nutrition: surgery including organ transplantation. Clinical Nutrition 2006; 25:224-44. [ Links ]
78. Goonetilleke KS, Siriwardena AK. Systematic review of perioperative nutritional supplementation in patients undergoing pancreaticoduodenectomy. JOP J Pancreas 2006; 7:5-13. [ Links ]
79. Brennan MF, Pisters PW, Posner M, Quesada O, Shike M. A prospective randomized trial of total parenteral nutrition after major pancreatic resection for malignancy. Ann Surg 1994; 220:436-44. [ Links ]
80. Gianotti L, Braga M, Gentilini O, Balzano G, Zerbi A, Di Carlo V. Artificial nutrition after pancreaticoduodenectomy. Pancreas 2000; 21:344-51. [ Links ]
81. Martignoni ME, Friess H, Sell F y cols. Enteral nutrition prolongs delayed gastric emptying in patients after Whipple resection. Am J Surg 2000; 180:18-23. [ Links ]
82. Baradi H, Walsh RM, Henderson JM, Vogt D, Popovich M. Postoperative jejunal feeding and outcome of pancreaticoduodenectomy. J Gastrointest Surg 2004; 8:428-33. [ Links ]
83. Heslin MJ, Latkany L, Leung D y cols. A prospective randomized trial of early enteral feeding after resection of upper gastrointestinal malignancy. Ann Surg 1997; 226:567-80. [ Links ]
84. Daly JM, Weintraub FN, Shou J, Rosato EF, Lucia M. Enteral nutrition during multimodality therapy in upper gastrointestinal cancer patients. Ann Surg 1995; 221:327-38. [ Links ]
85. Braga M, Vignali A, Gianotti L, Cestari A, Profili M, Di Carlo V. Immune and nutritional effects of early enetral nutrition after major abdominal operations. Eur J Surg 1996; 162:105-12. [ Links ]
86. Braga M, Gianotti L, Radaelli G y cols. Perioperative immunonutrition in patients undergoing cancer surgery. Arch Surg 1999; 134:428-33. [ Links ]
87. Braga M, Gianotti L, Nespoli L, Radaelli G, Di Carlo V. Nutritional approach in malnourished surgical patients. Arch Surg 2002; 137:174-80. [ Links ]
88. Van Berge Henegouwen MI, Akkermans LM, Van Gulik TM y cols. Prospective randomized trial on the effect of cyclic versus continuous enteral nutrition on postoperative gastric function after pylorus-preserving pancreaticoduodenectomy. Ann Surg 1997; 226:677-87. [ Links ]
89. Mack LA, Kaklamanos IG, Livingstone AS y cols. Gastric decompression and enteral feeding through a doublen-lumen gastrojejunostomy tube improves outcomes after pancreaticoduodenectomy. Ann Surg 2004; 240:845-51. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
C. Loinaz Segurola.
Fundación Hospital Alcorcón.
Madrid. España.
Recibido: 10-I-2008.
Aceptado: 15-II-2008.