Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.30 no.3 Cantabria 2010
Prevalencia de enfermedad cardiovascular en la uremia y relevancia de los factores de riesgo cardiovascular
Prevalence of cardiovascular disease in uraemia and relevance of cardiovascular risk factors
Silvia Collado Nieto1, E. Coll2, R. Deulofeu3, L. Guerrero3, M. Pons4, J.M. Cruzado5, B. de la Torre6, M. Vera7, M. Azqueta8, C. Nicolau9, A. Cases7
1Servicio de Nefrología. Hospital del Mar. Barcelona (España)
2Servicio de Nefrología. Fundació Puigvert. Barcelona (España)
3CDB. Hospital Clínic. Barcelona (España)
4CETIRSA. Barcelona (España)
5Instituto de Hemodiálisis. Barcelona (España)
6C.D. Bonanova. Barcelona (España)
7Servicio de Nefrología. Hospital Clinic Barcelona. Barcelona (España)
8Servicio de Cardiología. Hospital Clinic Barcelona. Barcelona (España)
9CDI. Hospital Clínic de Barcelona. Barcelona (España)
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la prevalencia de ECV y su asociación con FRCV clásicos y nuevos, así como el control de los mismos en pacientes con IRCT en programa de HD.
Pacientes y métodos: Se incluyeron 265 enfermos prevalentes con IRCT en HD de un hospital universitario y cuatro centros de diálisis. Estudio multicéntrico y transversal que analizó la prevalencia de ECV y su posible asociación con FRCV clásicos y nuevos. Se analizaron parámetros bioquímicos y hematológicos habituales, así como niveles de homocisteína, troponina-I, BNP, Lp(a), PCR,IL-6, fibrinógeno, ADMA, AOPP, malondialdehído, adiponectina, osteoprotegerina y fetuína. En un subgrupo de enfermos también se realizaron ecocardiografía y ecografía Doppler carotídea.
Resultados: La prevalencia de ECV fue del 52,8%. Los factores asociados positivamente a ECV prevalente fueron la edad, el índice de masa corporal, los antecedentes de HVI, la HTA, la dislipemia y la diabetes mellitus, el tiempo en diálisis, el índice de comorbilidad de Charlson, los niveles elevados de fibrinógeno, la osteoprotegerina, el BNP y la PCR, así como el grosor del complejo íntima-media carotídeo, la masa ventricular izquierda o la presión de pulso. Se asociaron negativamente: los antecedentes de trasplante previo, la fracción de eyección cardíaca y los niveles de cLDL ofósforo. En el análisis multivariante, los factores asociados con ECV fueron la dislipemia, la presencia de HVI, la edad y los nivelesde cLDL (negativamente).
Conclusiones: En los pacientes con IRCT en HD, la prevalencia de ECV es elevada y se asocia con la presencia de FRCV clásicos y ECV subclínica.
Palabras clave: Insuficiencia renal crónica terminal, Enfermedad cardiovascular, Factores de riesgo cardiovascular.
ABSTRACT
Aim: To evaluate the prevalence of cardiovascular disease (CVD) and its association with cardiovascular risk factors, as well as their control in end-stage renal disease (ESRD) patients under maintenance hemodialysis (HD).
Patients and methods: A total of 265 patients with ESRD on maintenance HD from a University Hospital and 4 dialysis units were included in this multicenter and cross-sectional study that analyzed the prevalence of CVD and the possible association with classic and new cardiovascular risk factors. Usual biochemical and haemathological parameters were analyzed, as well as plasma levels of homocysteine, troponin-I, BNP, lipoprotein(a), C reactive protein, IL-6, fibrinogen, asymmetrical dimethylarginine (ADMA), advanced oxidation protein products (AOPP), malondialdehyde, adiponectin, osteoprotegerin, and fetuin. In a subset of patients an echocardiography and carotid artery Doppler echography were also performed.
Results: The prevalence of CVD was 52.8%. Factors positively associated with prevalent CVD were age, BMI, left ventricular hypertrophy, hypertension, dyslipidemia and diabetes mellitus, dialysis vintage, Charlson's comorbility index, levels of fibrinogen, osteoprotegerin, BNP and CRP, as well as carotid intima-media thickness, left ventricular mass and pulse pressure. Factors negatively associated with prevalent CVD were: previous renal transplant, ejection fraction or levels of LDL-c and phosphorous. In the multivariate analysis dyslipidemia, left ventricular hypertrophy, age and LDL-c (negatively) were associated with CVD.
Conclusions: In HD patients the prevalence of CVD is high and is associated with the presence of cardiovascular risk factors and subclinical CVD.
Key words: End-stage renal disease, Cardiovascular disease, Cardiovascular risk factors.
Introducción
La patología cardiovascular (CV) representa la principal causa de muerte en los pacientes en hemodiálisis (HD) (cerca de la mitad del total de muertes)1-4 y alrededor de un 30% de las causas de hospitalización5. La tasa de mortalidad CV en estos pacientes es entre 10 y 20 veces superior a la de la población general1.
La mayor prevalencia de enfermedad CV (ECV) y de FRCV clásicos (Framingham) en los pacientes urémicos, tales como hipertensión arterial (HTA), diabetes, tabaquismo, hiperlipemia, sedentarismo o hipertrofia ventricular izquierda (HVI), no explican totalmente el aumento de mortalidad CV en estos pacientes5,6. De hecho, diferentes estudios han demostrado que el score de Framingham infraestima el riesgo CV en los pacientes renales7,8. Por otro lado, la utilización de fármacos que han demostrado reducir el riesgo CV en la población general, como las estatínas o los inhibidores del sistema renina-angiotensina- aldosterona (SRAA), no han evidenciado su eficacia en estos pacientes9,10 y además están infrautilizados en los mismos.
Se ha postulado que FRCV nuevos o propios de la uremia también estarían involucrados en el desarrollo de la aterosclerosis acelerada y arteriosclerosis que presentan estos pacientes11. Asimismo, el posible papel contribuyente de la técnica de dialisis12 en el elevado riesgo CV que presentan estos pacientes esta aun por definir. La prevalencia de FRCV nuevos o no tradicionales (hiperhomocisteinemia, lipoproteina[a] (Lp[a]), hiperfibrinogenemia, inflamación, estrés oxidativo13,14) también es muy elevada en estos pacientes; asimismo, las situaciones propias de la insuficiencia renal crónica terminal (IRCT) (enfermedad óseo-mineral, calcificación valvular, hipervolemia, anemia, malnutrición, etc.) también pueden contribuir a la elevada morbimortalidad CV en estospacientes10,15-19.
El objetivo del presente estudio fue estudiar la prevalencia de ECV y los FRCV asociados a la misma en una muestra de pacientes con IRCT en tratamiento sustitutivo renal con HD.
Pacientes y métodos
Diseño
Se realizó un estudio multicéntrico y transversal, en el que se incluyeron 265 pacientes adultos afectados de IRCT en programa de HD, durante al menos 6 meses, clínicamente estables y sin evidencia de insuficiencia cardiaca clínica en el momento de la inclusión (definida como disnea mas dos de las siguientes condiciones: aumento de la presión venosa yugular, crepitantes bibasales, hipertensión venosa pulmonar, edema intersticial que requiera ingreso, ultrafiltración extra o una fracción de eyección <35%), de ambos sexos, con una edad superior a 18 años y que aceptaron participar en el estudio. A todos los pacientes se les solicitó su consentimiento informado por escrito y el estudio fue aprobado por el Comité Ético del Hospital Clinic.
Métodos
Se recogieron las características demográficas (edad, sexo, tiempo en diálisis) y la presencia de ECV de origen cardiaco, definida por la existencia de enfermedad coronaria de origen isquémico, enfermedad valvular, antecedentes de episodios de insuficiencia cardiaca o arritmia, presencia de ECV de origen no cardiaco: cerebral (accidente vascular cerebral o accidente isquémico transitorio) o periférica (vasculopatia periférica enl as extremidades inferiores, amputación por isquemia, isquemia intestinal, etc.), presencia de diabetes, historia de HTA, dislipemia, tabaquismo y características de la HD (membranas celulosicas o sintéticas, tipo de acceso vascular, dosis de diálisis).
La medición de la presión arterial (PA) se realizó antes de cada una de las tres sesiones de HD de la semana de evaluación, después de 10 minutos de reposo en decúbito supino. Las extracciones de sangre se realizaron antes de la segunda o la tercera sesión de HD de la semana, tras 20-30 minutos en reposo en decúbito supino. Se realizaron las determinaciones propias del seguimiento clínico de estos pacientes (nitrógeno ureico en sangre [BUN], calcio, fósforo, albúmina, PTHi, hemoglobina, ferritina, proteína C reactiva [PCR], Kt/V), y como analíticas especiales se incluyeron: lipoproteína(a), homocisteína, dimetilarginina asimétrica (ADMA), productos avanzados de oxidación proteica (AOPP), malondialdehído (MDA), troponina-I, péptido natriurético cerebral (BNP), osteoprotegerina, fetuína y adiponectina. A un subgrupo de 120 pacientes no seleccionados también se les realizó un ecocardiograma, y en 87 se llevó a cabo una ecografía Doppler de troncos supraaórticos.
El ecocardiograma midió los tamaños telediastólico y telesistólicode los ventrículos para calcular la fracción de eyección, el grosor parietal para calcular la masa ventricular izquierda según el método de la Convención de Penn y se normalizo por la superficie corporal.
La ecografía Doppler de troncos supraaórticos evaluó la carótida primitiva, la bifurcación carotídea y el origen de la interna bilateral; asimismo, se midió el grosor del complejo íntima carotídeo prebifurcación, se obtuvieron cuatro mediciones y se calculó la media. Se tomo como valor de normalidad uno <0,9 mm, según los criterios de la Guía Europea de Hipertensión Arterial de la ESC-ESH del ano 200720.
La homocisteína se determinó por inmunoensayo en un autoanalizador Advia-Centaur (Siemens España, Barcelona), utilizando reactivos del mismo fabricante. Por su parte, la PCR fue cuantificada por nefelometría (BNII Siemens España, Barcelona), y la troponina I, mediante inmunoensayo de quimioluminiscencia (TnI Ultra, Siemens España, Barcelona) en un autoanalizador Advia Centaur (Siemens). Los niveles de BNP se determinaron también mediante inmunoensayo de quimioluminiscencia (BNP, Siemens España, Barcelona) en un autoanalizador Advia Centaur (Siemens). La lipoproteina(a) se determinó por inmunoturbidimetría (Dia-Sorin, Barcelona, España), y los niveles de ADMA, mediante HPLC. Los niveles de adiponectina se determinaron mediante radioinmunoensayo (Linco Research Inc., St. Charles,MO, EE.UU.), y los niveles de AOPP, mediante una técnica colorimetrica21. Los niveles de osteoprotegerina se establecieron mediante ELISA (Biomedica Medizinprodukte GmbH, Viena, Austria), y los niveles de fetuína, mediante un kit de ELISA suministrado por Epitope Diagnostics (Epitope Diagnostics, San Diego, California, EE.UU.).
Análisis estadístico
Para el análisis estadístico se utilizó el programa SPSS.15.0. Los datos se expresan como media ± DE. La comparación entre pacientes con y sin ECV se analizó mediante un test de la t de Student para datos no apareados en variables cuantitativas continuas o el test de la Ji cuadrado en variables cualitativas.
Si las variables cuantitativas no mostraban una distribución normal, se analizaron mediante la U de Mann-Whitney. Se consideró significativa una p <0,05.
Resultados
En la muestra de 265 pacientes, el 68,3% eran varones, la edad media era de 60,7 ± 16,17 años y el tiempo medio en programa de HD era de 60,85 ± 72,5 meses. El índice de comorbilidad de Charlson medio fue de 5,67 ± 2,47 puntos y el 25,66% de los pacientes tenían antecedentes de un trasplante renal previo.
Las etiologías más frecuentes de la insuficiencia renal fueron la vascular y la diabética, con un 17,7% de los casos cada una, seguidas de glomerulopatías en el 17,4%, causa no filiada en el 16,2%, poliquistosis renal en el 12,8%, nefropatía intersticial crónica en el 9,4% y otras en el 8,7% de los casos.
La prevalencia de ECV fue del 52,8%. El 44,9% de los pacientes presentaban patología cardíaca, y el 25,3%, enfermedad vascular no cardiaca (enfermedad cerebrovascular o vasculopatía periférica), como se muestra en la tabla 1. Al analizar la presencia de FRCV clásicos, el tabaquismo (activo y ex fumadores) estaba presente en el 41,5% de los casos (16,6 y 24,9%, respectivamente). El 26,8% de los pacientes tenían antecedentes de diabetes mellitus, y el 35,8%, de dislipemia. Cabe destacar la elevada prevalencia de HTA en el 86,8% de los sujetos. Cuando se analizo la PA media semanal prediálisis, el 31,4% presentaba PA sistólica >140 mmHg, y el 3,8%, PA diastólica >90 mmHg. La presión de pulso fue >60 mmHg en el 42,3% de los casos. El 19,9% de los pacientes recibían tratamiento con inhibidores de la enzima conversiva de angiotensina (IECA) o con antagonistas de los receptores de la angiotensina II (ARA II), y el mismo porcentaje, tratamiento betabloqueante. En el subgrupo de pacientes con enfermedad coronaria, el tratamiento con IECA/ARA II fue del 13,7%, y el de betabloqueantes, del 35,3%. De la población global, el 26,8% recibía tratamiento antiagregante, y el 6,9%, tratamiento anticoagulante. De los que padecían enfermedad coronaria, recibía tratamiento antiagregante el 41,4% y anticoagulante el 10%. Entre los pacientes diabéticos, recibía tratamiento antiagregante el 38%y anticoagulante el 7%.
Tabla 1. Distribución de la patología cardiovascular prevalente en la población 
Dentro de los factores de riesgo clásicos (tabla 2), presentaba niveles de colesterol elevados (>200 mg/dl) el 12,9%, cLDL >100 mg/dl el 29,5%, cHDL <40 mg/dl el 43,5% yTG >150 mg/dl el 30,5%. Recibían tratamiento con estatinas el 24,1% de los pacientes, pero entre los que presentaban cLDL >100 mg/dl, únicamente lo recibían el 33,8%. En pacientes con diabetes mellitus y cLDL >100 mg/dl, recibían estatinas solo un 38,4%, y en aquellos con historia de ECV prevalente y cLDL >100 mg/dl, las recibían el 57,69%. La presencia de niveles elevados de los nuevos FRCV también era frecuente entre los pacientes, tal y como se detalla en la tabla 2. Los marcadores inflamatorios y de malnutrición, como la PCR (>0,8 mg/dl), se encontraban elevados en el 40,7% de los pacientes, IL-6 (>5 pg/ml) en el 82,3%, albumina (<40 g/l) en el 39,1%, fibrinogeno (>4,5 g/l) en el 43%, lipoproteina(a) (>30 mg/dl) en el 36%, troponina-I (>0,1 ng/ml) en el 6,3% y homocisteina (>15 mmol/l) en el 89,4%. El 23,2% presentaba niveles de hemoglobina <11 g/l y el 30,9% un producto Ca x P superiora 55 mg2/dl2, con niveles de calcio y fósforo elevados en el 34,6 y el 65,6%, respectivamente, según criterios de las guías K/DOQI.
Tabla 2. Factores de riesgo cardiovascular clásicos y no tradicionales en la población de estudio 
HTA: hipertensión arterial; HVI: hipertrofia ventricular izquierda; PCR: proteína C reactiva.
Al valorar la prevalencia de ECV subclínica, observamos que el 74% de los pacientes con ecocardiograma presentaban HVI, y el 7,6%, una fracción de eyección <40%. De los pacientes con eco-Doppler carotídeo, el 25,3% presentaba un aumento del grosor íntima-media carotídeo (>0,9 mm).
En el análisis univariante, los factores que se asociaron a ECV prevalente, tal y como se muestra en las tabla 3 y tabla 4, fueron la edad, el índice de masa corporal, los antecedentes de HTA, la dislipemia y la diabetes mellitus, el tiempo previo en programa de HD, el índice de comorbilidad de Charlson, los niveles elevados de fibrinógeno y el BNP, el grosor del complejo intima media carotídeo, la masa ventricular izquierda y la presión de pulso. Se asociaron negativamente a la prevalencia de ECV: los antecedentes de trasplante renal previo, la fracción de eyección cardíaca y los niveles menores de cLDL y fósforo.
Tabla 3. Comparación entre pacientes con y sin enfermedad cardiovascular prevalente 
ECV: enfermedad cardiovascular; HD: hemodiálisis; IMC: índice de masa corporal;
PAS: presión arterial sistólica; PAD: presión arterial diastólica;
PAM: presión arterial media; PP: presión del pulso; HTA: hipertensión arterial;
HVI: hipertrofia ventricular izquierda; CIM: complejo íntima-media.
Tabla 4. Comparación de parámetros analíticos entre pacientes con y sin enfermedad cardiovascular prevalente 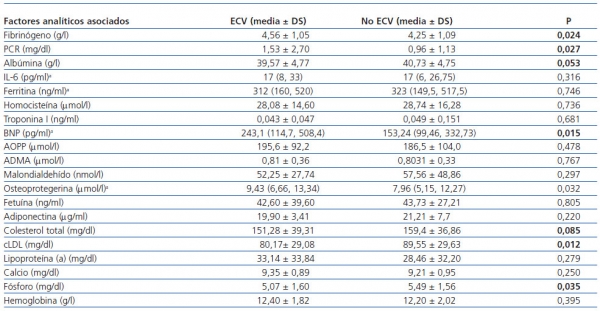
a En variables de distribución no normal, se ha realizado una prueba no paramétrica para muestras
independientes (U de Mann-Whitney).
ECV: enfermedad cardiovascular; PCR: proteína C reactiva; BNP: péptido natriurético cerebral;
AOPP: productos avanzados de oxidación proteica;
ADMA: dimetilarginina asimétrica.
En el análisis multivariante, los factores asociados con ECV prevalente fueron la edad, la dislipemia, la HVI y negativamente los niveles de cLDL, como se muestra en la tabla 5. En el análisis de curvas ROC, estos factores predecían la prevalencia de ECV con un valor de 0,736 (IC 95%: 0,675-0,797). (figura 1).

Figura 1. Análisis de curvas ROC.
Tabla 5. Factores asociados en el análisis multivariante 
Discusión
De los resultados del presente estudio, realizado en una población prevalente de pacientes con IRC en HD, destaca la elevada prevalencia de ECV, que no difiere mucho de otras series similares, lo que confirma este aspecto. Ello explicaría, en parte, la elevada incidencia de patología cardiovascular fatal y no fatal en estos pacientes. Asimismo, la prevalencia de ECV subclínica (HVI o aumento del grosor del complejo íntima-media carotídeo), así como de FRCV clásicos y nuevos también es alta en esta población no seleccionada de pacientes en HD.
El elevado riesgo cardiovascular que presentan los pacientes en HD es muy superior al de la población general, e incluso al de otros grupos reconocidos de pacientes de alto riesgo cardiovascular (p. ej., diabéticos o hipertensos). Ello es en parte explicable por la alta prevalencia de ECV, tanto clínica como subclínica. En el análisis univariante, los factores asociados con la presencia de ECV prevalente fueron la edad, la presencia de ECV subclínica o de FRCV clásicos, los marcadores de inflamación-malnutricion o los marcadores de enfermedad cardíaca, como BNP. En el análisis multivariante, solo mantenían el valor predictivo algunos FRCV clásicos y la HVI.
La aparente discrepancia entre el valor predictivo de la dislipemia y de niveles más bajos de cLDL puede explicarse por varios motivos. La historia clínica de dislipemia incluía la hipercolesterolemia, pero también niveles bajos de cLDL o hipertrigliceridemia (estos dos últimos son más frecuentes en los pacientes renales); por otra parte, los pacientes con ECV recibían más frecuentemente estatinas y, finalmente, niveles bajos de cLDL pueden asociarse con inflamación-malnutrición (otro FRCV reconocido en esta población). Estos datos refuerzan el papel predictivo de los FRCV clásicos en la predicción de ECV en pacientes en HD. Un hallazgo interesante en el análisis univariado fue que los pacientes con ECV presentaban niveles significativamente mayores de osteoprotegerina. En los últimos años hay un interés creciente por el posible papel de las alteraciones del metabolismo mineral, de sus marcadores (p. ej., osteoprotegerina, fetuína o FGF-23) o de las calcificaciones vasculares en la morbimortalidad cardiovascular en los pacientes en HD. Así, en recientes estudios se ha descrito una relación entre niveles elevados de osteoprotegerina y calcificaciones vasculares o mortalidad en estos pacientes22. Aunque en el análisis multivariante el papel predictivo de la OPG se perdía, nuestros resultados añaden la asociación entre este marcador y la ECV prevalente en estos pacientes.
Otro aspecto a destacar de nuestro estudio es que el grado de control de los FRCV en nuestros pacientes y el uso de tratamientos que han demostrado un efecto protector CV en la población no urémica (inhibidores del SRAA, estatinas, antiagregantes) es bajo en nuestra población, incluso entre pacientes diabéticos o con ECV, de manera similar a lo que se ha descrito en la literatura23. Este bajo control de FRCV y un cierto "nihilismo terapéutico" observado en nuestra serie y otras también podrían contribuir a la elevada morbimortalidad en los pacientes en HD. Ello puede ser debido, en parte, a que estos pacientes están polimedicados, lo que dificulta el cumplimiento terapéutico y facilita la inercia terapéutica, además de las escasas evidencias de los efectos beneficiosos de los tratamientos antes mencionados en la reducción del riesgo de eventos en los pacientes en HD9,10,24.
En conclusión, la prevalencia de ECV clínica y subclínica es muy elevada en nuestra población de pacientes en HD. Asimismo, la prevalencia de FRCV clásicos y nuevos también es alta. Los factores predictores de ECV clínica en nuestra población fueron la edad y la presencia de ECV subclínica (HVI) y FRCV clásicos. Además, el control de los FRCV y el uso de medicaciones cardioprotectoras en esta población general no es el adecuado, según recomendaciones de las distintas guías de práctica clínica en estos pacientes. Se precisa un esfuerzo para tratar precoz (en la etapa prediálisis) y agresivamente los FRCV en estos pacientes para intentar reducir su elevada morbimortalidad CV.
Referencias bibliográficas
1. Levey AS, Beto JA, Coronado BE, Eknoyan G, Foley RN, Kasiske BL, et al. Controlling the epidemic of cardiovascular disease in chronic renal disease: what do we know? What do we need to learn, Where do we go from here? Am J Kidney Dis 1998;32:853-906. [ Links ]
2. Rostand SG, Brunzell JD, Cannon RD, Victor RG. Cardiovascular complications in renal failure. J Am Soc Nephrol 1991;2:1053-62. [ Links ]
3. Parfrey PS, Harnett JD. Long-term cardiac morbidity and mortality during dialysis therapy. Adv Nephrol 1994;23:311-31. [ Links ]
4. USRDS US Renal Data System 1999. Annual Data Report. The National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases. Bethesda, MD. www.usrds.org/adr_1999.htm [ Links ]
5. Sarnak MJ, Levey AS. Epidemiology of cardiac disease in dialysis patients. Semin Dial 1999;12:69-76. [ Links ]
6. Zoccali C. Cardiovascular risk in uraemic patients-is it fully explained by classical risk factors? Nephrol Dial Transplant 2000;15:454-7. [ Links ]
7. Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DN, Levey AS, et al. The Framingham predictive instrument in chronic kidney disease. J Am Coll Cardiol 2007;50(3):217-24. [ Links ]
8. Shah DS, Polkinghorne KR, Pellicano R, Kerr PG. Are traditional risk factors valid for assessing cardiovascular risk in end-stage renal failure patients? Nephrology 2008;13:667-71. [ Links ]
9. Wanner C, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, et al.; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005;353:238-48. [ Links ]
10. Zannad F, Kessler M, Lehert P, Grünfeld JP, Thuilliez C, Leizorovicz A, et al. Prevention of cardiovascular events in end-stage renal disease: results of a randomized trial of fosinopril and implications for future studies. Kidney Int 2006;70:1318-24. [ Links ]
11. Lindner A, Charra B, Sherrard DJ, Scribner BH. Accelerated atherosclerosis in prolonged maintenance hemodialysis. N Engl J Med 1974;290:697-701. [ Links ]
12. Joki N, Hase M, Fukazawa M, Nakamura R, Ishikawa H, Tanaka Y, Inishi et al. Progression of coronary atherosclerosis is accelerated in hemodialyzed patients than chronic renal insufficiency patients. Nephrol Dial Transplant 1999;14:171A. [ Links ]
13. Stenvinkel P, Alvestrand A. Inflammation in end-stage renal disease: sources, consequences and therapy. Semin Dialysis 2002;15:329-37. [ Links ]
14. Descamps-Latscha B, Witko-Sarsat V, Nguyen-Khoa T, Nguyen AT, Gausson V, Mothu N, et al. Advanced oxidation protein products as risk factors for atherosclerotic cardiovascular events in nondiabetic predialysis patients. Am J Kidney Dis 2005;45:39-47. [ Links ]
15. Zoccali C. Cardiorenal risk as a new frontier of nephrology: research needs and areas for intervention. Nephrol Dial Transplant 2002;17(Supl 11):50-4. [ Links ]
16. Becker BN, Himmelfarb J, Henrich WL, Hakim RM. Reassesing the cardiac risk profile in chronic hemodialysis patients: A hypothesis on the role of oxidant stress and other non-traditional cardiac risk factors. J Am Soc Nephrol 1997;8:475-86. [ Links ]
17. London GM, Guerin AP, Marchais SJ, Pannier B, Safar M, Day M, et al. Cardiac and arterial interactions in end-stage renal disease. Kidney Int 1996;50:600-8. [ Links ]
18. Blacher J, Safar ME, Pannier B, Guerin AP, Marchais SJ, London GM. Prognostic significance of arterial stiffness measurements in end-stage renal disease patients. Curr Opin Nephrol Hypertens 2002;11:629-34. [ Links ]
19. Rakhit DJ, Marwick TH, Armstrong KA, Johnson DW, Leano R, Isbel NM. Effect of aggressive risk factor modification on cardiac events and myocardial ischaemia in patients with chronic kidney disease. Heart 2006;92:1402-8. [ Links ]
20. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al. ESH-ESC Task Force on the Management of Arterial Hypertension. 2007 ESH-ESC Practice Guidelines for the Management of Arterial Hypertension: ESH-ESC Task Force on the Management of Arterial Hypertension. J Hypertens 2007;25:1751-62. [ Links ]
21. Witko-Sarsat V, Friedlander M, Capeillère-Blandin C, Nguyen-Khoa T, Nguyen AT, Zingraff J, et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia. Kidney Int 1996;49:1304-13. [ Links ]
22. Nishiura R, Fujimoto S, Sato Y, Yamada K, Hisanaga S, Hara S, et al. Elevated osteoprotegerin levels predict cardiovascular events in new hemodialysis patients. Am J Nephrol 2009;29:257-63. [ Links ]
23. Ezekowitz J, McAlister FA, Humphries KH, Norris CM, Tonelli M, Ghali WA, et al.; APPROACH Investigators. The association among renal insufficiency, pharmacotherapy, and outcomes in 6,427 patients with heart failure and coronary artery disease. J Am Coll Cardiol 2004;44:1587-92. [ Links ]
24. Fellström BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med 2009;360:1395-407. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Silvia Collado Nieto,
Servicio de Nefrología,
Hospital del Mar, Barcelona, España
E-mail: scolladonieto@yahoo.es














