Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.81 no.8 Ago. 2006
ARTÍCULO ORIGINAL
Estudio comparativo de la inervación coroidea en el hombre y en el conejo (oryctolagus cuniculus)
A comparative study of choroidal innervation in the human and the rabbit (oryctolagus cuniculus)
De Hoz R.1, Salazar J. J.2, Ramírez A. I.2, Rojas B.1, Triviño A.1, Ramírez J. M.1
Instituto de Investigaciones Oftalmológicas Ramón Castroviejo. Universidad Complutense de Madrid. España.
1Doctor en Medicina y Cirugía.2Doctor en Ciencias Biológicas.
Proyecto Ministerio de Ciencia y Tecnología; Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica (BF-03-08108); y por la Red Temática de Investigación Cooperativa CO3/13 del Instituto de Salud Carlos III.
Dirección para correspondencia
RESUMEN
Objetivo: Analizar las diferencias morfológicas entre la inervación coroidea del hombre y el conejo, especie frecuentemente utilizada como modelo experimental de enfermedades oculares.
Método: Se estudiaron montajes planos de coroides (12 humanas y 12 de conejo albino) con la técnica de inmunohistoquímica indirecta de la peroxidasa-antiperoxidasa, utilizando un anticuerpo frente al neurofilamento de 200 kD.
Resultados: Las fibras nerviosas coroideas pueden ser perivasculares e intervasculares. Las perivasculares rodeaban las arterias formando una red que estaba más desarrollada en la coroides del conejo. En el humano, las fibras intervasculares se concentraban principalmente en el polo posterior donde formaban un plexo más denso y organizado que en el conejo, el cual no tenía una localización preferencial. Las células ganglionares eran más numerosas en el humano, concentrándose en un área circunferencial correspondiente a la entrada de las arterias ciliares cortas posteriores y en el área submacular. En el conejo estas células se situaban sólo en la periferia.
Conclusiones: Existen diferencias entre la inervación coroidea humana y del conejo. En el humano, la abundancia de células ganglionares y su distribución, podrían ser necesarias para mantener un flujo sanguíneo constante en el área central de la coroides. La falta de organización nerviosa en el polo posterior del conejo podría estar asociada a la ausencia de mácula. Estas diferencias, junto a las diferencias anatómicas de la vascularización retiniana, deberían ser tenidas en cuenta al utilizar el conejo como modelo experimental para estudiar enfermedades oculares en las que esté implicada la regulación del flujo sanguíneo coroideo.
Palabras clave: fibras nerviosas, células ganglionares, ojo, inmunohistoquímica, anti-NFs.
ABSTRACT
Objective: To analyze morphological differences between the choroidal innervation of the human and the rabbit, the latter being a species frequently used as an experimental model of human ocular diseases.
Methods: Twelve human and 12 rabbit choroidal whole mounts were processed using an indirect immunohistochemical technique, peroxidase-anti-peroxidase and antibodies against 200 kD neurofilament.
Results: Choroidal nerve fibers were perivascular and intervascular. Perivascular fibers surrounded all arteries forming a network that was more developed in the rabbit. In humans, intervascular fibers were mainly concentrated at the posterior pole where they formed a denser and more highly organized plexus than in the rabbit, which did not exhibit a preferential location for these fibers. Human choroidal ganglion cells were far more numerous than in the rabbit and were concentrated in a circumferential area corresponding to the entrance of the short posterior ciliary arteries of the submacular area. In the rabbit, these cells were restricted to the peripheral choroid.
Conclusions: Some differences were observed between human and rabbit choroidal innervation. The abundance of ganglion cells and their preferential distribution could be necessary to maintain a constant blood flow in the central area of the human choroid. The lack of organization of rabbit choroidal innervation at the posterior pole could be associated with an absence of the macula. These differences, along with peculiarities of retinal vascularization, should be taken into consideration when using the rabbit as an experimental model to study human eye diseases in which regulation of choroidal blood flow is involved (Arch Soc Esp Oftalmol 2006; 81: 463-470).
Key words: nerve fibers, ganglion cells, eye, immunohistochemistry, anti-NF.
Introducción
La inervación coroidea es un complejo sistema de fibras nerviosas y células ganglionares. Estas estructuras nerviosas tienen una considerable influencia en la fisiología del globo ocular a través del control que ejercen sobre el calibre vascular.
La morfología y distribución de la inervación coroidea fue inicialmente estudiada con técnicas de plata, poco selectivas dada la afinidad de la plata por estructuras no neuronales (1,2). Con el posterior desarrollo de las técnicas inmunohistoquímicas que permiten marcajes más especifico de las estructuras nerviosas, fue posible estudiar la inervación coroidea desde un punto de vista funcional con Neuropéptido-Y (NPY), Péptido vasoactivo intestinal (VIP) y Sustancia P (SP), que determinan respectivamente el origen simpático, parasimpático y sensitivo de estas estructuras (3-11). El uso de la NADPH-diaforasa y oxido nítrico sintetasa (NOS) facilitó un estudio más fisiológico de la inervación coroidea determinando qué fibras nerviosas coroideas usan el oxido nítrico como neurotransmisor (9-10). Sin embargo, existen muy pocos estudios morfológicos de la inervación coroidea utilizando estas técnicas. Los anticuerpos monoclonales frente a neurofilamentos (NFs) marcan selectivamente las fibras nerviosas tanto en el sistema nervioso central como periférico (12,13). Los NFs son proteínas estructurales del citoesqueleto axonal, por tanto su visualización permite analizar la morfología de las neuronas (8). Recientemente hemos utilizado anticuerpos frente a los NFs para estudiar las características morfológicas y la distribución de la inervación coroidea en diferentes especies (11,14-18). Además, comparando los diferentes anticuerpos contra los NFs (anti-NF 68, –160, –200) hemos demostrado que el mejor para el estudio de la morfología de las fibras nerviosas y células ganglionares es el anti-NF 200 (11,14,17,18).
El conejo es uno de los modelos animales utilizados para el estudio de enfermedades oculares humanas. Sin embargo, estudios mediante técnicas inmunohistoquímicas con NADPH-diaforasa y NOS han revelado diferencias entre las dos especies tanto en la distribución de las fibras nerviosas como en el numero de células ganglionares (9,10).
En este trabajo se ha utilizado anti-NF 200 en montajes planos de coroides humana y de conejo para analizar las diferencias morfológicas entre la inervación de ambas especies y por tanto considerar si el conejo constituye un modelo experimental adecuado para el estudio de enfermedades oculares en cuyos mecanismos fisiopatologicos esté implicada la regulación nerviosa coroidea.
Sujetos, materiales y métodos
Humanos
Doce ojos normales de adulto (rango de edad 18-58 años), que procedían de donaciones para transplante corneal y que fueron enucleados 2-4 horas post mortem, se fijaron por inmersión con paraformaldehido (PFA) al 4% (Sigma, USA) en tampón fosfato salino (TFS) 0. 1M a pH 7. 4 durante 24 horas. Para separar la coroides del resto de las túnicas oculares se practicó un corte alrededor del limbo esclero-corneal, extirpando en bloque cornea, iris y cristalino. De este modo queda en un casquete posterior retina, coroides-cuerpo ciliar y esclera. Finalmente se procedió a separar estos tejidos ayudándonos con unas pinzas y un pincel muy fino (000). Primeramente se disecó la retina y seguidamente se separó la coroides unida al cuerpo ciliar. Posteriormente las coroides fueron lavadas en TFS durante varias horas a 4ºC. A continuación fueron incubadas durante 10-15 días en peróxido de hidrógeno al 2% a 4ºC para bloquear la peroxidasa endógena. Este tiempo, más largo que el que habitualmente se utiliza para el bloqueo, es necesario para la despigmentación de este tejido (11). La inmunotinción se realizó siguiendo la técnica descrita previamente (14). El anticuerpo monoclonal primario frente al NF de 200 kDa (clon NE14, Sigma, USA) se utilizó a una dilución 1:200.
Conejos
Seis conejos albinos adultos raza New Zealand fueron sacrificado con una sobredosis de pentobarbital sódico siguiendo las normas de ARVO, y fueron perfundidos perimortem con PFA al 4% (Sigma, USA) en TFS 0. 1M a pH 7,4. Se enuclearon los ojos postfijándose por inmersión durante 4 h a 4ºC en PFA al 4% en TFS 0. 1M, pH 7. 4. A continuación se separaron las coroides y se lavaron en TFS durante varias horas a 4ºC. El protocolo de la inmunotinción fue el mismo al utilizado para los ojos humanos excepto: el bloqueo de la peroxidasa fue durante 30 minutos a temperatura ambiente y la dilución del anticuerpo primario fue (1:100).
Las imágenes fueron obtenidas con un microscopio óptico Jenalumar Light Microscopio (Carl Zeiss, Jena) y película Ektachrome 100 ASA (kodak).
Tanto en humanos como en conejos, todas las diluciones de los anticuerpos fueron realizadas en Triton X-100 al 0. 2%, suero normal de cabra 0,1% en TFS 0. 1M a pH 7,4. Los controles negativos se realizaron eliminando la incubación del anticuerpo primario. Para el contaje de las células ganglionares se seleccionaron aquellas coroides que presentaban una tinción homogénea en toda la preparación. Los contajes se realizaron con una magnificación x12,5.
Cuantificación de células ganglionares
Las células ganglionares de la coroides humana fueron cuantificadas siguiendo la técnica previamente descrita (11).
Resultados
1. Morfología y distribución de las fibras nerviosas
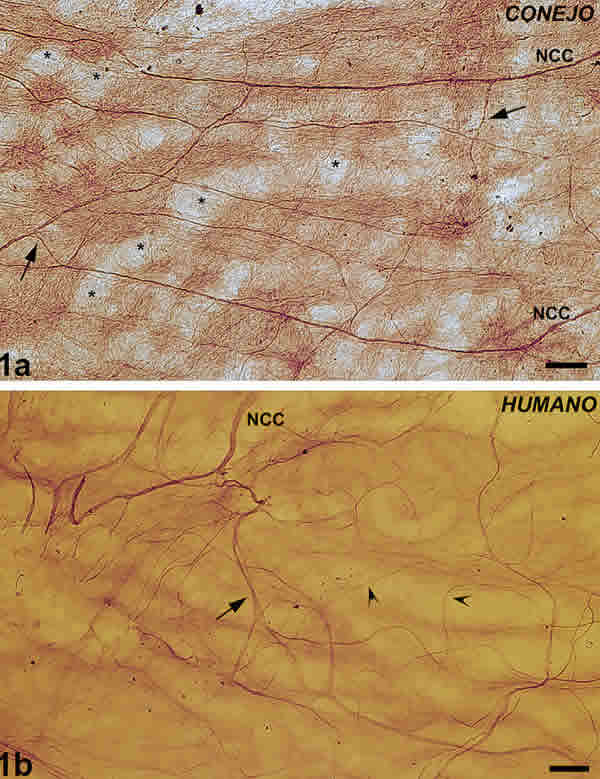
Dependiendo de su localización, las fibras nerviosas se clasificaron en perivasculares o intervasculares (fig. 1A, 1B ).
Fig. 1. Fibras nerviosas intervasculares coroideas. 1A: fibras nerviosas intervasculares del conejo:
ramas (flechas) de los nervios ciliares cortos (NCC): Vasos sanguíneos (*). Barra 100 µm.
1B: fibras nerviosas intervasculares humanas: ramas (flechas) de los nervios ciliares cortos (NCC)
dividiéndose en ramas de pequeño calibre (Cabezas de flecha). Barra 250 µm.
1. 1. Conejo
Fibras perivasculares
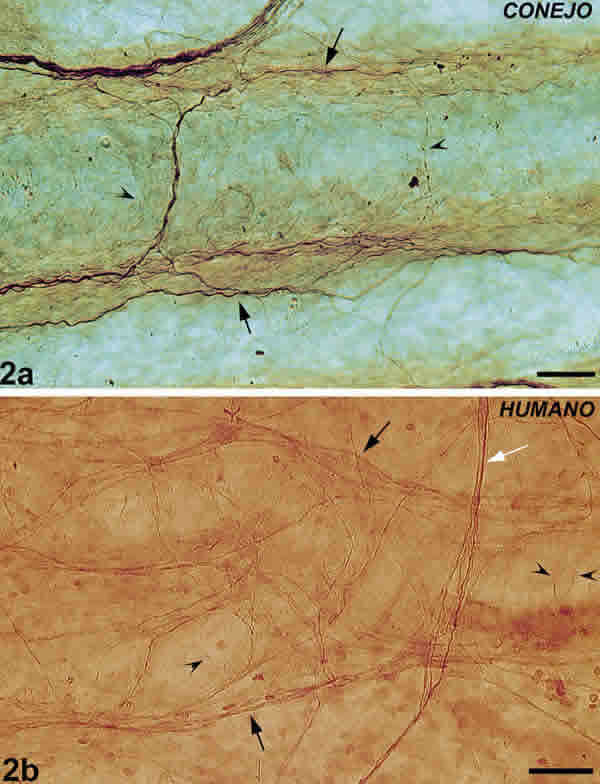
Eran fibras nerviosas de calibre delgado que rodeaban la pared de las arterias. En los grandes vasos presentaban un patrón circunferencial. Cuando los vasos se ramificaban, se disponían formando una red de fibras transversales y longitudinales que cubrían la superficie del vaso (fig. 2A ).
Fig. 2. Fibras nerviosas perivasculares coroideas. 2A: fibras nerviosas perivasculares del conejo (cabeza de flecha).
Fibras paravasculares (flechas). Barra 50 µm. 2B: fibras nerviosas perivasculares (cabezas de flecha).
Fibras paravasculares (flecha negra). Fibras intervasculares (flecha blanca). Barra 50 µm.
Fibras Intervasculares
En la supracoroides se observaron dos haces de fibras aplanadas (de 50-70 fibras cada uno) en la zona ecuatorial de las regiones nasal y temporal de la coroides y que podrían corresponder a los nervios ciliares largos (NCL).
Además, en la supracoroides y en las capas vasculares, haces formados por 5-20 fibras (fig. 3A ) se ramificaban en haces de mediano tamaño compuestos por 3-4 fibras. A su vez, estos se ramificaban en fibras muy finas que realizaban contactos con la pared de los vasos. En ocasiones, las fibras intervasculares se localizaban paralelas a la pared de los vasos (fibras paravasculares) (fig. 2A ). Las fibras intervasculares podrían ser ramas tanto de los NCL como de los nervios ciliares cortos (NCC) (fig. 1A , 3A ). También se observaron fibras que recorrían la supracoroides desde el polo posterior al cuerpo ciliar, fibras de largo recorrido, (FLR). En su recorrido hacia la coroides periférica, las FLR incrementaban el número de sus fibras hasta estar constituidos por 15-20 en las cercanías del cuerpo ciliar y hacían contacto con los vasos sanguíneos en varios puntos. En el cuerpo ciliar los haces formaban una extensa red y podrían ser ramas terminales de los NCL y NCC.
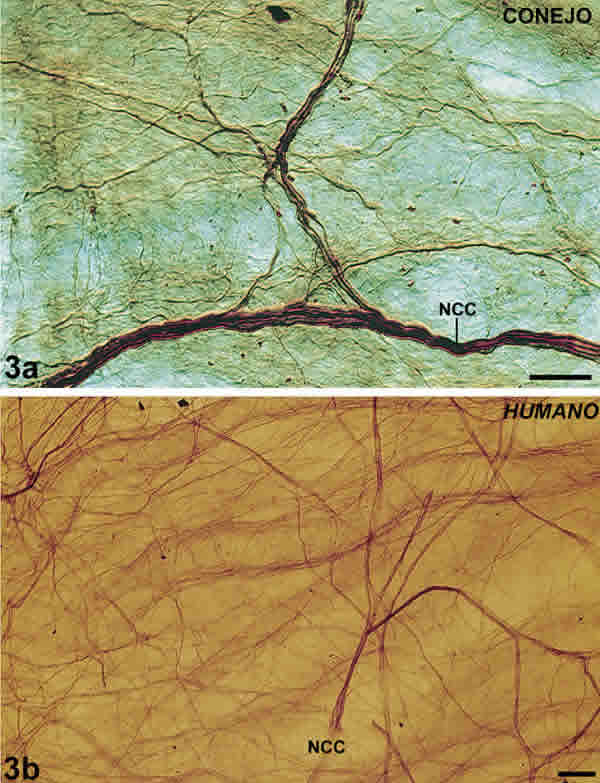
Fig. 3. Plexo intervascular supracoroideo. 3A: ramas de los NCC del conejo que se dividen
en múltiples fascículos de calibre variable. Barra 50 µm. 3B: Ramas de los NCC humanas formando
una malla en el polo posterior. Barra 250µm.
1. 2. Humano
Fibras perivasculares
Presentaban un patrón circunferencial en los grandes vasos. A medida que estos se ramificaban y disminuían su calibre, formaban una red compuesta de fibras longitudinales y transversales (fig. 2B ).
Fibras intervasculares
Se localizaban fundamentalmente en la supracoroides, en cuya parte más externa se observaron varios haces aplanados de fibras. Había dos haces mas gruesos (de 125 fibras cada uno) que penetraban en la supracoroides nasal y temporal, a nivel del ecuador. Por su localización podrían ser los NCL. También se observaron ocho a diez más finos (de 75-100 fibras cada uno) entre el polo posterior y el ecuador, que se extendían hasta el cuerpo ciliar donde daban ramas anastomóticas para fascículos vecinos formando un plexo con abundantes fibras. Por su localización, estos haces aplanados finos podrían ser los NCC. (figs. 1B , 3B ). Las ramas primarias de los NCC (de 40 fibras) se localizaban en la coroides central y daban ramas secundarias de calibre variable (2, 3 o más fibras). A su vez, las secundarias se dividían (en ocasiones estaban formadas por un solo axón) y constituían un extenso plexo (fig. 3B ). La densidad de este plexo era mucho mayor en el polo posterior y se incrementaba considerablemente en el área submacular donde constituía una autentica malla. (figs. 1B , 3B ).
Algunas ramas de los NCC penetraban en la capa de grandes vasos donde se adaptaban a la morfología vascular formando dos grupos: 1) fibras paralelas a las paredes de las grandes arterias y sus ramas primarias a modo de «fundas vasculares» (fibras para vasculares) (fig. 3B ); 2) fascículos próximos a la pared vascular y que se adaptaban a sus contornos, formando un red poligonal altamente especializada con frecuentes anastomosis (fig. 4 ). Ambos grupos de fibras fueron observados fundamentalmente en el polo posterior, disminuyendo su densidad, adaptación a los vasos y aspecto de red hacia la periferia. Cerca del plexo ciliar se observaban solamente fascículos escasos y delgados.
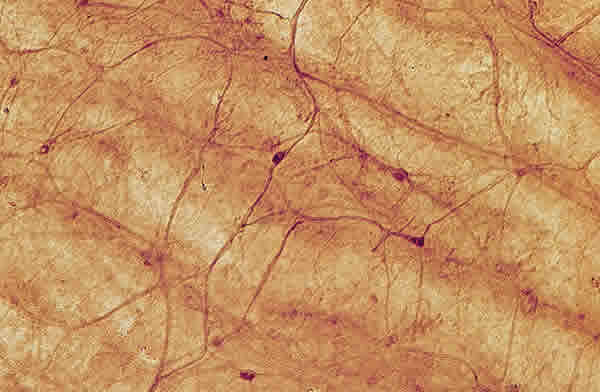
Fig. 4. Fibras intervasculares humanas adaptadas a la morfología vascular coroidea.
Fibras (cabeza de flechas) próximas a la pared de los vasos formando una red poligonal.
Células ganglionares (flechas). Barra 100 µm.
Ramas derivadas de los dos grupos descritos alcanzaban la pared vascular sin una terminación específica. En ocasiones, estas fibras penetraban hacia la capa de medianos vasos formando una red paralela a la pared de las arteriolas en la región macular.
En la supracoroides se observaron FLR que en el cuerpo ciliar formaban una densa red.
2. -Morfología y distribución de las células ganglionares
2. 1. Conejo
Las células ganglionares coroideas (CGC) estaban en las redes de fibras intervasculares de la coroides periférica. Las CGC eran muy escasas, aproximadamente 10 por coroides. La morfología bipolar predominaba sobre la multipolar. En general, se agrupaban en microganglios de 2 ó 3 células aunque en ocasiones, se encontraban aisladas (fig. 5A ).
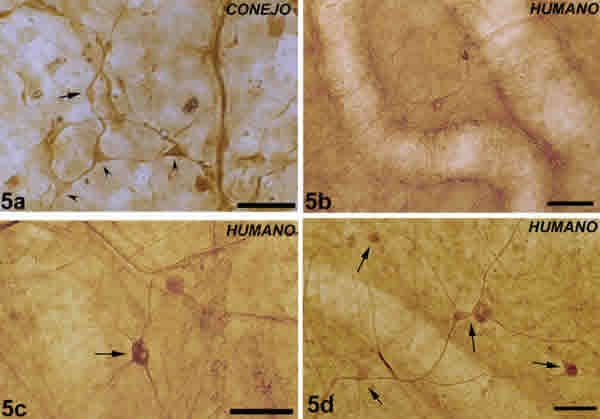
Fig. 5. Células ganglionares coroideas. 5A: células ganglionares coroideas de conejo formando parte de plexos intervasculares.
Célula bipolar (flecha). Célula multipolar (cabezas de flecha). Barra 25 µm. 5BCD: células coroideas ganglionares humanas(Barra100 µm). Célula ganglionar bipolar entre dos grandes vasos (5B); células ganglionares multipolares formando microganglios (flechas) (5C); células ganglionares multipolares formando una red en los plexus intervasculares (5D).
2. 2. Humano
La coroides humana contiene abundantes células ganglionares (figs. 5B, D, C ), aproximadamente de 1. 300 a 1. 500 CGC que se distribuían de una forma desigual al ser más numerosas en el área temporal (aproximadamente 1. 000) que en el nasal (aproximadamente 500). En ambos sectores, el número de células fue mayor en el polo posterior, concentrándose principalmente en un área circunferencial correspondiente a la entrada de las arterias ciliares cortas posteriores (ACCP) y en la vecindad del área submacular (fig. 4 ). El número de CGC va disminuyendo progresivamente desde el polo posterior hasta la coroides periférica (11).
Las CGC humanas se localizaban básicamente en la supracoroides en relación con las ramas primarias y secundarias de los nervios ciliares (figs. 5C, D ). La mayoría de las CGC se encontraban próximas a la pared de los grandes vasos (figs. 5B, C, D ), formando parte del plexo poligonal que sigue los contornos vasculares (fig. 4 ). Se observaban tanto aisladas (fig. 5B ) como en grupos de 2-10 células formando microganglios (figs. 5C, D ). predominaba la morfología multipolar (figs. 5C, D ) sobre la bipolar (fig. 5B ).
Discusión
Tanto en humanos como en animales de experimentación, la coroides está inervada por fibras nerviosas que se relacionan con los vasos sanguíneos de diferente forma. Fibras nerviosas situadas en la pared del vaso, en contacto directo con el mismo (perivasculares) y fibras localizadas entre los vasos, que se sitúan próximas a ellos y hacen contactos ocasionales con los mismos (intervasculares). De acuerdo con Tsai y col. (19), cuando las fibras nerviosas perivasculares presentan un patrón de red significa que han alcanzado la madurez. Este patrón en red ha sido observado en la arteria carótida interna con anticuerpos frente al VIP y NPY (19) y en las ACCP mediante la tinción con NADPH-diaforasa (9,10). En nuestros trabajos con anti-NFs hemos encontrado que las fibras nerviosas perivasculares de las ACCP presentan este mismo patrón tanto en humanos como en conejos (11,14-18). Varios autores han demostrado la presencia de fibras perivasculares NPY y VIP positivas en las ACCP y sus ramas (3-11). De acuerdo con estos hallazgos, las fibras perivasculares NFs(+) observadas por nosotros podrían ser fibras simpáticas o parasimpáticas, pudiendo por tanto estar implicadas en la regulación del flujo sanguíneo coroideo. Dicha regulación podría ser diferente entre ambas especies pues la red de fibras nerviosas perivasculares coroideas está mucho más desarrollada en los conejos que en los humanos.
En la regulación del flujo sanguíneo coroideo podrían intervenir además de las fibras nerviosas perivasculares, fibras intervasculares y CGC. En este estudio se ha encontrado que el humano y el conejo difieren considerablemente en el número y distribución de las estructuras nerviosas mencionadas, algo que había sido demostrado mediante el uso de la NADPH-diaforasa (9,10). En la coroides humana, la mayor concentración de fibras NF(+), que proceden de los nervios ciliares largos y cortos, son fibras intervasculares que forman un extenso plexo de fibras altamente organizadas, especialmente en el polo posterior y en las zonas adyacentes a la mácula. Adicionalmente, de este plexo intervascular supracoroideo parten ramas que se adaptan a los contornos vasculares de las principales ramas de las ACCP formando «fundas vasculares» que podrían regular el flujo sanguíneo en su entrada en la coroides. Contrariamente, en el conejo predomina la inervación perivascular; además, las fibras intervasculares NF(+) son escasas y aunque se sitúan paralelas a los vasos, no se adaptan a sus contornos ni forman un plexo organizado en el polo posterior como en la coroides humana. Todos estos hallazgos sugieren que los mecanismos que controlan el flujo sanguíneo podrían ser diferentes entre ambas especies.
En relación a las células ganglionares las comparaciones entre el humano y el conejo deben ser realizadas con precaución ya que existen diferencias en la literatura tanto en el número como en la distribución de estas neuronas. Así, con anticuerpos frente a neurotransmisores clásicos (3) las CGC del conejo no tienen una distribución preferencial, mientras que con NADPH-diaforasa se localizan cerca de las arterias ciliares largas posteriores (ACLP) en el polo posterior y próximas a los vasos en la coroides periférica (9). Con anti NF-200, las CGC del conejo son escasas y se encuentran solamente en la coroides periférica (14,17).
También existen diferencias en el número y distribución de las CGC humanas dependiendo del marcador utilizado para su estudio. Así, Miller y col. (4) describieron que las CGC VIP(+) de la coroides humana eran escasas (aproximadamente 10 por coroides) y no parecían concentrarse en ninguna región particular. Trabajos posteriores con NADPH-diaforasa (9,10) y con anti-NF (11) revelaron que existe un gran número de CGC humana (entre 1. 500-2. 000) y que estas células se localizan preferencialmente en la región temporal central adyacente a la macula. La presencia de un gran número de CGC en el área central de la coroides humana podría estar relacionada con la existencia de mácula (10,11). Esta hipótesis se apoya en la escasez de CGC NF-200(+) observadas en la región central de la coroides del conejo, una especie que carece de mácula y en la que las CGC NF-200(+) se localizan preferencialmente en la coroides periférica (14,17).
En la coroides humana el área macular presenta la mayor densidad arteriolar (20) para proveer el flujo sanguíneo de los conos. La función del gran número de CGC y la gran densidad de fibras nerviosas observada en la coroides submacular podría ser regular el flujo arteriolar de esta zona. Se ha postulado que estas neuronas serían las encargadas de provocar reflejos vasodilatadores rápidos (9) para regular el flujo sanguíneo en condiciones extremas tales como cambios bruscos de la presión arterial o incrementos de la temperatura (21,22). La alta concentración de CGC NF(+) en las cercanías de las entradas de las ACCP así como la existencia de abundante inervación intervascular en la coroides central humana podrían ser necesarios para mantener el flujo sanguíneo constante en esta zona.
La regulación del flujo sanguíneo coroideo, en la que participa la inervación, tiene un importante papel en la fisiología ocular. La inervación coroidea humana y del conejo presentan diferencia en: 1) la relación fibras nerviosas-vasos sanguíneos; 2) la organización y distribución de las fibras nerviosas; y 3) el número y distribución de las CGC. Las diferencias en la inervación de la coroides observadas en este estudio junto a la distinta vascularización retiniana que presentan ambas especies (23-29) deberían tenerse en cuenta a la hora de interpretar los hallazgos obtenidos cuando se utiliza el conejo como modelo experimental para el estudio de patologías oculares humanas en las que estén implicadas la regulación vascular coroidea.
Bibliografía
1. Wolter JR. Nerves of the normal human choroid. Arch Ophthalmol 1960; 64: 120-124. [ Links ]
2. Castro-Correia J. Studies on the innervation of the uveal tract. Ophthalmologica 1967; 154: 497-520. [ Links ]
3. Terenghi G, Polak JM, Probert L, McGregor GP, Ferri GL, Blank MA, et al. Mapping, quantitative distribution and origin of substance p- and VIP-containing nerves in the uvea of the guinea pig eye. Histochemistry 1982; 75: 399-417. [ Links ]
4. Miller AS, Coster DJ, Costa M, Furness JB. Vasoactive intestinal polypeptide immunoreactive nerve fibres in the human eye. Aust J Ophthalmol 1983; 11: 185-193. [ Links ]
5. Stone RA, Tervo T, Tervo K, Tarkkanen A. Vasoactive intestinal polypeptide-like immunoreactive nerves to the human eye. Acta Ophthalmol (Copenh) 1986; 64: 12-18. [ Links ]
6. Stone RA. Neuropeptide Y and the innervation of the human eye. Exp Eye Res 1986; 42: 349-355. [ Links ]
7. Stone RA. Vasoactive intestinal polypeptide and the ocular innervation. Invest Ophthalmol Vis Sci 1986; 27: 951-957. [ Links ]
8. Berry M, Bannister LH, Standring SM. Sistema nervioso. In: Bannister LH, Berry MM, Collins P, Dyson M, Dussek JE, Ferguson MW. Anatomía de Gray. Madrid: Harcourt; 1998; II: 901-1360. [ Links ]
9. Flugel-Koch C, Kaufman P, Lutjen-Drecoll E. Association of a choroidal ganglion cell plexus with the fovea centralis. Invest Ophthalmol Vis Sci 1994; 35: 4268-4272. [ Links ]
10. Flugel C, Tamm ER, Mayer B, Lutjen-Drecoll E. Species differences in choroidal vasodilative innervation: evidence for specific intrinsic nitrergic and VIP-positive neurons in the human eye. Invest Ophthalmol Vis Sci 1994; 35: 592-599. [ Links ]
11. Triviño A, De Hoz R, Salazar JJ, Ramirez AI, Rojas B, Ramirez JM. Distribution and organization of the nerve fiber and ganglion cells of the human choroid. Anat Embryol 2002; 205: 417-430. [ Links ]
12. Leim RK, Keith CH, Leterrier JF, Trenkner E, Shelanski ML. Chemistry and biology of neuronal and glial intermediate filaments. Cold Spring Harb Symp Quant Biol 1982; 46: 341-350. [ Links ]
13. Yen SH, Fields KL. Antibodies to neurofilament, glial filament, and fibroblast intermediate filament proteins bind to different cell types of the nervous system. J Cell Biol 1981; 88: 115-126. [ Links ]
14. Ramírez JM, De Hoz R, Salazar JJ, Ramírez AI, Triviño A, Romero A, et al. Estudio inmunohistoquímico de las fibras nerviosas coroideas usando anticuerpos contra NF-200. Arch Soc Esp Oftalmol 1994; 67: 579-584. [ Links ]
15. Ramírez JM, De Hoz R, Triviño A, Romero A, Salazar JJ, Ramírez AI. Estudio de la inervación coroidea utilizando el anti-NF 160 como marcador. Arch Soc Esp Oftalmol 1996; 70: 155-160. [ Links ]
16. Ramírez JM, De Hoz R, Salazar JJ, Ramírez AI, Triviño A. Estudio inmunohistoquímico de la inervación coroidea mediante la utilización de anticuerpos frente al NF-68. Arch Soc Esp Oftalmol 1997; 72: 5-10. [ Links ]
17. Ramirez JM, Triviño A, De Hoz R, Ramirez AI, Salazar JJ, Garcia-Sanchez J. Immunohistochemical study of rabbit choroidal innervation. Vision Res 1999; 39: 1249-1262. [ Links ]
18. Triviño A, de Hoz R, Rojas B, Salazar JJ, Ramirez AI, Ramirez JM. NPY and TH innervation in human choroidal whole-mounts. Histol Histopathol 2005; 20: 393-402. [ Links ]
19. Tsai SH, Tew JM, Shipley MT. Development of cerebral arterial innervation: synchronous development of neuropeptide Y (NPY)-and vasoactive intestinal polypeptide (VIP)-containing fibers an some observations on growth cones. Brain Res Dev 1992; 69: 77-83. [ Links ]
20. Oyster CW. The human eye. Structure and function. Suderland: Sinauer Associates; 1999; 477-482. [ Links ]
21. Parver LM, Auker CR, Carpenter DO, Doyle P. Choroidal blood flow. II. Reflexive control in the monkey. Arch Ophthalmol 1982; 100: 1327-1330. [ Links ]
22. Parver LM, Auker CR, Carpenter DO. Choroidal blood flow. III. Reflexive control in human eyes. Arch Ophthalmol 1983; 101: 1604-1606. [ Links ]
23. Hyvarinen L. Vascular structures of the rabbit retina. Acta Ophthalmol (Copenh) 1967; 45: 852-861. [ Links ]
24. Hyvarinen L. Circulation in the fundus of the rabbit eye. Acta Ophthalmol (Copenh) 1967; 45: 862-875. [ Links ]
25. Triviño Casado A, Ramírez Sebastián AI, Ramírez Sebastián JM, Salazar Corral JJ, Rivera de Zea M, García Sánchez J. Estudio de las relaciones vaso-gliales en la retina del conejo albino (Oryctolagus cuniculus). Arch Soc Esp Oftalmol Invest 1988; 1: 103-110. [ Links ]
26. Triviño A, Ramírez AI, Ramírez JM, Salazar JJ, García J. Estudio mediante el método de diafanización de la vascularización retiniana del conejo. St Ophthal 1991; 10: 13-18. [ Links ]
27. Triviño A, Ramírez JM, Ramírez AI, Salazar JJ, García-Sánchez J. Retinal perivascular astroglia: an immunoperoxidase study. Vision Res 1992; 32: 1601-1607. [ Links ]
28. Ramírez JM, Triviño A, Ramírez AI, Salazar JJ, García-Sánchez J. Immunohistochemical study of human retinal astroglia. Vision Res 1994; 34: 1935-1946. [ Links ]
29. Triviño A, Ramírez JM, Ramírez AI, Salazar JJ, García-Sánchez J. Comparative study of astrocytes in human and rabbit retinae. Vision Res 1997; 37: 1707-1711. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
José Manuel Ramírez Sebastián
Instituto de Investigaciones Oftalmológicas Ramón Castroviejo
Facultad de Medicina, Pab. VI, 4ª planta
Universidad Complutense de Madrid
28040 Madrid, España.
e-mail: ramirezs@med.ucm.es
Recibido: 12.05.05
Aceptado: 25.07.06