INTRODUCCIÓN
La rotura de un aneurisma aórtico abdominal (AAA) es un evento altamente letal, con cifras de mortalidad global del 70-90 % (1), lo que representa una emergencia quirúrgica de primer orden. En ausencia de tratamiento el desenlace es invariablemente fatal. A pesar de la rotunda disminución de la mortalidad en las últimas dos décadas (2), asociada a la implementación de la reparación endovascular (EVAR) y a las mejoras en el manejo anestésico y perioperatorio, un aneurisma aórtico abdominal roto (AAAr) continúa ligado a una elevada mortalidad (3).
La creación de protocolos y algoritmos de decisión para el manejo de pacientes con AAAr facilita la toma de decisiones, además de reducir el tiempo transcurrido desde la rotura hasta la reparación quirúrgica, lo que ha demostrado ser crucial para disminuir la morbimortalidad de esta entidad (4,5). Mehta y cols. demostraron que, en presencia de un protocolo, la mortalidad a los 30 días se reducía de un 32 % a un 18 % (5).
DIAGNÓSTICO
La presentación clínica de un AAAr es, con frecuencia, sutil y confusa, por lo que, ante signos de alerta de potencial rotura de un aneurisma aórtico, tales como síncope, hipotensión transitoria o pérdida de consciencia, es esencial un alto índice de sospecha. La triada clínica clásica de hipotensión, dolor abdominal o lumbar y masa abdominal pulsátil solo está presente en el 25-50 % de los pacientes (6).
La ecografía abdominal es muy útil en la detección de un AAA, aunque posee baja sensibilidad para visualizar un hematoma retroperitoneal, razón por la que la ecografía no debe emplearse en el departamento de urgencias para excluir rotura aneurismática, si bien el hallazgo ecográfico de un AAA en un paciente inestable es muy sugestivo de la misma.
En la actualidad, el TAC es la prueba de imagen clave ante la sospecha clínica de AAAr (7,8); el angio-TAC abdómino-pélvico, con cortes realizados a 1 mm, confirma el diagnóstico, determina si es factible la reparación endovascular de aneurisma aórtico (EVAR) y, asimismo, permite obtener las medidas necesarias de la aorta para llevar a cabo este procedimiento quirúrgico. Las zonas de sellado, proximal y distal, el cuello aórtico infrarrenal y los accessos iliofemorales han de ser evaluados y medidos.
Un metaanálisis reciente establece que en pacientes inestables hemodinámicamente con AAAr la reparación endovascular (REVAR) se asocia a una menor mortalidad hospitalaria que la cirugía abierta (37 % frente a 62 %; p = 0,009) (9). En base a este estudio, la guía europea sobre el manejo del aneurisma aórtico abdominal establece en sus directrices la recomendación de realizar un angio-TAC en todos los pacientes que se encuentren suficientemente estables (recomendación de clase I, nivel de evidencia B). Incluso en pacientes con inestabilidad hemodinámica debe sopesarse su realización (recomendación de clase II, nivel de evidencia B) para determinar la factibilidad anatómica del tratamiento endovascular (10). La guía española de 2015 sobre el manejo de AAA establece ya la recomendación del angio-TAC como prueba imprescindible (11).
Siempre que se mantenga una presión arterial registrable, la técnica de hipotensión permisiva, en la que se limita el aporte de líquidos, minimizaría la hemorragia en curso. No obstante, si persiste la inestabilidad hemodinámica, con pérdida/disminución del nivel de consciencia y/o una presión arterial sistólica (PAS) < 80 mmHg, el paciente ha de ser llevado a quirófano de forma inmediata para una cirugía abierta o aortografía intraoperatoria (con o sin balón de oclusión). En casos emergentes, esta aortografía podría ser suficiente para determinar si el tratamiento endovascular es posible y seleccionar la medida de la prótesis (Fig. 1).

Figura 1. Algoritmo diagnóstico de aneurisma de aorta abdominal roto (AAAr) que resume la secuencia de pasos hasta la reparación quirúrgica, en función de la estabilidad hemodinámica del paciente.
En esta primera etapa diagnóstica ha de existir una monitorización constante de los signos vitales del paciente. Una vez obtenido el diagnóstico de confirmación con TAC y avisado el cirujano vascular de guardia, se pone en marcha la optimización clínica del paciente, orientada a la reparación quirúrgica urgente; en el departamento de urgencias se cogen 2 vías periféricas, se restringe el aporte de fluidos intravenosos y se inicia la hipotensión permisiva; si es necesario, se transfunden derivados sanguíneos (Fig. 2). En ningún caso estas actuaciones han de suponer un retraso en el traslado urgente del paciente al quirófano.
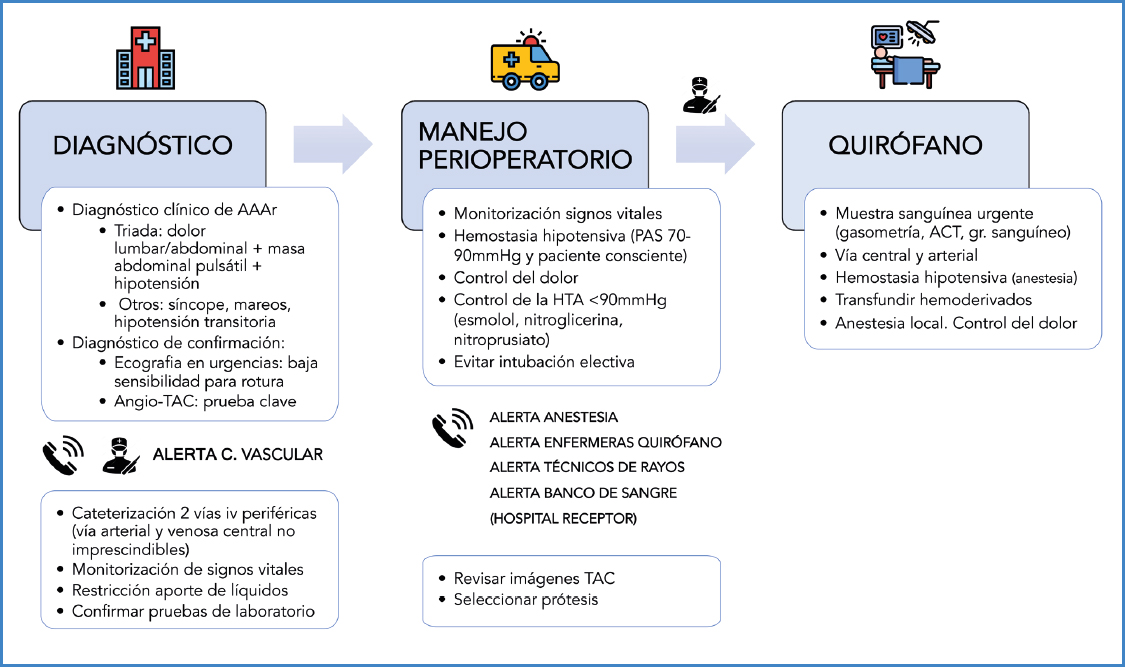
Figura 2. Manejo del paciente con aneurisma de aorta abdominal roto (AAAr). Se expone el conjunto de procesos y actuaciones protocolizadas organizadas en fases de diagnóstico, manejo perioperatorio y quirófano.
Los AAA sintomáticos no rotos merecen una consideración especial respecto al momento óptimo para ser reparados. Aunque presentan un riesgo de rotura mayor que el de un AAA asintomático, lo que podría justificar su reparación urgente, se ha hallado un aumento de las complicaciones perioperatorias en ese contexto (12,13). Por consiguiente, se sugiere una optimización de las condiciones del paciente seguida de una reparación urgente diferida en condiciones electivas (recomendación clase IIa, Guía europea sobre el manejo del aneurisma aórtico abdominal) (10)..
MANEJO PERIOPERATORIO
En esta segunda fase se completa la optimización del paciente orientada a una cirugía inminente (Fig. 2). Si es el caso, se traslada al paciente al hospital con servicio de cirugía vascular. Las listas de verificación de tareas han demostrado ser muy útiles en la coordinación de los hospitales emisor y receptor del paciente (Fig. 3).

Figura 3. Listado de verificación de actividades imprescindibles antes del traslado de un paciente con aneurisma de aorta abdominal roto (AAAr) y a su llegada al hospital receptor.
Con las nuevas tecnologías, el cirujano vascular puede revisar las imágenes del TAC y planear la estrategia quirúrgica.
La estrategia de la hipotensión permisiva
En el manejo de un AAAr, el término hipotensión permisiva (hemostasia hipotensiva) se refiere a la estrategia consistente en restringir el aporte agresivo de líquidos intravenosos en el periodo preoperatorio e intraoperatorio (también durante el traslado) hasta lograr el control aórtico proximal, siempre que el paciente se mantenga consciente, y con un objetivo de presión arterial sistólica (PAS) diana entre 70 y 90 mmHg.
Si la administración de volumen es inevitable, se recomienda aportar fluidos cristaloides, así como plasma fresco y hematíes.
A diferencia de la reanimación normotensa, en la que las pérdidas hemáticas se reemplazan de forma inmediata y rápida mediante la infusión de grandes volúmenes, la hipotensión permisiva posibilita la aparición de trombo y evita la aparición de coagulopatía por dilución e hipotermia, con lo que se controla una exacerbación del sangrado. Aunque su impacto beneficioso sobre la supervivencia se ha extrapolado de estudios en pacientes con shock hemorrágico secundario a traumatismo, la hipotensión permisiva se considera en la actualidad una práctica segura y bien documentada en el manejo perioperatorio del AAAr (14-17). Las limitaciones de la hemostasia hipotensiva derivan de la eventual hipoperfusión a nivel cerebral, coronario y renal.
El estudio IMPROVE (18) definió el rango seguro de PAS para una hipotensión permisiva en pacientes con AAAr. La mortalidad a los 30 días fue superior en pacientes con AAAr, en los que se registró, en el periodo preoperatorio, una PAS < 70 mmHg en comparación con los pacientes con PAS > 70 mmHg. Por eso, se sugiere que la PAS no caiga por debajo de los 70 mmHg, aunque la cifra ideal continúa siendo un aspecto controvertido.
La Sociedad Europea de Cirugía Vascular (ESVS), en sus guías recientemente publicadas en 2019 sobre el manejo del AAA (10), ha establecido la hipotensión permisiva como una recomendación de clase I (nivel de evidencia B). La guía americana de AAA de 2018 presenta esta recomendación con la misma rotundidad (19).
Algunos autores diferencian el concepto hipotensión permisiva de hipotensión controlada (también denominada hemostasia hipotensiva), refiriéndose a esta última cuando existe un proceso activo de disminución de la PAS con fármacos antihipertensivos (nitroglicerina, esmolol, nitroprusiato sódico…) con el fin de alcanzar una PAS diana < 90 mmHg en pacientes normotensos o hipertensos. Solo la guía americana señala en sus recomendaciones el uso de estos antihipertensivos, así como analgésicos, para prevenir la hipertensión y reducir el riesgo de rotura no contenida (19). En tales pacientes, el aporte de líquidos ha de restringirse al mínimo (20).
El control del dolor es un componente importante de la hipotensión permisiva en EVAR con anestesia local, ya que disminuye la actividad simpaticomimética.
QUIRÓFANO
El cirujano vascular recibe y evalúa al paciente, tras lo cual este es llevado urgentemente a quirófano.
Cirugía abierta o cirugía endovascular
El ensayo IMPROVE, aleatorizado en el momento del diagnóstico y con análisis por intención de tratar, no demostró diferencias en la mortalidad a los 30 días (35 % EVAR frente a 37 % en cirugía abierta). Tampoco demostró diferencias en la mortalidad a un año. Sin embargo, sí halló mayor calidad de vida, menor estancia hospitalaria y menor gasto, así como mayor supervivencia a 3 años con tratamiento endovascular, con niveles similares de reintervención para ambas técnicas (21,22). Estos hallazgos apoyan la estrategia endovascular cuando sea anatómicamente posible.
El metaanálisis de los estudios aleatorizados IMPROVE, AJAX y ECAR señala mayor supervivencia con el tratamiento endovascular, aunque sin obtener diferencias estadísticamente significativas (23).
Por otra parte, la revisión Cochrane de 2017, que incluye los estudios IMPROVE, AJAX, ECAR y Nottingham, no demostró clara superioridad para ninguna de las dos estrategias en términos de mortalidad a los 30 días (24).
En la actualidad, las guías europea y americana (10,19) recomiendan para el tratamiento del aneurisma roto la reparación endovascular (EVAR) sobre la cirugía abierta, siempre que anatómicamente sea factible. Esta directriz goza de un nivel de recomendación fuerte en ambas guías, pero con evidencia B (moderada) para la guía europea y C (baja) para la americana.
En los últimos años la reparación endovascular de un AAAr está imponiéndose a la cirugía abierta (25), aunque algunos estudios sugieren cautela y no abandonar la cirugía abierta (26).
Por su parte, las guías NICE del Reino Unido (27), presentadas en marzo de 2020, apuntan en sus recomendaciones que EVAR aporta más beneficio que la cirugía abierta para la mayoría de los pacientes, especialmente en varones de más de 70 años y mujeres de cualquier edad. Asimismo, la cirugía abierta aporta, probablemente, un mejor equilibrio beneficio-riesgo en varones de menos de 70 años. Admitiendo que el tratamiento endovascular es coste-efectivo en AAAr, el comité establece no recomendar EVAR, incluso en casos anatómicamente favorables, por dos razones:
Primera, la incertidumbre que genera la evidencia del estudio IMPROVE. El seguimiento máximo de los pacientes intervenidos con EVAR por AAAr es 7 años, lo que estima insuficiente, teniendo en cuenta que la supervivencia podría empeorar conforme aumenta el seguimiento (con convergencia a largo plazo de las curvas de supervivencia, de forma análoga a lo que sucede en EVAR en AAA no rotos).
En segundo lugar, la disparidad en los resultados del REVAR por subgrupos. Concretamente, la mayoría de las mujeres tienen mejor supervivencia a corto plazo con EVAR, en tanto que la cirugía abierta aporta mejores resultados en varones jóvenes.
Tipo de anestesia
Una vez en quirófano, el anestesista toma el control del proceso de hemostasia hipotensiva, iniciado en el preoperatorio, en el servicio de urgencias o durante el traslado.
Se recomienda transfundir preferiblemente sangre y hemoderivados, y se aconseja el aporte de plasma y de hematíes en una proporción 1:1, evitando la politransfusión masiva (28) (Fig. 2).
La anestesia general, imprescindible en la cirugía abierta de un AAAr, debido a la vasoplejia de la inducción anestésica condiciona la necesidad de infundir grandes volúmenes para alcanzar un equilibrio de líquidos y una presión arterial adecuados; esta sobrecarga de líquidos incrementa el riesgo de hemorragia, hipotermia, coagulopatía y síndrome compartimental abdominal. Asimismo, la anestesia general, con el uso de miorrelajantes, desciende el tono de la pared abdominal y puede contribuir a la transformación de una rotura aórtica contenida en rotura franca (29). Las ventajas de la anestesia general son el control de la vía aérea y del dolor.
La reparación endovascular de un AAAr (REVAR) permite, a diferencia de la cirugía abierta, realizar el procedimiento con anestesia local, con o sin sedación asociada (30). El control del dolor por el anestesista es clave: debe intentar minimizar la dosis de mórficos para evitar los efectos colaterales de disminución de la consciencia.
La anestesia local preserva el tono simpático y evita el colapso circulatorio propio de la inducción en la anestesia general, aportando mayor estabilidad hemodinámica; asimismo, mantiene el tono muscular de la pared abdominal, lo que facilita el efecto taponamiento del hematoma retroperitoneal. Además, como cualquier procedimiento que se realiza con anestesia local, permite la monitorización constante del estado neurológico del paciente. Sus principales desventajas están relacionadas con una pérdida súbita del nivel de consciencia, la falta de control de la vía aérea, el control subóptimo del dolor y la incomodidad del paciente y/o del equipo quirúrgico (31).
Un análisis post hoc del estudio IMPROVE demostró una reducción de la mortalidad en los AAAr intervenidos con anestesia local (32), por lo que las guías de la ESVS sugieren el empleo de la anestesia local (recomendación de clase IIa, nivel de evidencia B) (10).
Aunque REVAR podría realizarse enteramente con anestesia local, siempre que el paciente se mantenga estable y consciente, no es infrecuente la conversión a anestesia general. Las razones más frecuentes son: shock hipovolémico, incomodidad del paciente y la necesidad de un acceso ilíaco. En caso de necesidad de conversión a anestesia general en las fases iniciales, se recomienda antes colocar un balón de oclusión aórtico con anestesia local. En otros casos, el tipo de anestesia se modifica una vez controlado el aneurisma para un mejor posicionamiento de la prótesis o para realizar el bypass fémoro-femoral en caso de endoprótesis aorto-monoilíaca. Por otra parte, la anestesia general puede ser beneficiosa al final del procedimiento y en el posoperatorio inmediato, cuando son necesarias maniobras de resucitación con volumen, para mejorar una situación respiratoria comprometida o aminorar un síndrome compartimental. La anestesia epidural no se utiliza en REVA, principalmente debido al riesgo de complicaciones espinales en pacientes con coagulopatía.
Clampaje aórtico y balón de oclusión aórtico (BOA)
En quirófano, el objetivo primero esencial ante un AAAr es el control de la hemorragia.
En cirugía abierta, especialmente en pacientes hemodinámicamente inestables, recientemente se ha preconizado el “endoclampaje” antes de realizar la laparotomía (33). Un balón de oclusión aórtica (BOA) es llevado vía femoral a través de un introductor 12-14F (45-60 cm) e hinchado por encima de la rotura del aneurisma. Starnes y cols. abogan por su uso sistemático en todos los pacientes antes de que aparezca la inestabilidad hemodinámica (“clamp before you cut”) (34). Con ello se previene el colapso circulatorio que puede producirse durante la inducción anestésica.
Tradicionalmente, en pacientes hemodinámicamente inestables, se realiza un clampaje supracelíaco convencional por vía media.
En REVAR, las guías europea y americana (10,19) recomiendan el uso de un balón compliant aórtico de oclusión en caso de inestabilidad hemodinámica grave, ya que en estos pacientes el control de la aorta tiene que ser inmediato. La guía europea puntualiza que su uso es independiente de que la exclusión del aneurisma se haga después con cirugía abierta o endovascular (recomendación de clase IIa en base a un nivel de evidencia C en las guías ESVS) (10). Además, con el empleo del balón se obtiene un margen de tiempo adicional, útil para que el equipo quirúrgico revise rápidamente las imágenes del TAC, planifique la intervención y seleccione la prótesis (en caso de EVAR), al tiempo que el anestesista pueda terminar de obtener todos los accesos.
El BOA se hinchará en función de la situación hemodinámica del paciente. Idealmente, el control aórtico proximal debería hacerse en el nivel más bajo que detenga la hemorragia, por lo que el BOA ha de llevarse primero a la aorta suprarrenal (generalmente por encima del tronco celíaco) y, en cuanto sea posible, bajarlo a posición infrarrenal o pararrenal. Con ello se minimiza el riesgo de isquemia espinal y visceral. En este punto, un detalle técnico importante es el mantenimiento firme del extremo final del balón y del introductor para evitar que la presión cuando suba lo desplace caudalmente.
Raux y cols. hallaron que el balón de oclusión endovascular en cirugía abierta comparado con el clampaje aórtico convencional se asocia a menor mortalidad intraoperatoria en pacientes inestables, pero sin disminuir la mortalidad intrahospitalaria (33).
En un metaanálisis que engloba 39 estudios, la mortalidad en AAAr en pacientes inestables es significativamente inferior en los que se empleó un balón de oclusión para controlar proximalmente la aorta (35).
Ocasionalmente se utiliza la vía braquial para introducir el BOA. Debido al calibre 12-14F del introductor, recomendamos el acceso quirúrgico de la arteria humeral alta/axilar. La ventaja de este acceso es que deja libre los accesos femorales para la endoprótesis, además de una mayor estabilidad del balón, que queda “calzado” en el cuello infrarrenal. Los riesgos de este acceso son la isquemia de miembro superior, embolización cerebral y las dificultades logísticas de un tercer acceso. Asimismo, la caterización del arco y de la aorta torácica descendente puede retrasar el endoclampaje.
En la actualidad hay en el mercado balones de oclusión aórtica de bajo perfil (7F) que permitirían su uso percutáneo (36).
Elección de endoprótesis
En REVAR se recomienda un mayor sobredimensionamiento de la prótesis (hasta un 30 %) debido al colapso circulatorio del paciente (37). Con ello se evitan endofugas de tipo I. El principal factor que condiciona la elección de una endoprótesis aortomonoilíaca o bifurcada es la anatomía aortolíaca. En este punto hay dos factores a considerar: 1) la necesidad de una cateterización rápida de la rama contralateral por inestabilidad hemodinámica, y 2) la presencia de enfermedad oclusiva significativa (calcificación), escaso calibre y/o tortuosidad de la arteria ilíaca contralateral interfiriendo con el acceso. En el primer supuesto es preferible una endoprótesis aortomonoilíaca, aunque es cierto que mediante un balón de oclusión podría estabilizarse al paciente e implantar una prótesis bifurcada.
En el segundo supuesto la elección de una endoprótesis aortomonoilíaca es más segura y evitaría complicaciones catastróficas en accesos ilíacos imposibles. Otros factores condicionantes de la elección protésica son: experiencia del cirujano, disponibilidad y estabilidad hemodinámica del paciente (38).
Los investigadores del estudio IMPROVE han señalado una menor tasa de infección para la endoprótesis bifurcada frente a aortomonoilíaca (39); sin embargo, esta última tiene ventajas, ya que es un procedimiento más rápido y sencillo, con menos limitaciones anatómicas y que requiere una menor disponibilidad de depósito. Su inconveniente técnico es que requiere realizar un bypass fémoro-femoral, con la consiguiente conversión a anestesia general.
En la figura 4 se propone un algoritmo de actuación en REVAR que aborda modalidad anestésica, empleo de BOA y tipo endoprotésico.
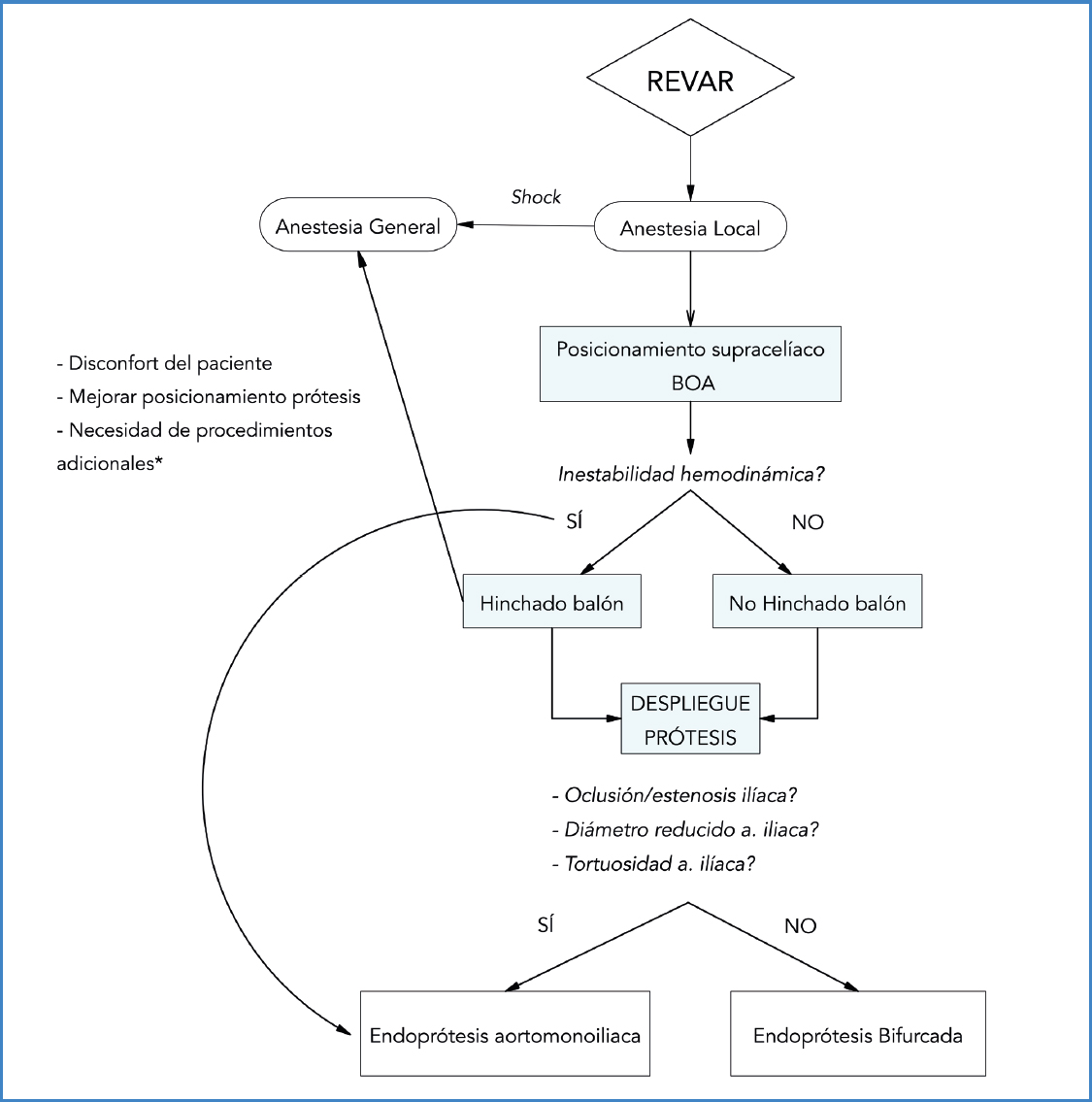
Figura 4. Algoritmo de actuación en REVAR (reparación endovascular de aorta abdominal). BOA: balón de oclusión aórtico.*Procedimientos adicionales: bypass fémoro-femoral, acceso ilíaco y endarterectomía.
Equipos quirúrgicos entrenados y con experiencia han visto cómo se reducía drásticamente el empleo de prótesis aortomonoilíacas frente a bifurcadas al aumentar experiencia en el EVAR. El empleo de endoprótesis aortomonoiliacas frente a las bifurcadas (40) es un factor independiente de mayor morbilidad.
Heparina intraoperatoria: ¿sí o no?
El riesgo de aumentar la hemorragia ha llevado a que la administración sistémica de heparina en la reparación de un AAAr sea un tema controvertido (41,42). Podría considerarse una vez realizado el control inicial en función de las pérdidas hemáticas previas, de los controles analíticos intraoperatorios de los parámetros de la coagulación y de la circulación de los miembros inferiores. En cualquier caso, en REVAR tan pronto como se despliegue la endoprótesis se aconseja administrar heparina. En cirugía abierta la no heparinización sistémica debe asociarse a gestos quirúrgicos básicos, tales como desclampaje momentáneo de la prótesis aórtica, antes de realizar las anastomosis distales, con heparización local de la misma, así como exploración con catéter Fogarty del eje fémoro-poplíteo-distal bilateral para extraer posibles trombos.
Tratamiento paliativo (desestimar la cirugía)
Cuando las probabilidades de supervivencia de un paciente con AAAr son muy bajas, el tratamiento paliativo puede presentarse como la mejor de las opciones, lo que evita el sufrimiento del paciente y de sus familiares.
En pacientes en los que, la cirugía abierta es prohibitiva por sus comorbilidades médicas si al mismo tiempo presentan una anatomía hostil para EVAR, se desaconseja rotundamente forzar esta técnica (19).
Se han propuesto multitud de escalas predictivas de mortalidad en AAAr (43) que podrían ayudar al cirujano en la toma de decisiones; sin embargo, ninguna ha demostrado ser absolutamente precisa. Ello ha llevado a que la guía clínica de ESVS sugiera que el tratamiento paliativo de un paciente con AAAr no puede estar basado únicamente en estas escalas (10).
La última de ellas que se ha propuesto es la escala de riesgo de Harborview, que considera únicamente variables preoperatorias. Factores predictivos de mortalidad tras cirugía abierta son: edad > 76 años, creatinina sérica > 2 g/dl, pH < 7,2 y presión arterial < 70 mmHg. Cuando los 4 están presentes, la mortalidad de la cirugía es del 100 % (44). Su aplicación podría ser muy útil para abortar traslados innecesarios al hospital de nivel terciario.
En las guías NICE (27) se destaca la falta de evidencia de las escalas de riesgo para determinar la idoneidad de la reparación, así como del traslado de un paciente con sospecha o confirmación de aneurisma roto, por lo que desaconseja su empleo.
Un punto controvertido en el manejo de un AAAr es la necesidad de RCP. Si bien es cierto que en este subgrupo de pacientes la mortalidad puede acercarse al 100 %, un estudio multicéntrico reciente ha mostrado que la mortalidad en pacientes que requieren RCP, a priori de pronóstico infausto, es equivalente a la del resto (45). Este hallazgo choca con la afirmación que aparece en las guías NICE de que la insignificante probabilidad de supervivencia en caso de parada cardíaca y/o pérdida de consciencia persistente debería limitar el tratamiento al final de la vida (27).
La edad avanzada como factor aislado no debe ser un criterio de exclusión quirúrgico. Metaanálisis y otros estudios realizados en octogenarios han revelado cifras de supervivencia aceptables (46-48).
POSOPERATORIO
Profilaxis de ETEV (enfermedad tromboembólica venosa)
Se sugiere diferir la profilaxis de trombosis venosa profunda (TVP) con heparina de bajo peso molecular hasta que la hemostasia sea satisfactoria, generalmente a las 24-48 h de la cirugía. Sin embargo, según American College of Chest Phisicians, un AAAr es una condición que representa un riesgo alto de TVP, por lo que la actitud más razonable es sopesar el riesgo de sangrado frente al de TVP de forma individualizada (49).
Síndrome de compresión abdominal
La hipertensión intraabdominal (HIA) se define como la presencia mantenida de una presión intraabdominal > 12 mmHg. Cuando la presión intraabdominal es > 20mmHg y se asocia a aparición de fallo orgánico, se habla de síndrome compartimental abdominal (SCA) (50).
Es una complicación relativamente frecuente, pero infradiagnosticada, que aparece tras la cirugía de AAAr (51) en aproximadamente un 7 % de los pacientes (52).. Por todo ello, desde la ESVS se establece como una recomendación de clase I, basada en un nivel de evidencia B, medir sistemáticamente la presión intraabdominal en todos los pacientes intervenidos (10). Las guías NICE subrayan la necesidad de que el clínico piense en esta entidad si tras la cirugía, abierta o endovascular, la evolución no es favorable (27).
Su diagnóstico se basa en un alto grado de sospecha clínica en pacientes con los siguientes factores de riesgo: pérdida de consciencia preoperatoria, baja presión arterial preoperatoria, necesidad de transfusiones masivas, uso de balón de oclusión aórtico, coagulopatía severa y necesidad de conversión de endoprótesis bifurcada a aortomonoilíaca (53).
El diagnóstico de sospecha de HIA/SCA debe llevar a instaurar precozmente tratamiento para reducir la PIA (10). Si fracasa el tratamiento conservador, ha de efectuarse una descompresión quirúrgica, preferentemente a través de una laparotomía media (52,54-56) (Fig. 5).

Figura 5. Algoritmo de manejo del síndrome de compresión abdominal tras cirugía abierta o endovascular de un aneurisma aórtico abdominal roto. HIA: hipertensión intraabdominal; SCA: síndrome compartimental abdominal; PIA: presión intraabdominal.
Un aspecto novedoso que aporta la actual guía sobre AAAr de la Society for Vascular Surgery (19,57), no presente en la guía europea, se refiere al establecimiento de un marco de tiempo de menos de 90 minutos para la reparación del aneurisma. Primera fase (30 minutos), comprendida desde la primera valoración médica hasta que el equipo de cirugía vascular es alertado del diagnóstico y decide su traslado, si procede. Segunda fase (30 minutos), representa el periodo del manejo perioperatorio y transferencia del paciente al centro de referencia. Tercera fase (30 minutos), desde que el equipo vascular evalúa al paciente (o lo recibe, si es derivado de otro hospital) hasta la colocación de un balón aórtico en quirófano (Fig. 2). Se aconseja que en pacientes que requieran ser trasladados a un hospital de referencia el objetivo 30-30-30 = 90 minutos sea la meta a alcanzar. Asimismo, las guías NICE coinciden en afirmar que el traslado emergente al centro de referencia, una vez dada la orden de transferencia del AAAr, debería tener lugar en 30 minutos (27).
La protocolización de los procesos y actuaciones multidisciplinarias en un área geográfica, sumando el componente de coordinación y celeridad, conforman el denominado Código Aneurisma, ya implantado en España en el Servicio Andaluz de Salud y preliminarmente en la Comunidad de Madrid (58).
En definitiva, el afán común en la rotura de un AAA ha de ser la puesta en marcha y el cumplimiento de protocolos basados en la evidencia científica, con algoritmos y listas de verificación, para reducir el tiempo desde el fatal evento a la reparación quirúrgica. Esto redundaría, invariablemente, en un aumento de la supervivencia de esta entidad.














