INTRODUCCIÓN
El cáncer asociado a enfermedad tromboembólica venosa (ETV) representa el 20 % de todas las ETV (1), pero la verdadera importancia de la ETV en estos pacientes es ser su segunda causa de muerte (2). El diagnóstico de ETV en pacientes con cáncer es frecuente, pues a este factor predisponente se añaden otros conocidos factores desencadenantes de ETV, como la elevada edad de muchos pacientes (y sus posibles comorbilidades), el empleo de catéteres venosos centrales, la quimioterapia o la cirugía (3). Al mismo tiempo, la incidencia de ETV está aumentado, entre otros motivos, por la mayor supervivencia de los pacientes con cáncer (4).
En todas las guías de práctica clínica las heparinas de bajo peso molecular (HBPM) son el estándar del tratamiento inicial y a largo plazo de las ETV asociadas a cáncer. Disponiendo de HBPM, las anti vitaminas K (AVK) son inaceptables en este grupo de pacientes. No obstante, la anticoagulación en esta población se asocia a un importante riesgo anual de recurrencia de ETV (10-20 %) y de hemorragia (8-10 %) (5).
En la búsqueda del anticoagulante ideal surgen los anticoagulantes orales directos (AOD) (6,7). Estos fármacos han demostrado un efecto comparable (en eficacia y en seguridad) al tratamiento convencional de la ETV (HBPM con o sin AVK). Sin embargo, en poblaciones específicas, como el caso del cáncer, persisten algunas controversias. Esclarecerlas son el motivo de la presente revisión.
BREVE HISTORIA DE LA RELACIÓN ETV-CÁNCER
La relación entre la ETV y el cáncer data del siglo XIX, cuando Armand Trousseau (1801-1867), un médico francés que alcanzó un enorme prestigio en su época, describió la asociación entre tromboflebitis y cáncer (síndrome de Trousseau o signo de malignidad de Trousseau), caracterizada por la aparición de trombosis venosas recurrentes en localizaciones inusuales, lo que podía constituir la manifestación de un tumor maligno. En 1865 determinó que la tromboflebitis (phlegmasia alba dolens) reflejaba la presencia de un carcinoma visceral. Irónicamente, en 1867 el propio Trousseau desarrolló una trombosis venosa profunda en su pierna izquierda y reconoció el pronóstico de su enfermedad cancerosa (de estómago), que lo llevó a la muerte seis meses más tarde (8).
En el curso de ciertas neoplasias es frecuente asistir al desarrollo de una ETV, que incrementa el riesgo 2-3 veces (9). Históricamente se han señalado distintas formas de trombosis venosa (tromboflebitis migratoria, flegmasia cerúlea) en relación con cánceres de páncreas, de pulmón, de estómago, neoplasias genitourinarias, de colon y de mama. La asociación de trombosis venosas en estados terminales en pacientes cancerosos se conoce desde hace muchos años, y fue resaltada por Sproul en 1938 (10).
En décadas posteriores, diferentes investigaciones identificaron la naturaleza multifactorial de la fisiopatología de la hipercoagulabilidad de la sangre asociada al cáncer, explicada por leucocitosis, trombocitosis, aumento de la circulación del factor tisular y citocinas inflamatorias (11). Durante muchos años, la ETV se consideró una secuela del cáncer y su valor pronóstico no se apreció hasta una época reciente. En 2007, Mandala y cols. (12) demostraron que la presencia de ETV es un factor pronóstico negativo en general y en particular para la supervivencia de los pacientes con un adenocarcinoma ductal pancreático irresecable. En 2018, Fuentes y cols. (13) demostraron que la ETV en el cáncer gástrico es un predictor de mortalidad independiente. Indudablemente el cáncer de páncreas y el de estómago son de los tumores sólidos más trombogénicos.
Por otro lado, es bien conocido que la cirugía oncológica pélvica y la abdominal o la quimioterapia son factores de riesgo independientes para desarrollar una ETV (14). La necesidad de profilaxis antitrombótica perioperatoria en este tipo de pacientes es un hecho bien determinado (15).
Finalmente, es importante conocer que el 75 % de los eventos de la ETV suceden en pacientes ambulatorios y que la tromboprofilaxis primaria en pacientes con cáncer es un área de gran interés. Con ese objetivo se realizaron los ensayos AVERT (apixabán) (16) y CASSINI (rivaroxabán) (17). Aunque importante, el tema de la profilaxis primaria en pacientes con cáncer no es el objetivo de la presente revisión.
MATERIAL Y MÉTODO
Definiciones
– Enfermedad tromboembólica venosa (ETV). Proceso caracterizado por la formación de un trombo (coágulo sanguíneo) en el interior de una vena (generalmente en el sistema venoso profundo = trombosis venosa profunda [TVP]) que puede crecer o fragmentarse, con lo que interrumpe la circulación normal de la sangre u ocasiona una embolia pulmonar (EP). Es decir, la ETV une la TVP con su más peligrosa y potencial complicación: la EP.
– Pacientes con cáncer. Cáncer activo, diagnosticado o tratado 6 meses antes, recurrente, regionalmente avanzado o metastásico. Cáncer que no está en remisión completa.
-
– Fases del tratamiento de la ETV. El tratamiento de la TVP de las extremidades inferiores se divide en tres fases (Fig. 1):
Inicial (diagnóstico: primeros 5-10 días) = tratamiento de la fase aguda.
Largo plazo (hasta los primeros 3-6 meses) = prevención de recurrencias a corto-medio plazo. Finaliza con la decisión de suspender o continuar con el tratamiento.
Extendida (desde los 3-6 meses hasta un límite temporal no predefinido, incluso indefinido) = prevención de recurrencias a largo plazo.
– Anticoagulantes orales directos (AOD). Son fármacos inhibidores directos de la trombina (dabigatrán) o del factor X activado (apixabán, edoxabán y rivaroxabán) administrados por vía oral, aprobados para el tratamiento de la ETV. Un quinto AOD anti-FXa, betrixabán, actualmente solo está aprobado para la prevención de la ETV en pacientes médicos hospitalizados. Sus ventajas e inconvenientes se aprecian en la tabla I.
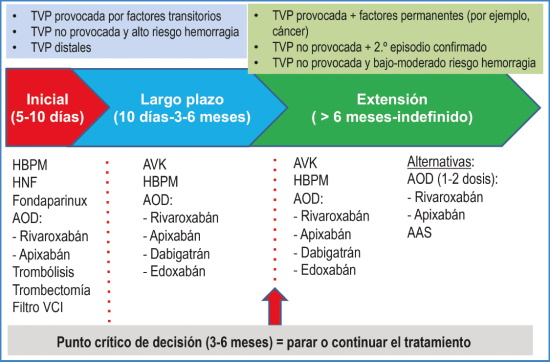
Figura 1. Fases del tratamiento de la enfermedad tromboembólica venosa de las extremidades inferiores y opciones terapéuticas. HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; AOD: anticoagulantes orales directos; AVK: anti vitaminas K; VCI: vena cava inferior; AAS: ácido acetilsalicílico.
Búsqueda
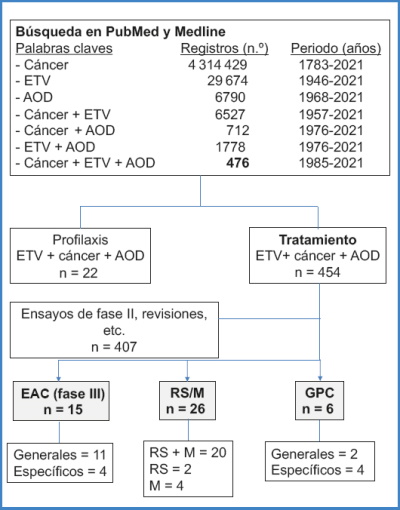
Se ha realizado una revisión bibliográfica en PubMed y Medline hasta el 31 de marzo de 2021. Se han empleado las siguientes palabras claves, aisladas y combinadas: “Venous Thromboembolism”, “Cancer” y “Direct Oral Anticoagulants”. Únicamente se han incluido en esta revisión ensayos aleatorios y controlados (EAC) (de fase III), revisiones sistemáticas (RS), metaanálisis (M) y guías de práctica clínica (GPC) (Fig. 2).
RESULTADOS Y DISCUSIÓN
Ensayos aleatorios y controlados de fase III
EAC en población general (ETV de diversas etiologías)
Entre 2009 y 2014 se han publicado seis EAC de fase III con AOD (RE-COVER I y II, EINSTEIN DVP y EP, AMPLIFY y HOKUSAY DVT) (18-23) para el tratamiento de la fase inicial (rivaroxabán y apixabán) y a largo plazo (dabigatrán, rivaroxabán, apixabán y edoxabán) de la ETV. Globalmente, los AOD mostraron, en una población general de pacientes con ETV, un efecto comparable (en eficacia y seguridad) al tratamiento convencional (HBPM o AVK) (Tabla II).
Tabla II. Tratamiento inicial y a largo plazo de la ETV. Ensayos clínicos de fase III con anticoagulantes orales directos
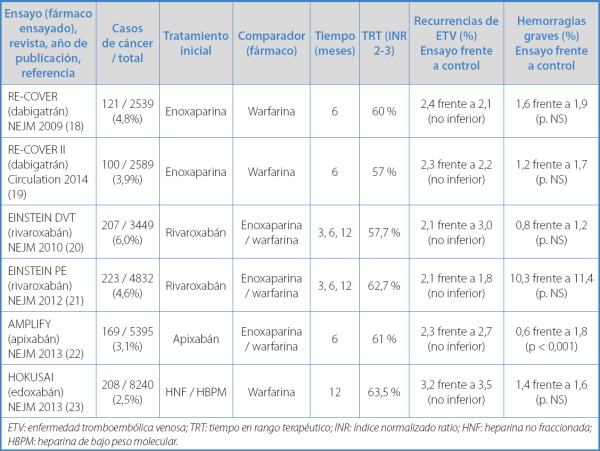
ETV: enfermedad tromboembólica venosa; TRT: tiempo en rango terapéutico; INR: índice normalizado ratio; HNF: heparina no fraccionada; HBPM: heparina de bajo peso molecular.
Estos ensayos incluyeron 27 044 pacientes con ETV, de los que 1028 asociaban cáncer (media: 3,8 %; intervalo: 2,5-6,0 %). Este subgrupo de pacientes fue la fuente fundamental de evidencia hasta 2018, fecha en la que se publican los primeros EAC de fase III con AOD en el tratamiento de la ETV en pacientes exclusivamente con cáncer.
Al mismo tiempo, entre 2010 y 2017 se publicaron otros cinco EAC de fase III con AOD (RE-MEDY y RE-SONATE con dabigatrán, EINSTEIN-EXT y EINSTEIN CHOICE con rivaroxabán y AMPLIFY-EXT con apixabán) con el objetivo de valorar la extensión del tratamiento de la ETV (mínimo 12 meses de tratamiento) (20,24-26). Todos ellos, salvo RE-SONATE (en el que no se incluyó ningún paciente con cáncer por ser una causa de exclusión del ensayo), incluyeron algunos pacientes ETV-cáncer, pero su número (y su porcentaje) fue inferior a los ensayos anteriormente comentados (304 casos de ETV-cáncer sobre 9934 pacientes; media: 3,1 %; intervalo: 1,7-4,5 %). Salvo RE-MEDY, las revisiones sistemáticas y los metaanálisis no han incluido estos ensayos.
EAC en poblaciones específicas (ETV y cáncer)
Entre 2018 y 2020 se han publicado cuatro EAC de fase III con AOD (Hokusay VTE-Cancer, SELECT-D, ADAM-VTE y CARAVAGGIO) (27-30) para el tratamiento de la fase inicial (rivaroxabán y apixabán) y a largo plazo (edoxabán, rivaroxabán, y apixabán) de la ETV en pacientes exclusivamente con cáncer (Tabla III).
Tabla III. Tratamiento inicial y a largo plazo de la ETV en pacientes con cáncer. Ensayos clínicos de fase III con anticoagulantes orales directos
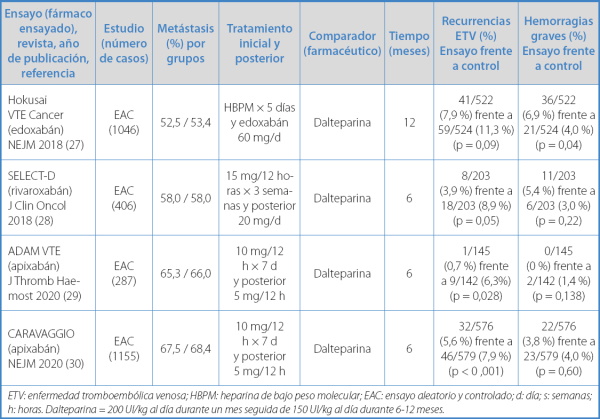
ETV: enfermedad tromboembólica venosa; HBPM: heparina de bajo peso molecular; EAC: ensayo aleatorio y controlado; d: día; s: semanas; h: horas. Dalteparina = 200 UI/kg al día durante un mes seguida de 150 UI/kg al día durante 6-12 meses.
Estos ensayos incluyeron un total de 2894 pacientes. Es importante señalar que más del 50 % presentaba metástasis (intervalo, 52,5-68,4 %). El objetivo de estos ensayos fue explorar el tratamiento de la ETV en la fase inicial (rivaroxabán y apixabán; edoxabán requiere de HBPM previa) y a largo plazo (los tres fármacos); es decir, durante al menos 6 meses de tratamiento (el ensayo con edoxabán llegó hasta los 12 meses).
Todos estos ensayos mostraron, de forma significativa, mayor eficacia de los AOD en reducir la recurrencia de ETV frente a HBPM. Respecto de las hemorragias graves, los AOD presentaron menor incidencia en dos ensayos (ambos con apixabán) y mayor incidencia en los otros dos, si bien globalmente las diferencias no fueron significativas en 3 de los 4 ensayos (rivaroxabán en un ensayo y apixabán, en dos) (Tabla III).
Revisiones sistemáticas y metaanálisis
Entre 2014 y 2021 se han publicado 26 revisiones sistemáticas o metaanálisis (31-56); un número de informes muy elevado (más de 3 por año) que refleja el interés por el tema que nos ocupa y las expectativas que suscitan los AOD.
Como hemos referido con anterioridad, hasta 2018, cuando aparecen los primeros EAC de fase III con AOD en el tratamiento de la ETV en pacientes con cáncer, la evidencia procedía de los pequeños subgrupos ETV-cáncer de los grandes ensayos generales. Por ese motivo, la información que aportan las diferentes RS/M ha variado con el tiempo. A partir del 2020 las revisiones sistemáticas ya incorporan los cuatros ensayos específicos referidos. Las conclusiones más significativas de estas numerosas RS o M pueden apreciarse en la tabla IV.
Tabla IV. Tratamiento de la ETV en pacientes con cáncer. Revisiones sistemáticas (RS) y metaanálisis (M) con anticoagulantes orales directos (AOD)
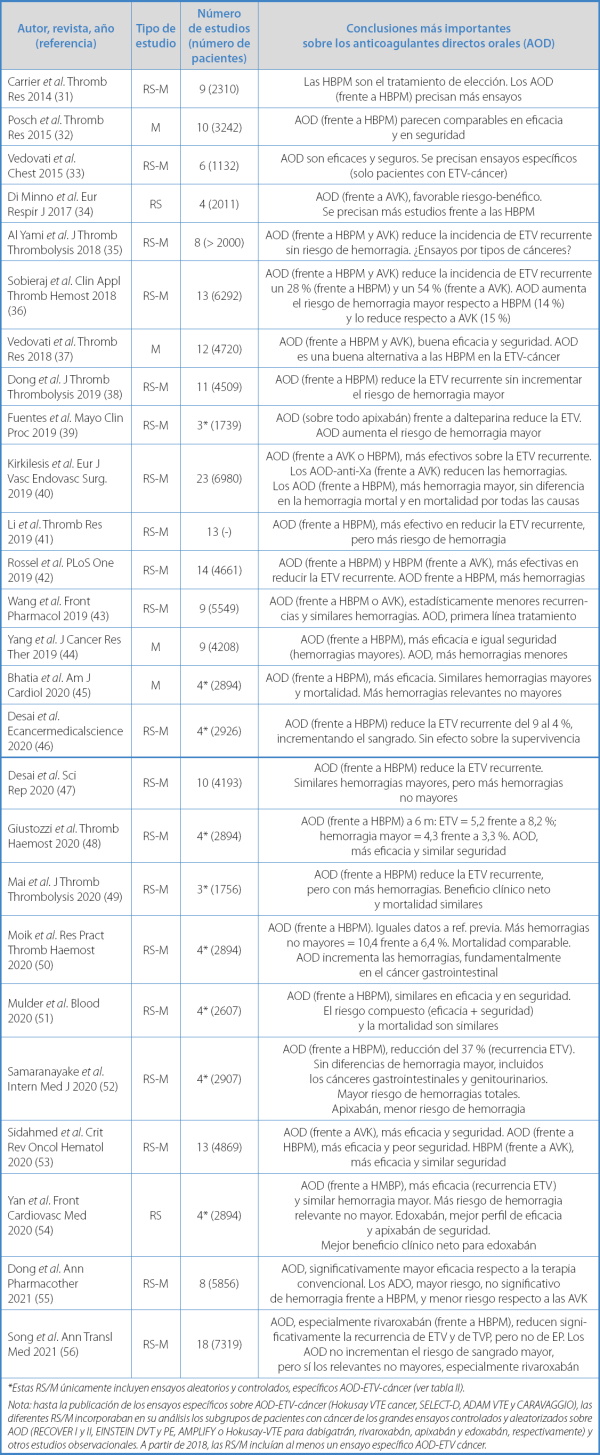
*Estas RS/M únicamente incluyen ensayos aleatorios y controlados, específicos AOD-ETV-cáncer (ver tabla II).Nota: hasta la publicación de los ensayos específicos sobre AOD-ETV-cáncer (Hokusay VTE cancer, SELECT-D, ADAM VTE y CARAVAGGIO), las diferentes RS/M incorporaban en su análisis los subgrupos de pacientes con cáncer de los grandes ensayos controlados y aleatorizados sobre AOD (RECOVER I y II, EINSTEIN DVT y PE, AMPLIFY o Hokusay-VTE para dabigatrán, rivaroxabán, apixabán y edoxabán, respectivamente) y otros estudios observacionales. A partir de 2018, las RS/M incluían al menos un ensayo específico AOD-ETV cáncer
De todas las RS/M seleccionamos las siete que analizan exclusivamente los cuatro ensayos ETV-cáncer (45,46,48,50-52,54). Hay que destacar que estos ensayos compararon un AOD (edoxabán, rivaroxabán o apixabán en dos estudios) frente a dalteparina (en todos se empleó el mismo comparador). Todas estas RS/M llegaron a la misma conclusión general: los AOD analizados respecto a dalteparina presentan: a) mayor eficacia, ya que reducen significativamente los eventos recurrentes, y b) similar seguridad sobre las hemorragias mayores y la mortalidad; sin embargo, los AOD presentan más hemorragias clínicamente relevantes no mayores.
Son aspectos particulares de estas RS/M que las hemorragias son más frecuentes en los cánceres gastrointestinales (50) y que apixabán presenta el mejor perfil de seguridad (52,54).
Por tanto, los AOD son una opción eficaz en el tratamiento de pacientes con cáncer y ETV (fase inicial y a largo plazo), con la precaución de identificar los pacientes de alto riesgo de hemorragia (por ejemplo, cáncer del tracto digestivo), pues algunos AOD presentan mayor riesgo de hemorragia, fundamentalmente las denominadas hemorragias clínicamente relevantes no mayores.
Guías de práctica clínica
GPC generales (ETV)
En 2016, la décima edición de la guía del American College of Chest Physicians (ACCP) incluyó por primera vez una recomendación sobre los AOD en el tratamiento de la ETV en pacientes con cáncer (57).
En 2021, la European Society for Vascular Surgery (ESVS) ha publicado la primera GPC de esta sociedad sobre el manejo de la ETV. En ella existe un capítulo dedicado al tratamiento de la ETV asociada al cáncer, incluyendo los AOD y proponiendo una recomendación al respecto (58).
GPC específicas (ETV en cáncer)
La International Iniciative on Thrombosis and Cancer (ITAC) publicó sus primeras GPC sobre profilaxis y tratamiento de la ETV en pacientes con cáncer en 2013. Estas se revisaron en 2016 y en 2019 (59). Dichas guías han sido avaladas por la International Society on Thrombosis and Haemostasis (ISTH). Como aspecto específico, cabe referir que en 2018 la Scientific and Standardization Committee de la ISTH (60) publicó recomendaciones específicas del papel de los AOD en el tratamiento de la ETV asociada a cáncer.
La American Society of Clinical Oncology (ASCO) publicó en 2007 sus primeras GPC sobre profilaxis y tratamiento de la ETV en pacientes con cáncer. Revisiones posteriores se publicaron en 2013, 2015 y 2019 (61).
Finalmente, en 2021, la American Society of Hematology (ASH) publicó su GPC específica para ETV-cáncer, coordinada con otros nueve paneles de la ASH y el centro McMaster (paneles que abordaban otros aspectos de la ETV) (62).
Las recomendaciones de las referidas GPC se presentan “literalmente” en el anexo 1. Siguiendo a Pernaud (63), podemos resumir que las directrices recomiendan los AOD como alternativa aceptable a las HBPM para el tratamiento de ETV asociado con cáncer, pero sugieren HBPM en pacientes con cáncer gastrointestinal o historia de hemorragia digestiva. En cualquier caso, los AOD permiten una individualización del tratamiento.
Anexo 1. Tratamiento de la ETV en pacientes con cáncer. Recomendaciones de las guías de práctica clínica sobre anticoagulantes orales directos (AOD)

ETV: enfermedad tromboembólica venosa; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; AVK: anti vitaminas K; AOD: anticoagulantes orales directos; ACCP: American College Chest Physicians; ESVS: European Society Vascular Surgery; SSC: Scientific and Standardization Committee; ITAC: International Iniciative on Thrombosis and Cancer; ISTH: International Society on Thrombosis and Haemostasis; ASCO: American Society of Clinical Oncology; ASH: American Society of Hematology.
CONCLUSIONES
El perfil farmacológico de los AOD, fármacos próximos al anticoagulante ideal, los hacen muy atractivos para médicos y pacientes.
Los AOD han revolucionado el tratamiento de la ETV en general y la ETV-asociada al cáncer en particular.
La evidencia científica sobre los AOD en el tratamiento de la ETV asociada a cáncer comienza a ser importante.
Se dispone de información sólida sobre el tratamiento de la fase inicial y a largo plazo (6 meses) de la ETV asociada a cáncer. Por el contrario, apenas existe información sobre la extensión del tratamiento (pasados 6 meses) de la ETV asociada a cáncer, aspecto este último relevante en este tipo de pacientes.
Los AOD muestran mayor eficacia (prevención de recurrencias de la ETV) y similar seguridad (hemorragias mayores) respecto a las HBPM.
Los AOD presentan mayor número de hemorragias clínicamente relevantes no mayores que las HBPM. Los cánceres gastrointestinales y urológicos presentan mayor predisposición a las hemorragias durante el empleo de los AOD.
De los cinco AOD comercializados, solo tres (edoxabán, rivaroxabán y apixabán) tienen ensayos específicos (ETV-cáncer). Existen algunas diferencias entre los distintos AOD en lo que respecta a su perfil de riesgo/beneficio y beneficio neto.
En la decisión de prescribir un AOD, es muy importante atender las preferencias del paciente y decidir sobre: ¿riesgos o beneficios?, ¿tratamiento oral o parenteral?, ¿costes?, etc.