INTRODUCCIÓN
La enfermedad arterial periférica es una condición caracterizada por una disminución del flujo sanguíneo arterial posterior al arco aórtico secundaria a un mecanismo obstructivo, sea intrínseco o extrínseco, principalmente provocada por ateroesclerosis, y esta a su vez se genera por una acumulación anormal de partículas lipoproteicas (LDL) y de tejido fibroso entre la capa íntima y muscular de la pared arterial. Dentro de sus formas de presentación se encuentran la claudicación intermitente, el dolor en reposo (estos con cambios tróficos debido a isquemia como la ulceración) y la isquemia crítica de miembros inferiores (1,2). Muchos estudios han demostrado su relación directa con un aumento en la morbilidad y en la mortalidad cardiovascular y con el desarrollo de enfermedad arterial periférica. Un índice tobillo-brazo (ITB) ≤ 0,90 se asocia con más del doble de tasas de eventos coronarios, mortalidad por eventos CV y mortalidad total a 10 años. Después de 5 años, el 20 % de los pacientes con claudicación intermitente (CI) presentan infarto de miocardio (IM) o ictus y la mortalidad es del 10-15 %. El diagnóstico oportuno y un manejo adecuado son de vital importancia para minimizar las complicaciones mencionadas (2).
DESARROLLO
Fisiopatología
La acumulación anormal de lípidos y de tejido fibroso por debajo de la íntima vascular puede provocar un estrechamiento de la luz del vaso. Múltiples factores contribuyen a la patogenia de la ateroesclerosis, entre los que se incluyen la disfunción endotelial, la dislipidemia, factores inflamatorios e inmunológicos y el tabaquismo (1,3).
El endotelio representa una interfase biológica entre la sangre y el resto de los tejidos, además de que tiene propiedades como regulación del tono, crecimiento y hemostasia. Cuando existe una disfunción endotelial se pierde la liberación de óxido nítrico, lo que disminuye su acción antiinflamatoria y vasodilatadora. Simultáneamente, mientras se lleva a cabo un proceso inflamatorio, se produce la acumulación de LDL en la pared arterial y las células endoteliales expresan varias moléculas de adhesión (VCAM-1, adhesinas), lo que permite la adherencia leucocitaria con la posterior acumulación de macrófagos inflamatorios (3,4). Estos leucocitos activados liberan enzimas proteolíticas y una variedad de factores de crecimiento peptídicos y citoquinas que degradan las proteínas de la matriz y estimulan las células musculares lisas, las células endoteliales y los macrófagos. Es entonces que las células espumosas se agregan como efecto del depósito de macrófagos de LDL oxidadas. Posteriormente, el calcio se acumula en el ateroma con la expresión de las células musculares y de las proteínas involucradas en la osteogénesis. De esta forma, el depósito de estos en las arterias de los miembros inferiores lleva a una estrechez progresiva hasta formar una insuficiencia arterial (3,4).
Se ha establecido una participación de desórdenes oxidativos dentro de la fisiopatología de la EAP, ya que el conocimiento avanzado sobre los biomarcadores oxidativos liberados en el torrente sanguíneo y sobre los biomarcadores inflamatorios que causan disfunción endotelial nos sugiere que la detección de oxidantes tanto en pacientes con EAP sintomáticos como asintomáticos será una herramienta útil para monitorear la eficacia de los tratamientos para la EAP (16).
Los síntomas debidos a un estrechamiento de la luz vascular dependerán del territorio donde se da lugar la formación de la placa de ateroma, así como del grado de obstrucción que esta genera (4,5).
Epidemiología
La prevalencia mundial de la enfermedad arterial periférica se encuentre entre el 3 y el 12 %. La mayoría de las personas con esta patología (70 %) vive en regiones de escasos o de moderados recursos. En el estudio NHANES de Estados Unidos, donde la EAP se definió como un índice tobillo-brazo < 0,9 en cualquier pierna, la prevalencia de EAP en personas en torno a los 40 años fue del 4,3 %. En este estudio, más del 95 % de pacientes con EAP tenían uno o más factores de riesgo cardiovascular (5).
La prevalencia de EAP está fuertemente relacionada con la edad: aumenta > 10 % entre los pacientes de entre 60 y 70 años. La prevalencia parece ser mayor entre los hombres que entre las mujeres para la enfermedad más grave o sintomática (6).
Factores de riesgo
Los factores de riesgo para EAP son similares a aquellos que promueven el desarrollo de ateroesclerosis coronaria. De acuerdo con la guía ACC/AHA de la American College of Cardiology/American Heart Association, se identifican grupos de riesgo que están asociados con un aumento en la prevalencia de EAP y el aparecimiento temprano de su forma sintomática (8) (Tabla I):
Los factores de riesgo para el desarrollo de la enfermedad arterial periférica son:
– Edad: la prevalencia de EAP aumenta progresivamente con la edad. Se inicia después de los 40 años. La relación entre la edad y la EAP se estableció en el estudio NHANES (de 40 a 49 años: 0,9 %; de 50 a 59 años: 2,5 %; de 60 a 69 años: 4,7 %; > 70 años: 14,5 % y > 80 años: 23,2 %) (6).
– Sexo: la prevalencia de EAP, sea esta sintomática o asintomática, es mayor en hombres que en mujeres, principalmente en los grupos más jóvenes. En pacientes con CI la relación de hombres a mujeres es de 1:1 y 2:1. Esta se incrementa en algunos estudios al menos a 3:1 en estadios más avanzados, como isquemia crítica de miembros inferiores (5,7).
– Raza: la prevalencia de EAP es mayor en individuos de raza negra (prevalencia del 7,8 % frente al 4,9 % en relación con individuos no hispánicos) (6,8).
-
– Tabaquismo: fumar está directamente relacionado con la enfermedad cardiovascular. El mecanismo por el cual el cigarrillo promueve el aparecimiento o la progresión de la aterosclerosis no está claro, pero sus efectos incluyen: daño endotelial, proliferación de músculo liso vascular, trombofilia, inflamación y otras anormalidades metabólicas (4).
En el estudio NHANES, el riesgo de EAP se incrementó en fumadores activos, mientras que no hubo asociación con otras formas de exposición al cigarrillo (5,6).
Además, existe evidencia de que la cantidad de cigarrillos que se consumen está en estrecha relación con el aparecimiento de EAP. Asimismo, el Framingham Heart Study encontró que el riesgo de desarrollar claudicación estaba directamente relacionado con la cantidad de cigarrillos fumados, con un aumento del riesgo de 1,4 veces por cada 10 cigarrillos fumados por día (8).
-
– Diabetes: la claudicación intermitente es aproximadamente el doble de común entre los pacientes diabéticos que entre los pacientes no diabéticos y la asociación entre la diabetes mellitus y el desarrollo de PAD ahora está bien establecida. Además, la EAP en pacientes con diabetes es más agresiva, con compromiso temprano de grandes vasos junto con microangiopatía.
Los pacientes con diabetes tienen enfermedad arterial avanzada al momento del diagnóstico. El estudio NHANES encontró un aumento en el riesgo de EAP en pacientes con diabetes (OR 2,71; IC 95 %, 1,03-7,12). Los pacientes diabéticos con CI tienen un 35 % de riesgo de isquemia súbita y un 21 % de riesgo de amputación mayor frente al 19 y al 3 %, respectivamente, de los pacientes no diabéticos (8).
– Hipertensión: su relevancia como factor de riesgo es menor que la del tabaquismo y que la de diabetes. No obstante, se considera que el riesgo de desarrollar EAP es el doble en pacientes con hipertensión en comparación con los controles (6,7).
– Hiperlipidemia: los pacientes con EAP tienen mayores niveles de triglicéridos o colesterol, lipoproteína (A) y de apolipoproteína B en comparación con pacientes sin EAP. Además, las lipoproteínas protectoras (HDL) están disminuidas. El tratamiento de hiperlipidemia puede disminuir el riesgo de progresión de EAP y la incidencia de claudicación intermitente (8,9).
– Homocisteína: este es uno de los marcadores más tempranos que se encuentran en relación con el aparecimiento de ateroesclerosis (esta se encuentra elevada en el 40 % de los pacientes con EAP) (5).
Manifestaciones clínicas
La enfermedad arterial periférica puede cursar de manera asintomática, especialmente en sus primeros estadios; por otro lado, cuando aparecen manifestaciones clínicas se deben predominantemente al estrechamiento progresivo de la luz vascular. En la tabla II se detallan las distintas manifestaciones de la enfermedad (9).
Los síntomas en pacientes con enfermedad arterial periférica pueden estratificarse a su vez de acuerdo a varios sistemas de clasificación que han venido implementándose, entre ellos, los más utilizados son la clasificación de Leriche-Fontaine (Tabla III) y la clasificación de Rutherford (Tabla IV). Esta última es la más reciente y en la que se basan la mayoría de los estudios actuales (el impedimento para caminar que define la claudicación leve, moderada y severa se especifica mediante el rendimiento en una prueba de cinta rodante de cinco minutos a 2 mph (3,218 km/h) con una inclinación del 12 % en la clasificación de Rutherford. Como parte de la clasificación de Fontaine se especifica como 650 pies (200 metros). Estas clasificaciones tienen un valor muy útil, ya que confieren un valor pronóstico y permiten una indicación del tratamiento de acuerdo con su grado (9,10).
La etapa I se caracteriza por la ausencia de síntomas. Incluye pacientes con EAP, pero sin repercusiones clínicas. Existen pacientes asintomáticos que tienen una extensa lesión arterial oclusiva en las piernas y un estilo de vida sedentario o están incapacitados por una enfermedad osteomuscular o neurológica. En estas situaciones, los pacientes pueden manifestar isquemia crítica directamente desde una etapa asintomática (8,9).
La etapa II se caracteriza por la presencia de claudicación intermitente. Esta etapa se divide a su vez en dos grupos: el IIA se refiere a pacientes con claudicación no invalidante o a largas distancias, mientras que el IIB se refiere a pacientes con claudicación a cortas distancias o que impiden la funcionalidad diaria (8,9).
La claudicación intermitente típica de los pacientes con EAP se define como la aparición de dolor en las masas musculares provocado por la marcha y que cesa inmediatamente después de suspender el ejercicio. Es importante señalar que el dolor siempre se presenta en los mismos grupos musculares y después de recorrer una distancia similar, siempre que se mantengan la misma pendiente y la misma velocidad (8,9).
La etapa III representa una fase más avanzada. Se caracteriza por la presencia de dolor (síntoma predominante) en grupos musculares determinados con el paciente en reposo, aunque también suelen presentar parestesias/hipoestesias en la parte delantera del pie y en los dedos. Estas parestesias en reposo suelen ser indistinguibles de las que se producen por la neuropatía diabética, aunque estas últimas suelen tener una distribución bilateral, simétrica, en calcetín. En esta etapa, el paciente suele presentar la extremidad fría, con un grado variable de palidez. Otros pacientes en cambio presentan una isquemia mayor, con una eritrosis del pie colgante debido a una vasodilatación cutánea extrema denominada “pata de langosta” (8,9).
El último grado de clasificación de Fontaine se caracteriza por cambios tróficos (úlceras) debidos a la reducción crítica de la perfusión distal a las lesiones. Estas se sitúan generalmente en las extremidades de los miembros, generalmente en los dedos, o también en el maléolo o en el talón. Pueden ser indoloras en el caso de pacientes con diabetes concomitante y son susceptibles de presentar infección y de manifestarse bajo la condición de un pie diabético, para lo que se encuentra el sistema de clasificación WiFi, que las clasifica en tres factores: la herida, la gravedad de la isquemia y la presencia de infección en el pie (8,9).
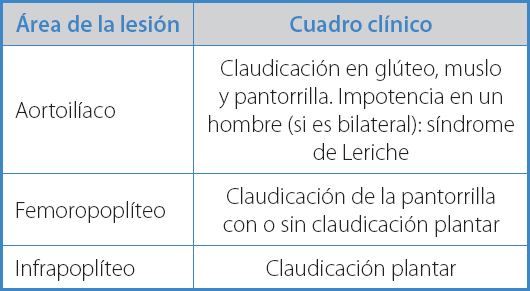
El grupo muscular afectado dependerá de la ubicación de la lesión oclusiva, aunque la mayoría presenta claudicación en el grupo muscular de la pantorrilla. La presencia de claudicación en las nalgas o en los muslos puede sugerir un nivel de lesión en la región ilíaca. En la tabla V se observan los síntomas acordes al área de lesión arterial (10).
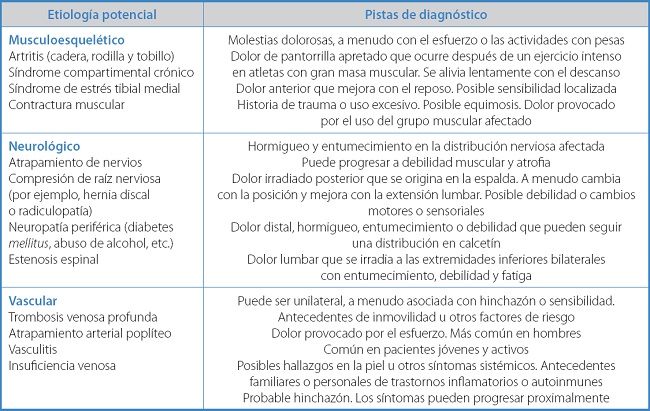
Existen muchos pacientes que presentan dolor muscular en las extremidades inferiores, pero no asociado a EAP. En estos casos, deberá realizarse un adecuado diagnóstico diferencial con otras patologías, que se encuentran en la tabla VI (10,11).
La examinación básica del sistema arterial está basada principalmente en la evaluación de la presencia de pulsos. Dentro de los miembros inferiores encontramos: pulso femoral, poplíteo, pedio y tibial posterior. En el caso de que la lesión se encuentre a nivel aortoilíaco, la ausencia o la disminución de todos los pulsos mencionados de la extremidad afectada son notorias. Por otro lado, en el caso de afectación a nivel femoropoplíteo, el pulso a nivel femoral está conservado. La presencia de soplos en la auscultación abdominal es indicativa de lesiones a nivel aórtico (11,12).
La auscultación de la región inguinal puede revelar la presencia de lesiones en los vasos ilíacos externos o en la bifurcación femoral. También es importante revisar la temperatura, el color y el trofismo del pie. Pacientes con claudicación (grado II de Fontaine) no suelen mostrar una reducción de la temperatura o llenado capilar. La frialdad y la palidez, con o sin cianosis o eritrosis colgante, son comunes en pacientes con isquemia crítica. Finalmente, el examen de las extremidades superiores no debe olvidarse, así como tampoco la auscultación cervical, debido a la gran prevalencia de lesiones carotídeas o de lesiones del tronco supraaórtico, que en la mayoría de los casos son subclínicas (13).
Diagnóstico
Para el diagnóstico de EAP, es necesaria una adecuada historia clínica con la presencia de historial de factores de riesgo o síntomas de EAP. Junto a los hallazgos de un adecuado examen físico es suficiente para establecer el diagnóstico de EAP. Cuando los pacientes acuden a consulta manifestando los síntomas típicos de una obstrucción arterial y con síntomas de claudicación intermitente es la punta del iceberg de un gran problema epidemiológico, ya que suelen pensar que estos síntomas se deben a problemas relacionados con su edad. Por otro lado, existen pacientes con síntomas atípicos o con examen de pulso dudoso. Para ello se utiliza el índice tobillo-brazo (con o sin ejercicio), que es diagnóstico de obstrucción arterial si este es ≤ 0,9 (13,14).
Examen arterial anormal / pérdida de tejido
En pacientes con factores de riesgo de EAP y sin antecedentes de síntomas que sugieran un proceso vascular alternativo (por ejemplo, dolor abdominal o de espalda, como en la disección aórtica), la presencia de anomalías evidentes en el examen del pulso, isquemia, dolor en reposo o la pérdida de tejido sugieren fuertemente la presencia de EAP (11,13,14).
Índice tobillo-brazo anormal
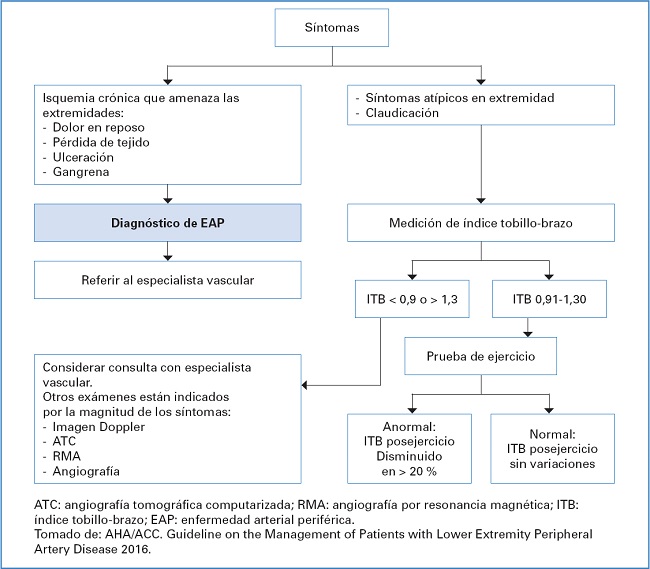
Aunque los antecedentes, los síntomas, el examen físico y el ITB al lado de la cama pueden sugerir fuertemente un diagnóstico de EAP, con frecuencia no son lo suficientemente específicos o sensibles para juzgar la gravedad de la enfermedad o localizar con precisión los sitios de obstrucción. Dependiendo de la presentación clínica, pueden indicarse pruebas formales de ABI o estudios adicionales. Estos pueden incluir otras pruebas fisiológicas en un laboratorio vascular (prueba de ejercicio en cinta rodante, presiones segmentarias o registros del volumen del pulso) o imágenes vasculares (14) (Fig. 1).

Figura 1. Medición y cálculo del índice tobillo-brazo (ITB) en el diagnóstico de la enfermedad arterial periférica. ITB es la relación de la presión arterial sistólica más alta entre la arteria tibial posterior y la arteria dorsal del pie (A) y la presión arterial sistólica más alta entre ambos brazos (B) (16).
Para los pacientes con factores de riesgo de EAP y síntomas de esfuerzo en las piernas (claudicación, dolor atípico), se sugieren pruebas de laboratorio vasculares formales para confirmar el diagnóstico (12).
La necesidad de realizar pruebas en pacientes con pérdida de tejido debe individualizarse. Para la mayoría de los pacientes, se sugieren estudios de laboratorio vascular formales, siempre que sea posible, antes de la intervención vascular (12).
Un índice tobillo-brazo anormal (ABI ≤ 0,9) tiene una precisión general excelente para detectar estenosis arterial ≥ 50 % utilizando la arteriografía como estándar. Para la mayoría de los pacientes con dolor en las extremidades por esfuerzo (claudicación clásica y síntomas atípicos), un ABI ≤ 0,9 es diagnóstico de EAP, particularmente en el contexto de la historia clínica adecuada. Sin embargo, otros procesos patológicos no ateroscleróticos también pueden ocasionar oclusión arterial y un ABI anormal (por ejemplo, aneurisma poplíteo trombosado) y es necesario distinguirlos de la aterosclerosis (13).
Existe una correlación general, pero no absoluta, entre los síntomas y el sitio y la gravedad de la EAP. La gravedad se estima a partir del índice tobillo-brazo:
Claudicación: 0,4 y 0,9.
Dolor en reposo: de 0,2 a 0,4.
Pérdida tisular (úlcera, gangrena): de 0 a 0,4.
Entonces, estos hallazgos positivos en el examen físico ayudan a los médicos a diagnosticar la presencia de enfermedad arterial periférica: pulso pedal anormal, extremidad fría unilateralmente, un tiempo de llenado venoso prolongado y un soplo femoral (13,14). Otros signos físicos ayudan a determinar la extensión y la distribución de la enfermedad vascular, incluido un pulso femoral anormal, soplos en las extremidades inferiores, rodillas calientes y la prueba de Buerger. La prueba de llenado capilar y los hallazgos de decoloración de los pies, la piel atrófica y las extremidades sin pelo no ayudan en las decisiones diagnósticas (13).
Cuestionarios
Se han utilizado algunos cuestionarios para detectar de una forma estandarizada la presencia de claudicación intermitente. En la actualidad, el cuestionario de claudicación de San Diego (SDCQ)12 y el cuestionario de claudicación de Edimburgo (ECQ)13 muestran sensibilidad y todos tienen una especificidad excelente. Estos cuestionarios se han traducido a otros idiomas, pero se requieren más traducciones validadas para habilitar su uso en todo el mundo (14,15).
Aunque estos cuestionarios, además de la medición del ABI, proporcionan datos más precisos sobre la prevalencia de EAP sintomática y asintomática, tienen limitaciones al no cubrir toda la gama de enfermedades sintomáticas. De hecho, muchos pacientes pueden tener una presentación atípica de claudicación o no presentar dolor porque no caminan lo suficiente por otras comorbilidades (15,17).
Sitio y gravedad de la EAP
Registros de presión segmentaria y volumen de pulso: los registros de presión segmentaria y de volumen de pulso, que son estudios fisiológicos realizados en el laboratorio vascular, son útiles para confirmar un diagnóstico de sospecha de EAP en las extremidades inferiores según la historia clínica y el examen físico y para determinar el sitio y la gravedad de la enfermedad (13,14).
Estos estudios incluyen pruebas formales de índice tobillo-brazo y se realizan en ambas piernas. La medición de la presión del dedo del pie/índice dedo del pie-brazo es una alternativa al ABI para establecer un diagnóstico de EAP en pacientes con vasos no comprimibles (generalmente pacientes con diabetes de larga evolución o de edad avanzada) (12,15).
Prueba de esfuerzo: algunos pacientes con EAP que tienen un historial tradicional de claudicación y otros con dolor atípico en las extremidades tienen un ABI normal en reposo (de 0,91 a 1,30). Para estos pacientes, está indicada la prueba de esfuerzo. Los ITB de ejercicio anormales apoyan un diagnóstico de PAD, como la etiología de sus síntomas. Las pruebas de ejercicio en cinta ergométrica son útiles para proporcionar la evidencia más objetiva sobre la magnitud de la limitación funcional en pacientes con claudicación y también pueden usarse para guiar la respuesta al tratamiento (13,15).
Imágenes vasculares: las imágenes vasculares generalmente no son necesarias para establecer un diagnóstico de PAD. Sin embargo, pueden estar indicadas para diferenciar la EAP de otras etiologías vasculares como fuente de obstrucción arterial si se cuestiona la EAP como etiología principal de los síntomas (por ejemplo, si se sospecha un aneurisma arterial o un tromboembolismo). Sin embargo, las imágenes vasculares son necesarias para identificar objetivos apropiados para la intervención y para la vigilancia continua después de la intervención (15,17). En la figura 2 se presenta un algoritmo diagnóstico para la EAP.
Manejo
El manejo de los pacientes con EAP de miembros inferiores va encaminado al alivio de los síntomas y a la disminución del riesgo de progresión de enfermedad cardiovascular y de sus complicaciones (17).
El manejo de la EAP incluye dejar de fumar, hacer ejercicio, un régimen dietético estricto y, además, tratamiento farmacológico con estatinas para alcanzar con ello un nivel objetivo de lipoproteínas de baja densidad de 100 mg/dL o menos y terapia antiplaquetaria con 75 a 325 mg de aspirina o 75 mg de clopidogrel a diario. Los pacientes con claudicación que limita el estilo de vida deben considerarse para una prueba de cilostazol en ausencia de insuficiencia cardíaca (17).
Modificación del estilo de vida
Cese del tabaquismo
Fumar está estrechamente relacionado con el desarrollo de la aterosclerosis, sea directa o indirectamente. En realidad, corresponde al factor de riesgo más importante para el desarrollo de la claudicación. El abandono total y permanente del tabaquismo representa la intervención clínicamente más rentable en pacientes con aterosclerosis. Los consejos simples no suelen ser muy efectivos, ya que fumar es una forma de adicción (18,21).
La combinación de terapia de ejercicio y dejar de fumar también puede ser beneficiosa. Finalmente, los tratamientos complementarios, como la terapia de reemplazo de nicotina y el bupropión (un inhibidor de la captación neuronal de norepinefrina, serotonina y dopamina), han tenido éxito en aumentar la probabilidad de dejar de fumar de forma permanente (18).
Ejercicio
El riesgo de EAP está inversamente relacionado con los niveles previos de actividad física, por lo que este resulta un factor protector. Se ha demostrado que la capacidad de caminar aumenta con el entrenamiento físico en pacientes con claudicación y que el ejercicio regular, junto con la modificación de los factores de riesgo, especialmente dejar de fumar, es la piedra angular de la terapia conservadora para la claudicación intermitente (17,18,21).
El ejercicio en la EAP generalmente consiste en caminar en una cinta rodante, aunque se han informado otras modalidades, como el ejercicio de las extremidades superiores y las zancadas en barra (18,19).
Además, la mejora en la capacidad para caminar inducida por el ejercicio da como resultado una mejora en las actividades diarias de rutina y la rehabilitación con ejercicios en sí se asocia con una morbimortalidad mínima (18).
Dieta y pérdida de peso
Existe evidencia de que los pacientes con enfermedad aterosclerótica deben seguir una dieta baja en grasas. Asimismo, también hay evidencia del beneficio de una dieta de tipo mediterráneo (18,19).
Además, se ha propuesto que el control del peso es una característica esencial de la estrategia de manejo general de la EAP, dado que la obesidad se asocia con mayores riesgos relativos de mortalidad total y enfermedades cardiovasculares. La distribución de la grasa abdominal, pero no de la grasa corporal total, se asocia con enfermedad oclusiva arterial periférica, independientemente de los factores de riesgo cardiovascular concurrentes (18,20).
Con base en esto, todo paciente con EAP con sobrepeso debe recibir un plan dietario óptimo y una meta para perder peso (18).
Se sugiere además el consumo de fibra, dado que esta interfiere con la absorción micelar de colesterol dietético. El aumento de la ingesta de fibra se asocia con una menor incidencia de EAP. A pesar de ello, hasta hoy no hay evidencia de que una dieta rica en frutas y verduras proteja contra la EAP, aunque no puede excluirse un beneficio modesto (18,19).
Con respecto a la restricción de sodio, se ha recomendado para los hipertensos. Los pacientes con EAP desarrollan un mayor grado de hipertrofia cardiaca que otros hipertensos con el mismo nivel de presión arterial media. Además, al ser una enfermedad aterosclerótica, tiene una relación estrecha con el desarrollo de hipertensión, por lo que se recomienda una restricción de sodio en estos pacientes (18,20).
Por último, con respecto al consumo de aceites de pescado, a pesar de que existen algunos efectos beneficiosos sobre los parámetros hemodinámicos, no hay evidencia de mejores resultados clínicos (20).
Diabetes
Dado que la claudicación intermitente es aproximadamente el doble de común entre los pacientes diabéticos que entre los pacientes no diabéticos, que se ha establecido la asociación entre la diabetes mellitus y el desarrollo de EAP y que esta es más agresiva en pacientes con diabetes, es necesario, por lo tanto, un control estricto en el aspecto dietético para conseguir un control adecuado de la glicemia con el fin de limitar el daño vascular en las extremidades (20).
El Estudio prospectivo de diabetes del Reino Unido (UKPDS) ha demostrado una reducción significativa en cualquier punto final de diabetes (principalmente microvascular) después de un control estricto de la glicemia. Estos datos parecen lo suficientemente sólidos como para hacer del buen control de la diabetes una prioridad en los pacientes con EAP (19,20).
Alcohol
Se ha informado de una asociación inversa entre el consumo de alcohol y la EAP en la población no fumadora. Por otro lado, con el aumento del consumo existe un mayor riesgo de hipertensión y de otras enfermedades cardíacas y no cardíacas que dan como resultado una mayor morbilidad y mortalidad prematuras. Es probable que los datos no sean lo suficientemente sólidos como para enfatizar el consumo de alcohol como parte del enfoque del estilo de vida de la EAP (19,20).
Antioxidantes
Los niveles disminuidos de antioxidantes están estrechamente relacionados con el desarrollo de EAP; especialmente se ha visto que las vitaminas E y C están implicadas. El estudio Rotterdam informó de un efecto inverso significativo de la ingesta de vitamina C sobre la prevalencia de EAP en las mujeres y de un efecto similar de la vitamina E en hombres. A pesar de ello, existe evidencia de que no ha demostrado ningún beneficio con su suplementación. Por ello, una revisión Cochrane de cinco estudios concluyó que no había pruebas suficientes para recomendar su uso actualmente en la claudicación (20).
Tratamiento médico
Tratamientos hipolipemiantes en EAP
Con base en el conocimiento de que niveles elevados de lípidos están asociados con un mayor riesgo cardiovascular en pacientes con EAP, las directrices sobre dislipidemia de la Sociedad Europea de Cardiología del 2019 recomiendan objetivos de C-LDL según el riesgo a 10 años de eventos cardiovasculares mortales. Los pacientes con EAP pertenecen a la categoría de muy alto riesgo, con ≥ 10 % de riesgo de un evento cardiovascular fatal. En estos pacientes, se recomiendan tanto la reducción de LDL-C ≥ 50 % desde el inicio y una meta de LDL-C de < 55 mg/dL (< 1,4 mmol/L) (21).
Para alcanzar este objetivo de C-LDL, se recomienda el tratamiento con una estatina de alta intensidad a la dosis máxima tolerada, dado que este está respaldado por pruebas definitivas de beneficios en la morbilidad y en la mortalidad cardiovascular. Además, también hay apoyo para los efectos positivos de la reducción de lípidos en los principales eventos adversos de las extremidades, así como en el rendimiento de la marcha en pacientes con EAP. Si los pacientes no pueden alcanzar el objetivo o informan de intolerancia a las estatinas, se recomienda una combinación de estatinas (en una dosis más baja si son intolerantes a las estatinas) con ezetimiba y, además, con la adición de un inhibidor de PCSK9 (21).
Terapias antitrombóticas en EAP
El tratamiento actual de la EAP sintomática comprende la monoterapia antiplaquetaria (sea esta aspirina de 75-100 mg al día o clopidogrel de 75 mg al día) con un beneficio mejorado de la terapia antiplaquetaria más intensa (21).
La terapia antiplaquetaria dual debe darse durante al menos un mes después de la angioplastia con balón recubierto con fármacos y durante 3 meses después de la liberación del fármaco o del stent cubierto (21).
Finalmente, basada en los resultados del estudio VOYAGER, la combinación de la terapia con aspirina (100 mg/día) y rivaroxabán (2 × 2,5 mg al día) debe considerarse para terapia dual posintervención (21).
Anticoagulación
Warfarina
A pesar de que existen estudios que respaldan el uso de warfarina con aspirina para la prevención de complicaciones en pacientes con antecedentes de síndrome coronario agudo, en el caso de los pacientes con EAP no mostró resultados prometedores. El ensayo WAVE investigó el uso de la anticoagulación con warfarina en combinación con aspirina para pacientes con EAP sintomática (81,8 % de la población total del ensayo), enfermedad de la subclavia y enfermedad de la carótida. El ensayo no encontró diferencias significativas en la ocurrencia de eventos cardiovasculares adversos mayores entre los pacientes que recibieron terapia combinada de aspirina y warfarina sola. Por otro lado, se encontró un mayor riesgo de sangrado intracraneal en estos pacientes (21).
En virtud de lo expuesto, no está indicado el uso de la warfarina en pacientes con EAP.
Rivaroxabán
El estudio COMPASS demostró una mejoría en la mortalidad con dosis bajas de rivaroxabán (2,5 mg dos veces al día) en combinación con aspirina para pacientes con EAP. Aunque los eventos hemorrágicos son más frecuentes con el uso de aspirina con rivaroxabán o rivaroxabán solo, ninguno de estos regímenes estuvo relacionado con sangrado fatal o intracraneal (21).
Vasodilatadores periféricos
La claudicación intermitente resulta de una isquemia periférica distal a una estenosis en el marco del esfuerzo. Este desajuste entre la oferta y la demanda tisular suele ser el resultado de la estenosis, por lo que una respuesta vasodilatadora insuficiente puede dar lugar a síntomas que se alivian con el reposo. Como tal, los vasodilatadores periféricos son potencialmente beneficiosos para la claudicación. Por ello, las pautas de ACC/AHA incluyen una recomendación de clase IA de cilostazol en el tratamiento de la claudicación sintomática (21). Múltiples ensayos han evaluado su utilidad en la claudicación sintomática. Se ha encontrado que el cilostazol aumenta la tolerancia al ejercicio en comparación con el placebo con una dosis de 100 mg dos veces al día. Dentro de sus eventos adversos más frecuentes se encuentran: cefalea, palpitaciones y diarrea. Además, el cilostazol está contraindicado en pacientes con insuficiencia cardíaca, ya que los medicamentos de esta clase pueden estar asociados con un exceso de mortalidad (21).
El perfil de efectos secundarios, la contraindicación para la insuficiencia cardíaca, la cantidad de píldoras que suelen tomar los pacientes (diabetes, hipertensión, etc.) y el beneficio sutil son razones por las que el cilostazol se usa con poca frecuencia y solo debe considerarse en pacientes médicamente optimizados con claudicación refractaria que pueden tolerar el medicamento (21).
Tratamiento con base en la revascularización
Sin la revascularización, la EAP de una de las extremidades a menudo resulta en su pérdida. Sin embargo, ni la revascularización quirúrgica abierta ni el tratamiento endovascular (TEV) garantizan el éxito del tratamiento ni la ausencia de reestenosis ni de fracaso de la revascularización. Hoy en día, la gestión del riesgo de fracaso de la revascularización es uno de los grandes retos en el campo vascular (22).
Los objetivos del TEV en pacientes afectados por EAP son el alivio del dolor, la cicatrización de las heridas y la preservación funcional de las extremidades. Sin embargo, la revascularización puede causar morbilidad, que se correlaciona con muchos ingresos hospitalarios, atención ambulatoria continua y costos significativos de tratamiento y de atención médica, así como con mortalidad. Por lo tanto, es necesario identificar a los pacientes para quienes el TEV puede ser beneficioso para evitar un posible fracaso (22).
Estimación del riesgo del paciente
La EAP generalmente afecta a pacientes con edad avanzada y múltiples comorbilidades. En este contexto, la estimación del riesgo operatorio y la esperanza de vida son fundamentales. La evaluación anestésica y la cardíaca preoperatoria antes de la revascularización de la extremidad son obligatorias. Se han identificado varios factores de riesgo de procedimiento para la población con EAP. Estos son: edad avanzada (más de 75 años), enfermedad arterial coronaria, insuficiencia cardíaca congestiva, diabetes mellitus (DM), enfermedad renal crónica (ERC), tabaquismo, enfermedad cerebrovascular, índice de masa corporal elevado, demencia, estado funcional y fragilidad (22).
Gravedad de la extremidad afectada
Los pacientes afectados con EAP presentan un amplio rango de severidad de la enfermedad, que va desde un riesgo de amputación muy bajo a uno alto, por lo que en virtud de ello deberá también basarse la decisión de un tratamiento quirúrgico de revascularización (22).
Patrón anatómico de la enfermedad
La individualización del paciente en virtud de la localización, del número de lesiones y del grado de extensión de la EAP, para lo que se utiliza actualmente la clasificación TASC II, definirá también el beneficio de un tratamiento quirúrgico de revascularización (22).
CONCLUSIONES
La enfermedad arterial periférica (EAP) constituye una enfermedad producida por una disminución del flujo sanguíneo arterial secundaria a aterosclerosis. Esto conduce a que la circulación periférica se vea afectada. Es mucho más frecuente en países en desarrollo. Los factores de riesgo para el desarrollo de EAP son los mismos que para cualquier otra enfermedad cardiovascular. Entre ellos se encuentran factores de riesgo no modificables (edad, sexo femenino y raza negra) y modificables (diabetes mellitus, dislipidemia, hipertensión arterial e hiperhomocisteinemia).
Esta puede cursar de manera asintomática, pero conforme progresa el estrechamiento de la luz vascular se presentan manifestaciones clínicas (claudicación intermitente, dolor en reposo, ulceración y gangrena). Para clasificar el estadio clínico en el que se encuentra el paciente una de las herramientas que se utiliza es la clasificación clínica de Fontaine.
Para el diagnóstico de EAP, se necesita una adecuada historia clínica (historia de factores de riesgo o síntomas compatibles), además de un adecuado examen físico en el que se evidencie una disminución o una ausencia de la amplitud de los pulsos distales, además de cambios tróficos en la extremidad afectada. Por otro lado, existen pacientes con síntomas atípicos o con examen de pulso dudoso. Para ello se utiliza el índice tobillo-brazo (con o sin ejercicio), que es diagnóstico de obstrucción arterial si este es ≤ 0,9.
El tratamiento de la EAP conlleva cambios en el estilo de vida (ejercicio físico, dieta y pérdida de peso y cese del tabaquismo), además de tratamiento farmacológico (estatinas y antiagregación plaquetaria) y, en casos en que conlleve una afectación importante a la calidad de vida, puede considerarse una prueba de cilostazol en ausencia de insuficiencia cardíaca.
El tratamiento quirúrgico (revascularización quirúrgica abierta o tratamiento endovascular) no garantiza el éxito del tratamiento, la ausencia de reestenosis ni el fracaso de la revascularización. Actualmente, la gestión del riesgo de fracaso de la revascularización es uno de los grandes retos en el campo vascular.