INTRODUCCIÓN
La pandemia representada por el síndrome respiratorio agudo severo del coronavirus 2 (SARS-CoV-2) ha conllevado una emergencia sanitaria a nivel mundial desde su inicio en diciembre de 2019. Actualmente, la vacunación constituye la primera estrategia de salud pública para su erradicación.
Hasta marzo de 2021 se habían desarrollado cuatro vacunas frente al SARS-COV-2, que recibieron una autorización de emergencia por parte de la Agencia Europea del Medicamento y de la Administración Federal de Alimentos y Fármacos de las Naciones Unidas y que demostraron una alta eficacia en la reducción de la infección sintomática y en la hospitalización por coronavirus (1-4).
Dos de estas vacunas utilizan ARN mensajero que codifica la proteína de la espícula del virus (BNT162b2, de Pfizer/BioNTech®, y mRNA-1273, de Moderna®), mientras que otras dos derivan de un vector viral (AZD1222 [ChAdOx1], de Astrazeneca®, y JNJ-78436735 [Ad26.COV2.S], de Janssen®). Hasta el 30 de septiembre del año 2021 casi dos millones de dosis de estas cuatro vacunas se habían administrado en la comunidad de Aragón (5).
Tras iniciarse su comercialización, se han visto asociadas a una serie de eventos adversos que entran dentro de lo esperado, de leves a moderados y de corta duración. Los más frecuentes son molestias en la zona de la punción y sintomatología similar al virus de la gripe (1-4). Cabe destacar que también se han reportado casos de enfermedad tromboembólica venosa (ETEV) en localizaciones atípicas, como la trombosis de senos venosos cerebrales o de venas esplácnicas (6-8), entidades poco comunes y con elevada mortalidad, en el contexto de vacunas derivadas de vectores virales.
A pesar de estos reportes, los casos publicados de una de las entidades más frecuentes en la práctica clínica habitual de ETEV, como es la trombosis venosa profunda (TVP), son anecdóticos. Estos han sido documentados en el primer mes tras la vacunación, algunos asociados a factores de riesgo para ETEV y al desarrollo de tromboembolismo pulmonar (TEP) (9,10).
El objetivo de este estudio es analizar y comparar los episodios de TVP durante el periodo de vacunación frente al virus SARS-CoV-2 en pacientes vacunados y no vacunados.
PACIENTES Y MÉTODOS
Se realiza un estudio observacional analítico de carácter retrospectivo. El ámbito de aplicación fue la población diagnosticada de TVP en nuestro medio, obtenida de la base de datos prospectiva de nuestro centro de alto volumen en Aragón, España (Hospital Universitario Miguel Servet), donde se recogen todos los pacientes valorados en el servicio de urgencias.
Criterios de inclusión: entre los pacientes con diagnóstico de ETEV en el servicio de urgencias de nuestro hospital se seleccionaron de forma consecutiva los pacientes diagnosticados de TVP de miembros inferiores por un cirujano vascular cualificado mediante prueba de imagen (ecografía Doppler de color o tomografía computarizada) desde el 1 de enero hasta el 30 de septiembre de 2021.
Criterios de exclusión: ETEV no diagnosticada mediante prueba de imagen, trombosis venosas superficiales y aquellos TEP en los que no se objetiva la presencia de trombo en el sistema venoso profundo de miembros inferiores. Se excluyeron también trombosis venosas de localización distinta a miembros inferiores, como territorio esplácnico o cerebral, así como las TVP secundarias a catéter.
Los datos demográficos y de comorbilidad se recogieron del historial médico físico o electrónico de los pacientes. Como variables demográficas y de comorbilidad, se seleccionaron el sexo, la fecha de nacimiento y la edad en el momento del inicio de la sintomatología, la vacuna, su fecha de administración y el número de dosis administradas, la presencia de factores de riesgo para TVP (idiopática, antecedente de enfermedad ETEV, inmovilización prolongada, traumatismo reciente, cirugía reciente, trombofilia, hormonoterapia o neoplasia), desarrollo de TEP concomitante y necesidad de ingreso hospitalario. Los datos respecto al episodio de TVP incluían la fecha de inicio de la sintomatología y, si fue necesario, las fechas de ingreso y de alta.
Estratificación por grupos
Se establecen dos grupos a estudio atendiendo al antecedente de vacunación frente al SARS-CoV-2 en los 28 días anteriores al inicio de la sintomatología de TVP, ya que los casos documentados de ETEV que se han asociado a estas vacunas se dan en el primer mes tras la vacunación frente al SARS-CoV-2 (9-11). Por un lado, los pacientes que fueron vacunados frente al SARS-CoV-2 en los 28 días anteriores a iniciar la sintomatología de TVP y, por otro, aquellos pacientes sin dicho antecedente.
Análisis estadístico
Para la realización de este estudio se usó como herramienta estadística el programa SPSS v25. Primero se llevó a cabo un análisis descriptivo de las variables cualitativas mediante n y porcentaje y de las variables cuantitativas mediante media y desviación estándar. Dentro de la fase analítica, se incluye un análisis bivariante mediante χ2 en variables cualitativas y mediante t de Student en variables cuantitativas. Se consideró como nivel de significación una p < 0,05. Posteriormente, y según los resultados obtenidos en dicho análisis, se llevó a cabo un estudio multivariable mediante regresión lineal (variables dependientes cuantitativas) y regresión logística (variables dependientes categóricas), incluyendo aquellas variables que en el análisis univariante presentaban una p < 0,2.
Variables de estudio
La variable principal fue la gravedad de la TVP, entendida como una combinación de desarrollo de TEP o necesidad de hospitalización. Como objetivos secundarios se establecieron la prevalencia de factores de riesgo de TVP (idiopática, antecedente de ETEV, inmovilización prolongada, traumatismo reciente, cirugía reciente, trombofilia, hormonoterapia y neoplasia).
RESULTADOS
Entre enero y septiembre de 2021, 376 pacientes fueron diagnosticados de ETEV en nuestro servicio de urgencias. 10 pacientes con trombosis en localización distinta a miembros inferiores fueron excluidos, así como 4 pacientes con trombosis venosa asociada a catéter. 170 pacientes fueron diagnosticados de TEP sin que se hallara TVP en miembros inferiores.
Un total de 192 pacientes cumplieron los criterios de inclusión mencionados anteriormente. Hubo 42 (21,9 %) pacientes diagnosticados de TVP que habían sido vacunados en los 28 días previos a presentar sintomatología y un total de 150 (78,1 %) pacientes que no presentaron el antecedente de vacunación.
No hubo diferencias estadísticamente significativas entre grupos respecto a sexo y a edad (Tabla I).
Tabla I. Características de base

DE: desviación estándar. Las variables continuas se presentan como media o mediana (desviación estándar) y las categóricas, como número (porcentaje). *Comparación entre vacunados y no vacunados.
Variable principal
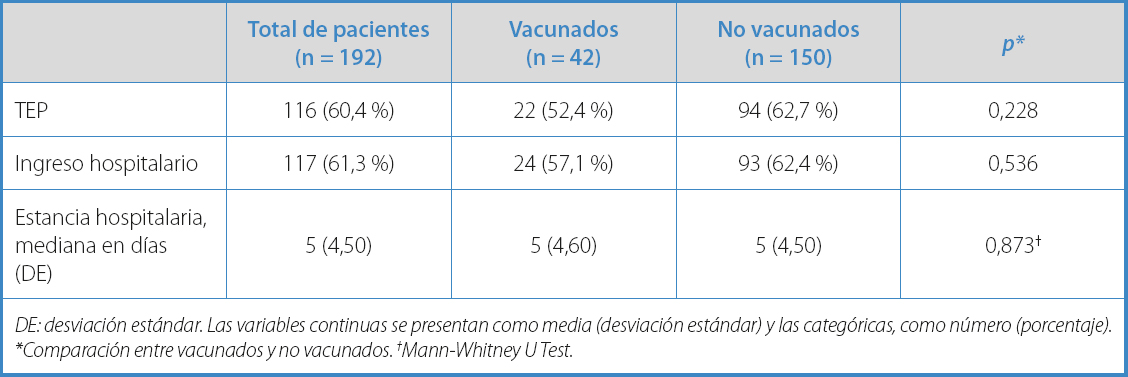
En cuanto a la severidad de la TVP, hubo un 52,4 % de TEP en el grupo de vacunados y un 62,7 % en el de no vacunados (p = 0,228). La necesidad de hospitalización se documentó en el 52,4 % de pacientes en el grupo a estudio y en el 62,4 % del grupo control (p = 0,536). Los resultados se muestran en la tabla II.
Variables secundarias
Se observó un mayor porcentaje de TVP idiopática en pacientes no vacunados (48 % frente a 28,6 %) (p = 0,025). Cuando los factores de riesgo para TVP se analizaron de forma independiente se encontraron diferencias estadísticamente significativas entre los grupos en la presencia de antecedente de trombofilia (16,7 % en el grupo estudio frente al 4 % en el de controles) (p = 0,009). El resto de factores de riesgo no revelaron diferencias entre grupos. Los resultados se muestran en la tabla III.
Tabla III. Variables secundarias

DE: desviación estándar. Las variables continuas se presentan como media (desviación estándar) y las categóricas, como número (porcentaje). *Comparación entre vacunados y no vacunados. †Test exacto de Fisher.
Se realiza el estudio univariante en el que se aprecia un OR de 0,433 (IC 95 %, 0,206-0,910; p = 0,027) para TVP idiopática y un OR de 4,767 (IC 95 %, 1,507-15,07; p = 0,008) para trombofilia. Tras analizar las variables de forma conjunta mediante el uso de técnicas de análisis multivariable, solo se mantiene la significación estadística para el factor de riesgo trombofilia con un OR de 6,10 (IC 95 %, 1,52-24,37; p = 0,01) para TVP en pacientes vacunados. No se apreciaba aumento del riesgo de TVP atendiendo al mecanismo de la vacuna o de su marca comercial.
Las vacunas administradas a nuestros pacientes fueron: un 70,7 % de Pfizer®, un 12,2 % de Moderna® y un 17,1 % de Astrazeneca® (83 % derivados de ARN mensajero y 17 % derivados de vectores virales). El 61,5 % de los pacientes presentaron la clínica tras la primera dosis; el 35,9 %, tras la segunda dosis y el 2,6 %, tras la tercera. La mediana de tiempo de instauración de la clínica fue de 10 días desde la inoculación (0-28 días).
De los 42 pacientes que presentaban TVP tras haber sido vacunados, el 60 % completaron la pauta de vacunación sin presentar nuevos eventos tromboembólicos, mientras que el 40 % restante no completó la vacunación. De estos, 7 fallecieron por causas ajenas a la enfermedad, 6 presentaron infección por SARS-CoV-2 anterior a la última dosis y 4 pacientes jóvenes con TEP decidieron no continuar con la pauta de vacunación.
DISCUSIÓN
El riesgo incrementado de ETEV en relación con la infección por el virus SARS-CoV-2 se ha documentado consistentemente en la literatura (12,13), debido probablemente a un estado de trombofilia secundario a la inflamación sistémica mantenida e inmunotrombosis (14), mientras que se desconoce el riesgo trombótico asociado a las vacunas frente a este coronavirus.
Tras el inicio de la vacunación, las vacunas derivadas de vectores virales estuvieron en el punto de mira debido a múltiples casos de trombocitopenia trombótica inmune (similar a la trombocitopenia autoinmune inducida por heparina) asociados a entidades de ETEV atípicas y severas, como trombosis de senos venosos cerebrales y venas esplácnicas (6-8). También se ha sugerido que las vacunas de ARN mensajero pueden unirse a los receptores de reconocimiento de patrones en los endosomas y el citosol, lo que conlleva la activación de cascadas proinflamatorias que favorecen la coagulopatía (15).
Al revisar la literatura encontramos dos artículos que sugieren una posible asociación entre ETEV y la vacunación frente al SARS-CoV-2.
Pottegård y cols. (11) realizaron un estudio de cohortes con base poblacional siguiendo a pacientes 28 días tras la vacunación con la vacuna de Astrazeneca® en Dinamarca y Noruega. Apreciaron un incremento en los eventos de ETEV observados respecto a los esperados, aunque con un riesgo absoluto de eventos tromboembólicos pequeño.
Por otro lado, Smajda y cols. (16) llevaron a cabo un análisis descriptivo basado en la base de datos de farmacovigilancia de la Organización Mundial de la Salud (Vigibase). Evaluaron los ratios de eventos tromboembólicos reportados y hallaron un ratio de 0,075 casos por millón de personas vacunadas-día (IC 95 %, 0,07-0,08).
En estos artículos abogan por sugerir una posible relación entre vacunación y ETEV, aunque resaltan, en todo caso, una incidencia de estos eventos muy discreta y la necesidad de un mayor número de investigaciones atendiendo al carácter observacional de estos estudios, aunque otros estudios han sugerido que estos fenómenos de ETEV no son una consecuencia de la vacunación, sino una coincidencia (17).
Partiendo de esta posible relación entre vacunación y ETEV, no hemos encontrado estudios similares al nuestro. Respecto a nuestros resultados, no apreciamos un aumento de la severidad de la TVP entendida como desarrollo de TEP o necesidad de hospitalización entre ambos grupos; de hecho, porcentualmente hablando, el número de pacientes no vacunados que desarrollaba TEP como complicación de la TVP era mayor (62,7 % frente al 52,4 %; p = 0,228).
Lo que llama la atención es que se aprecia una mayor proporción de TVP idiopática en pacientes no vacunados y, por ende, una mayor presencia de factores de riesgo para ETEV en el grupo de pacientes vacunados frente al SARS-CoV-2.
Dentro de estos factores de riesgo, incluso destacando que encontrábamos tres veces más de pacientes con hormonoterapia y un 10 % más de pacientes con antecedente de neoplasia en el grupo a estudio, el único factor que mostraba diferencias estadísticamente significativas entre los grupos era la trombofilia, que llegaba a alcanzar un OR de incidencia para TVP en vacunados de 6,10 en el análisis multivariante (IC 95 %, 1,52-24,37).
En el grupo de vacunados, 5 pacientes presentaron estados trombofílicos de alto riesgo, como déficit de proteína C o síndrome antifosfolipídico, y 2 eran portadores de mutaciones de bajo riesgo relacionadas con la hiperhomocisteinemia. En el caso de los pacientes no vacunados fue al contrario: 2 pacientes presentaron estas mutaciones de bajo riesgo y 1 de ellos un estado trombofílico de alto riesgo.
Por último, si bien es verdad que en el análisis univariante se aprecia una mayor incidencia de TVP idiopática en pacientes vacunados, esta significación se pierde cuando se realiza el ajuste por edad. La explicación puede residir en su incidencia habitual, ya que se aprecia un aumento de esta con el incremento de la edad, que pasa de una incidencia de 2-3 casos cada 100 000 habitantes de 30-49 años hasta los 20 casos entre los 70 y los 79 años (18).
Al revisar la literatura encontramos 8 casos publicados de TVP tras la vacunación: 3 después de ser vacunados con Moderna® (9,18), 2 tras Pfizer® (10,19), 2 tras Astrazaneca® (20) y un caso tras recibir la única dosis de Janssen® (21). La mayoría de casos ocurría en mujeres y en los 15 primeros días tras la vacunación. El 60 % desarrollan la clínica tras la primera dosis y otro 60 % de los pacientes presentaba al menos un factor de riesgo para TVP, similar a nuestros resultados (más de un 70 % de nuestros pacientes presentaba al menos un factor de riesgo de ETEV).
Cabe la posibilidad de que esta serie de casos represente una prevalencia normal de TVP dentro de una población que ha experimentando una campaña de vacunación masiva. La vacunación en sí misma constituye un factor de confusión. Mientras que es imposible determinar el mecanismo exacto de las TVP aquí mencionadas, no puede negarse que el tiempo transcurrido entre la vacunación y el desarrollo del evento sugiere una posible conexión entre ambas que es conveniente documentar y estudiar. La intensa respuesta inmunológica provocada por las vacunas podría conllevar la activación de una cascada proinflamatoria que actuase de desencadenante para eventos trombóticos en aquellos pacientes predispuestos. La trombosis secundaria a la inflamación es un mecanismo ya reconocido (22).
A pesar de que exista la posibilidad de que eventos trombóticos constituyan un efecto adverso poco frecuente asociado a estas vacunas, la vacunación ha probado que es segura, efectiva y necesaria para la erradicación de esta pandemia (1-4). Sin embargo, la necesidad de dosis de refuerzo nos lleva a recomendar el estudio de la posibilidad de este aumento de incidencia de TVP en pacientes de riesgo de cara a poder prevenir estos episodios o a establecer una vigilancia más estrecha de estos pacientes, en especial en aquello con trombofilia de base, que podrían llegar a beneficiarse de una profilaxis anticoagulante previa a la inoculación de la vacuna. Aunque los datos aquí expuestos deberían ser corroborados con estudios prospectivos que incluyan una mayor muestra poblacional.
CONCLUSIONES
La vacunación frente al SARS-CoV-2 no parece incrementar la severidad de la TVP, aunque una mayor prevalencia de TVP asociada a factores de riesgo se ha observado en pacientes vacunados, entre los que destacan aquellos con trombofilia de base.
Mientras que la vacunación frente al SARS-CoV-2 es esencial para frenar esta pandemia, debe mantenerse una vigilancia activa para detectar posibles efectos adversos. Un mayor seguimiento y una mayor difusión de las vacunas en la población son necesarios para clarificar la magnitud de estos potenciales efectos adversos que, aunque presentan una prevalencia muy baja, puede que no sean insignificantes a nivel de la población general.