INTRODUCCIÓN
La isquemia mesentérica aguda (IMA) se origina por un déficit de perfusión a nivel intestinal. La disfunción vascular se debe principalmente a la oclusión aguda de la arteria mesentérica superior (AMS), aunque en el 15 % de casos se observa hipoperfusión no oclusiva por estados de bajo gasto y otro 15 % son causados por trombosis venosa mesentérica (1). La mortalidad puede alcanzar el 75-90 %, que se atribuye principalmente a un retraso en el diagnóstico, con el consiguiente desarrollo de un extenso infarto intestinal, normalmente en pacientes mayores con múltiples comorbilidades (2). La oclusión por trombosis in situ suele acontecer sobre una arteria previamente enferma, con calcificación y placas de ateroma, lo que da lugar a síntomas propios de isquemia mesentérica crónica antes del episodio agudo, como dolor abdominal posprandial y pérdida ponderal debido a angina intestinal. En estos casos las lesiones suelen situarse en el origen de la arteria y el infarto intestinal suele ser extenso. Por otro lado, la oclusión embólica suele afectar a sectores más distales de la arteria, con menor extensión del área infartada y frecuentemente asociando de forma sincrónica procesos embólicos en otros lugares (1).
Frente a la afectación del intestino delgado por oclusión de la AMS, hay que tener presente aquellos casos de colitis isquémica por afectación de la arteria mesentérica inferior (AMI), de especial relevancia en el contexto de la patología aórtica. Tanto es así, que la incidencia de colitis isquémica después de una cirugía de reparación del aneurisma de aorta infrarrenal se encuentra en el 3 % para intervenciones electivas y es hasta de un 36 % para cirugía urgente, con cifras de mortalidad que alcanzan el 90 % en casos de afectación transmural (3). El uso de colonoscopia de rutina arroja cifras incluso mayores, con una incidencia del 7,4 % en casos de reparación electiva del aneurisma de aorta abdominal, que se eleva al 60 % en casos de rotura (4). La colitis isquémica en estos casos afecta predominantemente al colon sigmoide y entre las causas desencadenantes se encuentran la hipoperfusión, la embolización y el daño por reperfusión. En la patogenia se ven involucradas la macro- y la microcirculación. La macrocirculación puede verse afectada por la ligadura de la AMI o de las arterias hipogástricas si no hay suficiente colateralidad. En cuanto a la microcirculación, la hipotensión perioperatoria o la administración de catecolaminas puede causar un déficit de perfusión (4).
Dicho esto, cabe añadir que, si la tasa de mortalidad de la isquemia intestinal se ha mantenido en torno al 60-80 % en las últimas décadas a pesar de los avances en técnica de imagen y tratamiento, ha sido principalmente por un retraso en el diagnóstico, en el que juega un papel fundamental la sospecha clínica (5). Y es que la presentación clásica consiste en un dolor periumbilical difuso frecuentemente desproporcionado en relación con la exploración física. Además, en el 25 % de los casos se constata ausencia de dolor abdominal (6). Si atendemos a que la revascularización debe realizarse cuando la isquemia es todavía reversible, idealmente antes de que se establezca el daño transmural, se entiende que el diagnóstico precoz es una necesidad para disminuir la mortalidad. Y si bien el angio TC es la herramienta más sensible y específica a día de hoy (5), suele transcurrir demasiado tiempo hasta que se accede a la prueba de imagen, dada la presentación clínica poco específica en contraste con la gravedad que supone (6). A esto se añade que en varias ocasiones hay que recurrir a la laparotomía exploradora para confirmar la sospecha clínica, y no es infrecuente encontrar un intestino sano que no requiere intervención. En vista de lo cual, un marcador, no solo de elevación precoz, sino al mismo tiempo preciso, ayudaría a evitar la morbilidad asociada a la técnica quirúrgica en aquellos casos que resultan negativos para la sospecha (7).
El objetivo de este trabajo es repasar la evidencia actual acerca de los marcadores bioquímicos usados para la detección precoz de isquemia intestinal, así como la de aquellos que todavía están en fase de experimentación, aunque con un posible potencial clínico.
DESARROLLO
Fisiopatología
La circulación esplácnica demanda aproximadamente un 25 % del gasto cardíaco en reposo y puede requerir un 10 % adicional en el estado posprandial. Más de dos tercios de esta sangre se dirigen a la capa mucosa y submucosa del intestino para facilitar el intercambio de nutrientes (6). Así, el daño celular asociado a la isquemia comienza con la descamación y el sangrado de las vellosidades de la mucosa, altamente sensible a la hipoperfusión y a la hipoxia. Conforme aumenta el tiempo de isquemia, la barrera intestinal comienza a degenerar. Esta degeneración del epitelio favorece el paso de sustancias endoluminales, como endotoxinas bacterianas, a la circulación sistémica, lo que lleva a pensar que ciertos parámetros de translocación bacteriana sean útiles para detectar necrosis tisular en fases tempranas. Esta translocación bacteriana puede desencadenar un síndrome de respuesta inflamatoria sistémica (SRIS), con el consiguiente reclutamiento de mediadores inflamatorios, que potencian la hipoperfusión intestinal y el daño tisular (8). De manera que, si bien el daño isquémico en la mucosa intestinal suele ser reversible, la afectación transmural genera inflamación, necrosis, sepsis y fallo multiorgánico (5), con lo que se entiende que, en estadios avanzados de la isquemia, la decisión de revascularizar a estos pacientes pueda resultar controvertida, ya que si bien la reperfusión es indispensable para evitar la progresión hacia la necrosis y la necesidad de resección intestinal, hay que tener en cuenta que el aporte de oxígeno que sigue a una adecuada revascularización puede asociar más daño celular e inestabilidad hemodinámica al favorecer la formación de radicales libres que estimulan el reclutamiento y la activación leucocitaria, aumentan la permeabilidad microvascular por pérdida de integridad a nivel del endotelio (6) y generan un mayor estrés oxidativo que acelera la necrosis, el fallo multiorgánico y la muerte (8).
Marcadores bioquímicos
En contraste con los marcadores de daño miocárdico o hepático, precoces y precisos para el diagnóstico de isquemia en estos órganos, los marcadores serológicos de isquemia intestinal ofrecen una información más pobre, menos exacta y quizá menos útil. Entre las explicaciones de este fenómeno, destaca la complejidad del intestino, formado por varios tejidos (capas mucosa, submucosa y muscular), que alteran la concentración sanguínea de distintas moléculas. En segundo lugar, hay que recordar que las moléculas liberadas por el intestino pasan al sistema portal (muchas de ellas son aclaradas por el hígado sin llegar a la circulación sistémica) y, por último, también en relación con el hígado, ocurre que varios marcadores de daño intestinal son expresados también por el tejido hepático, lo que hace difícil discernir el origen de la molécula cuando se detecta en sangre periférica (7). Así, en la búsqueda de nuevos marcadores para alcanzar un diagnóstico precoz, la molécula ideal ha de ser tejido-específica, metabólicamente estable, indicadora de daño actual, específica para isquemia y altamente sensible (5). La integridad estructural de la proteína ha de mantenerse durante la circulación portal y tras el metabolismo hepático, de forma que sea valorable en las muestras de sangre venosa periférica. Y puesto que la isquemia comienza en la mucosa y se extiende hacia la serosa, una proteína derivada de la capa mucosa será superior como marcador precoz que otra derivada de la seromuscular (1). Además, es preciso una alta sensibilidad para excluir el diagnóstico, así como una especificidad suficiente para proceder a la realización del angio TC.
Hay que tener también en cuenta que la utilidad práctica de los marcadores para detectar isquemia intestinal depende de la prevalencia de esta entidad en los distintos ámbitos clínicos. Así, en ámbitos con baja prevalencia el uso de marcadores muy específicos puede resultar útil para discriminar falsos positivos, mientras que allí donde la prevalencia de isquemia intestinal es mayor (cirugías con clampaje prolongado o uso de inotrópicos a altas dosis) el uso de marcadores muy sensibles (dímero D o D-lactato) puede resultar apropiado para minimizar la tasa de falsos negativos (7).
Hasta ahora, se ha visto que ninguno de los marcadores usados tradicionalmente para detectar isquemia intestinal (lactato, láctico deshidrogenasa, creatina-cinasa, recuento leucocitario o exceso de bases) tiene buena capacidad diagnóstica (5), pues se asocian a inflamación sistémica y activación macrofagocitaria, lo que indica una progresión avanzada de la isquemia visceral (6). Además, se ha demostrado que los marcadores de daño muscular (láctico deshidrogenasa [LDH] y creatina-cinasa [CK]) se elevan por igual tanto en pacientes con isquemia intestinal como sin ella (5,9). Se ha hecho necesario, por tanto, profundizar en la búsqueda de otras alternativas.
Lactato
En cuanto al lactato sérico, ha sido reconocido como marcador de daño intestinal durante más de 50 años. Esta molécula se produce en estados de anaerobiosis por la acción de la enzima láctico deshidrogenasa (LDH) sobre el piruvato generado en la glicolisis, con lo que las células obtienen así su energía (ATP). Sucesivamente, este lactato resultante es recogido de los tejidos periféricos para ser reconvertido en piruvato y glucosa en el hígado mediante el ciclo de Cori. En estados de shock o de sepsis, la disfunción hepática explica que el lactato se acumule en la sangre por falta de utilización más que por aumento de producción en el contexto de hipoxia tisular (10), por lo que actualmente se sostiene que el lactato es un marcador inespecífico de hipoperfusión tisular y que solo se eleva significativamente en fases avanzadas de la isquemia intestinal (10). Así, lo que queda claro a día de hoy con respecto al lactato es su valor pronóstico. La disminución de sus niveles es un indicador de éxito tras el tratamiento (6).
Con todo, se ha llamado recientemente la atención sobre la diferenciación entre los esteroisómeros L y D, moléculas con la misma composición química, que difieren en la disposición tridimensional de los grupos atómicos en el espacio (6). Por un lado, el L-lactato aparece en todas las células como producto de la glicolisis en condiciones de hipoxia. La elevación temprana no suele ser valorable debido a que está sujeta a una intensa metabolización hepática que explica su ausencia a nivel sistémico incluso en procesos de isquemia intestinal extensa. Cuando se detecta, suele indicar un estado avanzado de hipoperfusión con infarto transmural y acidosis metabólica (6). Por tanto, no debe usarse como marcador diagnóstico precoz (1). Su incremento funciona más como indicador pronóstico desfavorable que como marcador diagnóstico (11).
Por otro lado, el D-lactato, un producto de la fermentación bacteriana llevada a cabo por la flora intestinal, se acumula en sangre cuando escapa por una barrera intestinal debilitada por la isquemia. Además, su vida media, mayor que la de otros compuestos (como el lipopolisacárido) liberados al torrente por interrupción de la mucosa, lo hace un buen candidato como marcador de isquemia intestinal. Sin embargo, aun siendo una molécula de exclusivo origen intestinal, se ha visto que se eleva en múltiples contextos, como en la cirugía de bypass gástrico, en el síndrome de intestino corto, en personas con abundante ingesta glucídica y en aquellas que usan probióticos (11). Así, mientras algunos estudios indican que tiene escaso valor discriminatorio para detectar isquemia intestinal (2,5), otros han demostrado su utilidad en el contexto de la cirugía de aorta, con una elevación significativa de D-lactato en las dos horas siguientes a la cirugía en aquellos pacientes que desarrollaron colitis isquémica confirmada histopatológicamente, además de observarse cómo la elevación se mantuvo durante los dos días siguientes a la cirugía frente a quienes no desarrollaron esta complicación (3). Se ha descrito una sensibilidad superior al 80 % para valores por encima de 0,2 mmol/L (7).
Dímero D
En cuanto al dímero D, conocido marcador de fibrinólisis, se usa para detectar procesos trombóticos. Ha demostrado una alta sensibilidad (96-100 %) para detectar isquemia mesentérica, además de ser un marcador de elevación precoz (1). Sin embargo, su especificidad es baja (40 %), y a pesar de su alta sensibilidad, su utilidad para descartar isquemia cuando resulta negativo es aún motivo de controversia (6). No obstante, la Sociedad Europea de Cirugía Vascular (ESVS) recomienda su medición como prueba de exclusión para isquemia mesentérica aguda en pacientes con dolor abdominal agudo (12). Se ha demostrado una sensibilidad del 90 % (y una especificidad del 23 %) para valores de dímero D por encima de 0,2 mg/L (2). No obstante, la determinación del dímero D carece de valor para el diagnóstico de la isquemia intestinal posoperatoria, ya que se encuentra siempre elevado como consecuencia del trauma quirúrgico.
Procalcitonina
El marcador procalcitonina (PCT) parece ser también prometedor como indicador diagnóstico de isquemia mesentérica aguda. Se trata de un precursor de la calcitonina y se piensa que se libera desde el parénquima hepático en situaciones patológicas ante la estimulación por endotoxinas bacterianas, factor de necrosis tumoral e interleucina-6. Se usa como marcador de infección bacteriana porque su secreción por el parénquima hepático es estimulada por la endotoxina. De hecho, cuando se prescinde de la PCT, la distinción entre infección bacteriana e inflamación no bacteriana puede resultar difícil, ya que en ambas condiciones se eleva el recuento leucocitario y el nivel de proteína C reactiva. En el caso de la isquemia intestinal, la endotoxina se eleva en sangre debido a una alteración de la barrera intestinal, lo que se refleja en un incremento de los niveles de PCT (4). Se ha demostrado su capacidad para discriminar pacientes con isquemia intestinal, además de ser marcador de necrosis, de extensión de la lesión y de mortalidad (5,13,14). Tiene un alto valor predictivo negativo (> 80 %) para descartar colitis isquémica tras cirugía de aorta. Se sabe incluso que valores de PCT por encima de 2,0 ng/mL en el segundo día posoperatorio asocian una sensibilidad del 100 % (con una especificidad del 83,9 %) para detectar colitis isquémica. Se recomienda la colonoscopia para la detección precoz de complicaciones isquémicas en aquellos pacientes sometidos a una cirugía de aorta con niveles de PCT sérica por encima de 2,0 ng/mL en el segundo día posoperatorio (4).
Glutatión S-transferasa
La glutatión S-transferasa (GST) es un enzima citosólica involucrada en procesos de detoxificación. Actúa como marcador de estrés oxidativo y se libera por varios tejidos en respuesta a la isquemia, entre ellos el intestino y el hígado. Aunque algunos estudios con animales han arrojado algún dato esperanzador, no se han conseguido los mismos resultados en cohortes con humanos, con lo que su utilidad clínica permanece en entredicho. Es necesaria mayor investigación al respecto (6,7).
Proteína ligadora de ácidos grasos intestinales
Específica del tejido intestinal, la proteína ligadora de ácidos grasos intestinales (I-FABP) es quizá el marcador más prometedor (5). Se trata de una proteína citosólica de los enterocitos de la vellosidad intestinal. La pérdida de integridad de la membrana celular en respuesta a la malperfusión conlleva la rápida liberación de esta proteína a la circulación sistémica, y puesto que es excretada por el riñón, puede detectarse tanto en plasma como en orina. Se ha registrado una favorable sensibilidad (90 %) y especificidad (89 %) para la detección temprana de isquemia mesentérica aguda (6) y se ha sugerido que la medición de I-FABP en orina pueda mejorar la agudeza diagnóstica (1).
En el contexto de la reparación abierta de aneurisma de aorta, niveles elevados de I-FABP plasmático al final de la cirugía demostraron una sensibilidad del 100 %, con una especificidad del 98,1 % para la detección de isquemia intestinal (15). En dicho estudio, durante la cirugía de reparación del aneurisma, el I-FABP se elevó en todos los pacientes, alcanzando el mayor pico al final del procedimiento. La función renal no se asoció con las oscilaciones en los niveles plasmáticos. Sin embargo, en los pacientes que desarrollaron necrosis intestinal, el pico de I-FABP fue mayor y la concentración plasmática seguía elevada el primer día después de la cirugía, mientras que en aquellos que no desarrollaron necrosis los niveles de I-FABP volvieron al valor basal el primer día posoperatorio. Estos resultados indican que la medición de I-FABP en el primer día posoperatorio puede ayudar a identificar aquellos pacientes que se beneficiarían de una relaparotomía o una laparoscopia exploradora, adelantando la indicación entre 24 y 48 horas frente a la decisión basada únicamente en criterios clínicos exploratorios. Por otra parte, el uso del I-FABP junto con parámetros de hipoxia, como el ascenso del lactato y la disminución del pH sérico, puede ayudar a definir el origen intestinal de la hipoxia en estos pacientes (15).
Péptido similar al glucagón de tipo 1
Por último, cabe mencionar la hormona intestinal péptido similar al glucagón de tipo 1 (GLP-1). Es una hormona producida por las células L enteroendocrinas del epitelio del íleon distal y del colon. El interés clínico que ha suscitado en los últimos años radica en su potencial terapéutico sobre la diabetes de tipo 2, ya que como incretina tiene un papel insulinotrópico sobre las células beta del páncreas, estimulando la biosíntesis de insulina e inhibiendo la producción de glucagón. Además, retrasa el vaciamiento gástrico e induce saciedad, lo que disminuye la ingesta alimentaria. Su secreción es estimulada fundamentalmente por los nutrientes ingeridos al contacto con receptores de membrana en la superficie de las células L. Sin embargo, se observó que la elevación posprandial de GLP-1 en plasma antecede a la llegada del alimento al intestino distal, donde se encuentran las células L. Esta discrepancia fue la que llevó al descubrimiento de otros mecanismos implicados en la secreción de esta hormona. En la célula L se encontraron receptores con capacidad para reconocer neurotransmisores, otras hormonas y moléculas inflamatorias. Así, más allá de su papel en el metabolismo de la glucosa, el GLP-1 podría tener otras funciones, particularmente en relación con la inflamación enteral. De hecho, el lipopolisacárido, molécula proinflamatoria presente en la superficie de las bacterias gramnegativas, estimula directamente la secreción de GLP-1 al activar el receptor de tipo toll (TLR-4) de las células L enteroendocrinas, fenómeno que ocurre rápidamente tras la instauración de la isquemia intestinal (8). Y es que conforme la barrera intestinal comienza a desintegrarse en respuesta a la isquemia, el lipopolisacárido endoluminal va ganando mayor acceso a las células enteroendocrinas del epitelio, lo que estimula la secreción de GLP-1. Se trata de un proceso que ocurriría incluso antes de la necrosis de la mucosa, como respuesta fisiológica de la célula epitelial al contacto con los contenidos de la luz intestinal, que normalmente se mantienen a cierta distancia del epitelio por el glicocálix que secreta la propia célula. La secreción de GLP-1 se diferencia, por tanto, de otros marcadores en estudio, los cuales se liberan únicamente tras la muerte celular (I-FABP) o cuando ya está en marcha la inflamación sistémica (D-lactato o procalcitonina).
CONCLUSIONES
La isquemia intestinal continúa siendo un reto diagnóstico al que tiene que enfrentarse el cirujano vascular.
De entre los marcadores comentados, se ha visto que el lactato, al menos en su forma L, no ayuda al diagnóstico precoz, puesto que, además de ser inespecífico, su elevación se produce en estadios avanzados.
La forma D del lactato sí ha demostrado en cambio alguna utilidad diagnóstica, junto al dímero D y la procalcitonina, para los cuales también existe evidencia acerca de su utilidad. Tienen establecidos puntos de corte que permiten aplicar su medición en la práctica clínica diaria.
Por último, el I-FABP y el GLP-1, más prometedores en tanto que potencialmente más específicos, se encuentran aún lejos de la práctica clínica habitual. Es necesario incentivar su investigación para mejorar el tiempo diagnóstico de esta enfermedad, que conlleva elevada morbimortalidad.
En la tabla I se recogen los biomarcadores analizados con su grado de validez según la evidencia actual.
Tabla I. Biomarcadores analizados y validez actual
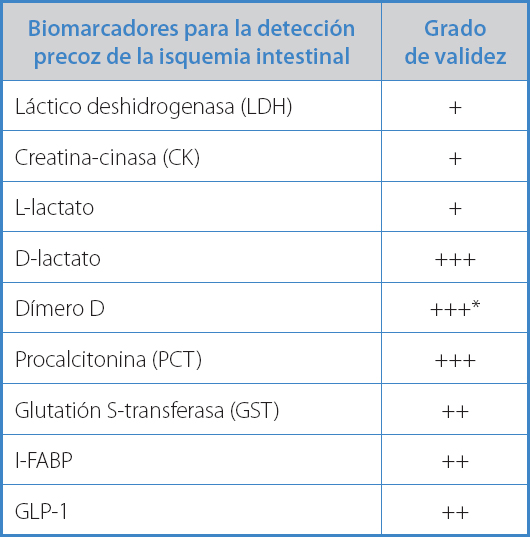
+: inespecífico; ++: en estudio; +++: en experimentación; I-FABP: proteína ligadora de ácidos grasos intestinales; GLP-1: péptido similar al glucagón de tipo 1. *Tiene validez en el contexto de aquellos pacientes con dolor abdominal agudo sin cirugías previas, ya que en el periodo posoperatorio los niveles de dímero D normalmente están elevados por la activación de la fibrinólisis (falso positivo).














