INTRODUCCIÓN
La prevalencia de enfermedad arterial periférica (EAP) está aumentando debido al envejecimiento de la población y a la reducción de su letalidad. Llega al 15-20 % en personas mayores de 70 años (1,2). En este contexto, la prevención de la enfermedad vascular aterosclerótica (incluyendo la EAP) constituye uno de los principales objetivos de salud pública en todo el mundo. El reconocimiento de los factores de riesgo de EAP que ahora se consideran como clásicos (edad, sexo masculino, tabaquismo y diabetes), gracias a cohortes como la de Framingham (3,4), contribuyó a la identificación de individuos con mayor riesgo de presentar esta enfermedad y, por consiguiente, a la posibilidad de su prevención. En los últimos años están tratándose de identificar nuevos biomarcadores que contribuyan a mejorar el conocimiento sobre la etiopatogenia de la enfermedad aterosclerótica y la identificación de la población de riesgo alto.
Uno de los biomarcadores en investigación es el epigenoma, que incluye una serie de moléculas o cambios moleculares que regulan la expresión génica (5); entre ellos, los más estudiados son los RNA no codificantes, la modificación de las histonas y la metilación del ADN. La metilación del ADN se produce por la incorporación de un grupo metilo a las citosinas próximas a guaninas (CpG). Recientemente ha podido analizarse el nivel de metilación del ADN, incluyendo más de 800 000 CpG repartidos por todo el genoma, y determinar así la relación entre el nivel de metilación y la exposición a factores ambientales o el riesgo de presentar una enfermedad mediante estudios de asociación global del epigenoma (epigenome-wide association studies [EWAS]) (6). Estos estudios han permitido identificar varios CpG que presentan metilación diferencial en relación con la exposición a tabaco (7), la práctica de actividad física (8) o la aparición de enfermedades como el infarto agudo de miocardio (9).
El tabaquismo es uno de los factores de riesgo más importante de la EAP (10,11). Se estima que la mitad de casos de EAP podrían atribuirse al tabaquismo (10). Los cambios inducidos a nivel de metilación del ADN podrían ser uno de los mecanismos que expliquen a nivel molecular la relación entre tabaco y EAP. El tabaquismo tiene efectos en la metilación del ADN en muestras de sangre completa (12-14), células bucales (15) y tejido pulmonar (16,17). Entre los loci identificados y que presentan metilación diferencial relacionada con el consumo de tabaco y la arteriosclerosis destacan CpG localizados en los genes F2RL3 (F2R like thrombin or trypsin receptor 3) y ALPPL2 (9,18).
El objetivo de este estudio es replicar la asociación entre la exposición al tabaco y el nivel de metilación de esos dos loci en pacientes con EAP.
MATERIALES Y MÉTODOS
Diseño
Estudio de cohortes prospectivo de pacientes diagnosticados de isquemia crónica de extremidades inferiores en varios estadios clínicos y visitados entre marzo de 2016 y diciembre de 2019 en el servicio de angiología, cirugía vascular y endovascular del Hospital del Mar de Barcelona y seguidos hasta la actualidad. El reclutamiento se estratificó por la gravedad de la EAP: isquemia crónica amenazante de extremidad, pacientes en fase de claudicación y asintomáticos para representar todas las fases clínicas evolutivas de la enfermedad. Para este análisis se han utilizado los datos correspondientes a la visita basal y un diseño transversal.
Se respetaron los acuerdos de la Declaración de Helsinki sobre los principios éticos de la investigación en humanos, de la Convención sobre los Derechos Humanos y la Biomedicina del Consejo Europeo (1997) y del protocolo adicional de 2005 y de la Declaración Universal de la Unesco sobre el Genoma Humano y Derechos Humanos. Se respetó también la legislación española en materia de investigación biomédica (Ley 14/2007) y de protección de datos personales (Ley Orgánica 3/2018). El protocolo del estudio fue aprobado por el comité de ética local (2015/6530/I). Todos los participantes han firmado un consentimiento informado.
Participantes
Para el diagnóstico de EAP se consideró a pacientes con un índice tobillo brazo (ITB) < 0,9 o con una prueba de imagen (ecografía, angio TAC o angio RMN) que confirmara la afectación arterial a nivel de las extremidades inferiores.
La medición del ITB se realizó con un aparato de Doppler continuo, con sonda de 8 MHz. Un ITB de entre 0,9 y 1,39 se consideró normal; un ITB < 0,9, diagnóstico de EAP, y un ITB > 1,39, sugestivo de calcificación arterial.
Para clasificar clínicamente a los participantes se ha utilizado la clasificación de Fontaine: estadio I, pacientes asintomáticos; estadio IIA, pacientes con claudicación intermitente leve > 150 m; estadio IIB, pacientes con claudicación intermitente moderada o grave < 150 m, y estadio III, pacientes que presentan dolor en reposo; estadio IV, pacientes que presentan lesiones tróficas. En el estudio se incluyó la mitad de pacientes en estadio de claudicación (I-IIA-IIB) y la otra mitad en estadio de isquemia crítica de EEII (III-IV), aproximadamente.
Análisis de la metilación de los CpG de interés
Para el presente estudio, se seleccionaron dos CpG asociados con el tabaquismo (8,18,19) y también con la enfermedad arteriosclerosa (10,17):
– cg21566642, localizado en el gen ALPPL2, cromosoma 2, posición 233284661.
– cg03636183, localizado en el gen F2RL3, cromosoma 19, posición 17000585.
De todos los participantes se obtuvo una muestra de sangre de 10 mL en un tubo de EDTA y se aisló el ADN utilizando métodos estandarizados (Puregen™; Gentra Systems). Para el análisis del nivel de metilación de los loci de interés se obtuvieron 500 mg de ADN y se realizó la conversión de bisulfito, la amplificación del fragmento de ADN de interés, y la pirosecuenciación:
– La conversión de bisulfito se realizó con el kit EZ DA Methylation Gold (Zymo Research), siguiendo las instrucciones del fabricante. Mediante esta conversión todas las citosinas no metiladas se desaminan y se convierten en uracilos, mientras que las citosinas metiladas permanecen sin cambios. El ADN se eluyó en 20 μl del buffer de elución suministrado por el kit. Las muestras se guardaron a -20 °C hasta su uso.
-
– Las reacciones de amplificación se llevaron a cabo en un volumen final de 25 μl que contenía 1,5 μl de ADN convertido, 1 × Pyromark PCR Master Mix (Qiagen), 1 × Coral Load Concentrate (Qiagen) y una concentración de primers final de 0,2 μM. Uno de los primers está biotinilado para poder realizar la purificación del producto final de PCR usando bolas de Streptavidin-Sepharosa HP.
Para el locus cg21566642 (ALPPL2) se utilizó un ensayo de diseño propio: F-5' TGTTGGGATTATAGGTTTGAGT3' (biotinilado); R-5' TCCTCCACCTCCCTTATAAATT3'. El producto de PCR obtenido tenía una longitud de 211 pb y contenía 3 sitios CpG; el de nuestro interés era el segundo.
Para el locus cg03636183 (F2RL3) se utilizó el ensayo comercial PM00668787 (GeneGlobe, Qiagen). En este ensayo el primer biotinilado es el reverso y se obtiene un producto de PCR de 307 pb que contiene 3 sitios CpG; el de nuestro interés es el segundo.
El programa de PCR usado fue de 95 °C durante 15 minutos seguido de 45 ciclos de 94 °C, 30 segundos; 58 °C, 30 segundos y 72 °C, 30 segundos, con una extensión final de 30 segundos a 72 °C. Los productos de PCR biotinilados se purificaron y convirtieron en monocatenarios para que actuaran como molde en la reacción de pirosecuenciación utilizando el pyrosequencing Vacuum PrepTool (Qiagen).
-
– La determinación del estado de metilación de los CpG de interés se realizó mediante pirosecuenciación utilizando el sistema PyroMarkTMQ96 ID (Qiagen). La pirosecuenciación implica la incorporación gradual de trifosfatos de desoxinucleótidos en la hebra en crecimiento de ADN naciente. Para ello, se sometieron a pirosecuenciación 20 μl de los productos de PCR utilizando un primer específico de secuenciación a 0,1 μM y el kit PyroMark Q96 Gold Reagents (Qiagen) siguiendo las instrucciones del fabricante. Para el gen ALPPL2, el primer utilizado fue: 5'AACAAACCAATCACTTAAAATCAAA3'. Para el gen F2RL3, el primer de secuenciación utilizado fue el suministrado en el ensayo correspondiente.
Se usaron controles internos para verificar la conversión eficiente del ADN con bisulfito para las citosinas no metiladas. El pico de control para la conversión de bisulfito pasó la evaluación de calidad para todas las muestras. Se usaron controles experimentales en cada gen utilizando Epitect Control DNA y Control DNA Set (Qiagen) (control no metilado, no convertido; control metilado, convertido; control no metilado, convertido).
Los datos de metilación se analizaron utilizando el software PyroMark Q96 (Qiagen). El grado de metilación se expresó como porcentaje de citosinas metiladas sobre la suma de citosinas metiladas y no metiladas. Se excluyeron los resultados que no tenían señal o tenían señal baja.
Consumo de tabaco
El consumo de tabaco se cuantificó mediante un cuestionario adaptado y validado (19) administrado por personal de enfermería entrenado. Se clasificó a los participantes en: fumadores (activos o exfumadores < 1 año), exfumadores (> 1 año) y no fumadores.
Además, se calculó la carga de tabaco: número de paquetes fumados al día × 365 días × años fumados. De esta forma resultan los paquetes de tabaco fumados a lo largo de la vida del individuo.
Otras variables de interés
Se registraron los factores de riesgo cardiovascular clásicos: edad, sexo, tabaquismo, hipertensión arterial (HTA), presión arterial sistólica (PAS), presión arterial diastólica (PAD), diabetes mellitus (DM), colesterol total, LDL colesterol, HDL colesterol, trigliceridemia (TGD), creatinina, filtrado glomerular (FG), índice de masa corporal (IMC), perímetro de cintura, historia de enfermedad cardiovascular (infarto de miocardio, angina o ictus) y antecedentes de revascularización de extremidades inferiores. Se consideraron pacientes con hipertensión aquellos diagnosticados por un médico y en tratamiento farmacológico y los que presentan PAS ≥ 140 mmHg o PAD ≥ 90 mmHg. Se consideraron pacientes con diabetes aquellos ya diagnosticados y en tratamiento, así como aquellos que presentaron una glucemia en ayuno > 125 mg/dL. Se registró asimismo el tratamiento crónico de los pacientes incluidos en el estudio: antiagregante, antihipertensivo, hipolipemiante y antidiabético. La historia de enfermedad cardio- y cerebrovascular (infarto de miocardio, angina o ictus) se consideró positiva si fue diagnosticada por un médico y también revisando las historias clínicas de los pacientes. Se revisaron las historias clínicas de los participantes para identificar los antecedentes de revascularización de las extremidades inferiores.
Análisis estadístico
Para el análisis descriptivo se utilizó la media y desviación estándar (DE) para las variables cuantitativas que seguían una distribución normal, y la mediana y el rango intercuartílico si no seguían una distribución normal. Las variables cualitativas se presentan como frecuencia y porcentajes. La comparación entre grupos se realizó mediante el análisis de la variancia (ANOVA) para las variables cuantitativas y el χ2 para las cualitativas. Para analizar la asociación entre variables cuantitativas se utilizó la correlación de Spearman. Se analizó si el nivel de metilación de los CpG de interés podía discriminar entre los tres grupos de exposición al tabaco definidos calculando el área bajo la curva ROC (AUC). Por último, para controlar por variables de confusión se utilizó la regresión lineal múltiple considerando el nivel de metilación como variable dependiente y la exposición a tabaco como variable independiente principal de interés. Se definieron tres modelos: modelo 1, sin ajustar y considerando la variable exposición al tabaco como variable dummy; modelo 2, ajustado por edad y sexo, y modelo 3, ajustado por todas las variables relacionadas con la metilación (edad, sexo, peso, talla, filtrado glomerular, hemoglobina, hipertensión arterial y diabetes mellitus).
Se consideró que existían asociaciones estadísticamente significativas si el valor de p era menor de 0,05. El análisis estadístico se realizó mediante el programa SPSS versión 22.
RESULTADOS
En la tabla I se presentan las características de los 297 pacientes que se incluyeron en el estudio por grupo de exposición al consumo de tabaco. Los pacientes fumadores eran más jóvenes, con una mayor proporción de hombres. También se observaron diferencias en la proporción de pacientes que presentaban factores de riesgo y antecedentes de enfermedad cardiovascular entre grupos.
Tabla I. Características de la población a estudio por grupo de exposición al consumo de tabaco.
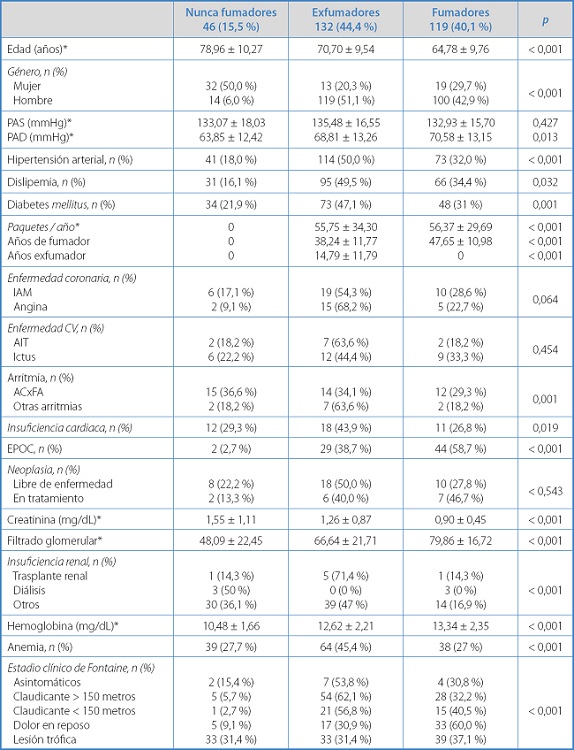
PAS: presión arterial sistólica; PAD: presión arterial diastólica; IAM: infarto agudo de miocardio; CV: cerebrovascular; ACxFA: fibrilación auricular; EPOC: enfermedad pulmonar obstructiva crónica.
*Media ± desviación estándar.
El nivel de metilación de los CpG de interés en los grupos de exposición al tabaco se presenta en la tabla II. No se observó una asociación entre la exposición al tabaco y el nivel de metilación del Cg02156642, pero sí que se observó asociación con el nivel de metilación del Cg03636183: los fumadores presentaban menor nivel de metilación. Además, hemos identificado que la metilación del Cg03636183 se asoció con la carga del tabaco: a más carga, menos metilación (Rho de Spearman: -0,324; p < 0,001).
Tabla II. Nivel de metilación de los CpG de interés según la exposición al consumo de tabaco.
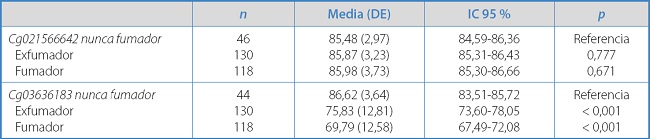
DE: desviación estándar.
En la figura 1 se presenta la capacidad del nivel de metilación del Cg03636183 para discriminar entre los tres grupos de exposición al tabaco definidos: a) fumador frente a nunca fumador, AUC 91 % (IC 95 %, 86-95 %); b) exfumador frente a nunca fumador, AUC 80 % (IC 95 %: 73-87 %); c) fumador frente a exfumador, AUC 68 % (IC 95 %: 61-75 %). Un nivel de metilación en este CpG del 80 % tiene una sensibilidad del 90,0 % y especificidad del 83,5 % para discriminar entre fumadores y nunca fumadores. Ese mismo nivel de metilación tiene una sensibilidad del 92,9 % y una especificidad del 52,6 % para discriminar entre exfumadores y nunca fumadores. Para discriminar entre fumadores y exfumadores, un nivel de metilación del 75 % tiene una sensibilidad del 69 % y una especificidad del 56,9 %.
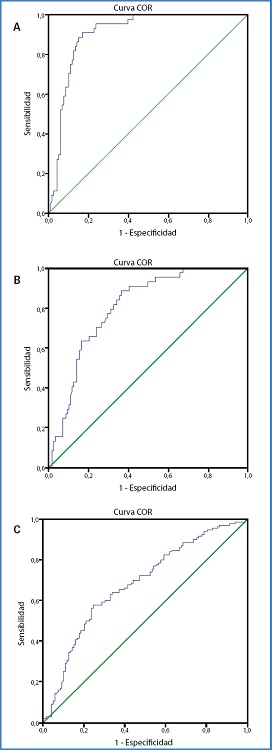
Figura 1. Curva de supervivencia de Kaplan-Meier y mortalidad a 30 días en pacientes infectados por la COVID-19 y TAAMI.
En la tabla III se presentan los resultados del análisis de regresión lineal multivariado. En el modelo ajustado por edad y sexo (modelo 2) se observó que los exfumadores y los fumadores presentaban un nivel de metilación del Cg03636183 inferior a los nunca fumadores: -5,32 % y -10,49 %, respectivamente. Al ajustar por todas las variables relacionadas con la metilación (modelo 3), la magnitud de esta asociación se reducía ligeramente: -4,39 % y -7,81 %, respectivamente. La significación estadística se mantenía al menos entre los nunca fumadores y los fumadores. Los tres modelos explicaban el 15,4 %, el 18,1 % y el 27,1 % de la variabilidad del nivel de metilación del Cg03636183, respectivamente.
Tabla III. Resultados del análisis de regresión lineal multivariable (tres modelos) con el nivel de metilación del Cg03636183 como variable dependiente y el nivel de exposición a tabaco como variable independiente de interés (grupo de nunca fumadores como grupo de referencia).
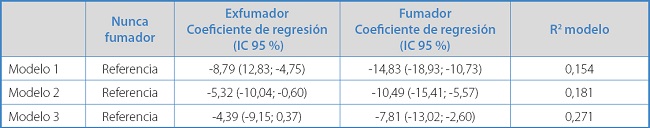
Modelo 1: no ajustado; modelo 2: ajustado por edad y sexo; modelo 3: ajustado por todas las variables relacionadas con la metilación (edad, sexo, peso, talla, filtrado glomerular, hemoglobina, hipertensión y diabetes mellitus).
DISCUSIÓN
En el presente estudio hemos observado una asociación entre el nivel de metilación del cg03636183 y el tabaquismo, así como con la carga de tabaco: a más carga, menos metilación. También se ha observado que el nivel de metilación del cg03636183 puede ser un biomarcador para discriminar fumadores de nunca fumadores, e incluso entre fumadores y exfumadores.
Estos datos están en concordancia con estudios previos que demuestran una asociación del cg03636183 con el tabaquismo (20-22), así como con la carga de tabaco (21,22) y con el abandono del tabaco (22).
Algunos estudios previos han mostrado relación entre la metilación del cg21566642 y el tabaquismo (9,20-23). Sin embargo, en nuestro análisis no encontramos una relación estadísticamente significativa. Esto puede ser causado por diferentes motivos, entre ellos, porque la muestra sea insuficiente, porque la mayor parte de la muestra está o ha estado expuesta al tabaco (85 %) o porque el tabaco no se asocie con la metilación de este CpG en pacientes con EAP.
Aunque en los últimos años han aparecido estudios de epigenética y su relación con la EAP, no hay evidencia de la relación entre la metilación de estos 2 CpG y el riesgo de presentar EAP (24-26).
En cuanto a los factores de riesgo cardiovascular, los resultados de nuestra cohorte están en concordancia con estudios previos (27), entre los que destacan el género masculino (78,5 %), HTA en más del 75 %, un 65 % de dislipemia y más de la mitad (52 %) con diabetes. El tabaquismo es un factor de riesgo muy importante, presente en el 84,5 % de estos pacientes, ya sean fumadores (40 %) o exfumadores (44 %).
Existen diversos marcadores bioquímicos de tabaquismo. Entre los más importantes están: la nicotina, la cotinina, la carboxihemoglobina y el tiocianato (SCN); estos dos últimos son los más empleados (28). Es importante contar con biomarcadores de tabaquismo para discernir si los pacientes son o no fumadores, ya que este factor de riesgo es importante en el curso clínico y pronóstico de estos pacientes. En la mayoría de los casos nos basamos en la declaración del paciente. De los marcadores previamente comentados, la carboxihemoglobina tiene una vida media en sangre de aproximadamente 4 horas, por lo que su concentración se hace supranormal después de dejar de fumar y sirve para discernir tabaquismo o no en los primeros días. Por el contrario, la vida media del SCN en sangre es de 14 días, lo que permite tener mayor información una vez suspendido el hábito. Aun así, faltan marcadores a más largo plazo, por lo que sería útil tener marcadores genéticos como los analizados en este estudio a través de la metilación de genes específicos asociados con tabaquismo y EAP. En este trabajo se presenta la capacidad de discriminación del nivel de metilación del cg03636183, que es elevada, y se proponen unos puntos de corte para diferenciar los diferentes niveles de exposición al tabaco, que son del 75 % o del 80 % según los grupos a discriminar.
Limitaciones
En el desarrollo del estudio hay que tener en cuenta las siguientes limitaciones:
– La metilación se analizó en células sanguíneas circulantes y podemos perder información tejido específica. De todos modos, para analizar el papel de la metilación como biomarcador es necesario que su determinación sea viable en un tejido fácilmente accesible.
– La asignación al nivel de exposición al tabaco se basa en la autodeclaración del paciente.
– La muestra es limitada y de un único centro. Los resultados y los puntos de corte propuestos deberían validarse en una serie independiente.
CONCLUSIÓN
Estos datos preliminares indican que la metilación del CpG cg03636183 puede ser un biomarcador del tabaquismo en pacientes con EAP y está directamente relacionada con la carga de tabaco. Este biomarcador podría utilizarse en la práctica clínica para valorar el consumo de tabaco de nuestros pacientes, ya que es un indicador objetivo de la exposición al tabaco.














