INTRODUCCIÓN
Los dispositivos liberadores de energía permiten conseguir la sección y el sellado de los vasos sanguíneos de una forma segura y eficaz (1-3). Su uso está extendido en la cirugía laparoscópica, en la que las técnicas convencionales de ligadura pueden retrasar los tiempos quirúrgicos (4,5) e incluso han disminuido el sangrado intraoperatorio (4,6).
Entre los principales dispositivos de hemostasia por energía se encuentran la electrocoagulación bipolar controlada por temperatura (EB) y el bisturí armónico (BA). El EB consigue el sellado y la coagulación de los tejidos mediante energía térmica, que se genera en función de la impedancia de los tejidos pinzados y que se calcula por el propio instrumento. Puede sellar de forma eficaz vasos sanguíneos de diámetro inferior a 7 mm (4).
El BA consigue la hemostasia mediante energía de ultrasonidos producida por un material piezoeléctrico en la punta de la pinza que consigue generar la energía térmica suficiente para la coagulación y la transección de los tejidos. Este dispositivo permite la hemostasia de vasos de hasta 5 mm de diámetro (7).
La eficacia de ambos dispositivos en el sellado de vasos sanguíneos y de otros tejidos se conoce ampliamente en el campo de la cirugía abdominal, torácica o cervical, según otros estudios previos (3,8,9). En el ámbito de la cirugía de la revascularización coronaria, también se han empleado estos dispositivos para la disección endoscópica de la vena safena interna o de la arteria radial, con una buena permeabilidad del injerto y menor tasa de infección de heridas (10,11).
Sin embargo, en la cirugía de revascularización de miembros inferiores, la disección endoscópica de la vena safena asistida con sistemas de sellado con EB ha presentado resultados dispares. En alguna de las series publicadas se ha observado una menor permeabilidad, probablemente en relación con la manipulación excesiva de la vena con los instrumentos de disección (12-14), aunque estudios más recientes han demostrado que, con una mayor experiencia en la técnica, pueden alcanzarse resultados similares a los obtenidos en la safenectomía abierta (15,16).
No obstante, en ninguno de estos estudios se analiza la resistencia del sellado de las colaterales venosas y no se conoce la eficacia y la seguridad a medio plazo de los distintos tipos de sistema de hemostasia por energía de las colaterales venosas, las cuales están sometidas a alta presión tras su arterialización.
En un estudio previo realizado por nuestro grupo se evaluó la eficacia y la seguridad de ambos dispositivos de hemostasia en colaterales venosas de VS en un modelo in vitro. Los fragmentos venosos fueron interpuestos en un circuito con una máquina de rodillo para simular un flujo pulsátil y se elevó progresivamente la presión en el interior del sistema hasta alcanzar la rotura. La presión de estallido se registró para ambos dispositivos y se obtuvieron presiones suprafisiológicas (788,9 ± 455 mmHg para EB y 602,5 ± 363,1 mmHg para BA) sin obtener diferencias estadísticamente significativas entre ellos, aunque sí se observaron diferencias en el lugar donde se localizaba la zona de fuga. Los injertos sellados con EB fueron más resistentes (17).
Sin embargo, se desconoce la resistencia de la zona de sellado tras superar el periodo de cicatrización, así como el riesgo de degeneración aneurismática en el injerto que pueda generar complicaciones a medio plazo.
Para poder evaluar correctamente in vivo las características de estos dispositivos de sellado es necesario disponer de un modelo animal eficaz, con la mayor tasa de supervivencia posible, y que permita valorar, a medio plazo, la eficacia del sellado de colaterales de vena safena interpuesta en un sistema arterial. Con ese objetivo, en el presente estudio hemos diseñado dos modelos animales diferentes y hemos analizado su viabilidad en términos de tiempo de isquemia, de supervivencia y de complicaciones posoperatorias.
METODOLOGÍA
Diseño
Se trata de un estudio experimental in vivo de aorta de conejo. Para ello se desarrollaron dos modelos de injerto venoso: el primero consistió en la interposición término-terminal de un segmento de vena safena (VS) humana en la aorta infrarrenal. En el segundo, se realizó una plastia de aorta infrarrenal con parche de VS humana con colateral venosa.
Los fragmentos de vena safena se extrajeron del cadáver de un donante o de remanentes de cirugía de revascularización o amputación.
En ambos modelos se realizó la disección de la aorta abdominal infrarrenal de conejo, la resección de segmento aórtico o arteriotomía en cara anterior de aorta, según el modelo, y la inserción del injerto de VS humana, incluyendo una colateral venosa. La colateral venosa se selló tras desclampaje aórtico con uno de los dispositivos de sellado, EB o BA, según aleatorización previa.
En ambos modelos de aorta de conejo, se procedió a la eutanasia a las 4 semanas y se realizó una prueba de resistencia de la zona de sellado mediante cateterización de aorta y clampaje distal y de sus ramas. Posteriormente, se aumentó progresivamente la presión hasta provocar la rotura en el fragmento de aorta estudiado, identificando la fuga de forma directa o indirectamente a través de la pérdida de presión.
El diseño experimental fue aprobado por el Comité de Ética de Experimentación Animal y por la Conselleria de Agricultura, Medio ambiente, Cambio Climático y Desarrollo Rural con el código 2021/VSC/PEA/0191.
Ámbito
La extracción del fragmento de VS del cadáver de un donante o de remanentes de cirugía de revascularización o amputación se realizó, por parte del Servicio de Angiología, Cirugía Vascular y Endovascular del Hospital Universitari i Politècnic La Fe, mediante procedimientos rutinarios hasta obtener un total de 16 fragmentos de VS. Las intervenciones quirúrgicas realizadas en animales, así como su seguimiento posoperatorio y estabulación durante 4 semanas, se realizaron en el animalario del Instituto de Investigación Sanitaria La Fe (IISLAFE) bajo supervisión de personal responsable hasta la finalización de la fase de experimentación animal y cumpliendo la normativa vigente.
Sujetos
Se utilizaron 16 conejos macho New Zealand con un peso comprendido entre 2,5 y 3 kg. Se obtuvieron 16 fragmentos de VS del cadáver de un donante o remanentes de cirugía de revascularización o amputación.
Variables
Como variable principal del estudio se registró la supervivencia del animal tras el procedimiento a las 4 semanas. Como variables secundarias se analizaron: paresia de miembros inferiores, presencia de sangrado abdominal y la presión de estallido en la prueba de resistencia de la zona de sellado en aquellos sujetos que sobrevivieron al periodo de seguimiento posoperatorio de 28 días. Se establecieron como criterios de punto final para la interrupción anticipada del experimento los siguientes: infección activa con supuración de la herida quirúrgica, peritonitis, dolor no controlable con las pautas de analgesia, signos de caquexia, taquipnea o letargia mantenida, pérdida de peso > 25 %, peritonitis o un periodo de ayuno superior a 48 h. En dichos casos se realizó la eutanasia y la autopsia del animal.
Análisis estadístico
Se realizó un estudio descriptivo de las variables por cada grupo de modelo animal. Para la comparación de los parámetros de tiempo de cirugía, de tiempo de isquemia y de presiones de estallido se realizaron análisis no paramétricos (Wilcoxon-Mann-Whitney). Para la comparación de variables dicotómicas, como la mortalidad y la paraplejia posoperatoria, se usó el test no paramétrico F de Fisher. Todos los análisis se realizaron mediante el software SPSS (versión 26.0 o superior).
PROCEDIMIENTO
Técnica quirúrgica
Todos los animales se anestesiaron por personal veterinario investigador del IISLAFE. Se empleó como medicación preoperatoria enrofloxacina 10 mg/kg intravenoso (IV), metoclopramida IV 0,5 mg/kg, ranitidina IV 2 mg/kg para prevenir úlceras gástricas y meloxicam 0,25 mg/kg IV como analgésico. Se indujo la anestesia mediante ketamina intramuscular (IM) (50 mg/kg) y xilacina IM (5 mg/kg). El animal se inmovilizó, previamente, envolviéndolo con un paño e inyectando la premedicación en el bíceps femoral.
Posteriormente, se canuló la vena marginal de la oreja y se mantuvo la anestesia general con sevofluorano 2,5-3 % y bolos de fentanilo-fluanisona 0,2-0,3 ml/kg IM cada 30-45 min.
La técnica consistió en abordaje quirúrgico mediante laparatomía media, exposición del retroperitoneo y disección de aorta infrarrenal y ramas lumbares. Tras heparinización sistémica con bolus de heparina sódica (0,5 mg/kg peso) se procedió al clampaje de la aorta infrarrenal e inmediatamente por encima de las arterias ilíacas comunes. Se interpuso un fragmento de VS humana según los modelos de aorta animal propuestos.
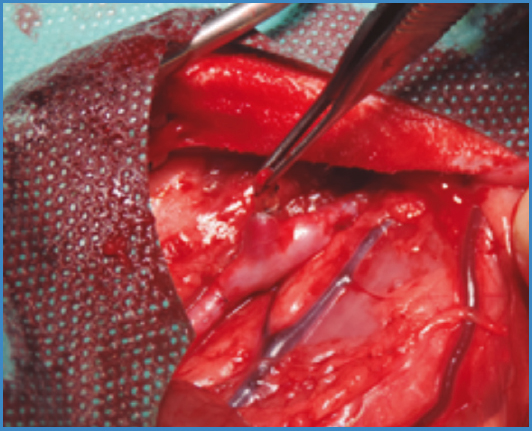
En el primer modelo se realizó un bypass aorto-aórtico con interposición de un fragmento venoso de aproximadamente 3 cm con la colateral a estudio (Fig. 1). Los injertos se suturaron de forma término-terminal, realizando ambas anastomosis (proximal y distal) con sutura continua de polipropileno 6/0 con lupas de aumento de × 2,5.
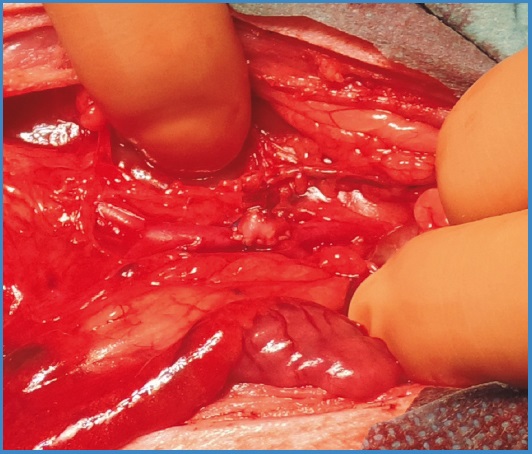
En el segundo modelo descrito, se realizó una plastia de aorta abdominal infrarrenal con parche de fragmento venoso con la colateral a sellar (Fig. 2). Se realizó la sutura continua del injerto con el mismo material descrito previamente.
Tras finalizar las suturas vasculares, se procedió al desclampaje tras el purgado previo con suero fisiológico heparinizado al 1 %. Posteriormente, se selló la colateral venosa con uno de los dispositivos (EB o BA). Para el sellado con EB se utilizó Ligasure® (Maryland Sealer/Divider, Covidien, Colorado, EE. UU.) y su generador Valleylab® LS10, mientras que para el BA se empleó un equipo Sonicision® (Cordless Ultrasonic Dissector, Covidien, Colorado, EE. UU). En ambos casos se comprobó la estanqueidad del sellado inmediatamente tras el desclampaje.
Se verificó la hemostasia del lecho quirúrgico y se procedió al cierre de la pared abdominal por planos con sutura continua de ácido poliglicólico 3/0 y plano cutáneo con sutura continua intradérmica con ácido poliglicólico 4/0.
Seguimiento posoperatorio
Los animales fueron estabulados en jaulas individuales y mantenidos de acuerdo con la legislación vigente para el mantenimiento de los animales utilizados en experimentación y otros fines científicos y reflejado en el RD 53/2013, anexo II, apartado 2.
Durante 3 días se inyectó meloxicam cada 24 h subcutánea (SC), metoclopramida sc cada 12 horas hasta el restablecimiento del tránsito intestinal y como protector gástrico, ranitidina SC cada 12 horas. Para el control del dolor posoperatorio se empleó buprenorfina 0,03 mg/kg SC cada 12 horas. Se administró heno de diente de león ad libitum para evitar impactación cecal, facilitar el peristaltismo intestinal y evitar su parada.
Todos los animales fueron sometidos a dieta normal a partir de las 24 h del procedimiento e inmunosupresión con ciclosporina oral 5 mg/kg cada 24 h para evitar el rechazo del injerto.
Eutanasia
En aquellos animales supervivientes, se realizó la eutanasia a las 4 semanas, siguiendo el protocolo contemplado en la legislación. Se empleó sobredosis de pentobarbital y exanguinación tras la resección de la pieza a estudio (aorta abdominal con injerto experimental de VS) (Fig. 2), previa sedación con ketamina y xilacina.
Prueba de resistencia de la zona de sellado
Este test se realizó en aquellos animales que sobrevivieron a las 4 semanas posoperatorias. Para ello, se realizó la cateterización de la aorta abdominal infrarrenal del conejo mediante laparatomía media y clampaje de ambas arterias ilíacas y ramas lumbares. Se realizó la eutanasia y posteriormente se elevó progresivamente la presión intraarterial con una jeringa manómetro Encore® (Boston Scientific, Estados Unidos) hasta provocar la rotura y la fuga en la zona de sellado de la colateral o en la pared de la aorta. La presión de estallido fue registrada con un manómetro industrial GOD0002 (Goodyear®, Estados Unidos).
RESULTADOS
El primer modelo de aorta (interposición término-terminal de injerto de VS en aorta infrarrenal) fue utilizado como técnica de elección en los primeros 5 conejos, que presentó una pérdida por muerte del animal durante la inducción anestésica. Los resultados individuales para cada sujeto aparecen detallados en la tabla IA.
Tabla IA. Resultados y características individuales de los animales experimentales con el modelo de injerto de interposición.
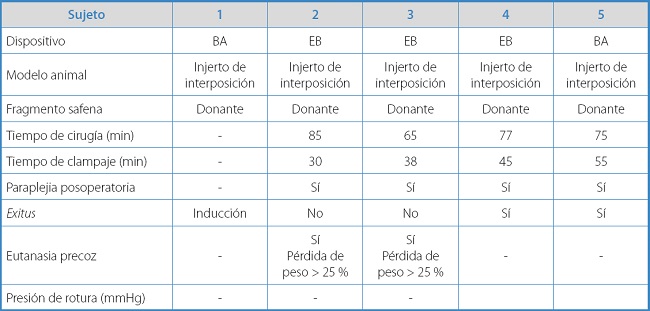
El tiempo medio del procedimiento quirúrgico para el modelo de bypass áortico fue de 75 ± 8,23 min, con un tiempo medio de isquemia de 42 ± 10,61 min.
La supervivencia de este grupo a los 7 días fue de un 50 % (2 sujetos). La tasa de paraplejia en todos los conejos intervenidos mediante este modelo fue del 100 %. En los dos supervivientes, tuvo que realizarse eutanasia precoz a las 3 semanas posoperatorias por pérdida de bienestar animal debido a una disminución del peso superior al 25 % secundario a la paraplejia. No se objetivó hemorragia intraabdominal ni en las autopsias de los 2 conejos fallecidos de forma espontánea ni en los 2 a los que se les había practicado la eutanasia. En todos los casos presentaban estanqueidad del sellado de la colateral y permeabilidad del sector aortoilíaco.
En este modelo animal no pudo realizarse la prueba de resistencia del sellado ni se obtuvo ninguna presión de estallido al no conseguir ningún superviviente a las 4 semanas posoperatorias necesarias para finalizar el proceso de cicatrización.
Tras considerar las posibles causas de mortalidad y una tasa de paraplejia mayor de la esperada, se decidió interrumpir la experimentación para revalorar el protocolo y el refinamiento del procedimiento quirúrgico. Entre los distintos modelos alternativos analizados con la finalidad de minimizar la disección periáortica y el tiempo de clampaje, se eligió finalmente el de plastia de aorta infrarrenal con parche de VS. Con este modelo, se intervinieron los 11 conejos restantes. Los resultados individuales para cada sujeto aparecen detallados en la tabla IB.
Tabla IB. Resultados y características individuales de los animales experimentales con el modelo de plastia de aorta.
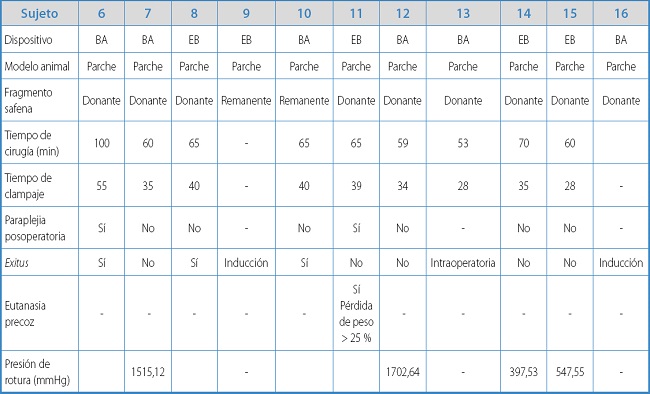
En este modelo, el tiempo medio quirúrgico fue de 66,33 ± 13,53 min, inferior al de interposición del injerto (p = 0,076), y el tiempo medio de isquemia fue de 37,11 ± 8,1 min, inferior al modelo de bypass aórtico (42 ± 10,61 min), pero ambos sin diferencias estadísticamente significativas (p = 0,414).
La supervivencia a los 7 días fue de 5 de 9 animales (55,56 %), ya que se produjeron 2 pérdidas por muerte preoperatoria durante la inducción anestésica. La tasa de paraplejia fue del 25 %, significativamente inferior al modelo de injerto de interposición (100 %) (p = 0,03). La supervivencia a las 4 semanas fue de 4/9 (44,44 %). En uno de los animales, tuvo que realizarse una eutanasia precoz a los 7 días posoperatorios por pérdida de bienestar animal, con disminución significativa de peso, secundario a paraplejia. En todas las autopsias se descartó sangrado intraabdominal, con presencia de reacción fibrótica alrededor de la zona de sellado de la colateral.
En los 4 supervivientes se realizó estudio de resistencia de la zona de sellado, con una presión media de rotura para el dispositivo EB (n = 2) de 491,29 ± 132,59 mmHg y una presión media de estallido para el sistema de sellado BA (n = 2) de 1608,88 ± 132,59 mmHg, sin diferencias estadísticamente significativas.
En cuanto a la localización de la zona de fuga, para EB en 1 caso se produjo en la zona de sellado y la otra, a nivel de la pared lateral de la aorta, mientras que para BA uno de los estallidos tuvo lugar en la zona sellada por el dispositivo y el otro, a nivel de las conexiones del sistema de registro de la presión a 1515 mmHg.
No se produjeron complicaciones infecciosas ni otras reacciones adversas a la inmunosupresión en ningunos de los grupos estudiados.
DISCUSIÓN
El sellado con dispositivos liberadores de energía es eficaz en la hemostasia de arterias o de venas en casos como la nefrectomía (8), la histerectomía (18) o la toracotomía (19). Sin embargo, existen diferencias entre las presiones de estallido en el territorio venoso, que es inferior en comparación al arterial (20), por lo que se precisan estudios que evalúen la eficacia del sellado a medio plazo en colaterales venosas sometidas a sistemas de alta presión, como ocurre en el caso de la cirugía de revascularización de miembro inferiores.
En un estudio previo realizado por nuestro grupo se demostró la no inferioridad de estos sistemas de sellado con respecto a la ligadura convencional, en colaterales venosas sometidas a presiones arteriales y con presiones de estallido suprafisiológico en un circuito hemodinámico in vitro (17).
Sin embargo, para demostrar su durabilidad y, por tanto, su eficacia a medio plazo, es necesaria su demostración en un modelo in vivo que permita evaluar la resistencia a la rotura de las colaterales en condiciones fisiológicas una vez superados los periodos inflamatorios y de cicatrización convencionales, más allá de las 3 semanas (21).
El modelo de aorta de conejo es el ideal, dadas sus características anatómicas en su porción abdominal, con una longitud y un diámetro medio (3 cm × 3,7 mm) congruente con los segmentos de VS, así como su menor precio y mayor facilidad de manejo y mantenimiento que el modelo alternativo de arteria carótida canina.
En el estudio de Ribas y cols. (22) se realizó un implante de polidimetilsiloxano en conejos New Zealand como modelo de bypass protésico en arterias de pequeño tamaño. En dicho estudio la tasa de supervivencia fue del 46,9 %, con una tasa de paraplejia del 17,2 % en los supervivientes.
En nuestro estudio, el modelo de interposición aórtica término-terminal del injerto presentó una mortalidad a los 7 días del 50 % y del 100 % a las 4 semanas, así como una tasa de paraplejia del 100 %. Esta elevada tasa de complicaciones neurológicas por isquemia medular condicionó un posoperatorio con mayores comorbilidades debido a la dificultad para la movilización del animal, la ausencia de micción espontánea, que precisó de maniobras de vaciado diarias, así como una pérdida de peso progresiva superior al 25 %. Todos estos condicionantes implicaron una pérdida de bienestar animal y, por tanto, el cumplimiento de los puntos de criterio final para su eutanasia.
Una tasa similar de complicaciones se ha descrito en otros estudios de experimentación en conejos como modelo de isquemia medular. En el estudio de Saba y cols. (23), 37 conejos fueron sometido a un clampaje endoluminal de la aorta durante 30 minutos para la creación de un modelo de isquemia medular. En el grupo sin neuroprotección la tasa de paraplejia fue del 100 %, mientras que en el grupo de diltiazem intraarterial la tasa de paraparesia fue del 12,5 % (escala de Tarlov inferior a 3) a las 48 h. En el caso del grupo de Oyar y cols. (24) se realizó el experimento en 27 conejos, con un tasa de paraplejia del 100 % en el grupo sin neuroprotección y del 75 % a las 48 h en el grupo con adrenomedulina. Existía una mayor gravedad de la paraparesia en aquellos animales con un tiempo de isquemia superior a 30 minutos, lo que explica la mayor tasa de complicaciones neurológicas en relación con el tiempo (23,24).
A diferencia del estudio de Ribas y cols. (22), en el que el modelo arterial consistía en un bypass aórtico en paralelo con un nuevo material protésico, con ambas anastomosis en configuración término-lateral, lo que permitía reperfundir los tejidos tras la realización de la primera anastomosis, en nuestro primer modelo la anastomosis era término-terminal, con interposición recta del injerto venoso, por lo que el tiempo de isquemia fue mayor al tener clampada la aorta durante las dos suturas vasculares, lo que podría justificar, al menos en parte, las mayores tasas observadas de mortalidad y de paraplejia.
Dada la alta tasa de morbimortalidad con dicho modelo, y siguiendo el principio de refinamiento de animales de laboratorio, se propuso un segundo modelo animal, que consistió en una plastia de aorta infrarrenal con parche de injerto de vena safena humana. Este nuevo modelo precisaba solo una anastomosis vascular y, por tanto, un menor tiempo de isquemia medular. Este hecho, junto al menor número de arterias lumbares que precisaban su oclusión temporal durante el tiempo de isquemia, resultó en un menor porcentaje de paraplejias (25 %) en los sujetos supervivientes.
La anatomía de las arterias del conejo presenta una similitud con la de los humanos en cuanto a la bifurcación de la aorta abdominal en arterias ilíacas comunes y la presencia de ramas lumbares (25). Sin embargo, en el conejo las arterias lumbares presentan una escasa colateralidad, de ahí su mayor número de complicaciones neurológicas durante la manipulación y la oclusión temporal de la aorta infrarrenal y de sus ramas (26).
Las arterias lumbares en el conejo se presentan en 7 pares, con un tronco común desde la pared posterior de la aorta. El séptimo par suele ser la rama distal de la arteria sacra media, que se origina en un 50 % de los casos a nivel caudal de L6, mientras que la bifurcación aórtica se presenta en el 53,3 % de los casos a nivel craneal de L7 en el conejo (27). Esto implica un pequeño espacio de disección a nivel de la aorta infrarrenal distal si se quieren respetar todas las ramas lumbares con el objetivo de prevenir la isquemia medular.
En el segundo modelo, como precisa una menor longitud de aorta clampada y solo una anastomosis, se observó una menor tasa de paraplejia. Además, se decidió realizar la plastia de aorta lo más caudal posible con el objetivo de respetar la arteria sacra media, que da origen al último par de arterias lumbares. En el caso de que el ostium arterial estuviera en una localización más caudal, su reflujo durante la sutura se controló mediante la colocación de un par ligaduras de seda de 3/0 enfrentadas, sin llegar a circunferenciar cada una de ellas toda la arteria, como se observa en la figura 3. Con esto se reducía el reflujo de la arteria sacra media y permitía realizar la anastomosis del injerto venoso en la aorta en condiciones óptimas.
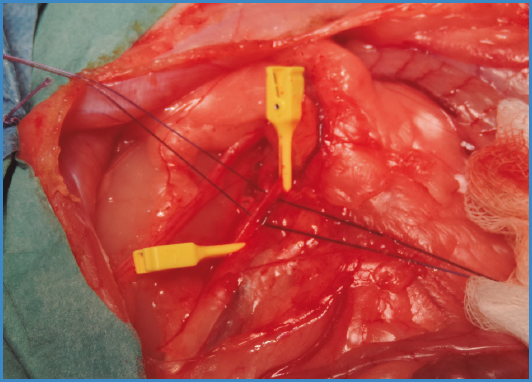
Figura 3. Imagen intraoperatoria de la arteria sacra media con control del reflujo con un par de ligaduras de seda 3/0, sin rodear por completo la arteria para evitar su lesión.
Tanto en el modelo arterial de injerto de interposición como en el de plastia de aorta, se demostró la eficacia en la hemostasia del sellado con ausencia de sangrado abdominal en todas las autopsias. Sin embargo, solo en este último modelo arterial se obtuvieron supervivientes a las 4 semanas para realizar la prueba de resistencia de la zona de sellado. La presión de estallido con ambos dispositivos fue siempre a presiones suprafisiológicas, con una presión media de 491,29 mmHg para EB y de 1608,88 mmHg para BA, pero sin obtener diferencias significativas.
En todas las autopsias se demostró la permeabilidad del sector aortoilíaco intervenido, excepto en una caso en el que se detectó trombosis precoz de la aorta terminal durante la intervención y se decidió eutanasia precoz, según criterios de punto final. No se identificaron sangrado ni hemorragia intraabdominal con estanqueidad de la zona de sellado ni en el modelo de injerto de interposición ni de plastia de aorta.
Como limitaciones del estudio, debemos señalar el pequeño tamaño muestral obtenido para realizar la prueba de presión de estallido. A pesar de un tamaño muestral inicial de 16 animales, solo pudo realizarse en 4 conejos. Una de las principales limitaciones fue la baja supervivencia con el modelo animal de bypass término-terminal. A pesar de ello, la presión de estallido obtenida fue siempre a presiones suprafisiológicas (> 300 mmHg); sin embargo, no se encontraron diferencias significativas entre ambos dispositivos debido al número insuficiente de sujetos para realizar el test de resistencia.
En futuros estudios es preciso refinar el modelo animal para obtener un mayor número de supervivientes tras el proceso de cicatrización a las 4 semanas. Si bien el conejo presenta un mayor riesgo de isquemia medular, consideramos que se trata del modelo animal más adecuado, dado que presenta un diámetro de aorta similar al de la VS y que cumple el criterio de reducción al evitar emplear especies de mayor tamaño, con mayor dificultad técnica en cuanto al posoperatorio e implicaciones bioéticas.
Este estudio preliminar ha permitido refinar el protocolo para comprobar la eficacia del sellado de colaterales venosas con dispositivos liberadores de energía, con unas tasas de mortalidad y de paraplejia aceptables en un modelo de aorta de conejo in vivo.
No obstante, pese a haber conseguido resolver, al menos parcialmente, el inconveniente de la isquemia medular precoz, no ha podido obtenerse un número suficiente de sujetos que permita realizar una comparación adecuada entre ambos dispositivos respecto a la presión de estallido por sobrepresión. Por tanto, en un futuro próximo se continuará el estudio con el desarrollo de este segundo modelo de aorta hasta conseguir un número suficiente de supervivientes que permita verificar la eficacia a medio plazo del sellado de colaterales mediante sistemas liberadores de energía.











 texto en
texto en