INTRODUCCIÓN
La diabetes mellitus es una patología que afecta a millones de personas en todo el mundo. La prevalencia mundial ha aumentado rápidamente en los últimos treinta años. El pie diabético (PD) se define en el glosario del Consenso Internacional del Pie Diabético como una herida que penetra la piel en cualquier región por debajo del tobillo, en personas afectadas con diabetes y que incluye, además, la gangrena y la necrosis como resultado de la interacción de diferentes factores inducidos por la hiperglucemia mantenida y causas traumáticas previas, aunque el pie no presente lesiones (1).
Las úlceras del pie diabético (UPD) son complicaciones frecuentes de la diabetes mellitus y representan una morbilidad, una mortalidad y unos gastos sanitarios significativos. Es una entidad con una incidencia anual del 2 %, que se presenta, según estudios europeos, entre el 19 y el 34 % de los pacientes con diabetes mellitus a lo largo de su vida. En Latinoamérica es motivo de ingreso en el 3,7 % de los casos y en el 20 % de los internados con diabetes mellitus. Las úlceras del pie diabético son una causa importante de morbilidad y representan al menos dos tercios de todas las amputaciones no traumáticas realizadas en los Estados Unidos (1,2).
Las úlceras del pie diabético infectadas o isquémicas representan aproximadamente el 25 % de todas las estancias hospitalarias de los pacientes con diabetes. De acuerdo con datos de la Organización Mundial de la Salud, las complicaciones de la diabetes en las extremidades inferiores representan una de las diez afecciones principales en términos de años vividos con discapacidad. Además, los pacientes con diabetes con o sin úlcera del pie diabético tienen mayores tasas de depresión y la expresión de signos de depresión se asocia con un mayor riesgo de úlceras del pie diabético. La isquemia por obstrucción arterial (que existe en el 50 % de las úlceras) y la infección son las que determinarán el pronóstico de la úlcera y de la extremidad. Estas observaciones ilustran la importancia del tratamiento rápido y adecuado de las úlceras del pie en pacientes con diabetes (1,2).
DESARROLLO
Definición y clasificación
La enfermedad del pie diabético es una de las complicaciones más graves de la diabetes mellitus. Es una fuente de gran sufrimiento y costos económicos para el paciente y también impone una carga considerable a la familia del paciente, a los profesionales, a los centros de salud y a la sociedad en general (2,3).
En cuanto a la clasificación, aunque algunas pueden usarse en un contexto especializado (por ejemplo, para determinar la necesidad de una investigación detallada de un componente de la úlcera), es importante que el sistema adoptado permita que el equipo de atención permanezca alerta con respecto a otros componentes y a los procesos asociados de atención según la región geográfica (y las consiguientes características de la población), así como según la disponibilidad de recursos (2,3).
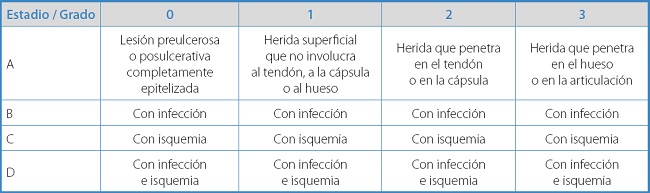
Si bien el sistema de Wagner fue el primero en ser ampliamente adoptado, no está bien validado y no distingue bien entre los tipos de úlceras. La clasificación de la Universidad de Texas (Tabla I) está bien validada y se ha vuelto ampliamente utilizada, pero adolece de la falta de referencia a la neuropatía o al área de la úlcera, que se considera uno de los principales determinantes del tiempo de curación. Por otra parte, la clasificación de Infectious Diseases Society of America/International WorkingGroup on Diabetic Foot (IDSA/IWGDF) se desarrolló originalmente como una guía diseñada para ayudar en las decisiones relacionadas con el ingreso hospitalario, pero luego se evaluó no con este propósito, sino como un predictor de amputación combinada mayor y menor. Esta debe elegirse para la categorización de la infección. Por otro lado, la clasificación WIfI debe elegirse para evaluar la perfusión y cualquier posible beneficio de la revascularización. Esta se construyó a partir de 3 factores que han demostrado ser predictores del riesgo de amputación: la extensión de la lesión (wound), el grado de isquemia (ischemia) y la gravedad de la infección (foot infection) (2,3).
Otro sistema de clasificación, el PEDIS, nace como un sistema de clasificación de lesiones en pie diabético capaz de cubrir las necesidades específicas de los grupos investigadores en el campo del pie diabético. Este sistema se concibió específicamente para ayudar a interpretar correctamente datos en proyectos de investigación (4). Evalúa cinco categorías que, según la literatura científica y la opinión de los expertos, son los parámetros más relevantes para los proyectos de investigación en úlceras diabéticas. Estas categorías son: irrigación, extensión, profundidad, infección y sensibilidad. Cada una de estas categorías se valora de forma independiente. Es un sistema complejo que requiere para su uso de pruebas diagnósticas complementarias (4).
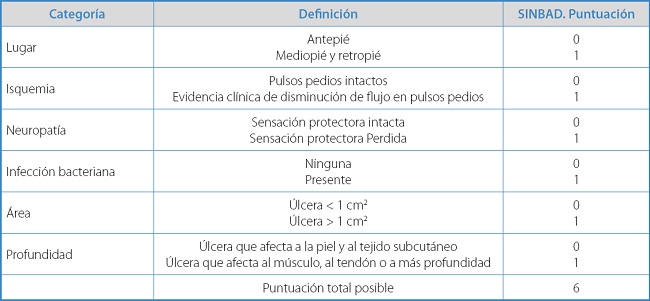
En general, el sistema SINBAD (Tabla II) es el sistema más ampliamente validado y es el que debe utilizarse para efectos de comunicación entre clínicos; además, incluye parámetros que son importantes predictores de morbimortalidad, como el tamaño y la localización de la úlcera del pie diabético. La puntuación del sitio, la isquemia, la neuropatía, la infección bacteriana, el área y la profundidad (SINBAD) se diseñaron para auditar poblaciones de úlceras e incluyen las mismas variables clínicas que S(AD)SAD plus site. Clasifica cada una como ausente (0 puntos) o presente (1 punto), lo que crea un sistema de puntuación fácil de usar que puede alcanzar un máximo de 6 puntos (4,5).
Fisiopatología
Una tríada de neuropatía, traumatismo con infección secundaria y enfermedad oclusiva arterial explica la fisiopatología de la úlcera del pie diabético. La neuropatía periférica produce atrofia muscular intrínseca, que conduce a cambios anatómicos funcionales de formación de dedos en martillo y al desarrollo de zonas de alta presión en la superficie plantar del pie en las cabezas de los metatarsianos. Los traumatismos repetitivos al caminar, junto con disminución de la sensibilidad y la propiocepción, predisponen a lesiones cutáneas al producir atrofia y dislocación de las almohadillas protectoras de grasa plantar, que conducen a ulceración e infección con protección inadecuada de la piel o calzado inadecuado (4,5).
La falta de atención al cuidado de la piel, así como la falta de uso de cremas humectantes o el reconocimiento rápido de un traumatismo dérmico (enrojecimiento, formación de ampollas, etc.), pueden provocar ulceración y el desarrollo de una infección invasiva de los tejidos blandos. Si no se trata con prontitud, la ruptura del tejido continuará, especialmente si el individuo continúa caminando. Finalmente, los procesos destructivos del traumatismo y la infección penetran en la fascia profunda, lo que permite que la infección se extienda a los músculos de la parte media del pie, las articulaciones y las vainas de los tendones (4,5).
Neuropatía
La neuropatía producida por la diabetes mellitus es una polineuropatía simétrica en la que las funciones motoras, sensoriales y autonómicas se ven afectadas en diversos grados. En algunos pacientes, las fibras motoras de mielina periférica se ven afectadas en un patrón dependiente de la longitud, con los nervios más largos afectados primero, lo que da como resultado una distribución media de la pérdida sensitiva/motora. La pérdida del reflejo de Aquiles es el signo más temprano de estos cambios. Con la atrofia de los músculos lumbricales e interóseos, la anatomía del arco del pie cambia, con un aumento relativo en las fuerzas de los tendones extensores, que producen una deformidad en “garra” de los dedos. Un cambio en la función extrínseca del músculo/tendón contribuye a la depresión de las cabezas de los metatarsianos, a la contractura del dedo en martillo de los dedos y a la deformidad del tobillo equino (4,5).
Además de la disfunción de las fibras motoras, la pérdida sensorial que afecta a las fibras de mielina de tipo A provoca una pérdida de la propiocepción, la sensación de presión, la percepción vibratoria y la alteración de la marcha. La destrucción de las fibras sensoriales de tipo C conduce a una incapacidad para apreciar los estímulos dolorosos. Como resultado de estas sensaciones alteradas, el paciente diabético puede experimentar traumatismos repetitivos en el pie, incluida la formación de ampollas o incluso la fractura del hueso metatarsiano sin apreciar la incomodidad del pie. La neuroartropatía o pie de Charcot implica una destrucción extensa de la parte media del pie con colapso del arco y pérdida de la estabilidad del pie (4,5).
La disfunción del sistema autónomo, con alteración de la termorregulación microvascular y anhidrosis, se suma a las alteraciones motoras y sensoriales. La piel se vuelve seca y propensa a agrietarse, lo que disminuye su eficacia como barrera contra la invasión de microorganismos, y se vuelve susceptible a infecciones dérmicas, es decir, a celulitis (3,5).
Insuficiencia arterial
La hiperglucemia y los cambios asociados en el metabolismo de la glucosa producen daño endotelial, hiperlipidemia, aumento de la viscosidad y de la actividad de las plaquetas, y con el tiempo, el desarrollo de aterosclerosis. La disfunción endotelial con alteración de la vasodilatación dependiente de óxido nítrico favorece la permeabilidad endotelial a las partículas LDL. La resistencia a la insulina activa la señalización inducida por la proteína cinasa C y aumenta la producción de especies reactivas de oxígeno, lo que favorece la producción de LDL oxidada. La hiperglucemia favorece la expresión de genes que codifican un gran número de mediadores que participan en la aterogénesis y, entre ellos, proteínas quimiotácticas de monocitos, lo que favorece la reacción inflamatoria subendotelial y la fagocitosis de las LDL. La diabetes también estimula la aterogénesis inducida por LDL por la disfunción de las células musculares lisas, que favorece su migración y participación en la progresión de las placas de ateroma en parte mediado por la activación del factor nuclear Kb (5,6). La distribución de la enfermedad aterosclerótica de las extremidades inferiores en los diabéticos difiere de la de los no diabéticos y afecta preferentemente a las arterias infrageniculadas de las piernas (arterias tibiales anterior y posterior), con una afectación menos común del segmento arterial femoropoplíteo (femoral superficial y poplíteo) y, a menudo, sin afectación del segmento aortoilíaco (5,6).
El desarrollo de enfermedad oclusiva difusa de las arterias tibiales u oclusión arterial más proximal pueden resultar en una perfusión del pie por debajo de un nivel adecuado para mantener la integridad de la piel y puede desarrollarse una úlcera isquémica o gangrena (6,7) (Fig. 1).
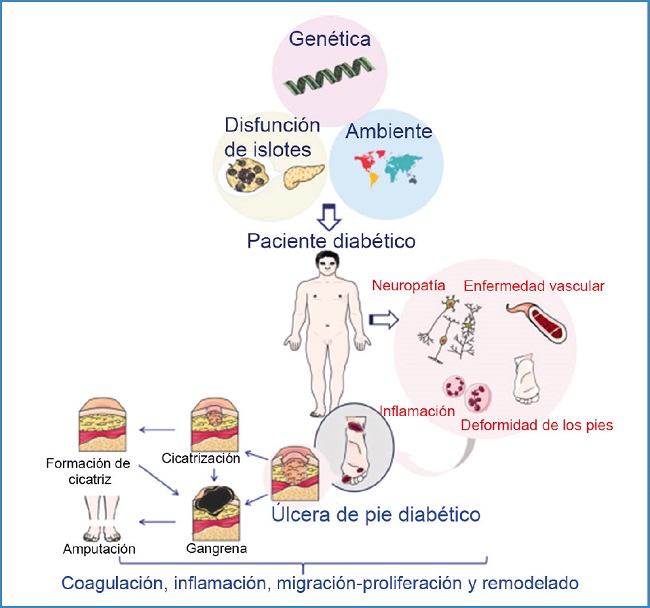
Fuente: Wang, 2021
Figura 1. Factores fisiopatológicos de la úlcera del pie diabético (UPD) y su proceso de cicatrización.
Finalmente, la naturaleza de la infección del pie diabético puede variar desde la celulitis no complicada hasta la fascitis necrosante, que amenaza la vida y las extremidades. Los intervalos de control glucémico deficiente producen disfunción inmunológica con alteración de la actividad de los leucocitos y la función del complemento, que facilitan el desarrollo de una infección tisular invasiva. En presencia de piel y de tejidos blandos dañados o mal perfundidos, puede ocurrir una rápida penetración de bacterias en lo profundo de la fascia, lo que produce una infección y sepsis que amenazan el pie. Las infecciones polimicrobianas (estafilococos, estreptococos, enterococos, E. coli y otras bacterias gramnegativas) son comunes, al igual que la presencia de cepas bacterianas resistentes a los antibióticos, especialmente Staphylococcus aureus resistente a la meticilina (SARM), presente en el 30-40 % de los casos. El riesgo de amputación aumenta cuando la infección del pie diabético involucra cepas bacterianas resistentes, que a menudo son el resultado del uso repetido o prolongado de antibióticos (6,7).
Epidemiología
La incidencia informada de UPD varía ampliamente según el diseño del estudio, la población y la época. En series desde 2010, la incidencia anual generalmente oscila entre el 0,2 % y el 11 % en entornos clínicos específicos de diabetes o entre menos del 0,1 % y el 8 % en cohortes basadas en la comunidad (8,9).
Los datos recientes sobre la incidencia relativa en la diabetes de tipo 1 frente a la diabetes de tipo 2 son contradictorios y las diferencias en el riesgo de UPD entre las poblaciones de diabetes de tipo 1 y de tipo 2 estarán fuertemente determinadas por las diferencias en la edad y en la duración de la diabetes. La Fundación Internacional de Diabetes estima que entre 40 y 60 millones de personas en todo el mundo se ven afectadas por la UPD, un marcado aumento con respecto a las estimaciones de 2015, que oscilaron entre 9 y 26 millones (8,9).
Al igual que la incidencia, las estimaciones de prevalencia varían ampliamente y están influenciadas por las diferencias en las definiciones de DFU, el enfoque de la vigilancia, la integridad del seguimiento y la definición y el enfoque de diabetes (8,9).
Si bien históricamente se han informado las tasas más altas de UPD en América del Norte, los estudios de cohortes modernos encuentran tasas superiores al 15 % en poblaciones de personas con diabetes en África y América del Sur. Se informa de que la prevalencia global de UPD es más baja en adultos con diabetes de tipo 1 en comparación con diabetes de tipo 2, lo que puede reflejar una edad más joven y una duración acumulada, diferencias en el diseño del estudio y en la recopilación de datos o falta de cohortes representativas de personas con diabetes de tipo 1 (8,9).
Los patrones de prevalencia de UPD se han mantenido estables a pesar de las fluctuaciones en la incidencia. La persistencia de tiempos prolongados de curación y las tasas de recurrencia de un año por encima del 20 % no han mejorado en los últimos 15-20 años a pesar de los avances en el cuidado de las heridas y en las técnicas de revascularización. El riesgo de por vida de UPD se ha informado con frecuencia en el rango del 12 % al 25 %, aunque un informe reciente de Armstrong y cols. sugieren que el riesgo de por vida es mayor (entre 19 % y 34 %) como resultado de aumentos en la expectativa estimada de vida (8,9).
Se necesitan más estudios epidemiológicos a gran escala basados en la comunidad para caracterizar mejor la frecuencia, el curso clínico y los factores de riesgo de la UPD (9).
Factores de riesgo
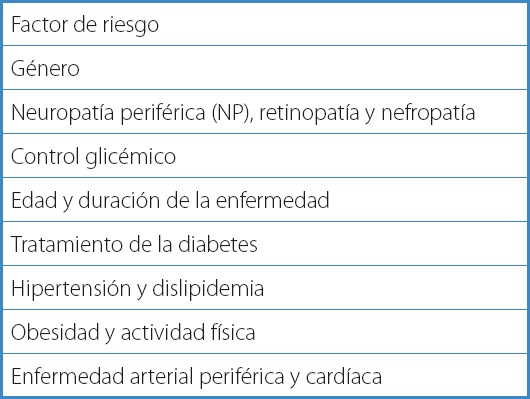
Son varios los factores de riesgo que son predictivos de úlceras y de amputaciones, por lo que el reconocimiento temprano y el manejo de los factores de riesgo son importantes para reducir la morbilidad de la ulceración del pie. La mayoría de estos se identifican fácilmente a partir de la historia clínica o del examen físico. Los factores de riesgo más importantes son: ulceración previa del pie, deformidad del pie, enfermedad vascular y neuropatía (9,10).
Género: uno de los factores de riesgo con mayor consistencia es el sexo masculino. Se ha demostrado una relación de riesgo de al menos 1,5 para los pacientes masculinos con diabetes en comparación con las pacientes femeninas con diabetes (10,11).
Edad: el riesgo de UPD aumenta con la edad, lo que está estrechamente relacionado con una mayor duración de la diabetes, con los efectos acumulativos de la hiperglucemia y con una mayor prevalencia de complicaciones micro- y macrovasculares. Los adultos jóvenes y de mediana edad con UPD tienden a presentar un estadio de úlcera más avanzado y es más probable que tengan infección del pie, hospitalización y recurrencia de la úlcera que los adultos mayores tratados en entornos similares (10,11).
Control glicémico: aunque una fuerte relación positiva con un control glucémico deficiente sería lógica para todas las complicaciones tardías de la diabetes, existen discrepancias en resultados de varios estudios en cuanto a los resultados de HbA1C y glucosa en ayunas (10,11).
Raza y condición socioeconómica: los grupos negros, hispanos y otros grupos que no son blancos experimentan una carga de diabetes mucho mayor que los adultos blancos, incluida una carga más alta de UPD. La probabilidad de una úlcera en etapa avanzada en el momento del diagnóstico y el riesgo de hospitalización por UPD son mayores entre los adultos afroamericanos e hispanos, las personas de las categorías de ingresos más bajos, las que tienen un seguro menos completo, las que tienen niveles educativos más bajos y las que viven en barrios socioeconómicamente desfavorecidos (10,11).
Tratamiento de la diabetes: en comparación con algunos agentes orales e inyectables para la diabetes, los inhibidores del cotransportador de sodio-glucosa 2 (SGLT2) pueden estar asociados a un mayor riesgo de amputación según un mayor riesgo observado con canagliflozina en un gran ensayo clínico aleatorizado. Los pacientes con antecedentes de amputación o de enfermedad vascular periférica tienen el mayor riesgo absoluto de esta complicación. Por lo tanto, debe evitarse el uso de inhibidores de SGLT2 en pacientes con mayor riesgo de úlceras del pie diabético (11).
Hipertensión y dislipidemia: a pesar de que ambas entidades son fenómenos concomitantes en la diabetes mellitus, en cuanto a la hipertensión existen estudios que apoyan su relación con la aparición de PD mientras que otros no; por otro lado, con respecto a la dislipidemia, no existe una asociación clara entra esta y el desarrollo de PD (10,11).
Obesidad y actividad física: aunque la obesidad y la falta de actividad física son dos de los principales factores de riesgo para el desarrollo de la DM y la mayor parte de la DM2 podría incluso atribuirse a la obesidad, estos factores no parecen jugar un papel crucial en el desarrollo del desarrollo y de las complicaciones del PD (11).
Consumo de cigarrillo: fumar está asociado con un mayor riesgo de neuropatía periférica en adultos con diabetes y es un factor de riesgo extremadamente fuerte para enfermedad arterial periférica. Varios estudios informan de fuertes asociaciones entre el tabaquismo y la UPD, un tiempo de curación más prolongado, tasas más altas de UPD que no cicatrizan y un riesgo subsiguiente de amputación 1,5-2,5 veces mayor (10,11).
Enfermedad arterial periférica y cardíaca: en cuanto a la historia de la enfermedad arterial periférica, existe una asociación consistente con PD. Desde el punto de vista fisiológico, la neuropatía periférica y el daño de los vasos sanguíneos, que debe adelantarse en pacientes con antecedentes de enfermedad cardiovascular, potencian el daño del PD, lo que lleva a una posible necrosis del tejido y a la necesidad de amputación (10,11).
Neuropatía periférica (NP), retinopatía y nefropatía: se ha documentado una asociación similarmente fuerte con PD para NP y retinopatía, así como para nefropatía. Una posible explicación de este resultado podría deberse a un origen fisiológico común: las complicaciones diabéticas tardías se clasifican en enfermedades macrovasculares y microvasculares, estas últimas derivadas del daño de los vasos sanguíneos pequeños y que conducen a retinopatías, nefropatías y neuropatías, un prerrequisito crucial para las condiciones de PD (10,11).
En la tabla III se exponen los factores de riesgo (11).
Manifestaciones clínicas
El pie diabético se manifiesta clínicamente como una complicación de la diabetes mellitus; por tanto, los pacientes presentan sintomatología correspondiente a la diabetes (polidipsia, poliuria, polifagia y pérdida de peso), además de las comorbilidades que los pacientes puedan presentar (10,11).
Las infecciones del pie diabético suelen desarrollarse sobre úlceras ya previamente establecidas, heridas traumáticas, grietas o fisuras en la piel u otros defectos en la piel del pie o del lecho ungueal (paroniquia). Por lo tanto, la infección puede presentarse como una afectación cutánea superficial localizada en el sitio de una lesión preexistente o como una infección de la piel o de estructuras cutáneas más profundas que se ha diseminado más allá del sitio del traumatismo local. Estas infecciones pueden extenderse posteriormente a las articulaciones, a los huesos y a la circulación sistémica (11,12).
Las infecciones del pie diabético a menudo se acompañan de manifestaciones cardinales de inflamación (eritema, calor, hinchazón y sensibilidad) o de la presencia de pus en una úlcera. Sin embargo, estos signos locales de infección pueden no ser evidentes en todos los casos. Es posible que las infecciones no se manifiesten con calor y eritema en el marco de una isquemia grave. Los diabéticos con neuropatía sensorial pueden tener la sensibilidad disminuida en el área afectada y, por lo tanto, es posible que no se quejen de sensibilidad ni, en algunos casos, que se den cuenta de que hay una infección. En tales casos, la infección puede progresar y afectar a tejidos más profundos antes de que el paciente busque atención clínica (11,12).
Otros signos locales que pueden estar presentes en las infecciones del pie diabético son inespecíficos e incluyen drenaje no purulento, tejido de granulación friable o decolorado y socavación de los bordes de la herida (9,10). A su vez, pueden sumar signos sistémicos como fiebre, escalofríos, hipotensión y taquicardia a los signos locales de infección y su presencia indica una mayor gravedad de la infección (11,12).
Diagnóstico
Todos los pacientes con diabetes deben ser examinados para identificar el riesgo de ulceración del pie. Los pies deben inspeccionarse visualmente en cada visita de rutina para identificar problemas con el cuidado de las uñas, con el calzado (que no calce bien y que produzca barotrauma), infecciones fúngicas y formación de callos, que pueden provocar problemas más graves en los pies. Debe realizarse un examen anual completo de los pies en pacientes con diabetes para identificar factores de riesgo predictivos de úlceras y de amputaciones (11,12).
Los pacientes con una úlcera en el pie existente o con factores de riesgo de ulceración en el pie (por ejemplo, ulceración previa en el pie, neuropatía, deformidad en el pie o enfermedad vascular periférica) deben ser derivados a un especialista en cuidado de los pies (12).
Historia clínica
Los antecedentes que deben obtenerse incluyen la duración de la diabetes, el control glucémico, la presencia de enfermedad microvascular o macrovascular, antecedentes de lesiones previas en el pie que resultaron en deformidades o en úlceras previas, derivaciones o amputaciones de miembros inferiores, presencia de claudicación y antecedentes de tabaquismo (11,12).
Evaluación de los pies
El examen completo anual de los pies puede realizarse en el entorno de Atención Primaria y debe incluir la inspección, la evaluación de los pulsos de los pies y la prueba de pérdida de la sensación protectora. La presencia de eritema, calor o fisuras puede indicar áreas de tejido dañado. Los pacientes con evidencia de una úlcera existente requieren una evaluación adicional (11,12).
También deben evaluarse las deformidades óseas, la movilidad articular y la marcha y el equilibrio. La evaluación puede revelar varias anomalías que resultan de la neuropatía diabética, como los dedos en garra y la artropatía de Charcot (también llamada artropatía neuropática diabética). La neuropatía motora crónica a menudo afecta a los pequeños músculos intrínsecos de los pies, de modo que la acción de los músculos más grandes en el compartimento tibial anterior no tiene oposición. Esto conduce a la subluxación de las articulaciones interfalángicas-metatarsianas proximales, lo que da como resultado una apariencia de dedo en garra. Una consecuencia de esta anormalidad es el aumento de la presión sobre las cabezas de los metatarsianos, que son un sitio común de desarrollo de úlceras (11,12).
Una complicación posterior es la artropatía de Charcot, que se caracteriza por el colapso del arco de la parte media del pie y prominencias óseas anormales. Estos cambios a menudo son desencadenados por lesiones, inflamación e hiperperfusión, acompañados por la tríada de atrofia muscular, disminución de la sensibilidad y distribución anormal del peso al estar de pie, lo que lleva a microtraumatismos repetitivos debido a la ausencia de la sensación protectora del dolor (11,12).
Evaluación de UPD como complicación neuroisquémica: evaluación de pulsos pedios
Es necesaria la evaluación de la enfermedad arterial periférica preguntando sobre antecedentes de claudicación y evaluando los pulsos de los pies, la temperatura y la presencia de rubor dependiente, un hallazgo tardío. Si los pulsos pedios están ausentes, deben evaluarse los pulsos femoral y poplíteo. Los hallazgos del examen físico, como la disminución de los pulsos, la disminución de la temperatura de la piel, la piel delgada, la falta de vello en la piel y la cianosis distal, no son lo suficientemente específicos como para guiar el manejo posterior en un paciente individual. Los pacientes con sospecha de arteriopatía periférica deben someterse a una prueba del índice tobillo-brazo (ITB) (Fig. 2) para guiar el tratamiento posterior, aunque esto puede ser insensible en la diabetes debido a la calcificación vascular o a la falta de detección de la enfermedad en la microcirculación (12).
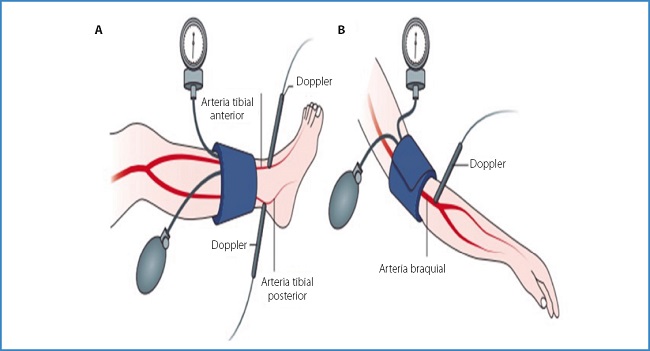
Fuente: Faglia, 2009
Figura 2. Medición y cálculo del índice tobillo-brazo (ITB) en el diagnóstico de enfermedad arterial periférica. ITB es la relación de la presión arterial sistólica más alta entre la arteria tibial posterior y la arteria dorsal del pie (A) y la presión arterial sistólica más alta entre ambos brazos.
Examen arterial anormal/pérdida de tejido: en pacientes con factores de riesgo de EAP y sin antecedentes de síntomas que sugieran un proceso vascular alternativo (por ejemplo, dolor abdominal o de espalda, como en la disección aórtica), la presencia de anomalías evidentes en el examen del pulso, isquemia, dolor en reposo o la pérdida de tejido sugieren fuertemente la presencia de EAP (12,13).
Índice tobillo-brazo anormal: aunque los antecedentes, los síntomas, el examen físico y el ITB al lado de la cama pueden sugerir fuertemente un diagnóstico de EAP, con frecuencia no son lo suficientemente específicos o sensibles para juzgar la gravedad de la enfermedad o localizar con precisión los sitios de obstrucción. Dependiendo de la presentación clínica, pueden ordenarse pruebas formales de ABI o estudios adicionales. Estos pueden incluir otras pruebas fisiológicas en un laboratorio vascular (prueba de ejercicio en cinta rodante, presiones segmentarias o registros del volumen del pulso) o imágenes vasculares (13).
Evaluación de la pérdida de sensación protectora (neuropatía)
Es necesario probar la pérdida de la sensación protectora con un monofilamento Semmes-Weinstein 5.07 (10 g) más cualquiera de los siguientes: vibración con un diapasón de 128 Hz o un biotesiómetro, sensación de pinchazo y reflejos del tobillo. En la tabla IV se observan las características de las distintas pruebas (13).
Si la sensación de vibración está disminuida, evaluamos otras causas de neuropatía (incluida la deficiencia de vitamina B12), ya que la neuropatía diabética es un diagnóstico de exclusión (13,14).
Presión transcutánea de oxígeno
La determinación del oxígeno transcutáneo (TcpO2) es una técnica que permite realizar una estimación de la presión parcial de oxígeno transcutáneo en la superficie de la piel mediante la utilización de un electrodo no invasivo. Esta prueba suele realizarse en el dorso del pie (entre el primer y el segundo metatarsiano), con el paciente respirando aire a presión ambiental o normobárica. La TcpO2 en sujetos sanos debe ser mayor de 50 mmHg (13,14).
Además, la determinación de la presión transcutánea de oxígeno permite la valoración de todos los pacientes antes, durante y después de la realización de la angioplastia transluminal de miembro inferior en relación con la medición del índice tobillo-brazo obtenido mediante Doppler, ya que este último presenta limitaciones en la valoración de la eficacia de la angioplastia transluminal de los pacientes diabéticos con isquemia crónica de miembro inferior y muestra falsos positivos y falsos negativos, en donde los casos más severos de la enfermedad quedan excluidos de su estudio y análisis (14,15).
Evaluación de una úlcera existente
La evaluación de una úlcera de pie diabético existente incluye un examen cuidadoso y una clasificación de la herida. Las úlceras del pie generalmente se clasifican en dos grupos: úlceras agudas secundarias a la abrasión dérmica por zapatos que no calzan bien y úlceras crónicas que ocurren en áreas propensas a la presión. La ulceración crónica probablemente sea multifactorial, debido a una combinación de neuropatía diabética (con disminución de la sensación de dolor y deformidad), disfunción autonómica e insuficiencia vascular (15).
La úlcera se examina en busca de drenaje, olor, presencia (o ausencia) de tejido de granulación y cualquier estructura subyacente expuesta, como tendones, cápsula articular o hueso. Un médico experimentado o un cirujano pueden palpar la herida suavemente con una sonda roma y estéril para revelar la presencia de un trayecto sinusal o comunicación con estructuras más profundas, lo que puede cambiar la clasificación de la herida (15).
Signos de infección
La presencia de una infección del pie diabético es probable si hay eritema, calor, sensibilidad o hinchazón (especialmente con dos o más de estos hallazgos) alrededor del sitio de la úlcera. La infección está aún más indicada por el pus que sale del sitio de una úlcera (14,15).
Pruebas de imagen
Las radiografías simples pueden detectar deformidades estructurales del pie, gas en tejidos blandos y cuerpos extraños, así como osteomielitis. Sin embargo, los cambios radiológicos ocurren tarde en el curso de la osteomielitis y las radiografías negativas no la excluyen. Las técnicas de formación de imágenes más sensibles que se han utilizado incluyen imágenes óseas con radionúclidos, imágenes por resonancia magnética e imágenes con leucocitos marcados con indio (15,16).
Por otro lado, cuando los diagnósticos no invasivos así lo indiquen, deben realizarse estudios de imagen del árbol arterial, especialmente de las arterias crurales y del pie. Esto puede realizarse mediante ultrasonido dúplex, angiografía por resonancia magnética (RMN), angiografía por tomografía computarizada (TC) o angiografía por sustracción digital (ASD). La imagen es de importancia clave en la decisión de cómo tratar las lesiones arteriales. En los diabéticos, las arterias aortoilíacas y la arteria femoral común a menudo no se ven afectadas, e incluso la arteria femoral superficial puede verse afectada y las lesiones oclusivas se concentran en las partes distales del árbol arterial de las extremidades inferiores. La calcificación extensa del árbol arterial infrapoplíteo puede impedir un diagnóstico dúplex y una TC adecuados, aunque el uso de dispositivos multicorte disminuye las dificultades de interpretación causadas por las calcificaciones de la pared arterial. En los diabéticos con úlcera del pie la insuficiencia renal crónica es cada vez más frecuente. La metformina debe suspenderse antes de la angiografía, ya que puede causar acidosis láctica (15,16).
Debe considerarse la realización de una prueba de imagen vascular urgente, y la revascularización, en una paciente con úlcera de pie diabético y una presión de tobillo < 50 mmHg, un ITB < 0,5, una presión digital < 30 mmHg o una TcPO2 < 25 mmHg. Además, debe considerarse siempre una prueba de imagen vascular en pacientes con úlcera de pie diabético, independientemente de los test rutinarios, cuando la lesión no cicatriza en 4-6 semanas a pesar de un tratamiento estándar adecuado (16).
Probe to bone test
La prueba de sonda a hueso (PTB, por sus siglas en inglés) realizada al sondear la úlcera con una sonda de metal estéril es una prueba de cabecera que puede ayudar con el diagnóstico de osteomielitis subyacente. Si la sonda toca el hueso, la prueba es positiva (4). Los resultados positivos de la prueba de sonda a hueso son útiles, especialmente cuando se realizan en pacientes con diabetes mellitus (16).
Biomarcadores
Con respecto al uso de biomarcadores como estrategia diagnóstica temprana para la UPD, como propiedades características representativas de la patogénesis de las heridas diabéticas, pueden ser útiles para una mayor comprensión de la UPD, mejorando el diagnóstico clínico temprano, la prevención de la enfermedad, la predicción de la progresión de la enfermedad e incluso la evaluación del tratamiento de la UPD. Los objetivos bioquímicos y moleculares revelados por los enfoques biotecnológicos modernos pueden utilizarse como nuevos biomarcadores potenciales para la UPD, que indican daño endotelial como consecuencia de la fisiopatología de la enfermedad, que pueden aplicarse en el diagnóstico de la UPD en la etapa temprana después de más investigaciones, lo que lleva a un mejor tratamiento y, por lo tanto, previene el trauma de amputación (16).
Por ejemplo, según Lin y cols., el uso de micro-ARN como biomarcadores, en comparación con pacientes con DM y controles sanos, los niveles séricos de miR-217 en pacientes con UPD estaban elevados, mientras que los niveles de HIF-1α y VEGF se encuentran disminuidos (16).
MANEJO
Los objetivos del tratamiento del pie diabético son lograr la cicatrización de los tejidos mientras se mantiene una función y una carga de peso adecuadas para la deambulación. El tratamiento antibiótico de la infección invasiva, junto con el desbridamiento o la amputación del tejido y la descarga de la presión del pie hasta que se logre la curación, son los principios esenciales del manejo. Algunos desarrollan una rápida propagación de la infección a lo largo de los planos tisulares y de las vainas tendinosas y se presentan con necrosis tisular local, celulitis diseminada y respuesta inflamatoria sistémica. Estos pueden ser potencialmente una amenaza para las extremidades sin una intervención oportuna, ya que la demora conducirá a una mayor pérdida de tejido. El concepto de “el tiempo es tejido” es aplicable a dicha infección, que se denomina “ataque del pie diabético” (16,17).
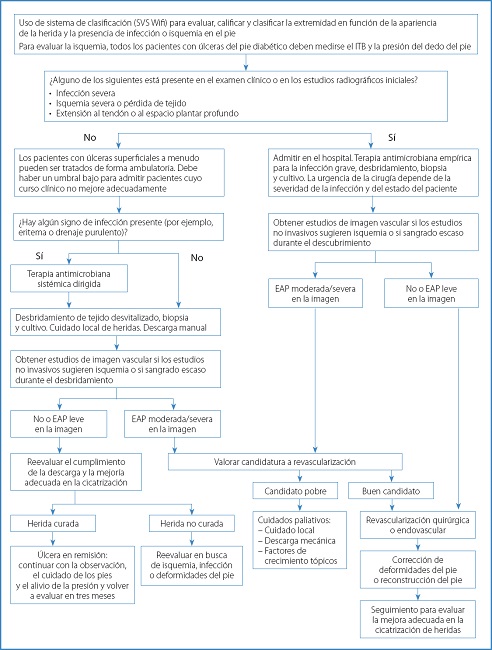
En pacientes que presentan isquemia avanzada, el control de la infección tiene prioridad sobre la revascularización de la extremidad. El riesgo de amputación de una extremidad puede estimarse utilizando la clasificación WIfI de la Sociedad de Cirugía Vascular de pérdida de tejido, gravedad de la isquemia y presencia de infección invasiva del pie. Los pacientes que presentan una lesión tisular avanzada, ausencia de pulsos pedales e infección invasiva requieren atención hospitalaria. Una consulta de cirugía vascular es imperativa, y cuando la sepsis del pie está presente puede ser necesario un desbridamiento emergente del pie (16,17).
Una vez que se trata la afección del pie, es indispensable contar con un equipo multidisciplinar que incluya al médico de Atención Primaria, al diabetólogo, al enfermero educador, al protésico y al enfermero de atención domiciliaria para ayudar al cirujano a tratar a los pacientes que presentan infecciones invasivas del pie, úlceras neuropáticas o isquemia tisular con y sin gangrena (17).
En la tabla V se evidencian las medidas terapéuticas de acuerdo al objetivo que se persigue en las personas que padecen de pie diabético.
Tabla V. Manejo multifactorial de pie diabético.
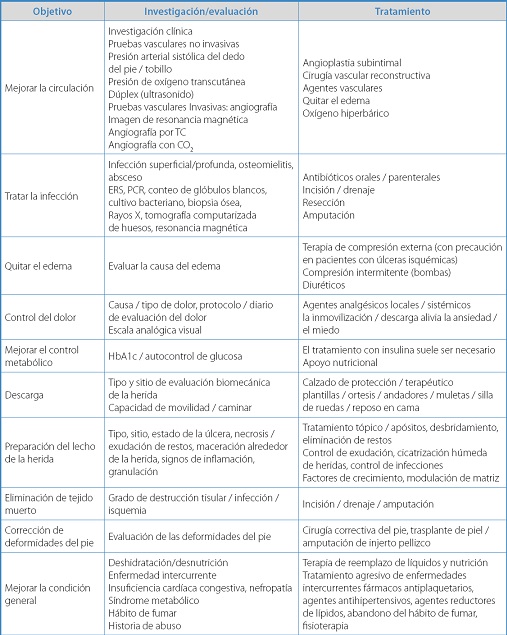
ERS: eritrosedimentación; PCR: proteína C reactiva; TC: tomografía computarizada.
Se ha demostrado que las terapias complementarias específicas ayudan en la cicatrización de úlceras/heridas, como ungüentos antimicrobianos tópicos (sulfadiazina de plata o murpicina), factores de crecimiento de heridas, apósitos biológicos, terapia de heridas con presión negativa y tratamientos con oxígeno hiperbárico.
Se han optimizado las tasas de curación de heridas en clínicas que brindan tratamientos especializados en conjunto con técnicas de descarga de presión (16,17).
Es necesario adoptar un enfoque según el estadio y la profundidad de la úlcera: el tratamiento se basa en la clasificación de la úlcera (17,18).
No infectadas: las úlceras superficiales del pie diabético (clasificación de la Universidad de Texas: grado 1; etapa A) generalmente pueden desbridarse en la clínica o al lado de la cama. Cuando no se dispone de un médico con experiencia en desbridamiento cortante, pueden utilizarse hidrogeles autolíticos. Para las úlceras no infectadas que se extienden a tejidos más profundos (grado/estadio: 2A, 3A), sugerimos el desbridamiento quirúrgico inicial en un quirófano. Para las úlceras por presión, debe implementarse la descarga mecánica (18,19).
Infectadas: el tratamiento de las úlceras del pie diabético infectadas (Texas: grados 1 a 3; etapa B) incluye terapia antimicrobiana y desbridamiento quirúrgico. Los antibióticos elegidos y la duración del tratamiento dependen de la profundidad y de la gravedad de la infección. La consulta con un cirujano es importante para cualquier infección que se extienda más allá de la dermis (18,19).
Isquémica: aproximadamente la mitad de los pacientes con diabetes que presentan úlceras del pie diabético tienen algún elemento de isquemia (Texas: grados 1 a 3; etapa C). Además de los cuidados locales adecuados (desbridamiento, cobertura de heridas y alivio de la presión), los pacientes con isquemia importante de las extremidades deben ser derivados a un especialista vascular para una posible revascularización. Debe considerarse la revascularización (abierta y endovascular) en pacientes con cualquier grado de isquemia de las extremidades y úlcera del pie que no mejora con el transcurso del tiempo apropiado (19,20).
Infección e isquemia combinadas: las úlceras infectadas e isquémicas (Texas: grados 1 a 3; estadio D) representan el mayor riesgo de falta de cicatrización y amputación. Estos pacientes generalmente requieren un manejo en equipo por parte de médicos y cirujanos con experiencia en el control médico y quirúrgico de la infección y la revascularización (19,20).
En la figura 3 se observa un algoritmo terapéutico ante una UPD.
Isquemia y revascularización
La revascularización juega un papel importante en el tratamiento de las úlceras del pie diabético en pacientes con enfermedad arterial periférica documentada. Cuando es factible, la revascularización se asocia con una menor incidencia de amputación en pacientes con úlcera de pie diabético e isquemia grave de las extremidades. En un estudio longitudinal realizado por Dinoto y cols., de 267 pacientes con una edad media de 72,5 años que se incluyeron en el estudio, la tasa de amputación mayor fue del 6,2 % y la tasa de amputación menor fue del 17 %. Así, la revascularización extrema para obtener flujo directo redujo la tasa de amputaciones, con una aumento en la cicatrización de úlceras (20).
Sin la revascularización, la arteriopatía periférica que desencadena una úlcera de pie diabético de una de las extremidades a menudo genera su pérdida. Sin embargo, ni la revascularización quirúrgica abierta ni el tratamiento endovascular (TEV) garantizan el éxito del tratamiento, la ausencia de reestenosis ni el fracaso de la revascularización. Hoy en día, la gestión del riesgo de fracaso de la revascularización es uno de los grandes retos en el campo vascular (21).
Los objetivos del TEV en pacientes afectados por EAP son el alivio del dolor, la cicatrización de las heridas y la preservación funcional de las extremidades. Sin embargo, la revascularización puede causar morbilidad, que se correlaciona con muchos ingresos hospitalarios, atención ambulatoria continua y costos significativos de tratamiento y atención médica, así como mortalidad. Por lo tanto, es necesario identificar a los pacientes para quienes el TEV puede ser beneficioso para evitar un posible fracaso (22).
La revascularización mediante cirugía abierta de la enfermedad oclusiva de las arterias distales se realiza principalmente mediante bypass con material autólogo (preferentemente vena safena). Por su parte, las técnicas de cirugía endovascular incluyen principalmente la angioplastia transluminal percutánea (ATP), que puede asociarse a stenting, láser y técnicas de reducción del volumen de la placa. El incremento exponencial del uso de estas técnicas endovasculares, en comparación con la revascularización quirúrgica abierta, se debe principalmente al mayor beneficio respecto al riesgo secundario a los bajos porcentajes de morbilidad y de mortalidad asociados a las técnicas percutáneas. Pueden usarse técnicas mixtas (cirugía abierta + endovascular) (22,23).
Cuidado multidisciplinario
La atención especializada del pie diabético está convirtiéndose en el nuevo estándar de atención en áreas donde los recursos están disponibles. La mayoría de las guías de expertos ahora recomiendan la derivación a un centro de atención multidisciplinar para el manejo de las UPD (23).
Las pautas del equipo de pie diabético de respuesta rápida aguda (DRRAFT, por sus siglas en inglés) sugieren que el cirujano vascular y el podólogo diabético constituyen el “mínimo irreductible” en la formación de un equipo de pie diabético, con la inclusión frecuente de especialistas adicionales según estén disponibles y sean necesarios de acuerdo a la estrategia toe and flow (23).
Numerosos estudios y revisiones sistemáticas han mostrado efectos positivos en la atención multidisciplinaria en la reducción de los tiempos de cicatrización de heridas, las tasas de amputación y la gravedad de la amputación (24).
La definición de atención multidisciplinaria del pie diabético varía ampliamente en la literatura, pero a menudo incluye un cirujano (general, vascular, ortopédico, etc.), un podólogo, un especialista en diabetes, un fisioterapeuta y una enfermera de atención de heridas (24).
Medidas de prevención
La educación del paciente en lo relativo a técnicas del cuidado meticuloso de los pies y del calzado apropiado es fundamental. Es imperativo un enfoque multidisciplinario que incluya evaluaciones periódicas (en caso de pacientes de alto riesgo, con mayor frecuencia) de médicos de Atención Primaria, de un podólogo o de un especialista vascular para evaluar la perfusión arterial. Debe instruirse al diabético con neuropatía periférica para que realice un autoexamen rutinario de la piel y del pie y debe educársele en la higiene de la piel y del uso del calzado. El autoexamen y la educación son las piedras angulares de un programa de prevención y de vigilancia (24,25).
La educación del diabético, de sus familias o de sus cuidadores debe incluir: instrucciones para la higiene de los pies, el uso adecuado del calzado y la importancia de una evaluación rápida de cualquier lesión nueva en la piel o dolor en el pie. Los diabéticos con neuropatía periférica, deformidad del pie, ausencia de pulsos en los pies o presión en los dedos del pie < 40 mmHg y ulceración previa tienen un alto riesgo de desarrollar una afección del pie diabético y se beneficiarían de un programa multidisciplinario de cuidado del pie diabético (26,27).
CONCLUSIONES
Las úlceras en los pies son una causa importante de morbilidad en pacientes con diabetes. Tanto las enfermedades vasculares como las neurológicas aumentan el riesgo de úlceras en los pies. Debe realizarse un examen completo de los pies anualmente en pacientes con diabetes para identificar factores de riesgo predictivos de úlceras y amputaciones.
El tratamiento de las úlceras del pie diabético comienza con una evaluación integral de la úlcera y la condición médica general del paciente. Debe buscarse activamente evidencia de neuropatía subyacente, deformidad ósea y arteriopatía periférica.
El desbridamiento adecuado, el cuidado local adecuado de la herida, la redistribución de la presión sobre la úlcera mediante descarga mecánica y el control de la infección y de la isquemia (cuando están presentes) son componentes importantes del tratamiento de todas las úlceras, independientemente del estadio y de la profundidad.
Debe brindarse asesoramiento sobre el cuidado preventivo de los pies a cualquier paciente cuyos pies estén en riesgo de ulceración. Las medidas preventivas incluyen evitar el tabaco, caminar descalzo y usar zapatos ajustados que no calcen bien.