My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos de Zootecnia
On-line version ISSN 1885-4494Print version ISSN 0004-0592
Arch. zootec. vol.60 n.230 Córdoba Jun. 2011
https://dx.doi.org/10.4321/S0004-05922011000200008
Caracterização morfo-anatômica do colmo de genótipos de milho
Morpho-anatomical characterization of stem of corn genotypes
Ferreira, G.D.G.1, Barrière, Y.2, Emile, J.C.2 e Jobim, C.C.3
1Universidade Federal Rural de Pernambuco. Unidade Acadêmica de Garanhuns. Avenida Dom Pastor. Boa Vista. Garanhuns. Pernambuco. Brasil. geane@uag.ufrpe.br
2Unité de Génetique et d'Amélioration dês Plantes Fourragères. Lusignan. France. barriere@lusignan.inra.fr; emile@lusignan.inra.fr
3Departamento de Zootecnia. Universidade Estadual de Maringá. Maringá. Paraná. Brasil. ccj@uem.br
RESUMO
Objetivou-se avaliar as características morfo-anatômicas de cinco genótipos de milho normais (F2, Lu16, F271, Lu5 e Lu6) e cinco bm3 (F2bm3, Lu16bm3, F271bm3, Lu5bm3 e Lu6bm3) com inferência à qualidade para silagem cultivados em Druelle-França, em parcelas de 150 m² durante o período de maio a setembro de 2002 (150 dias). Todas as avaliações foram realizadas no entrenó abaixo da espiga principal. O delineamento experimental utilizado foi o inteiramente casualizado com cinco repetições por tratamento. Os genótipos apresentaram diferenças significativas quanto aos aspectos anatômicos, sendo que todos os genótipos bm3 apresentaram menores quantidades de células lignificadas tanto na região medular (1,24) quanto na região do córtex (1,72). Observou-se correlação positiva (r= 0,70) entre a quantidade de células lignificadas da região medular e a porcentagem de região medular. Também houve correlação positiva (r= 0,67) e negativa (r= -0,67), entre a espessura da parede celular com a % de xilema e com a % de floema, respectivamente. Os resultados encontrados estão coerentes aos tipos de linhagens estudadas, pois as linhagens bm3 são caracterizadas por apresentarem menores proporções de lignina quando comparados com genótipos normais.
Palavras chave: Celulose. Feixes vasculares-Lignina. Monocotiledôneas.
SUMMARY
The objective was to evaluate the morphoanatomical characteristics of ten genotypes of corn to silage, five normal (F2, Lu16, F271, LU5 and LU6) and five bm3 (F2bm3, Lu16bm3, F271bm3, Lu5bm3 and Lu6bm3), grown in Druelle-France, in plots of 150 m² during the period from May 2002 to september 2002, totaling a period of 150 days. All evaluations were performed in internode below the primary ear. The experimental design was completely randomized, with five replications per treatment. The genotypes showed significant differences on the anatomical aspects evaluated, and that all bm3 genotypes showed lower amounts of both lignified cells in the medullar region (1.24) as in the cortex (1.72). The statistic analysis pointed positive correlation (r= 0.70) between the amount of lignified cells in the medullar region and the percentage of medullar region. There was also positive correlation (r= 0.67) between the thickness of the cell wall with the xylem % and negative correlation (r= -0.67) between the thickness of cell wall with the phloem %. The results are consistent to the types of strains studied, because the bm3 lines are characterized by smaller proportions of lignin compared to normal genotypes.
Key words: Cellulose. Vascular bunches. Lignin. Monocotyledons.
Introducão
O milho é uma das forrageiras mais importantes e versáteis destinadas à confecção de silagem (Castillo et al., 2009).
Diante disto, a pesquisa atual busca em suas variedades, boa produção de matéria seca, precocidade, resistência contra agentes externos e conseqüentemente, bons valor nutritivo (Barrière et al., 1992). Entretanto, existem fatores que limitam a qualidade da forragem e, estes são complexos e interativos (Akin, 1989). Por exemplo, o envelhecimento dos tecidos dos vegetais e a conseqüente redução na digestibilidade são fenômenos intimamente associados. Com o avanço da maturidade fisiológica, as forrageiras acumulam maior quantidade de matéria seca, ganhando altura pelo alongamento do colmo e folhas. Nos tecidos das plantas, observa-se a redução do lume das células, pelo espessamento da parede celular, com a conseqüente ampliação da área ocupada pelo tecido vascular lignificado (Wilson, 1993; Álvares de Brito et al., 1999; Álvares de Brito e Rodella, 2002; Paciullo et al., 2002; Ferreira et al., 2007).
As células dos vegetais são compostas por dois tipos de parede celular, a parede primária (PP) e a parede secundária (Ps). A PP é estreita e consiste de uma variedade complexa de carboidratos (celulose, hemicelulose e pectina) e proteínas (glicoproteínas ricas em hidroxiprolina e proteínas ricas em glicina e prolina) que interagem uns com os outros (Baucher et al., 1998). Os precursores de carboidratos são sintetizados e transportados intracelularmente via sistema endomembrana e unidos extracelularmente. Na expansão celular, esse mecanismo favorece a mudanças na parede celular. Esta transição é devido ao acúmulo de polissacarídeos distintos daqueles da parece celular primária (não pectina, mas um incremento na soma de celulose altamente cristalina e hemicelulose) e deposição de lignina. Neste período de transição, a célula perde a maior parte de sua elasticidade, seu teor em água diminui progressivamente e inicia-se a formação da Ps. As Ps lignificadas são caracterizadas pela alta força tênsil e também por serem hidrofóbicas (Iiyama et al., 1994). Desta forma, paredes de células mais lignificadas tendem a ser mais espessas quando comparadas com outras menos lignificadas.
Dos componentes da parede celular a lignina apresenta o principal efeito negativo sobre a degradação ruminal (Terry e Tilley, 1964; Jung e Vogel, 1986). A lignina é depositada principalmente na parede celular dos tecidos envolvidos no mecanismo de suporte ou na condução de água (principalmente xilema, mas também esclerênquima, fibras do floema e periderme). Além disto, a lignina apresenta papel de proteção, atuando como barreira fisicoquínica contra patógenos e/ou em resposta ao estresse, tal como ferimentos (Yamamoto et al., 1990). segundo Deschamps (1999), a lignificação influencia a digestão do colmo mais drasticamente do que a digestão das folhas.
Um dos principais objetivos da caracterização morfo-anatômica dos colmos de variedades genéticas de milho é melhor compreender como essas características podem afetar o consumo e a digestibilidade da parede celular e, suas possíveis correlações com os tecidos existentes na planta. Segundo Wilkins (1972), algumas paredes celulares em gramíneas são lignificadas e o conteúdo de tecido lignificado é variável. O efeito negativo da lignina sobre a digestibilidade de outros componentes da parede celular é afetado por vários fatores como, por exemplo, a sua possível distribuição em relação aos outros componentes da parede celular. Porém, o estudo da distribuição dos tecidos lignificados em plantas forrageiras ainda é pouco explorado. Atualmente, os principais resultados encontrados na literatura são relacionados à composição da parede celular, sem levar em consideração a distribuição dos tecidos na planta. Mechin (2000) estudando a histologia de diferentes colmos de genótipos de milho registrou correlação positiva e negativa (r= 0,55 e r= -0,73) entre os teores de digestibilidade da parede celular e as superfícies de celulose e lignina, respectivamente, além de correlações negativas, porém não significativa (r= -0,23 e r= -0,25), entre a espessura do córtex e superfície dos feixes vasculares nos cortes histológicos avaliados. Ferreira et al. (2007) verificaram correlação positiva entre os teores de lignina com as quantidades de células lignificadas no parênquima e córtex e correlação negativa entre a digestibilidade da parede celular e a proporção de células lignificadas no parênquima medular e células lignificadas no córtex do colmo de híbridos de milho.
As variedades genéticas de milho destinadas para produção de silagem apresentam algumas particularidades. Por exemplo, os mutantes de milho brown-midrib (bm) têm sido estudados por meio de seleção de mutantes. Estes são caracterizados por apresentar uma coloração marrom nas nervuras das folhas, esclerênquima e também no tecido lignificado dos colmos quando comparado com linhagens normais de milho (Baucher et al., 1998). Os milhos bm apresentam baixos teores de lignina e ácido p -cumárico, fazendo com que apresentem maiores valores de digestibilidade da parede celular quando comparado com outras variedades de milho (Akin, 1988). Embora os milhos bm apresentem melhor qualidade em termos de digestibilidade da parede celular, a sua produção é limitada tornando-os pouco comercializados. Além disso, os milhos bm apresentam ainda maior sensibilidade contra agentes externos quando comparado com linhagens normais (Anglade et al., 1992). Essa menor resistência contra patógenos externos pode ser explicada pela menor proporção de lignina nos colmos. Ferreira et al. (2007) avaliando as características morfoanatômica de híbridos de milho, registraram menores proporções de lignina tanto na região do córtex quanto na região medular (1,7 e 1,2) para o híbrido DK265 bm3 em relação ao híbrido DK265 normal (3,8 e 2,3).
O objetivo deste trabalho foi caracterizar morfológica e anatomicamente os colmos de linhagens de milho (Zea mays L.).
Material e Métodos
Dez genótipos de milho, sendo cinco brown-midrib (F2bm3, Lu16bm3, F271bm3, Lu5bm3, Lu6bm3) e cinco normais (F2, Lu16, F271, Lu5 e Lu6) foram plantados em parcelas com tamanho médio de 150 m2/genótipo, com espaçamento entre linhas de 0,75 m e densidade de plantio de 7 plantas/metro linear (95 000 plantas/ha). O experimento foi estabelecido em Druelle-França, com semeadura em maio de 2002 e colhidos em setembro de 2002, durante um período de 150 dias.
O solo é classificado como argiloso (±60% de argila), com pH= 5,8; teor de matéria orgânica de 2,4% e saturação de base 71% e o clima típico de Lusignan é classificado Cf.b, segundo Köppen. Com inverno chuvoso e verão seco e quente.
Para o estudo da caracterização morfo-anatômica dos genótipos foi feita à coleta de cinco plantas ao acaso por parcela dos respectivos 10 genótipos. Em seguida, foi realizada a amostragem de 5 cm do colmo no entrenó imediatamente abaixo da inserção da espiga principal de cada planta. As amostras foram identificadas e armazenadas em frascos de polietileno contendo uma solução de fixação (paraformaldeído 2% mais glutaraldeído 25%) e por fim, enviados para o INRA (Unité de Génétique et d'Amélio-ration des Plantes Fourragères, Lusignan-France) onde ficaram armazenadas em câmara fria até as análises laboratoriais.
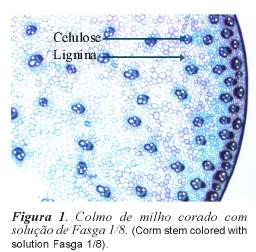
Para cada amostra de colmo, foi feita a medida da superfície total para a determinação do raio. Em seguida, foram feitos três cortes de 70μm de diâmetro, com a ajuda de um Vibratome 1000 (lâmina e amostras inertes em água). Após foi adicionado hipoclorito de sódio a 6%, em todas as secções obtidas no Vibratome durante 20 minutos. O hipoclorito de sódio foi utilizado para eliminar todo o conteúdo celular, evitando desta forma, precipitações entre o conteúdo celular e o corante. O hipoclorito de sódio permite também, uma melhor visualização da parede celular (Tolivia e Tolivia, 1987). Os cortes (frações) foram em seguida, lavados por três vezes com água desmineralizada durante 15 minutos. Uma vez, finalizadas todas as etapas de lavagem, os cortes foram então incubados durante uma noite em solução de Fasga diluída a 1/8 (Tolivia e Tolivia, 1987). Após, os cortes receberam a última lavagem com água desmineralizada e foram colocados individualmente entre lâmina e lamínula com a ajuda de uma gota de água por amostra. Todas as lâminas e lamínulas foram seladas com verniz transparente. A coloração dos cortes com solução de Fasga, permitiu que a fração lignina fosse corada em vermelho e a celulose em azul (figura 1).
Foi realizada a captura das imagens com a ajuda de uma câmara montada sobre uma lupa binocular e/ou sobre um microscópio. Com uso da lupa (objetiva x 0,8) foram determinados a proporção de células lignificadas do parênquima medular, superfície de uma pequena área do córtex, número de vasos do córtex, superfície dos vasos do córtex, superfície de uma pequena área do parênquima medular, número de vasos do parênquima medular e superfície dos vasos do parênquima medular. Com uso de microscópio com objetiva x dois, determinouse o raio do córtex e, com uso de microscópio com a objetiva x quatro, determinou-se a proporção de células lignificadas da região do córtex, tamanho de um dos vasos de cada amostra, além da porcentagem do floema e do xilema mais fibras de esclerênquima.
As quantidades de células vermelhas (lignificadas) e células azuis (celulose) do córtex e da região medular, foram determinadas visualmente, por meio de pontuações variando de 1 a 5, sendo 1 para regiões totalmente cobertas por células azuis e 5 para regiões totalmente cobertas por células vermelhas (Ferreira et al., 2007). Os números e as superfícies dos feixes vasculares do córtex e parênquima medular, após captura das imagens, foram estimados em áreas padronizadas de 2,5 mm e 25 mm, respectivamente.
O delineamento experimental foi o inteiramente casualizado com 5 repetições por tratamento, segundo o modelo:
onde:
Y[jk] = efeito de todas as observações;
μ= constante geral;
Ti= efeito do tipo de genótipo i; i=1 e 2;
Gj= efeito do genótipo j; j= 1, 2, 3, 4 e 5;
Rk = efeito da repetição k; k = 1, 2, 3, 4 e 5;
e[jk] = erro aleatório associado a cada observação Y[jk]
As variáveis analisadas foram: raio, Proporção de células vermelhas do parên-quima medular, Proporção de células vermelhas do córtex, Parênquima medular (%), Córtex (%), Largura do córtex (mm), superfície do feixe vascular (mm2), Xilema + fibras de esclerênquima (%), Floema (%), Espessura da PC do feixe vascular (mm), Número de feixes vasculares do córtex, superfície dos feixes vasculares do cortex (mm), Número de feixes vasculares do parênquima medular, superficie dos feixes vasculares do parênquima medular (mm).
As médias foram comparadas pelo teste de Tukey e foi feito um estudo de correlação entre as variáveis estudadas.
Resultados e Discussão
Pela análise de variância verificou-se diferenças significativas (p<0,05) para todas as características avaliadas entre os genótipos e também algumas diferenças marcantes entre plantas bm3 e normais (tabela I). Observa-se pelos valores médios que os genótipos bm3 apresentaram menor comprimento de raio do colmo (8,92 mm), quando comparados com os genótipos normais (10,21 mm). As variedades bm3 tendem a apresentar menor diâmetro de colmo quando comparados com genótipos ou híbridos normais tanto de milho como de sorgo (Anglade et al., 1992; Baucher et al., 1998). Entretanto, observa-se que não houve variabilidade (p>0,05) entre os genótipos bm3. Os genótipos normais apresentaram variabilidade (p<0,05) quanto ao comprimento do raio, variando de 11,91 mm para o genótipo Lu5 e de 8,32 mm para o genótipo F271. Porém, o genótipo F271 não diferiu (p>0,05) do genótipo Lu16 (9,35 mm). Verifica-se (tabela I), que existem poucas diferenças entre o genótipo Lu16 normal quando comparado com o genótipo Lu16 bm3. Ferreira et al. (2005) trabalhando com os mesmo genótipos e mesma idade de colheita, registraram que o Lu16 foi caracterizado por apresentar altos valores de DIVMs (digestibilidade in vitro da matéria seca) e da parede celular quando comparado com os demais genótipos normais. Segundo Cruz e Pereira Filho (2001) plantas com haste de melhor qualidade, geralmente resultam em plantas menos produtivas e com elevado índice de acamamento, resultante do processo de epistasia genética.
O comprimento do raio apresentou correlações positivas (r= 0,71) com a proporção de células lignificadas no córtex e correlações negativas com o número de feixes vasculares do córtex (r= -0,72) e número de feixes vasculares do parênquima medular (r= -82), conforme tabela II. Este resultado pode ser justificado pelo fato de que genótipos normais apresentaram maior comprimento do raio, associado com maior número de células lignificadas no córtex. Da mesma forma, pode-se justificar as correlações negativas.
Os genótipos normais apresentaram maior proporção de tecido lignificado (p<0,05) que os genótipos de milho bm3, tanto na região medular como na região do córtex (tabela I). Quando se observa os genótipos bm3 individualmente, constatase que o F2 bm3 foi que apresentou maior proporção de células lignificadas na região do parênquima medular (1,8), não diferindo (p>0,05) dos genótipos F271 bm3 (1,2) e do Lu5 bm3 (1,4). Entre os genótipos normais, o F2 e o F271, foram os que apresentaram maiores proporções de células lignificadas (5,0), seguidos pelo Lu6 (4,0). Na região do córtex, o genótipo Lu6 se destacou dos demais (5) quanto à proporção de células lignificadas, entretanto, não diferindo do Lu5 (3,1). Estes resultados encontrados entre as linhagens normais, conferem com os resultados obtidos por Ferreira et al. (2005), trabalhando com os mesmos genótipos avaliados. Pois, segundo os autores o genótipo F271 foi o que apresentou menor teor de digestibilidade in vitro da parede celular (27,78%), não diferindo dos genótipos F2 (31,26%), Lu5 (30,56%) e do Lu6 (30,06%), respectivamente. Porém, houve poucas variações entre esses genótipos quanto aos teores de lignina. A lignina apresenta o principal efeito negativo sobre a digestibilidade (Jung, 1989). Porém, outros efeitos podem estar envolvidos, como arranjo, espaçamento e composição da parede celular (Jung, 1989; Argillier et al., 1996; Álvares de Brito et al., 1999; Mechin, 2000; Mechin et al., 2005; Deschamps e Ramos, 2002).
As linhagens normais apresentaram o menor número de feixes vasculares no córtex e também, menor número de feixes vasculares na região medular (tabela I). No entanto, não houve diferença (p>0,05) entre os dois tipos quanto à superfície dos feixes vasculares nas duas regiões avaliadas. Esses resultados levam a inferir que, o número dos feixes vasculares, quando avaliado individualmente, não é um bom preditor para justificar valores referentes à qualidade de colmo e, sim, quando avaliados em conjunto com a superfície dos feixes vasculares.
A superfície dos feixes vasculares (SFV), % de xilema e % de floema, também apresentou diferenças significativas (p<0,05) entre os dois tipos de genótipos estudados (tabela I). Os genótipos normais apresentaram em média maior superfície dos feixes vasculares (0,06 mm²), maiores porcentagem de xilema e de fibras de esclerênquima (89,95%), entretanto, menor porcentagem de floema (10,04%). Porém, houve diferenças (p>0,05) para SFV entre as linhagens bm3, enquanto que, entre os genótipos normais houve diferenças (p<0,05), com variações de 0,043 a 0,075 mm² para os genótipos F271 e Lu6, respectivamente.
Observa-se pela tabela I, que entre as linhagens normais, a Lu16 apresentou 0,071 mm² de superfície total dos feixes vasculares e maior proporção (93,12%) de xilema + fibras de esclerênquima em relação aos demais genótipos normais. Entretanto, por meio dos resultados de análises químicas realizadas por Ferreira et al. (2005), verificou-se que a linhagem Lu16 apresentou melhores valores de digestibilidade da matéria seca (69,82%), digestibilidade da parede celular (48,05%) e menor teor de lignina (3,47%), diferindo apenas da linhagem Lu5 (6,15 mg/ g de FDN) quanto aos teores de ácido ferúlico total. Talvez, o menor número de feixes vasculares na região do cortex, menor superfície dos feixes vasculares na região do córtex, menor proporção de células lignificadas na região do córtex e região medular (tabela I) e também os tipos de ligações (éter ou éster) entre as ligninas e as hemiceluloses, que não foram avaliadas no presente trabalho, em conjunto, sejam as melhores variáveis para justificar os resultados referentes a digestibilidade do colmo de milho.
Segundo Morrison et al. (1998), Deschamps (1999) e Barrière e Emile (2000) outros fatores além do teor em lignina influenciam na digestibilidade, ou seja, o arranjo da lignina e seus precursores com os demais componentes da parede celular, podem ser os responsáveis por boa parte das limitações observadas na digestão das forragens. Desta forma, a concentração dos seus precursores e principalmente a associação destes com os carboidratos constituintes da parede celular, demonstram um papel mais importante. Os ácidos fenólicos, principalmente p -cumárico e ferúlico, estão diretamente envolvidos na associação da lignina com as hemiceluloses da parede celular. As principais formas de interação molecular estão bem estabelecidas e envolvem ligações éster e éter com os carboidratos e unidades condensadas da lignina (Jung e Deetz, 1993). Alguns cortes histológicos têm demonstrado que tecidos contendo lignina são pouco ou praticamente não degradados pelos microrganismos do rúmen (Akin, 1988). Entretanto, adicionalmente, alguns tecidos não lignificados apresentam baixa digestão ruminal. Este fato pode ser justificado pela ligação destes tecidos com moléculas de baixo peso molecular.
Verifica-se pela tabela II, que não houve correlações significativas entre a superfície total dos feixes vasculares, com as demais características avaliadas. Entretanto, a % de xilema foi negativamente correlacionado (p<0,01) com a % de floema (r= -0,99).
Quando se observa o número dos feixes vasculares da região do córtex (NFVC) e do parênquima medular (NFVP) (tabela I), verifica-se que as linhagens bm3 apresentaram resultados superiores (p<0,05) às linhagens normais. Porém, não houve diferenças significativas (p>0,05) dentro de tipos para a sFV, tanto da região do parênquima medular (sFVP), como região do córtex (sFVC). Porém entre os genótipos bm3, o NFVC e NFVP, variaram de 20,5 a 35,24 em 2,5 mm² e 28,30 a 45,56 em 25 mm², respectivamente. Entre os genótipos normais, verifica-se que a Lu16 foi a que apresentou menor número (18,87 em 2,5 mm²) e superfície (1,81 mm² em 2,5 mm²) de feixes vasculares no córtex.
A espessura da parede celular dos feixes vasculares (EPCFV), variou de 0,0040 a 0,0045 mm entre as linhagens bm3, e de 0,0042 a 0,0046 mm entre as linhagens normais, respectivamente. As linhagens bm3 apresentaram menor diâmetro médio da parede celular (0,0042 mm) quando comparadas com as linhagens normais (0,0044 mm). segundo Iiyama et al. (1994) paredes celulares mais lignificadas tendem a serem mais espessas quando comparadas com outras menos lignificadas. Verifica-se pela tabela II, que a EPCFV apresentou correlação positiva (r= 0,67) com a % do xilema e negativa (r= -0,67) com a porcentagem do floema. Este resultado é bastante coerente, visto que o xilema é composto por elementos lignificados, podendo conter fibras, vasos e células parenquimáticas (Grenet, 1997). O aumento da idade de corte de uma planta forrageira resulta em incrementos na produção de Ms, porém, paralelamente, ocorre declínio no valor nutritivo, principalmente devido ao aumento nos teores fibra em detergente neutro e decréscimo nos teores de proteína bruta e digestibilidade da matéria seca (Gonçalves et al., 2002). segundo Ferreira et al. (2007) a proporção de tecidos e, também, a proporção dos elementos que compõem o colmo apresentam-se como fator chave para maiores ou menores digestibilidade.
Conclusoes
Os genótipos bm3 apresentam maior número de feixes vasculares tanto na região medular como na região do córtex, porém, com superfícies de feixes vasculares semelhantes aos genótipos normais.
A avaliação do número de feixes vasculares tanto na região do córtex quanto na região medular deve ser feita juntamente com avaliações da superfície dos feixes vasculares.
O uso de mutantes bm3 nas avaliações histológicas de variedades genéticas de milho é importante, pois as mesmas apresentam características que possibilitam explicar melhor as variações existentes entre os genótipos normais.
Bibliografia
Akin, D.E. 1988. Biological structure of lignocellulose and its degradation in the rumem. Anim. Feed sci. Technol., 21: 295-310. [ Links ]
Akin, D.E. 1989. Histological and physical factors affecting digestibility of forages. Agronomie, 81: 17-25. [ Links ]
Álvares de Brito, C.J.F., Rodella, R.A., Deschamps, F.C. e Alquini, Y. 1999. Anatomia quantitativa e degradação in vitro de tecidos em cultivares de capim-elefante (Pennisetum purpureum schumach.). Rev. Bras. Zootecn., 28: 223-229. [ Links ]
Álvares de Brito, C.J.F. e Rodella, R.A. 2002. Caracterização morfo-anatômica da folha e do caule de Brachiaria brizantha (Hochst. Ex A. Rich.) stapf e B. Humidicola (Rendle) schweick. (Poaceae). Rev. Bras. Bot., 25: 221-228. [ Links ]
Anglade, P., Barriere, Y., Beckert, M., Boyat, A., Derieux, M., Gallais, A., Giauffret, C., Hébert, Y. et Pollacsek, M. 1992. Le maïs. Dans: Amélioration des espèces végétales cultivées. Gallais, A., Bannerot, H. INRA. Paris. pp. 89-123. [ Links ]
Argillier, O., Barriere, Y., Lila, M., Jeanneteau, A., Gelinet, K. and Menanteau, V. 1996. Genotypic variation in phenolic components of cell-walls in relation to the digestibility of maize stalks. Agronomie, 16: 123-130. [ Links ]
Baucher, M., Monties, B., Montagu, M.V. and Boerjan, W. 1998. Biosynthesis and genetic engineering of lignin. Crit. Rev. Plant. Sci., 17: 125-197. [ Links ]
Barrière, Y., Traineau, R., Emile, J.C. and Hebert, Y. 1992. Variation and covariation of silage maize digestibility estimated from digestion trials with sheep. Euphytica, 59: 61-72. [ Links ]
Barrière, Y. et Emile, J.C. 2000. Le maïs fourrage. III-Evaluation et perspectives de progrès génétique sur les caractères de valeur alimentaire. Fourrages, 163: 221-238. [ Links ]
Castillo, R.B.O., Anchondo, A., Rodríguez, C., Beltrán, R., Laoz, O. y Payán, J. 2009. Efectos de enzimas e inoculantes sobre la composición del ensilaje de maíz. Arch. Zootec., 58: 163-172. [ Links ]
Cruz, J.C. e Pereira Filho, I.A. 2001. Cultivares de milho para silagem. Em: Cruz, J.C., Pereira Filho, I.A., Rodrigues, J.A.S., Ferreira, J.J. Produção e utilização de silagem de milho e sorgo. EMBRAPA. sete Lagoas. pp. 11-37. [ Links ]
Deschamps, F.C. 1999. Implicações do período de crescimento na composição química e digestão dos tecidos de cultivares de capim-elefante (Pennisetum purpureum schum.). Rev. Bras. Zootecn., 28: 1358-1369. [ Links ]
Deschamps, F.C. e Ramos, L.P. 2002. Método para a determinação de ácidos fenólicos na parede celular de forragens. Rev. Bras. Zootecn., 31: 1634-1639. [ Links ]
Ferreira, G.D.G., Barrière, Y., Emile, J.C., Jobim, C.C. e Lefève, B. 2005. Valor nutritivo de plantas de milho (Zea mays L.) sem espigas. Acta Sci. Anim. Sci., 27: 433-438. [ Links ]
Ferreira, G.D.G., Emile, J.C., Barrière, Y. e Jobim, C.C. 2007. Caracterização morfoanatômica do colmo de híbridos de milho para avaliar a qualidade de silagem. Acta Sci. Anim. Sci., 29: 249-254. [ Links ]
Grenet, E. 1997. Aspects microscopiques de la dégradation micronienne dês tissus végétaux dans le rumen. INRA Product. Anim., 10: 241-249. [ Links ]
Gonçalves, G.D., Santos, G.T., Cecato, U., Jobim, C.C., Damasceno, J.C., Branco, A.F. e Faria, K.P. 2002. Produção e valor nutritivo de gramíneas do gênero Cynodon em diferentes idades ao corte durante o ano. Acta Sci. Anim. Sci., 24: 1163-1174. [ Links ]
Iiyama, K., Lam, T.B.T. and Stone, B.A. 1994. Covalent cross-links in the cell wall. Plant Physiol., 1: 315-320. [ Links ]
Jung, H.G. and Vogel, K.P. 1986. Influence of lignin on digestibility of forage cell wall material. J. Anim. Sci., 62: 1703-1712. [ Links ]
Jung, H.G. 1989. Forage lignins and their effects on fiber digestibility. Agronomie, 81: 33-38. [ Links ]
Jung, H.G. and Deetz, D.A. 1993. Cell wall lignification and degradability. In: Jung, H.G., Buxton, D.R., Hatfield, R.D. et al. (Eds.) Forage wall structure and digestibility. ASA/CSSA/ SSSA. Madison. pp. 313-346. [ Links ]
Mechin, V. 2000. Etude de facteurs biochimiques et génétiques explicatifs de la variabilité pour la valeur alimentaire du maïs fourrage. Tese (Doutorado em agronomia). Institut national Agronomique. INRA. Lusignan. France. 192 pp. [ Links ]
Mechin, V., Argillier, O., Rocher, F., Yannick Hébert, Y., Mila, I., Pollet, B., Barriére, Y. and Lapierre, C. 2005. In search of a maize ideotype for cell wall enzymatic degradability using histological and biochemical lignin characterization. J. Agric. Sci., 53: 5872-5881. [ Links ]
Morrison, T.A., Jung, H.G. and Buxton, D.R. 1998. Cell wall composition of maize internode of varying maturity. Crop Sci., 38: 455-460. [ Links ]
Paciullo, D.S.C., Gomide, J.A., Silva, E.A.M., Queiroz, D.S. e Gomide, C.A.M. 2002. Degradação in vitro de tecidos da lâmina foliar e do colmo de gramíneas forrageiras tropicais, em função do estádio de desenvolvimento. Rev. Bras. Zootecn., 31: 900-907. [ Links ]
Terry, R.A. and Tilley, J.M.A. 1964. The indigestibility of the leaves and stems of perennial ryegrass, cocksfoot, timothy, tall fescue, lucerne and sainfoin as measured in vitro procedure. J. Brit. Grassld. Soc., 19: 362-372. [ Links ]
Tolivia, D. and Tolivia, J. 1987. Fasga: a new polychromotic method for simultaneous and differential staining of plant tissue. J. Microsc., 148: 113-117. [ Links ]
Wilkins, R.J. 1972. The potential digestibility of cellulose in grasses and its relationship with chemical and anatomical parameters. J. Agric. Sci., 78: 457-464. [ Links ]
Wilson, J.R. 1993. Organization of forage plant tissues; In: Jung, H.G., Buxton, D.R. Forage cell wall structure and digestibility. ASA/CSSA/ SSSA. Madison. pp. 1-32. [ Links ]
Yamamoto, E., Inciong, M.E.J. and Davin, L.B. 1990. Formation of cis -coniferin in cell-free extracts of Fogus grandifolia Ehrh bark. Plant Physiol., 94: 209-213. [ Links ]
Recibido: 10-7-08.
Aceptado: 15-9-09.