My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos de Zootecnia
On-line version ISSN 1885-4494Print version ISSN 0004-0592
Arch. zootec. vol.61 n.234 Córdoba Jun. 2012
https://dx.doi.org/10.4321/S0004-05922012000200012
Persistência de patógenos e do antibiótico salinomicina em pilhas de compostagem de cama de aviário
Persistence of pathogens and the salinomycin antibiotic in composting piles of poultry litter
Hahn, L.1*, Padilha, M.T.S.2, Padilha, J.C.F.2, Poli, A.3 e Rieff, G.G.1
1Faculdade de Agronomia. Departamento de Solos. Universidade Federal do Rio Grande do Sul (UFRGS). Porto Alegre-RS. Brasil. *hahnleandro@yahoo.com.br
2Departamento de Zootecnia. Centro de Ciencias Agrárias. Universidade Federal de Santa Catarina. CCA/ UFSC. Florianópolis-SC. Brasil. mariliap@mbox1.ufsc.br; jpadilha@mbox1.ufsc.br
3Departamento de Farmacologia. Centro de Ciências Biológicas. Universidade Federal de Santa Catarina. CCB/UFSC. Florianópolis-SC. Brasil. poli@farmaco.ufsc.br
RESUMO
A cama de aviário pode causar contaminação ambiental pelo excesso de nutrientes, microorganismos patogênicos e resíduos químicos. Para minimizar estes impactos pode-se fazer compostagem da cama de aviário antes de sua aplicação como fertilizante, porém, ainda existem muitas dúvidas sobre a eficiência deste tratamento. O objetivo deste trabalho foi analisar a persistência de patógenos e do antibiótico salinomicina em cama de aviário submetida à pilhas estáticas de compostagem. Os três tratamentos usados foram: CSC (cama de aviário com camadas de solo e coberto com capim) CP (cama de aviário coberta com polietileno) e CCC (cama de aviário com camadas de capim e coberto com capim). Acompanhou-se a evolução da temperatura nas pilhas, pH, níveis de Escherichia coli, oocistos de eimérias e concentrações do antibiótico salinomicina. O tratamento CP foi o menos eficiente na degradação do antibiótico salinomicina até os 90 dias. A compostagem da cama de aviário, independente dos tratamentos, é eficiente na eliminação de E. coli.
Palavras chave: Fertilizante orgânico. Escherichia coli. Contaminação ambiental. Eimérias.
SUMMARY
The high concentration of poultry litter in some regions has caused environmental pollution because of excess of nutrients, pathogenic microorganisms and chemical residues. In order to minimize these impacts, the producers have been stimulated to composting the poultry litter before its application as a fertilizer, however there are many doubts concerning the efficiency of this treatment. The goal of this research was analyse the persistence of pathogens and the salinomycin antibiotic in unturned static composting piles of poultry litter. The three used composting treatments were: CSC treatment (poultry litter with soil layers and covered with grass), CP (poultry litter covered with polyethylene) and CCC (poultry litter with grass layers and covered with grass). It was attended the evolution of the temperature of the layers, humidity, Escherichia coli level, oocysts of Eimeria and concentrations of salinomycin antibiotic until 90 days. The CP treatment is less efficient for degradation of the salinomycin antibiotic. Independent of the treatments, the composting of poultry litter is efficient in elimination of E coli.
Key words: Organic fertilizant. Escherichia coli. Environment contamination. Eimeries.
Introdução
A produção avícola intensiva é uma atividade de grande importância para o Brasil e, especialmente, para o Sul do Brasil, onde está concentrada em poucas regiões, o que gera uma alta concentração de cama de aviário. Este resíduo contém os excrementos, penas, ração desperdiçada e material absorvente usado sobre o piso dos aviários. Apesar de suas vantagens como fertilizante, esta pode conter inúmeros contaminantes, destacando-se os microorganismos patogênicos e resíduos de produtos veterinários utilizados na ração dos animais.
Entre os principais patógenos presentes na cama de aviário temos a Escherichia coli, a Salmonella e os oocistos de eimérias. Deve-se evitar a disseminação destes porque muitos podem sobreviver até 11 semanas fora do sistema digestivo das aves (Haapapuro et al., 1997) e são resistentes aos antibióticos usados na avicultura, podendo transmitir esta resistência à patógenos humanos e animais (Baquero et al., 2008). Uma questão chave para esta preocupação é a integração de genes de resistência para antibióticos em elementos de transferência de genes, como por exemplo, plasmídios, o que pode aumentar os riscos da disseminação destes genes (Cattoir et al., 2008).
Na avicultura industrial são utilizados inúmeros antibióticos como promotores de crescimento. Chee-Sanfordet al. (2009) citam que aproximadamente 75% desses produtos não são absorvidos pelos animais e seriam eliminados pelas fezes e, quando a cama de aviário é utilizada como fertilizante, os antimicrobianos e seus metabólitos podem causar impactos adversos nos ecossistemas (Migliore et al., 1997 e Wollenberger et al., 2002). Segundo Jjemba (2002), Kim e Carlson (2006), Lissemore et al. (2006) e Managakiet al. (2007) antimicrobianos utilizados na produção avícola já foram detectados no solo, água, sedimentos e plantas.
Ionóforos é o grupo de antibióticos mais utilizados para fins veterinários. Dentre eles, a salinomicina, é um antibiótico comumente adicionado na ração de frangos de corte (50 a 70 mg kg-1) como promotor de crescimento e preventivo de coccidiose causada por Eimeria tenella, E. necatrix, E. acervulina, E. maxima, E. brunetti e E. mivati (Ferreira e Dell'Porto, 1999).
Para minimizar os impactos do uso da cama de aviário nos ecossistemas quando ela é utilizada como fertilizante, os agricultores têm sido estimulados pelas empresas integradoras a fazer a sua compostagem. Esta prática foi demonstrada como sendo eficaz na degradação de antimicrobianos (Bakshi e Fontenot, 1998 e Ramaswamy et al., 2010) e na eliminação de microorganismos patogênicos (Bushet al., 2006). O efeito positivo na qualidade sanitária da cama de aviário será tanto maior quanto mais intensa for a oxidação do material orgânico durante este tratamento (Haug, 1993). Porém, esta prática tem a desvantagem de diminuir a qualidade de um resíduo como fertilizante devido principalmente à perda de nitrogênio na forma de amônia e de carbono perdido na forma de gás carbônico e metano. Estas perdas são mais significativas quando aumenta a aeração do material (Kirchmann e Lundvall, 1998).
O objetivo deste trabalho foi estudar o efeito de três tratamentos de compostagem da cama de aviário nas características microbiológicas e na persistência do antibiótico salinomicina que possibilitem a sua transformação em um adubo orgânico de alta qualidade como fertilizante.
Material e métodos
O trabalho experimental foi realizado no município de Palhoça/SC e as análises foram feitas na Universidade Federal de Santa Catarina, Florianópolis, SC.
A cama de aviário utilizada durante um ano (seis lotes de frangos de corte), proveniente da Macedo Koerich S.A., foi amontoada em pilhas de 2,5 m3 e submetida a três tratamentos em pilhas estáticas de compostagem (com seis repetições). As pilhas do tratamento CP foram manejadas de acordo com o praticado pelos agricultores, em que as pilhas de cama são apenas cobertas com polietileno de cor azul. No tratamento CSC foram utilizadas camadas de solo como inoculante de microrganismos (aproximadamente 10% do volume de cama de aviário e com 2 cm de espessura) intercaladas na cama de aviário e cobertas com aproximadamente 15 centímetros de capim braquiária do brejo (Brachiaria arrecta) para aumentar a aeração da pilha. No tratamento CCC foram utilizadas camadas de capim braquiária do brejo (cerca de 25% do volume da cama de aviário e com 10 cm de espessura) intercaladas na cama de aviário. A cobertura das pilhas foi a mesma que no tratamento CSC.
Amostras de cama das pilhas de compostagem foram coletadas com um trado calador da superfície até o interior da pilha numa profundidade de 70 cm durante 90 dias. As temperaturas médias do ar e a 10 cm e 50 cm de profundidade do material em compostagem foram registradas usando sensores acoplados a um armazenador de dados. As temperaturas médias do ar durante o período experimental foram obtidas da Estação Meteorológica da Epagri de São José/SC.
Nas amostras foram determinadas a concentração de Escherichia coli segundo MAA (1998) e o número de oocistos de eimérias segundo Long e Rowell (1958).
A salinomicina foi adicionada na ração dos frangos de corte numa concentração de 60 mg/kg-1 de ração durante o período de criação. A extração deste antibiótico nas amostras de cama foi realizada com acetona e a análise realizada por cromatografia líquida de alta eficiência (CLAE) usando uma coluna C18 Sephasil Peptide, 5 µm, 250 x 4,6 mm DI com uma fase móvel constituída por metanol - ácido acético glacial 0,15% na proporção de 96:4. A derivatização póscoluna com a vanilina foi realizada num reator helicoidal a 85oC. Os picos do complexo de salinomicina foram detectados pela absorbância de luz visível em comprimento de onda (λ) de 520 nm. Uma curva de calibração foi construída utilizando soluções nas concentrações 0,0; 0,3; 0,6 1,0; 3,0 e 6,0 ppm. Além disso, foi realizado o inter e intra-ensaio para determinar a precisão e exatidão dos mesmos.
O pH das amostras foi determinado com potenciômetro numa suspensão cama de aviário:água de 1:2,5 com tempo de repouso de 30 minutos.
Os dados foram analisados estatisticamente por análise de regressão.
Resultados e discussão
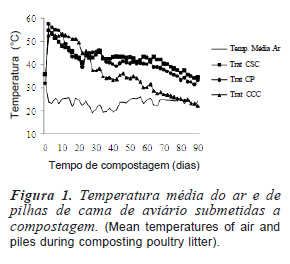
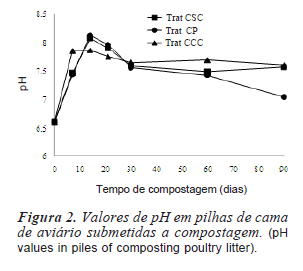
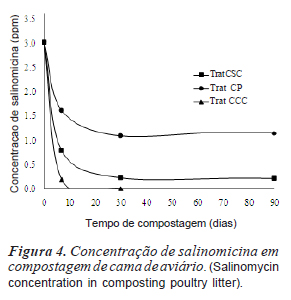
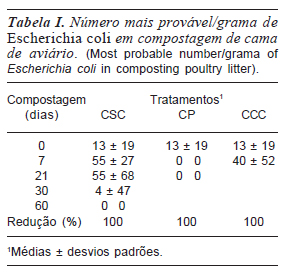
As maiores alterações dos parâmetros sanitários da cama de aviário para todos os tratamentos ocorreram nos primeiros 30 dias de compostagem, indicado pela variação nos dados da temperatura (figura 1), pH (figura 2) dos patógenos analisados (tabela I e figura 3) e da concentração de salinomicina (figura 4).
Após a montagem das pilhas de compostagem houve um rápido aumento da temperatura nas pilhas (figura 1) em todos os tratamentos devido à intensa atividade biológica decorrente da oxidação do material orgânico. A temperatura média das pilhas do tratamento CCC permaneceu acima de 50oC por um período maior de tempo. Uma maior aeração do material neste tratamento pode ter sido favorecida pelo uso do capim como cobertura e a sua adição na pilha ter estimulado uma maior ação microbiana. Kirchmann e Witter (1989) e Kwak et al. (2005) obtiveram um aumento maior da temperatura na compostagem de pilhas de cama de aviário com o aumento da aeração, o que promoveu transformações químicas e microbiológicas mais intensas nestas pilhas.
As variações nos valores de pH (figura 2) foram semelhantes às variações de temperatura das pilhas. O valor de pH inicial foi 6,8 e aumentou até um máximo de 8,1 aos 14 dias de compostagem, o que pode ser devido à amônia produzida pela atividade microbiana, Após este período, ocorre uma diminuição gradual dos valores de pH. Provavelmente, após o consumo de oxigênio pelos microrganismos no período inicial da compostagem, o metabolismo anaeróbio dos microrganismos começa a predominar e ocorre a liberação de ácidos orgânicos. Além disso, a volatilização de nitrogênio amoniacal libera íons H+ o que também pode ter contribuído para a redução destes valores. Os tratamentos com incremento da atividade biológica pela adição de solo e capim e cobertura com capim (CCC e CSC) apresentaram os maiores aumentos de pH e se mantiveram mais altos aos 90 dias de compostagem. Por outro lado, a cobertura das pilhas do tratamento CP com polietileno pode ter permitido um ambiente mais anaeróbio e uma maior produção de ácidos orgânicos pelos microrganismos.
O número mais provável (NMP) de E. coli na cama de aviário submetida à compostagem foi de 65 por grama de cama de aviário (tabela I). A população deste microorganismo em cama de aviário é bastante variável, dependendo principalmente do manejo sanitário da criação. Quantidades bem superiores de E. coli foram encontradas por Bakshi e Fontenot (1998) ao analisarem cama de aviário coletada após a retirada dos frangos (1,55 x 104 bactérias g-1 de cama).
Em todos os tratamentos não foi mais detectada a presença de E. coli após um mês de compostagem. Sua eliminação pode ser devida às altas temperaturas e ao aumento de pH registrados neste período inicial de compostagem. Este mesmo período de tempo foi necessário para eliminar a E. coli em pilhas anaeróbias de cama de aviário no trabalho de Bakshi e Fontenot (1998). Porém, Kwak et al. (2005) necessitaram apenas sete dias para eliminar este microorganismo. O tratamento CP apresentou a mais rápida redução desta bactéria, sendo que na coleta feita após sete dias de compostagem não foi mais detectada a sua presença. O provável acúmulo de amônia próximo da superfície de contato com o polietileno apresenta uma forte ação germicida e pode ter contribuído no resultado deste tratamento. O tratamento CSC apresentou o maior tempo de sobrevivência de E. coli, sendo que somente aos 60 dias esta bactéria não foi mais detectada. A redução mais lenta desta bactéria pode ser atribuída à fração da amostra próxima da superfície da pilha, onde as temperaturas verificadas foram menores (dados não apresentados) e podem ter possibilitado uma redução mais lenta na população microbiana patogênica.
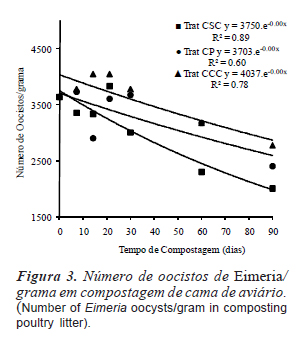
O número de oocistos de eimérias no início da construção das pilhas foi de 3,64 x 103 oocistos/g de cama de aviário e não apresentou diferenças significativas entre os tratamentos durante o período analisado (figura 4). Valores semelhantes em criações comerciais foram encontrados por Costa e Ávila (1996) e Luchese et al. (2007). Mesmo com 90 dias de compostagem, o número de oocistos por grama de cama de aviário reduziu menos que 50% da contagem inicial. Estes dados comprovam a alta resistência deste protozoário fora do sistema digestivo das aves e a baixa eficiência da compostagem para reduzir a contaminação por estes organismos. Isto é provavelmente à habilidade de protozoários formar cistos e oocistos para proteção contra pressões ambientais.
Na análise cromatográfica, a salinomicina foi adequadamente separada em 15,5 minutos. A sensibilidade do método mostrou-se adequada e suficiente para o objetivo pretendido, com limite de quantificação de 0,6 ppm. As curvas de calibração ajustadas por regressão linear apresentaram boa linearidade na faixa de concentração das soluções padrões utilizadas, sendo a média dos valores dos coeficientes de determinação linear (R2) igual a 0,994. O procedimento de extração no intra-ensaio assegurou recuperação média de 49,35 ± 7,89% (média ± DP).
O decréscimo significativo das concentrações de salinomicina na primeira semana de compostagem da cama de aviário no tratamento CSC (redução de 47%) e, principalmente no tratamento CCC (redução de 95%) (figura 3), pode ser atribuído à intensa atividade biológica ocorrida neste período para estes dois tratamentos. Ramaswamy et al. (2010) conseguiram uma redução deste antibiótico de mais de 99,8% durante um período de 38 dias de compostagem sem aeração, e, de uma maneira semelhante aos nossos dados, a maior degradação ocorreu nos primeiros seis dias. Vertesy et al. (1987) reportam que a salinomicina rapidamente perde sua atividade antimicrobiana sob condições ácidas e seus metabólitos não possuem mais atividade antibiótica. Diferentes enzimas hidrolíticas liberadas por microrganismos durante a compostagem (Mondini et al., 2004) podem ser responsáveis pela degradação de salinomicina, cuja molécula possui ligações poliéter sujeitas às enzimas microbianas.
Por outro lado, uma menor atividade microbiana no tratamento CP possibilitou uma menor redução da salinomicina na primeira semana (redução de 25%) e aos 90 dias de compostagem ela ainda foi detectada neste tratamento numa concentração de 1,14 ppm. Isto representa uma redução de 62% da concentração inicial de salinomicina, o que consideramos insuficiente para garantir uma segurança sanitária adequada da cama de aviário para ser aplicada como fertilizante com este tipo de tratamento. Por ser o tratamento tradicionalmente adotado pelos avicultores no Sul do Brasil, é importante que sejam adotados métodos de compostagem da cama de aviário que intensificam a aeração e consequentemente a atividade microbiana.
A ação da salinomicina e seus metabólitos no solo, pelo uso de cama de aviário, apresenta ainda conseqüências pouco conhecidas sobre os organismos do solo e da água, principalmente por ser um antibiótico de amplo espectro de ação biológica. A molécula é apolar, o que lhe confere baixa solubilidade e alta persistência na fase sólida, portanto, pode ser esperado maior risco de contaminação do solo e águas superficiais. Em um estudo de Kim e Carlson (2006) a concentração de salinomicina foi aproximadamente 500 vezes maior em sedimentos do que na água.
A semelhança estrutural existente entre a molécula de salinomicina e de outros antibióticos ionóforos poliéter, como a monensina, a narasina e a lasalocida (Ferreira e Dell'Porto, 1999), também de amplo uso na veterinária, permite-nos supor que a compostagem da cama de aviário possa promover uma degradação dessas moléculas de modo semelhante ao verificado para a salinomicina nos três tratamentos, o que precisa ser confirmado.
Conclusões
A compostagem em pilhas estáticas pode ser utilizada para transformar a cama de aviário em fertilizante agrícola, pois elimina Escherichia coli em até 60 dias e reduz a concentração do antibiótico salinomicina. No entanto, este tratamento é pouco eficaz para reduzir a população de eimérias.
Apesar do tratamento da cama de aviário tradicionalmente adotado pelos avicultores apresentar a mais rápida eliminação de E. coli, proporciona a menor redução do antibiótico salinomicina.
Bibliografia
Baquero, F., Martinez, J.L. and Canton, R. 2008. Antibiotics and antibiotic resistance in water environments. Curr Opin Biotech, 19: 260-265. [ Links ]
Bakshi, M.P.S. and Fontenot, J.P. 1998. Processing and nutritive evaluation of broiler litter as livestock feed. Anim Feed Sci Tech, 74: 337-345. [ Links ]
Bush, D.J., Pooreb, M.H., Rogersa, G.M. and Altiera, C.2006. Effect of stacking method on Salmonella elimination from recycled poultry bedding. Bioresource Technol, 98: 571-578. [ Links ]
Cattoir, V., Poirel, L., Aubert, C., Soussy, C.J. and Nordmann, P. 2008. Unexpected occurrence of plasmid-mediated quinolone resistance determinants in environmental Aeromonas spp. Emerg Infect Dis, 14: 231-237. [ Links ]
Chee-Sanford, J.C., Mackie, R.I., Koike, S., Krapac, I., Maxwell, S., Lin, Y. and Aminov, R.I. 2009. Fate and transport of antibiotic residues and antibiotic resistance genetic determinants during manure storage, treatment, and land application. J Environ Qual, 38: 1086-1108. [ Links ]
Costa, C.A.F. e Ávila, V.S. 1996. Efeito da idade das aves e da reutilização e manejo da cama do aviário sobre a coccidiose em frangos de corte. Arq Bras Med Vet Zoo, 48: 430-413. [ Links ]
Ferreira, A.J. e Dell'Porto, A. 1999. Agentes antiprotozoários. Em: Spinosa, H.S., Gorniak, S.L., Bernardi, M.M. Farmacologia aplicada à medicina veterinária. 2a ed. Editora Guanabara Koogan S.A. Rio de Janeiro. pp. 467-469. [ Links ]
Haapapuro, E.R., Barnard, N.D. and Simon, M. 1997. Review: Animal waste use as livestock feed: dangerous to human health. Prev Med, 26: 599-602. [ Links ]
Haug, R.T. 1993. The practical handbook of compost engineering. Lewis Publishers. Boca Raton. 717 pp. [ Links ]
Jjemba, P.K. 2002. The effect of chloroquine, quinacrine, and metronidazole on both soybean plants and soil microbiota. Chemosphere, 46: 1019-1025. [ Links ]
Kim, S. and Carlson, K. 2006. Occurrence of ionophore antibiotics in water and sediments of a mixed-landscape watershed. Water Res, 40: 2549-2560. [ Links ]
Kirchmann, H. and Lundvall, A. 1998. Treatment of solid animal manures: Identification of low NH3 emission practices. Nutr Cycl Agroecosys, 51: 65-71. [ Links ]
Kirchmann, H. and Witter, E. 1989. Ammonia volatilization during aerobic and anaerobic manure decomposition. Plant Soil, 115: 35-41. [ Links ]
Kwak, W.S., Huh, J.W. and Mccaskey, T.A. 2005. Effect of processing time on enteric bacteria survival and on temperature and chemical composition of broiler poultry litter processed by two methods. Bioresource Technol, 96: 1529-1536. [ Links ]
Lissemore, L., Hao, C., Yang, P., Sibley, P.K., Maybury, S. and Solomon, K.R. 2006. An exposure assessment for selected pharmaceuticals in Southern Ontario. Chemosphere, 64: 717-729. [ Links ]
Long, P.L. and Rowell, J.G. 1958. Counting oocysts of chicken Coccidia. Lab Practice, 7: 515-534. [ Links ]
Luchese, F.C., Perin, M., Aita, R.S., Mottin, V.D., Molento, M.B. e Monteiro, S.G. 2007. Prevalência de espécies de Eimeria em frangos de criação industrial e alternativa. Braz J Vet Res Anim Sci, 44: 81-86. [ Links ]
MAA. 1998. Compêndio brasileiro de alimentação animal. Ministério da Agricultura e do Abastecimento. Brasília. 246 pp. [ Links ]
Managaki, S., Murata, A., Takada, H., Yuyen, B.C. and Chiem, N.H. 2007. Distribution of macrolides, sulfonamides, and trimethoprim in tropical waters: ubiquitous occurrence of veterinary antibiotics in the Mekong Delta. Environ Sci Technol, 41: 8004-8010. [ Links ]
Migliore, L., Civitareale, S., Brambilla, G. and Di Delupis, G.D. 1997. Toxicity of several important agricultural antibiotics to Artemia. Water Res, 31: 1801-1806. [ Links ]
Mondini, C., Farnasier, F. and Sinicco, T. 2004. Enzymatic activity as a parameter for the characterization of the composting process. Soil Biol Biochem, 36: 1587-1594. [ Links ]
Ramaswamy, J., Prasher, S.O., Patel, R.M., Hussain, S.A. and Barrington, S.F. 2010. The effect of composting on the degradation of a veterinary pharmaceutical. Bioresource Technol, 101: 2294-2299. [ Links ]
Wollenberger, L., Halling-Sørensen, B. and Kusk, K.O. 2002. Acute and chronic toxicity of veterinary antibiotics to Daphnia magna. Chemosphere, 40: 723-730. [ Links ]
Vertesy, L., Hril, K., Fehlhaber, H.W. and Ziegler, W.1987. Microbial decomposition of salinomycin. J Antibiot, 40: 388-390. [ Links ]
Recibido: 20-4-11
Aceptado: 22-12-11.