My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.60 n.3 Apr. 2007
UROLOGÍA ONCOLÓGICA
Linfadenectomía retroperitoneal reducida en cáncer testicular de células germinales no seminomatoso estadio clínico I
Reduced retroperitoneal lymphadenectomy for clinical stage I non seminomatous germ cell testicular cancer
Juan Pablo Valdevenito Sepúlveda, Emilio Merhe Nieva, Raúl Valdevenito Sepúlveda, Miguel Cuevas Toro, Álvaro Gómez Gallo, Hugo Bermúdez Luna, Luis Contreras Meléndez, Iván Gallegos Méndez, Jorge Gallardo Escobar y Cristián Palma Ceppi
Servicios de Urología, Anatomía Patológica y Oncología. Hospital Clínico Universidad de Chile. Santiago. Chile.
Dirección para correspondencia
RESUMEN
Objetivo: Existe controversia sobre el tratamiento óptimo de los cánceres testiculares de células germinales no seminomatosos (CTCGNS) estadio clínico I. La linfadenectomía permite una adecuada estadificación retroperitoneal y cura hasta el 70% de los pacientes en estadio II patológica. El objetivo de este estudio es analizar nuestra experiencia en el tratamiento de estos pacientes mediante orquiectomía radical y linfadenectomía retroperitoneal reducida (LRR) como tratamiento inicial.
Método: Estudio retrospectivo de pacientes con CTCGNS estadio clínico I sometidos a orquiectomía radical y LRR en el Servicio de Urología del Hospital Clínico Universidad de Chile entre Enero de 1990 y Diciembre de 2000. Criterios de inclusión: estadificación retroperitoneal con tomografía computada (TC), marcadores tumorales normales después de la orquiectomía y biopsia testicular y retroperitoneal informada en nuestro hospital. Se revisaron los siguientes factores de riesgo de metástasis: invasión vascular (venosa y/o linfática), infiltración de túnica albugínea, rete testis, epidídimo y cordón espermático.
Resultados: Se analizan 36 pacientes con 37 tumores testiculares (1 caso bilateral). Edad promedio 28 años. Veinte y nueve tumores mixtos (78%); histología mas frecuente carcinoma embrionario (76%). Tiempo promedio de la cirugía 2 horas y 7 minuntos ; promedio de ganglios resecados 13. Complicaciones intraoperatorias 2,8%; complicaciones postoperatorias: a) tempranas 5,6%, b) tardías 5,6%. Sin mortalidad, sin reoperaciones ni transfusiones sanguíneas. Cuatro casos de LRR positivas (11%). Sólo recaídas retroperitoneales en 2 casos (8%), una fuera de los límites de disección. Quimioterapia en 7 pacientes (19%), un total de 18 ciclos. Cuatro casos de tumor testicular contralateral durante el seguimiento (11%). Cien por ciento de sobrevida a 76 meses (16-160). Describimos sensibilidad, especificidad y valor predictivo positivo y negativo de los factores de riesgo de metástasis. Sólo la infiltración de epidídimo fue predictor de metástasis (p=0,04).
Conclusión: En nuestras manos la LRR es una cirugía segura que presenta complicaciones mayores en el 5,6% de los casos. El bajo porcentaje de falsos negativos de la TC en la estadificación y la alta tasa de recaída retroperitoneal contrasta con los datos de otras publicaciones. La infiltración de epidídimo fue el único predictor de metástasis estadísticamente significativo, lo cual se encuentra limitado por el tamaño del grupo estudiado. Los CTCGNS etapa clínica I tratados inicialmente con LRR tienen un 100% de sobrevida.
Palabras clave: Cáncer testicular. Estadio clínica I. Linfadenectomía retroperitoneal.
SUMMARY
Objectives: The best treatment of clinical stage I non-seminomatous germ cell testicular cancer (NSGCTC) is controversial. Lymphadenectomy allows an adequate retroperitoneal staging and cures up to 70% of patients in pathological stage II. The objective of this study is to analyse our experience in the treatment of this patients with radical orchiectomy and reduced retroperitoneal lymphadenectomy (RRL) as the initial treatment.
Methods: Retrospective study of patients with clinical stage I NSGCTC submitted to radical orchiectomy and RRL at the Urology Service of the University of Chile Clinical Hospital, from January 1990 to December 2000. Inclusion criteria: retroperitoneal staging with computed tomography (CT), normal tumor markers after orchiectomy and testicular and retroperitoneal biopsy informed at our hospital. The following metastatic risk factors in the testicular biopsy were checked: vascular invasion (venous and/or lymphatic), infiltration of tunica albuginea, rete testis, epididymis, and spermatic cord.
Results: 36 patients with 37 testicular tumors were analysed (1 bilateral case). Average age 28 years old. Twenty nine mixed tumors (78%); most frequent histology embryonal carcinoma (76%). Average surgery time 2hr 7min; average dissected lymph nodes 13. Intraoperative complications: 2,8%; postoperative complications: a) early 5,6%; b) late: 5,6%. No mortality, no second surgeries nor blood transfusions. Four cases of positive RRL (11%). Only retroperitoneal relapses in 2 cases (8%), one out of the limits of dissection. Chemotherapy in 7 patients (19%) a total of 18 cycles. Four cases of contralateral tumor during follow-up (11%). Hundred percent survival at 76 months (16-160). We described sensibility, specificity, positive and negative predictive value of metastatic risk factors. Only epididymis infiltration was a significant predictor of metastasis (p=0,04).
Conclusions: In our hands RRL is a safe surgery, with 5,6% mayor complications. The low false negative rate of CT in staging (11%) and the high number of retroperitoneal relapses (8%) in our study contrast with those of other publications. Limited by the size of our study group, the epididymis infiltration was the only statistically significant predictor of metastasis. Clinical stage I NSGCTC initially managed with RRL has a 100% survival.
Keywords: Testicular cancer. Clinical stage I. Retroperitoneal lymphadenectomy.
Introducción
El cáncer testicular es la neoplasia sólida maligna más común en hombres entre 15 y 35 años (1). En Chile su tasa de mortalidad se situó en 1,21 por 100.000 hombres en el 2001, lo que representa el 0,98 % de las muertes por cáncer (2).
Aproximadamente un tercio de los cánceres testiculares no seminomatosos (CTCGNS) se presentan en estadio clínico, siendo su manejo actual motivo de controversia si se tiene en cuenta que se debe reducir al máximo los efectos adversos. Independiente del cual sea el tratamiento inicial su sobrevida varía entre el 95 y el 100% (3).
Mayoritariamente los CTCGNS se diseminan a los ganglios retroperitoneales y de ahí al resto del organismo. En sólo un 12 a 15 % de los casos las metástasis se saltan el retroperitoneo (4). La estadificación retroperitoneal con métodos de imágenes sigue siendo uno de los principales problemas, con un 10 a 60 % de falsos negativos si se compara con los resultados histológicos de la linfadenectomía (5-11).
La linfadenectomía retroperitoneal (LR) permite una adecuada estadificación y cura entre el 50 y 70% de pacientes en etapa II patológica (10, 12, 13), sin embargo carece de rol terapéutico en el 40 a 90 % de los casos. Su principal morbilidad tardía es la eyaculación retrógrada (14). El conocimiento de las zonas de diseminación metastásica del cáncer testicular (15, 16) y el reconocimiento general de que la región crítica para la preservación de la eyaculación es el tejido para aórtico bajo el nivel de la arteria mesentérica inferior permitió el desarrollo de modificaciones técnicas como son la LR reducida unilateral (6, 17, 18) y la LR con preservación de nervios (19, 20) con lo cual se evita esta complicación en la gran mayoría de los pacientes. Últimamente, después de su primera descripción por Rukstalis y Chodak (21), la vía laparoscópica ha permitido reducir el dolor postoperatorio, la morbilidad del acceso al retroperitoneo y la estancia hospitalaria, acelerando la reinserción laboral de los pacientes, sin alterar su eficacia oncológica (22, 23).
El objetivo de este estudio es dar a conocer nuestra experiencia en el tratamiento del CTCGNS en estadio I mediante orquiectomía radical y linfadenectomía retroperitoneal reducida (LRR) unilateral como tratamiento inicial, enfatizando en las características clínicas de los pacientes, la morbilidad de la LRR, su rol en la estadificación y recaídas, la importancia de los factores histológicos en la biopsia testicular como predictores de metástasis y la sobrevida de éstos pacientes, de modo de compararlos con nuestra serie en curso de LR laparoscópicas.
Material y método
Se realizó un estudio descriptivo retrospectivo de pacientes con cáncer testicular de células germinales no seminomatoso (CTCGNS) en estadio clínico I (T1-4 N0 M0 S0) de la clasificación de tumores malignos TNM de 2002 (24), que fueron sometidos a orquiectomía radical y LRR entre enero de 1990 y diciembre de 2000 en el Servicio de Urología del Hospital Clínico Universidad de Chile. La información se obtuvo del registro de tablas operatorias del Servicio de Urología, de los informes de biopsias del Servicio de Anatomía Patológica y de las observaciones clínicas de los pacientes.
Se consideró seguimiento real el tiempo transcurrido hasta la última evaluación clínica que incluyera marcadores tumorales (MT) gonadotrofina coriónica subunidad beta (beta HCG) y alfafetoproteína (AFP), tomografía computada (TC) de abdomen y pelvis y radiografía y/o TC de tórax. Los datos de sobrevida global se obtuvieron ingresando el nombre completo y número de Cédula Nacional de Identidad de los pacientes en el Registro Civil e Identificación de la República de Chile.
Los procedimientos diagnósticos empleados fueron el examen clínico, la ecotomografía testicular y los MT. La estadificación se hizo con TC de abdomen y pelvis, radiografía y/o TC de tórax. Los pacientes fueron sometidos a orquiectomía radical y posteriormente a LRR a través de laparotomía supra e infraumbilical. Se utilizó de rutina profilaxis antibiótica (cefalosporina 1ª generación), de trombosis venosa (heparina subcutánea) y protección gástrica (bloqueadores H2).
En el postoperatorio inmediato se manejó a todos los pacientes con sonda nasogástrica y uretrovesical y recibieron analgesia endovenosa con antiinflamatorios no esteroidales y opiáceos en bomba de infusión continua o analgesia peridural continua. Los límites de la disección retroperitoneal fueron:
1) tumores del lado izquierdo:
a) límite superior: borde superior de vena renal izquierda;
b) límite derecho: borde lateral de vena cava inferior hasta el nivel de la emergencia de la arteria mesentérica inferior cruzando hacia borde lateral de aorta (bajo la emergencia de dicha arteria) y borde lateral de arteria iliaca hasta entrecruzamiento del uréter izquierdo; c) límite izquierdo: pelvis renal y uréter izquierdos;
2) tumores del lado derecho:
a) límite superior: borde superior de ambas venas renales;
b) límite izquierdo: borde lateral de aorta hasta el nivel de la emergencia de la arteria mesentérica inferior cruzando hacia el borde lateral de la arteria iliaca hasta el entrecruzamiento del uréter derecho;
c) límite derecho: pelvis renal y uréter derechos. En el caso del tumor testicular bilateral se sumaron ambas áreas.
Las piezas operatorias testiculares fueron fijadas en formalina e incluidas en parafina. Se realizó al menos un corte por cada centímetro de eje mayor del tumor y tiñeron con hematoxilina-eosina. El estudio anatomopatológico fue reevaluado por dos especialistas de acuerdo a la clasificación de la Organización Mundial de la Salud de Mostofi y Sobin de 1977 (25), ocasión en que además se analizaron los siguientes factores de riesgo de metástasis: invasión vascular (venosa o linfática), compromiso de albugínea, de rete testis, de epidídimo y de cordón espermático. Los factores de riesgo en la biopsia testicular fueron confrontados con las metástasis presentadas: LRR positivas y recaídas de pacientes con LRR inicial negativa, considerando sólo aquellos pacientes con seguimiento real mayor de 18 meses (n = 29). Se describe la sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN) de dichos factores de riesgo en forma independiente y asociados. Se realizó análisis estadístico independiente para cada factor de riesgo con la prueba exacta de Fisher, considerándose significativo un p < 0,05.
Los ciclos de quimioterapia fueron realizados con cisplatino 20 mg/m2 por día durante 5 días, etopósido 100 mg/m2 por día durante 5 días y bleomicina 30mg en una dosis semanal por 3 semanas.
Se consideraron los siguientes criterios de inclusión:
1) Cirugía testicular y retroperitoneal realizada en nuestro Servicio
2) Estadificación retroperitoneal con TC y
3) MT normales después de orquiectomía: beta HCG < 5 mUI/mL y AFP < 15 ng/mL.
Resultados
Se analizan 36 pacientes con 37 tumores testiculares que fueron sometidos a orquiectomía radical y LRR en el Hospital Clínico Universidad de Chile.
Características clínicas: la edad de los pacientes fluctuó entre los 16 y 55 años, con un promedio de 28 años. Un 47% tenía entre 21 y 30 años, 21 tumores fueron izquierdos(58%) y 1 bilateral sincrónico (Tabla I). Se obtuvo el valor de los marcadores testiculares (MT) antes de la orquiectomía en 23 pacientes (64%), en 10 de los cuales fueron normales (43%). Cinco pacientes presentaron ambos MT elevados, 4 tuvieron sólo beta HCG elevada y 4 sólo AFP elevada (Tabla II).
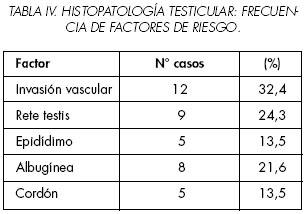
Histopatología testicular: 29 tumores fueron mixtos (78%), siendo los tipos histológicos más frecuentes el carcinoma embrionario (26 casos, 76%) y el teratoma (24 casos, 65%). Sólo un paciente presentó coriocarcinoma mixto (Tabla III). Los factores histológicos de riesgo de metástasis se presentaron en la siguiente frecuencia: invasión vascular: 12 casos (32,4%), compromiso de rete testis: 9 casos (24,3%), compromiso de albugínea: 8 casos (21,6%), compromiso de epidídimo: 5 casos (13,5%), compromiso de cordón espermático: 5 casos (13,5%). En 18 casos (48,6%) no se encontró ningún factor histológico de riesgo (Tabla IV).
Linfadenectomía retroperitoneal: se efectuaron 35 cirugías unilaterales y 1 cirugía bilateral en el paciente con tumor testicular bilateral sincrónico. El tiempo entre la orquiectomía y la linfadenectomía varió entre 8 y 98 días, con un promedio de 35 días. En 22 casos se intervino bajo anestesia general (72%) y en 10 casos se agregó peridural continua. El tiempo operatorio promedio de las cirugías unilaterales fue de 2 horas y 7 minútos, resecándose entre 3 y 36 ganglios con un promedio de trece. La cirugía bilateral demoró 3 horas 30 minutos resecándose 23 ganglios.
Complicaciones intraoperatorias (2,8%): 1 caso de ligadura advertida de arteria polar inferior de riñón derecho que evolucionó a atrofia parcial del polo inferior en TC tardía.
Complicaciones postoperatorias: a) tempranas, ocurridas durante la hospitalización inicial en dos pacientes(5,6%): 1 caso de laringoespasmo y edema pulmonar agudo transitorio que requirió ventilación mecánica por 14 hrs y 1 caso de ileo adinámico de 4 días de duración, que motivó el alta al octavo día postoperatorio; además 1 paciente presentó fiebre (temperatura axilar > 37,5°C) de menos de 72 horas de evolución;
b) tardías, ocurridas después del alta (5,6%): 1 caso de compresión duodenal extrínseca a nivel del ángulo de Treitz, que motivó rehospitalización al 12º día de evolución por 22 días, que se atribuyó a un hematoma retroperitoneal y que se resolvió espontáneamente; y 1 caso de HTA severa que se presentó a los dos y medio meses después de la cirugía, en que se objetivó isquemia del polo inferior renal izquierdo por arteriografía y se manejó con enalapril oral. Hubo conservación de la eyaculación en todos los 28 casos en que se obtuvo dicho dato (78% de los pacientes). No hubo mortalidad, reoperaciones ni transfusión sanguínea en nuestra serie. El tiempo de hospitalización promedio fue de 4,6 días con un rango entre 3 y 8 días, sin contar las complicaciones tardías.
Histopatología retroperitoneal: hubo 4 casos de linfadenectomía positiva (11%). Dos casos presentaron histología de seminoma, correspondientes a tumores testiculares mixtos con un 90 y 80% de seminoma respectivamente; uno presentó dos ganglios de 1 cm de diámetro comprometidos y el otro un lganglio de 1,5 cm de diámetro comprometido (este último sospechado como positivo durante la cirugía). Los otros dos casos presentaron histología de carcinoma embrionario, con histología testicular en un caso de teratoma, carcinoma embrionario y seminoma, y en el otro de carcinoma embrionario y teratoma; uno presentó cuatro ganglios de hasta 1 cm de diámetro comprometidos y el otro doce ganglios de hasta 3 cm de diámetro comprometidos (este último sospechado como positivo durante la cirugía). No se tomó biopsia rápida ni se extendió los límites de resección en los dos casos con sospecha macroscópica de compromiso tumoral.
Seguimiento: el seguimiento real se llevó a cabo en 33 de los 36 pacientes (92%) con un promedio de 47 meses y un rango entre 4 y 123 meses. El 50% de los pacientes tiene dos o más años de seguimiento real y el 39% cinco o más años.
Recaídas: dos pacientes con tumores testiculares derechos cuya LRR fue negativa presentaron recaída retroperitoneal. Un caso correspondió a un carcinoma embrionario que se presentó a los 9 meses de evolución con una trombosis de la vena cava inferior y de ambas venas iliacas comunes en relación a una masa de 7 cm de diámetro mayor, precava y pre-aortica distal a la arteria mesentérica inferior, con MT normales (dentro de los límites de disección). Fue sometido a 3 ciclos de quimioterapia con cisplatino, etopósido y bleomicina (PEB) sin reducción significativa de la masa retroperitoneal, y posteriormente a resección quirúrgica de ésta cuya biopsia informó carcinoma embrionario con extensa necrosis y focos viables de teratoma, por lo que finalmente recibió 2 nuevos ciclos de PEB. El otro caso correspondió a un tumor del saco vitelino (TSV) que se presentó a los 11 meses de evolución como una masa de 6 cm de diámetro mayor medial a los vasos iliacos externos derechos, asociado a elevación de beta HCG y AFP (fuera de los límites de disección). Fue sometido a 3 ciclos de PEB, con normalización de los MT, sin cambio del tamaño de la masa y posteriormente a resección quirúrgica de ésta, cuya biopsia informó teratoma y presencia focal de TSV con signos involutivos. Estos 2 casos de recidiva retroperitoneal corresponden al 6,1% (2/33) de todas las LRR negativas y al 8% (2/25) de las LRR negativas con seguimiento real superior a 18 meses.
Quimioterapia: siete pacientes fueron sometidos a quimioterapia (19%). Cuatro pacientes fueron sometidos a 2 ciclos de cisplatino, etopósido, bleomicina (PEB): tres pacientes con linfonodos positivos en la LRR y 1 paciente con coriocarcinoma mixto cuya LRR fue negativa. Otro paciente fue sometido a un ciclo de PEB y a otro de PE por toxicidad pulmonar a bleomicina. Los 2 pacientes con recaída fueron sometidos a 3 ciclos de PEB y resección de la masa retroperitoneal residual, a lo que se agregó otros 2 ciclos de PEB en uno de ellos (total 18 ciclos) Tabla V.
Tumor testicular contralateral: esta serie presenta 1 caso de tumor testicular bilateral sincrónico (1/36, 2,8%) y 4 asincrónicos (4/36, 11%). Los casos asincrónicos correspondieron a 3 seminomas puros en etapa I, que se presentaron a los 4, 36 y 48 meses respectivamente después de la orquiectomía inicial. Dos fueron sometidos a radioterapia externa y el otro fue observado. El cuarto caso correspondió a un paciente con un carcinoma embrionario y teratoma testicular derecho inicial que se presentó clínicamente a los 53 meses como un ascenso de la AFP y una masa retroperitoneal lateroaórtica de 10 cm de diámetro mayor, asociada a una lesión ecográfica testicular izquierda del polo superior de 7 mm de diámetro, no palpable, cuya histología reveló un acúmulo de material hemático sin células tumorales, que se interpretó como un tumor quemado. En forma programada fue sometido a 1 ciclo de quimioterapia con PEB, resección quirúrgica de la masa retroperitoneal (cuya histología demostró teratoma y carcinoma embrionario) y a otros 3 ciclos de quimioterapia con iguales drogas , evolucionando satisfactoriamente (Tabla VI).
Sobrevida: en un seguimiento promedio de 76 meses (rango 16-160) se comprobó 100% de sobrevida.
Factores de riesgo de metástasis en biopsia testicular: la sensibilidad, especificidad, VPP y VPN de los factores de riesgo en forma independiente se muestran en la Tabla VII y en forma asociada en la Tabla VIII. Sólo un paciente sin ningún factor de riesgo en la biopsia testicular presentó metástasis y correspondió a un tumor de 8 cm de diámetro mayor. En el análisis estadístico independiente para cada factor de riesgo sólo el compromiso de epidídimo fue significativo como predictor de metástatsis (p = 0,04) (Tabla IX).
Discusión
En el Hospital Clínico Universidad de Chile la LRR en CTCGNS estadio I es una intervención quirúrgica que no presenta mortalidad, no requiere de transfusiones sanguíneas y que presenta un bajo nivel de complicaciones. Si se considera complicación mayor aquella que prolonga el tiempo de hospitalización o requiere tratamiento adicional significativo Donohue y cols. las reportan en 2 de 95 pacientes (2,1%) sometidos a LR en estadio I (26) y Baniel y cols. en 25 de 416 pacientes (6%) sometidos a LRR unilateral, siendo en este último estudio la infección de la herida operatoria la complicación mas frecuente. (27). Pizzocaro y cols. reportan 2 complicaciones mayores en 61 LRR unilaterales (3,3%) correspondientes a un caso de necrosis ureteral isquémica y un caso de obstrucción intestinal tardía que requirieron de nueva intervención quirúrgica (6). Por otra parte Mc Leod y cols. en 264 pacientes en estadio patológico I informan 11 casos de lesión intraoperatoria de grandes vasos o de víscera (4%) (9). Estos resultados no difieren mayormente con el 5,6% de complicaciones mayores de nuestro estudio, las cuales se presentaron en forma tardía y requirieron de hospitalización sin reintervención quirúrgica.
La estadificación retroperitoneal sigue siendo un problema en los CTCGNS, especialmente en el caso de ganglios comprometidos de tamaño normal. Nuestro estudio muestra que 4 de 36 pacientes con CTCGNS en estadio clínico I presentan LRR positiva (11%), lo que sumado a los dos casos de recaída retroperitoneal (2/25, 8%) suman un máximo total posible de 19% de falsos negativos de la TC de abdomen y pelvis como método de estadificación retroperitoneal. Diferentes estudios en que también se utiliza la TC para estadificarr el retroperitoneo describen entre un 23 y un 44% de ganglios con células tumorales en pacientes en esta misma etapa clínica (5,7, 28), los cuales en al menos la mitad de los casos presentan tamaño superior a los 2 cm de diámetro (5, 7). Leibovitch y cols. usando 3 mm como nivel de corte de ganglios patológicos logra cerca de un 91% de sensibilidad en el diagnóstico de ganglios comprometidos, sin embargo la tasa de falsos positivos se acerca al 50% (29). Por otro lado la resonancia nuclear magnética no supera a la TC en la estadificación de linfadenopatías retroperitoneales (30).
Un estudio prospectivo, aleatorio y multicéntrico de Williams y cols. en que pacientes con cáncer testicular estadio II patológica fueron asignados a quimioterapia adyuvante inmediata o a observación demostró un 6% de recaída en el grupo de quimioterapia y un 49% de recaída en el grupo sometido a observación, sin diferencia estadística según el grado de compromiso linfático y sin diferencia final en la tasa de curación (12). Sin embargo Richie y cols. informa sólo 3 recaídas en 39 pacientes (8%) sometidos a observación después de LR cuya biopsia evidenció menos de 6 ganglios comprometidos de menos de de 2 cm de diámetro y sin extensión tumoral mas allá de la cápsula del ganglio, por lo que plantea que la quimioterapia en este grupo de pacientes debe reservarse sólo para la recaída (13). En nuestro estudio todos los pacientes con ganglios comprometidos fueron sometidos a dos ciclos de quimioterapia complementaria; dos de ellos presentaron ganglios visiblemente comprometidos y no se extendió los límites de la disección retroperitoneal.
En la Tabla X se presentan dos grandes estudios de pacientes con CTCGNS estadio clínico I sometidos a observación que muestran que entre un 86 y 89% de las recaídas se presentan a los 18 meses de seguimiento (31, 32). En nuestros 25 pacientes con LRR negativa y este seguimiento mínimo se presentaron dos recaídas retroperitoneales (8%) en pacientes con tumor testicular derecho, una dentro y otra fuera de los límites de la disección. Aquella fuera de los límites de disección se presentó en ubicación medial a los vasos iliacos externos derechos, lo cual es teóricamente muy infrecuente (16). Esta frecuencia de recaídas retroperitoneales contrasta con la de otros estudios donde la mayoría de las recaídas ocurren fuera del abdomen, con recaídas retroperitoneales entre el 0 y el 2,65% de los pacientes con LR negativa (Tabla XI) (6, 8, 9, 20).
Lo anterior se explicaría en parte por el tamaño y el tiempo de seguimiento de nuestra serie y nos obligan a ser mas meticulosos en los límites de la disección retroperitoneal en aquellos pacientes cuya biopsia testicular muestre factores de riesgo. El bajo porcentaje de compromiso retroperitoneal que informamos en este estudio, incluyendo las linfadenectomías positivas (11%) y las recidivas retroperitoneales (8%), difiere del 27% de recaídas en las grandes series de observación (31, 32), lo cual en parte podría ser explicado nuevamente por diferencias en el tiempo de seguimiento de los pacientes, por diferencias en los factores de riesgo de metástasis en la biopsia testicular, como también por falsos negativos de la histología retroperitoneal. Este último posible factor no debería incidir en el control oncológico de los pacientes ya que se trataría de casos de compromiso linfático microscópico en los cuales la LRR cumple un rol terapéutico (13).
En pacientes con CTCGNS estadio clínico I sometidos a protocolos de observación se han descrito como factores histopatológicos independientes de riesgo de recaída la presencia de histología indiferenciada (31, 32, 33), la invasión linfática (31, 33), la invasión venosa y la ausencia de elementos del saco vitelino (31, 32). En un análisis independiente nuestro estudio muestra a la invasión de epidídimo como único factor estadísticamente significativo de riesgo de metástasis. El alto porcentaje de carcinoma embrionario de nuestros pacientes no permitió utilizar esta variable como factor de riesgo. Sin embargo el tamaño del grupo estudiado y el bajo número de casos positivos (LRR positiva o recaída) en nuestro estudio constituye una limitante importante que debe tenerse en cuenta.
Otro factor a considerar en los estudios de cáncer testicular es el problema en el seguimiento de los pacientes. En nuestros casos de CTCGNS estadio clínico I esto se evidencia por el número de pacientes que nunca fueron controlados después de la LRR (8%), por el menor tiempo real de seguimiento de acuerdo al periodo de estudio y por el gran tamaño de las masas retroperitoneales al momento de las recaídas.
Conclusiones
Finalmente planteamos que aquellos pacientes con CTCGNS estadio clínico I sin factores histológicos de riesgo de metástasis en la biopsia testicular y que fueran confiables en la adherencia a las indicaciones médicas, podrían ser sometidos a protocolos de observación, con lo que en nuestro estudio sólo uno de 18 casos (5,5%) habría presentado recaída. Los pacientes con cualquier factor histológico de riesgo de metástasis podrían ser sometidos a LRR siendo muy estrictos con los límites disección, con lo que en nuestro estudio habríamos presentado 4 de 19 LRR positivas (21%).
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
1. EIHNHORN, L.H.; RICHIE, J.P.; SHIPLEY, W.U.: Cancer of the testis. De Vita VT, Hellman S, Rosenburg SA, editors. Cancer: principle and practice of oncology. 4th edition. Philadelphia: J.B. Lippincott 1126-51. 1993. [ Links ]
2. ANUARIO DE ESTADÍSTICAS VITALES 2001. Instituto Nacional de Estadísticas, Servicio Registro Civil e Identificación, Ministerio de Salud. Chile 2003. [ Links ]
3. STERNBERG, C.N.: The management of stage I testis cancer. Urol. Clin. North Am., 25: 435, 1998. [ Links ]
4. DONOHUE, J.P.: Management of low clinical stage testis cancer: editorial comment. Urol. Clin. North Am., 14: 729, 1987. [ Links ]
5. RICHIE, J.P.; GARNICK, M.B.; FINBERG, H.: Computerized tomography: how accurate for abdominal staging of testis tumors?. J. Urol., 127: 715, 1982. [ Links ]
*6. PIZZOCARO, G.; SALVIONI, R.; ZANONI, F.: Unilateral Lymphadenectomy in intraoperative stage I nonseminomatous germinal testis cancer. J. Urol., 134: 485, 1985. [ Links ]
*7. SAMUELSSON, L.; FORSBERG, L.; OLSSON, A.: Accuracy of radiological staging procedures in nonseminomatous testis cancer compared with findings from surgical exploration and histopathological studies of extirpated tissue. Brit. J. Rad., 59: 131, 1986. [ Links ]
8. KLEPP, O.; OLSSON, A.M.; HENRIKSON, H. y cols.: Prognostic factors in clinical stage I nonseminomatous germ cell tumors of the testis: multivariate analysis of a prospective study. J. Clin. Oncol., 8: 509, 1990. [ Links ]
*9. McLEOD, D.G.; WEISS, R.B.; STABLEIN, D.M. y cols.: Staging relationships and outcome in early stage testicular cancer: a report from the testicular cancer intergroup study. J. Urol., 145: 1178, 1991. [ Links ]
**10. DONOHUE, J.P.; THORNHILL, J.A.; FOSTER, R.S.: Primary retroperitoneal lymph node dissection in clinical stage A non-seminomatous germ cell testis cancer. Review of the Indiana University experience 1965-1989. Br. J. Urol., 71: 326, 1993. [ Links ]
*11. ALBERS, P.; SIENER, R.; KLIESCH, S.: Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the german testicular cancer study group trial. J. Clin. Oncol., 21: 1505, 2003. [ Links ]
**12. WILLIAMS, S.D.; STABLEIN, D.M.; EINHORN, L.H. y cols.: Immediate adjuvant chemotherapy versus observation with treatment at relapse in pathological stage II testicular cancer. N. Engl. J. Med., 317: 1433, 1987. [ Links ]
**13. RICHIE, J.P.; KANTOFF, P.W.: Is adjuvant chemotherapy necessary for patients with stage B1 testicual cancer?. J. Clin. Oncol., 9: 1393, 1991. [ Links ]
*14. NARAYAN, P.; LANG, P.; FRALEY, E.: Ejaculation and fertility after extended retroperitoneal lymph node dissection for testicular cancer. World J. Urol., 127: 685, 1982. [ Links ]
15. RAY, B.; HAJDU, S.I.; WHITMORE, W.F.: Distribution of retroperitoneal lymph node metastases in testicular germinal tumors. Cancer, 33: 340, 1974. [ Links ]
16. DONOHUE, J.P.; ZACHARY, J.M.; MAYNARD, B.R.: Distribution of nodal metastases in nonseminomatous testis cancer. J. Urol., 128: 315, 1982. [ Links ]
*17. FOSSA, S.D.; KLEPP, O.; OUS, S.: Unilateral retroperitoneal lymph node dissection in patients with non-seminomatous testicular tumor in clinical stage I. Eur. Urol., 10: 17, 1984. [ Links ]
18. RICHIE, J.P.: Clinical stage I testicular cancer: the role of modified retroperitoneal lymphadenectomy. J. Urol., 144: 1160, 1990. [ Links ]
19. JEWETT, M.A.; KONG, Y.S.; GOLDBERG, S.D.; Retroperitoneal lymphadenectomy for testis tumor with nerve sparing for ejaculation. J. Urol., 139: 1220, 1988. [ Links ]
20. DONOHUE, J.P.; FOSTER, R.S.; ROWLAND, R.G.: Nerve-sparing retroperitoneal lymphadenectomy with preservation of ejaculation. J. Urol., 144: 287, 1990. [ Links ]
*21. RUKSTALIS, D.B.; CHODAK, G.W.: Laparoscopic retroperitoneal lymph node dissection in a patient with stage I testicular carcinoma. J. Urol., 148: 1907, 1992. [ Links ]
22. RASSWEILER, J.J.; SEEMANN, O.; HENKEL, T.O.: Laparoscopic retroperitoneal lymph node dissection for nonseminomatous germ cell tumors: indicationa and limitations. J. Urol., 156: 1108, 1996. [ Links ]
23. JANETSCHEK, G.; HOBISCH, A.; PESCHEL, R.: Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous testicular carcinoma: long-term outcome. J. Urol., 163: 1793, 2000. [ Links ]
24. SOBIN, D.H.; WITTEKING, C.H.: EDS, TNM classification of malignant tumours. 6 th. edition. New York: Wiley-Liss 2002. [ Links ]
25. MOSTOFI, F.K.; SOBIN, L.H.: Histological typing of testis tumours. International histological classification of tumours, Nº16. Geneva, Switzerland, World Health Organization, 1, 1977. [ Links ]
26. DONOHUE, J.P.; ROWLAND, R.G.: Complications of retroperitoneal lymph node dissection. J. Urol., 125: 338, 1981. [ Links ]
27. BANIEL, J.; FOSTER, R.S.; ROWLAND, R.G. y cols.: Complications of primary retroperitoneal lymph node dissection. J. Urol., 152: 424, 1994. [ Links ]
28. STROHMEYER, T.; GEISER, M.; ACKERMANN, R.: Value of computed tomography in the staging of testicular tumors. Urol. Int., 43: 198, 1988. [ Links ]
29. LEIBOVITCH, T.; FOSTER, R.S.; KOPECKY, K.K. y cols.: Improved accuracy of computerized tomography based clinical staging in low stage nonseminomatous germ cell cancer using size criteria of retroperitoneal lymph. J. Urol., 154: 1759, 1995. [ Links ]
30. ELLIS, J.H.; BIES, J.R.; KOPECKY, K.K. y cols.: Comparison of NMR and CT imaging in the evaluation of metastatic retroperitoneal lymphadenopathy from testicular carcinoma. J. Comput Assist Tomogr., 8: 709, 1984. [ Links ]
31. FREEDMAN, L.S.; PARKINSON, M.C.; JONES, W.G.: Histopathology in the prediction of relapse of patients with stage I testicular teratoma treated by orchidectomy alone. Lancet, 2: 294, 1987. [ Links ]
*32. READ, G.; STENNING, S.P.; CULLEN, M.H.: Medical research council study of surveillance for stage I testicular teratoma. J. Clin. Oncol., 10: 1762, 1992. [ Links ]
**33. HOSKIN, P.; DILLY, S.; EASTON, D.: Prognostic factors in stage I non-seminomatuos germ cell testicular tumors managed by orchiectomy and surveillance: implications for adjuvant chemotherapy. J. Clin. Oncol., 4: 1031, 1986. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan Pablo Valdevenito Sepúlveda
Jefe de Clínica Servicio de Urología
Hospital Clínico Universidad de Chile
Rodrigo de Triana 4333 Depto 72
Las Condes. Santiago. (Chile)
jpvaldevenito@redclinicauchile.cl