Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.60 no.4 may. 2007
Cirugía renal robótica: pieloplastia.
Robotic renal surgery: pyeloplasty
José Gregorio Pereira Arias, Mikel Gamarra Quintanilla, José Antonio Gallego Sánchez, Isabel Camargo Ibergaray, Ander Astobieta Odriozola y Gaspar Ibarluzea González.
Urología Clínica. Clínica Virgen Blanca. Bilbao. Vizcaya. España.
Dirección para correspondencia
RESUMEN
El tratamiento de la estenosis de la unión pieloureteral nos ofrece un boceto exquisito de la evolución paralela entre la disponibilidad tecnológica y los cambios acontecidos en el proceder quirúrgico. Desde la pieloplastia abierta de Anderson-Hynes, pasando por la endopielotomía percutánea o retrógrada con distintos dispositivos; hasta llegar al abordaje laparoscópico, la tecnología y el ingenio humano han encontrado en este proceder reconstructivo un interesante escenario de desarrollo. La cirugía robótica se encuentra en su adolescencia y comienza a definir su papel en la cirugía urológica. Existen procedimientos asentados como la prostatectomía radical, resta por definir que tipo de intervenciones se van a beneficiar de la tecnología robótica, por ello los resultados están en continua evaluación. El avance imparable de la tecnología informática garantiza los futuros logros de la tecnología robótica. El objetivo es conseguir que el cirujano pueda realizar procedimientos quirúrgicos difíciles con un nivel de precisión y unos resultados clínicos difícilmente alcanzables con los métodos convencionales. Se analizan aspectos técnicos, resultados y estudios comparativos de la pieloplastia robótica en la literatura. La cirugía robótica ha demostrado su utilidad para realizar con buenos resultados la técnica de la pieloplastia en estenosis primarias y secundarias, en niños y adultos y en diferentes etiologías. La robótica permite disminuir las dificultades de la sutura intracorpórea y la curva de aprendizaje para cirujanos no habituados a la laparoscopia. No obstante, aunque la experiencia clínica inicial con la pieloplastia robótica es favorable, se hace necesaria una evaluación continua de los resultados para determinar si este proceder es tan eficaz a largo plazo como lo son la pieloplastia abierta y laparoscópica.
Palabras clave: Pieloplastia robot-asistida. Pieloplastia laparoscópica.
SUMMARY
The treatment of ureteropyelic junction (UPJ) obstruction offers a perfect sketch of the parallel evolution of the availability of technology and changes in surgical proceedings. From the open Anderson-Hynes pyeloplasty, passing through percutaneous or retrograde endopyelothomy with various instruments, to the laparoscopic approach, technology and human talent have found a field for development in this reconstructive procedure. Robotic surgery is young and starts to define its role in urology surgery. There are established procedures such as radical prostatectomy; it remains to be established what operations will benefit from the robotic technology, so results are under continuous evaluation. The non stopping advance of computer technology guarantees future achievements of robotic technology. The objective is to achieve that surgeons could perform difficult surgical procedures with a level of accuracy and clinical results that would be difficult to achieve with conventional methods. We analyze the technical features, results and comparative studies of the robotic pyeloplasty from the medical literature. Robotic surgery has demonstrated its usefulness in the performance of pyeloplasties, with good results in primary and secondary UPJ stenosis in children and adults, in various aetiologies. Robotics enables to diminish the difficulties of intracorporeal suture and the learning curve for surgeons without laparoscopic experience. Nevertheless, although initial clinical experience with robotic pyeloplasty is favourable, continuous evaluation of results is necessary to determine if the surgical procedure is as effective in the long-term as laparoscopic and open pyeloplasty.
Key words: Robot-assisted pyeloplasty. Laparoscopic pyeloplasty.
Introducción
La estenosis de la unión ureteropiélica (UPU) se caracteriza por una alteración funcional significativa en el tránsito de la orina debido a una obstrucción extrínseca o intrínseca del área de unión del uréter con la pelvis renal. En la mayoría de las ocasiones su origen es congénito; no siendo infrecuente el concurso de entidades adquiridas como causa de obstrucción y sintomatología. La estenosis de la UPU, no representando una patología extremadamente frecuente, si nos ofrece un vivo ejemplo de la evolución que ha experimentado nuestra disciplina con el devenir del tiempo bajo los auspicios de los avances tecnológicos.
El primer procedimiento reconstructivo de la pelvis renal que implicaba la sección del uréter y su anastomosis se realizó con éxito por primera vez en 1892 (1). Desde entonces, se han ido desarrollando distintas alternativas técnicas de cirugía abierta, entre las que destaca de forma más relevante la pieloplastia de Anderson-Hynes (1949); Foley (1937) y la de Scardino-Prince (1953).
En el momento en el que la cirugía abierta adquiere su máximo esplendor; se comienza a desarrollar el acceso percutáneo de la vía urinaria alta. Este acceso perseguía inicialmente la resolución de la patología litiásica. No fue hasta 1941, cuando Rupel y Brown documentaron el primer caso exitoso de extracción litiásica renal percutánea mediante el empleo de un cistoscopio y a través de un tracto maduro de nefrostomía clásica (2). Esta técnica no gozó de clara aceptación entre el colectivo urológico, y una revisión de la literatura entre 1941 y 1980 refería sólo 11 casos practicados, y en todos ellos mediante acceso percutáneo por trayecto maduro. A pesar de que la primera extracción endoscópica percutánea de una litiasis renal es la descrita por Rupel y Brown, se reconoce a Fernström y Johansson como los primeros en realizarla de manera programada en 1976 en el Hospital Karolinska de Estocolmo (3). Aprovechando el desarrollo de los endoscopios y con el abordaje percutáneo establecido, el grupo del Dr. Wickham comunica la experiencia en pielolisis endoscópica como alternativa a la pieloplastia desmembrada en el tratamiento de la estenosis de la unión pieloureteral (4). Los primeros informes sobre endopielotomías aparecieron a mediados de los ochenta (5). A posteriori se planteó el abordaje retrógrado mediante control fluoroscópico y endoscópico de la endopielotomía. No obstante, a pesar de las claras ventajas de un proceder mínimamente invasivo; el abordaje endoscópico anterógrado o retrógrado de la estenosis de la UPU no ofrecía resultados comparados a los reflejados por la pieloplastia abierta.
La irrupción de la cirugía laparoscópica renal, con la realización de las primeras nefrectomías y adrenalectomías por Clayman, Rassweiler y Schuessler en 1992, ha habilitado la oportunidad de extender este proceder al tratamiento de la estenosis de la UPU. Así, desde la primera descripción por Schuessler y cols en 1993 de la técnica de la pieloplastia laparoscopica, este abordaje se ha convertido en un procedimiento de primera elección en el tratamiento de la estenosis de la UPU en la mayoría de los centros (6). En comparación con otros tratamientos, el abordaje laparoscópico ha ofrecido las ventajas de la cirugía mínimamente invasiva endoscópìca y la tasa de buenos resultados de la pieloplastia abierta (96-100%). No obstante, las dificultades técnicas de la sutura intracorpórea han limitado su aplicación clínica generalizada.
La incorporación de los sistemas robóticos en la cirugía urológica por Binder, Vallancien y cols. en el 2000; y su posterior desarrollo por Menon y cols principalmente en la prostatectomía radical; ha permitido simplificar la sutura intracorpórea y el incremento en la posibilidad de aplicación de técnicas quirúrgicas avanzadas como la pieloplastia laparoscópica. Los primeros estudios experimentales en animal sobre pieloplastia robótica fueron efectuados por Sung y cols. en 1999 y Guillonneau, B. y Hubert, J. en 2003, quedando patente la corta curva de aprendizaje, la reducción de la fatiga para el cirujano y las ventajas en procedimientos reconstructivos como la pieloplastia (7, 8, 9).
Nuestra experiencia en cirugía robótica comienza su singladura en enero de 2006, siendo el segundo centro después de la Fundación Puigvert en iniciarse en el Estado. Nuestra actividad es discreta y se ha centrado en la prostatectomía radical, realizándose en este primer año: 54 prostatectomías radicales, 2 nefroureterectomías, 1 nefrectomía radical y 1 adrenalectomía por feocromocitoma. En este artículo se describen aspectos técnicos y resultados iniciales de la pieloplastia laparoscópica robot-asistida reflejados en la literatura.
Indicaciones y contraindicaciones
Las indicaciones de la pieloplastia laparoscópica robot-asistida (PRA) son básicamente las mismas que la pieloplastia laparoscópica: obstrucción sintomática, alteraciones de la función renal y desarrollo de cálculos o infecciones recurrentes. El objetivo será reestablecer un drenaje no obstructivo en la unión ureteropiélica mediante un proceder reconstructivo. La PRA se puede efectuar con la misma diligencia sobre estenosis primarias o secundarias de la UPU. De igual modo, se pueden abordar las diferentes etiologías de la estenosis de la UPU, obstrucciones extrínsecas o intrínsecas, inserciones ureterales altas, pelvis redundantes o cruce de vasos polares. De hecho los cruces vasculares, presentes en el 33%-76% de las ocasiones, son perfectamente abordados mediante cirugía robot-asistida gracias a la visión tridimensional, la magnificación y los 7 grados de libertad del instrumental que habilitan una exquisita disección alrededor de estas delicadas estructuras vasculares.
Entre las contraindicaciones para la PRA destacan la insuficiencia renal con deterioro severo e irreversible del parénquima renal, el fracaso previo de una pieloplastia abierta y la presencia de una pelvis intrarrenal pequeña. En este último escenario la escasa movilidad de la pelvis y la necesidad de una disección intrahiliar laboriosa, condicionan un proceder reconstructivo complejo siendo más recomendable el abordaje endoscópico anterógrado o retrógrado. Una pieloplastia abierta previa fallida obligaría a realizar una disección exquisita de las adherencias en la zona de sutura, si bien no constituye una contraindicación absoluta para la ejecución de una PRA, si pueden disminuir las posibilidades de éxito. La cirugía abdominal previa puede condicionar un mayor tiempo operatorio pero no es una contraindicación absoluta para el abordaje laparoscópico.
Antes de la intervención, se establece el diagnóstico según la sintomatología y los estudios radiológicos. Las pruebas diagnósticas convencionales son la urografía intravenosa y el renograma nuclear diurético, en caso de duda del estado de la función renal y el comportamiento obstructivo de la estenosis de la UPU. En situaciones seleccionadas, puede ser de utilidad la identificación de cruces vasculares (arteria segmentaria hiliar anteroinferior) mediante la realización de TAC (10), ecografía-doppler (11) o angioresonancia nuclear magnética (12). No obstante, una vez planificado un abordaje laparoscópico no es imprescindible la búsqueda de vasos polares, si bien su conocimiento previo a la intervención nos permite un recorrido anatómico más guiado. El interés en conocer los cruces vasculares de la UPU tiene más utilidad ante un abordaje endoscópico anterógrado o retrógrado, con el fin de evitar su lesión en la incisión, así como la persistencia de la causa extrínseca obstructiva de no conocerlos. No obstante, la posibilidad de integrar esta información anatómica en los sistemas robóticos actuales, hace atractiva la idea de realizar estos estudios de imagen (TAC y RNM) para poder planificar y guiar la intervención quirúrgica. La fusión de la tecnología virtual y la robótica permitirá practicar la intervención en un contexto donde se incorporan las características anatómicas de un paciente y patología concretos.
Aspectos técnicos
- Equipamiento
- Preparación y colocación del paciente
- Abordaje y colocación de los puertos de acceso
- Exposición de uréter y pelvis renal
- Incisión y anastomosis
Mediante el sistema robótico da Vinci®, es posible realizar todos los pasos de la pieloplastia tradicional desmembrada de Anderson-Hynes, de la plastia en YV y de la plastia no desmembrada de Fenger (13). Es oportuno informar al paciente de que el procedimiento planificado puede terminar, por la presencia de complicaciones, en un procedimiento laparoscópico convencional o en cirugía abierta. La dependencia de la tecnología nos obliga a contemplar la posibilidad excepcional de fallo del sistema robótico y condicionar la reconversión de la intervención quirúrgica, por ello es adecuado informar oportunamente al paciente.
Equipamiento
Para la pieloplastia robótica, se pueden utilizan diferentes instrumentos robóticos intercambiables: Pinza disectora bipolar de Maryland, tijera curva monopolar o Erina (hook) y portaagujas. De igual modo, es oportuno disponer de material de laparoscopia convencional como: cánula de aspiración-irrigación, pinzas disectoras y de agarre, tijeras de diseño roticular y todo lo oportuno para un abordaje convencional laparoscópico de ser preciso. En los procedimientos robóticos pélvicos (prostatectomía y cistectomía radical), es recomendable el empleo de instrumental largo (aspirador y tijeras), con la finalidad de que el ayudante no presente problemas en su labor, dado que los trócares suelen ocupar una posición alta en el abdomen (por detrás de los trócares de trabajo del robot). No obstante, en los procedimientos renales, como el que nos ocupa, el instrumental adicional no difiere del empleado en los procedimientos laparoscópicos habituales (Figura 1).
La PRA se suele realizar vía transperitoneal y mediante el empleo del sistema da Vinci® de tres brazos: uno para la cámara de 0º ó 30º de óptica, sobre un trócar estándar de 12 mm (Ethicon) y dos puertos metálicos de 8 mm para los brazos robóticos de trabajo. Es aconsejable un cuarto puerto auxiliar de 12 mm para el ayudante. Por este puerto se puede introducir la cánula de irrigación, agujas y diferentes instrumentos para facilitar la retracción y disección de los tejidos. De igual modo, se puede reemplazar por un trocar de 5 mm, si bien esto limita la operatividad para la introducción y extracción de agujas. Se emplean habitualmente suturas de 4-0 de monocryl o Polysorb para la reconstrucción ureteropiélica.
Preparación y colocación del paciente
Algunos autores aconsejan una preparación intestinal el día previo a la intervención quirúrgica, así como una adecuada profilaxis antitrombótica y antibiótica (habitualmente monodosis). Es imperativo una adecuada esterilización de la orina previa a cualquier instrumentación quirúrgica, por ello los pacientes con infección urinaria activa y/o litiasis asociada a la estenosis ureteropiélica, deben recibir un tratamiento antibiótico apropiado. Por regla general, los pacientes candidatos a un PRA son personas jóvenes y no suelen presentar excesiva patología asociada, por lo que sobrellevan bien los procedimientos laparoscópicos.
Una vez inducida la anestesia general y para el abordaje transperitoneal, el paciente debe ser colocado en posición de decúbito lateral modificado con una inclinación de 45-60º al igual que en otros procedimientos laparoscópicos renales. Para una adecuada colocación, se aplica un soporte renal y una conveniente flexión de la mesa quirúrgica con el objetivo de incrementar el espacio entre la parrilla costal y la cresta ilíaca. Es importante comprobar el correcto almohadillado de todos los puntos de decúbito así como la adecuada sujeción del paciente a la mesa de quirófano. Antes de la preparación y sujeción es oportuno y necesario colocar una sonda nasogástrica y una sonda de Foley.
En la pieloplastia laparoscópica existen varias alternativas respecto a la conveniencia o no de colocar un stent ureteral previo a la intervención quirúrgica. Así y aunque no se trata de una práctica habitual; algunos autores recomienda la colocación de un catéter ureteral 1 semana antes de la cirugía para permitir una dilatación pasiva de la vía urinaria y facilitar la posterior reconstrucción (14). No obstante, la mayoría de autores opta por una tutorización ureteral perioperatoria o intraoperatoria con la intención de evitar una maniobra adicional al procedimiento. De modo y manera que se puede optar por colocar un catéter ureteral de punta abierta o un catéter doble J distal a la estenosis previo a la colocación del paciente en decúbito lateral (15-17). Esta maniobra incrementa el tiempo quirúrgico al precisar primero una posición de litotomía y luego la recolocación en decúbito lateral. No obstante, facilita la identificación del uréter durante la disección y simplifica la cateterización retrograda una vez nos encontremos realizando la reconstrucción laparoscópica de la unión ureteropiélica. La ubicación del catéter distal a la estenosis permitiría reducir el riesgo de sección del mismo durante la incisión de la UPU y mantener la pelvis distendida lo que facilita su disección (18).
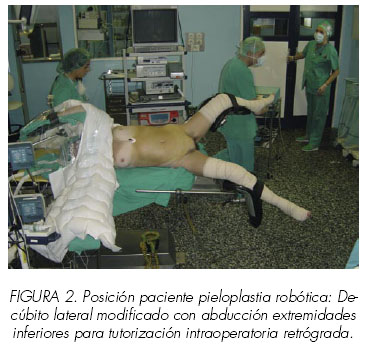
Otra interesante alternativa, a la que se suma nuestro grupo, sería la tutorización intraoperatoria. Algunos grupos, realizan la cateterización de manera anterógrada una vez abierta la vía urinaria. Con el lumen ureteral expuesto y a través de un abbocat o de una cánula de succión situada a nivel subcostal, se introduce una guía en el uréter de manera anterógrada sobre la que a posteriori se posiciona un catéter doble J. El procedimiento tiene cierta dificultad y complejidad técnica, pero evitaría la realización de una cistoscopia y facilitaría la disección de la pelvis distendida sin cateterización previa. No obstante, siempre existe la duda de la adecuada posición del extremo distal en el interior de la vejiga (19, 20). Una variante constituye la colocación el paciente en una posición de decúbito lateral modificada con abducción de las extremidades inferiores para permitir una cistoscopia y la posterior cateterización retrógrada intraoperatoria. Esta posición, muy empleada en nuestro centro para el abordaje integral de la vía urinaria durante los procedimientos endourológicos (cirugía renoureteral percutánea) permitiría tener un control endoscópico del extremo vesical del catéter ureteral y un control laparoscópico del extremo piélico al mismo tiempo (Figura 2). La única limitación, sería la incapacidad anatómica por artropatía degenerativa o malformación musculoesquelética del paciente para la abducción de las extremidades inferiores. No obstante, en general se trata de pacientes jóvenes que toleran bien esta disposición con el adecuado almohadillado de los puntos de decúbito. Una alternativa elegante, que no precisa de excesiva modificación postural sería el empleo de un cistosnefroscopio flexible para tutorizar el uréter una vez sea identificada y disecada la UPU por vía laparoscópica. No obstante, el cateterismo retrógrado ureteral en posición forzada con instrumental endoscópico flexible entraña una discreta complejidad técnica y la necesidad de disponer de instrumental para éste menester.
Abordaje y colocación de los puertos de acceso laparoscópico
Una vez, posicionado el paciente de manera oportuna, se procede a la preparación cutánea convencional desde xifoides hasta sínfisis del pubis. La localización de los puertos de acceso laparoscópico para los procedimientos renales resulta más compleja que para los procedimientos pélvicos. La ubicación de los puertos debe contemplar la localización de interés, el grado de hidronefrosis y las características físicas individuales que puedan causar desplazamiento del riñón. Una vez establecido el neumoperitoneo con aguja de Veress se colocaran los 4 puertos de acceso. Es recomendable que el anestesista corrija los déficits hídricos previo a la creación del neumoperitoneo para prevenir los cambios hemodinámicos que pueden verse aumentados por la depleción de volumen. Es igualmente recomendable el empleo de sistemas de calentamiento corporal. Los brazos de trabajo del robot se introducen a través de los puertos metálicos reutilizables de 8 mm y la cámara a través de un trocar laparoscópico estándar de 12 mm (Ethicon). El ayudante empleará los instrumentos laparoscópicos convencionales a través de un puerto de 5 o 10-12 mm (preferible de 10-12 mm) (21).
Se puede realizar la pieloplastia robótica por vía transperitoneal o retroperitoneal. El abordaje más referido en la literatura y más habitual es el primero. En este abordaje transperitoneal, el puerto de 12 mm para la cámara se puede situar en el ombligo o en la línea medioclavicular, por fuera del músculo recto y a nivel del ombligo. En pacientes delgados y en niños, la ubicación umbilical es más adecuada. El trócar de la cámara es el punto a partir del cual puede variar la localización de los puertos de acceso para los brazos de trabajo del robot. Así, los trócares de 8 mm se colocan bajo visualización directa en posiciones equidistantes (8-10 cm) respecto al puerto de la cámara y adoptando entre sí una configuración triangular. La colocación demasiado cercana a la cámara puede condicionar interferencias por colisión de los brazos con la misma. El puerto de acceso auxiliar puede colocarse en la línea media subxifoideo para la pieloplastia derecha y a 4-5 cm por debajo del ombligo para el abordaje de la estenosis de la UPU izquierda, tal y como se muestra en el gráfico (Figura 3 y 4).
En un abordaje retroperitoneal, menos común en la pieloplastia laparoscópica robotasistida, se realiza una incisión de 1,5 cm por detrás de la punta de la 12ª costilla, atravesando la piel y alcanzando el espacio retroperitoneal. Se desarrolla este espacio mediante disección roma digital o con el laparoscopio; o bien se crea un espacio con cualquier sistema de balón globo de distensión. A continuación se sustituye por un trócar de 12 mm para la cámara. Tras inspeccionar el espacio retroperitoneal, y bajo visión directa se colocan los trócares de 8 mm para los brazos robóticos equidistantes del trocar de la cámara (8-10 cm). La disposición de los trócares puede ser variable según las necesidades del paciente. Así, la cámara se puede ubicar en la línea axilar posteriormedial, por fuera del cuadrado lumbar, equidistante de cresta iliaca y 12ª costilla; y los trócares adicionales en ángulo recto y en línea axilar media subcostal y por encima de cresta iliaca. De igual modo, la cámara se puede localizar en la línea axilar media sobre la cresta iliaca y los trócares de 8 mm en línea axilar posterior y anterior equidistantes y en ángulo recto. El trócar de 10-12 mm del ayudante puede situarse 2 cm por encima de la cresta iliaca (22, 23).
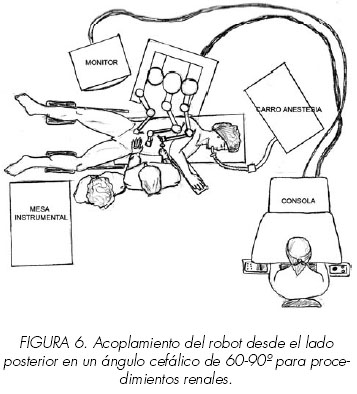
Una vez posicionados los trócares de acceso, se acopla el robot al paciente desde el lado posterior en un ángulo cefálico de 60º con respecto a la columna vertebral del paciente (Figura 5 y 6). Con el robot y sus brazos acoplados a los trócares, el ayudante tiene libertad absoluta de movimientos en la parte anterior del abdomen. En los pacientes delgados el robot se puede acoplar desde la espalda en ángulo de 90º sin que ello interfiera en su operatividad y movilidad. El brazo robótico del sistema da Vinci® tiene una longitud de 15 cm y se puede articular para conseguir una longitud máxima de trabajo de 25 cm. Así, el órgano a intervenir debe encontrarse en el perímetro quirúrgico de este radio de acción de 25 cm.
Exposición del uréter y pelvis renal
El procedimiento quirúrgico no difiere del procedimiento estándar de la pieloplastia laparoscópica convencional. En el lado derecho, se incide la línea de Toldt y se retrae medialmente la flexura hepática para identificar la fascia de Gerota; mientras que en el lado izquierdo se moviliza el cólon descendente. Se incide cuidadosamente la fascia de Gerota sobre el polo inferior del riñón en busca de la unión ureteropiélica y los vasos que atraviesan la zona. Se identifica el uréter que suele ocupar una posición más lateral y profunda que la vena gonadal. Una vez asilado se eleva suavemente para proseguir la disección cuidadosa hasta la UPU. La disección se debe limitar a los 3-4 cm de uréter lumbar para intentar preservar su vascularización al máximo. A medida que accedemos a la unión ureteropiélica debemos prestar atención a las posibles estructuras vasculares que puedan cruzar el uréter. El abordaje robótico ofrece claras ventajas de visualización tridimensional ideal ante estenosis de la UPU secundarias a cruce vascular, inserción ureteral alta o pelvis renal de gran tamaño. Para la disección de la UPU y los vasos polares, el hook (gancho) puede ser un instrumento de utilidad. En ocasiones y para facilitar la realización de la anastomosis de la UPU es útil la tracción de la pelvis renal mediante punto de sutura de 3.0 (nylon o seda) a través de la pared abdominal y fijarlo con un clamp en el exterior.
En los casos de estenosis secundaria de la UPU, la disección resultará más compleja debido a la presencia segura de fibrosis cicatricial. En estos casos, la pelvis, la UPU y el uréter proximal deben ser completamente liberados antes de la sección, puesto que la disección posterior resultaría compleja una vez se descomprima y vacíe la pelvis renal.
Incisión y anastomosis
La técnica a realizar dependerá de los hallazgos preoperatorios e intraoperatorios. Así, ante estenosis de la UPU con pelvis renal redundante, con inserción ureteral alta o presencia de vasos cruzados; la técnica a realizar sería la pieloplastia de Anderson-Hynes. En los pacientes con pelvis más pequeña se puede realizar una plastia en YV o una plastia de Fenger.
Una vez identificada la estenosis, se efectúa una incisión circunferencial de la misma con las tijeras curvas del brazo robótico. A continuación se espátula el uréter en su parte lateral evitando realizar la incisión de manera espiral. Por ello, es preciso mantener una adecuada orientación e identificar la parte lateral del uréter evitando su rotación. La longitud de la espatulación depende del calibre del uréter del paciente y de la necesidad o no de resecar parte del mismo. La longitud de espatulación suele ser de 12-15 mm, y es aconsejable espatular antes de resecar tejido para minimizar la cantidad del mismo a extirpar. Ante estenosis secundarias a cruces vasculares no suele ser necesario resecar una porción del uréter, y será suficiente realizar la anastomosis en situación anterior a los vasos. No obstante, incluso en estas situaciones se estima oportuno practicar la exéresis de la zona estenótica y remitir el espécimen a estudio histológico. La pelvis redundante se beneficiará de una resección parcial; si no es el supuesto, será preciso realizar una incisión para espatularla a nivel medial. En los casos donde se presenten litiasis renales asociadas podemos emplear el cistonefroscopio o ureteroscopio flexible y explorar la vía urinaria una vez expuesta. Se puede introducir a través de un trócar de 10 mm y realizar litofragmentación y extracción de cálculos antes de proceder a la reconstrucción (24).
Algunos autores, aconsejan la tutorización ureteral previa a la sección completa de la luz de la vía urinaria. Esta medida, facilitará el paso del catéter o de un guía de manera retrógrada o anterógrada. No obstante, la visión tridimensional de alta resolución y la libertad de movimientos del instrumental robótico simplifica las maniobras de cateterismo y anastomosis. De igual modo, se puede colocar el catéter ureteral una vez realizada la anastomosis ureteropiélica de la cara posterior. La tutorización de la vía urinaria con stent doble J puede realizarse de manera preoperatoria o intraoperatoria. El proceder común es intraoperatorio, y este puede ser retrógrado o anterógrado, tal y como se refirió en apartados anteriores. Nuestro grupo, prefiere el cateterismo intraoperatorio retrógrado en posición modificada para facilitar el abordaje cistoscópico y laparoscópico simultáneo
La reanastomosis precisa de al menos tres suturas de material reabsorbible de 4-0 de 12-15 cm de longitud. Esta medida resulta variable en función de la magnitud de la resección piélica y de la distancia de espatulación ureteral. Las suturas se introducen por el 4º brazo del ayudante. Se realiza una primera sutura intracorpórea entre el vértice del uréter espatulado y la parte más inferior de la pelvis renal. A continuación se realizan dos suturas continuas para realizar la anastomosis posterior y anterior, pudiéndose anudar entre sí una vez finalizada la sutura. El cierre del defecto piélico remanente puede precisar de alguna sutura adicional.
El procedimiento finaliza con la revisión de la hemostasia, colocación de un drenaje mixto tipo Jackson-Prat, desanclaje de los brazos robóticos, retirada de los trocares bajo visión directa y cierre de las incisiones cutáneas. La hospitalización suele ser breve, la sonda vesical se puede retirar al segundo día. El catéter ureteral se mantiene durante 6-8 semanas. A los 3 meses de control, se efectúa una urografía intravenosa o renograma diurético de comprobación.
Resultados y discusión
La cirugía robótica, también llamada cirugía de tercera generación, ofrece unas prestaciones de sumo interés para el paciente y cirujano. El paciente se beneficia de las ventajas de un abordaje laparoscópico en lo que se refiere a: corta estancia hospitalaria, menor necesidad de analgésicos y rápida recuperación y retorno a las actividades normales. Y por otro lado, el cirujano puede trabajar en una posición ergonómica, con menor fatiga y sobrecarga muscular, con una visión tridimensional, panorámica y de alta resolución; con escalonado y filtrado de los movimientos de 2:1 a 5:1 lo que elimina el temblor y con 7 grados de libertad de movimientos frente a los 4 grados del instrumental laparoscópico convencional, lo que sin duda redunda en un incremento generoso de la precisión quirúrgica. Estas ventajas se traducen en un menor curva de aprendizaje de los procedimientos laparoscópicos complejos y hacen de la cirugía robótica un excelente sistema para realizar procedimientos reconstructivos en espacios pequeños. Todos estos matices, ya comentados en otros capítulos del monográfico, encuentran una interesante aplicación en la pieloplastia laparoscópica.
El tratamiento de la estenosis de la UPU nos ofrece un boceto exquisito de la evolución paralela entre la disponibilidad tecnológica y los cambios acontecidos en el proceder quirúrgico. Desde la pieloplastia abierta de Anderson-Hynes, pasando por la endopielotomía percutánea o retrógrada con distintos dispositivos; hasta llegar al abordaje laparoscópico, la tecnología y el ingenio humano han encontrado en este proceder reconstructivo un interesante escenario de desarrollo. La pieloplastia laparoscópica agrupa las ventajas de un abordaje minimamente invasivo con los excelentes resultados de la cirugía reconstructiva abierta. El soporte de los sistemas robóticos permitiría incrementar la precisión del delicado procedimiento de sutura intracorpórea.
Los primeros ensayos de aplicar la tecnología robótica a la pieloplastia fueron efectuados por SUNG y cols en 1999 (7). En este modelo animal porcino de experimentación, se compararon los resultados de la pieloplastia laparoscópica convencional y los obtenidos con soporte robótico Zeus. El tiempo quirúrgico (94.5 min vs 115.2 min); el tiempo de anastomosis (64.3 vs 75.7 min) y el número de puntos de sutura aplicados en la anastomosis (12.5 vs 13) no evidenció diferencias significativas, aunque el procedimiento resultó factible. No obstante, el mismo grupo reportó ventajas del sistema robótico da Vinci® frente al Zeus en lo que respecta al carácter intuitivo y la operatividad en la realización de la pieloplastia en modelo porcino. De igual modo, se reflejaban menores tiempos de sutura y mayor número de puntos en las anastomosis robot-asistidas (25). Otros autores demostraron igualmente los beneficios del sistema da Vinci®® en los procedimientos laparoscópicos reconstructivos como la pieloplastia en modelo porcino, destacando la rápida curva de aprendizaje en cirujanos sin experiencia laparoscópica (8, 9). Recientemente un grupo canadiense ha demostrado la utilidad del sistema robótico Zeus en un modelo porcino de anastomosis ureteropiélica. El tiempo de anastomosis resultó de 51 minutos (39-63 min) con tiempo total de intervención de 76 minutos (57-87 min) destacando su potencial aplicación en la cirugía infantil (26).
La experiencia clínica, reflejada en la literatura, se ha desarrollado principalmente con el sistema da Vinci®. Desde que la FDA aprobó el sistema robótico da Vinci® en el año 2000, se ha aplicado a diferentes intervenciones urológicas como queda patente en este monográfico. Las primeras pieloplastias laparoscópicas robot-asistidas (PRA) fueron publicadas por Gettman y cols y realizadas entre junio del 2001 y febrero del 2002. En ésta serie de 9 pacientes el tiempo quirúrgico total fue de 138.8 minutos y un tiempo de realización de la sutura de 62.4 minutos. La pérdida hemática resultó inferior a los 50 ml y la estancia media fue de 4,7 días (27).
Durante estos 5 años (2001-2006) las series presentadas en la literatura son relativamente cortas y los resultados preliminares. Se han documentado alrededor de 350-400 casos de pielopasltia robótica en éste periodo. La mayoría de los artículos concluyen que la PRA es una alternativa a la pieloplastia laparoscópica con excelentes resultados a corto plazo y tasas de éxito objetivas. El procedimiento ha sido realizado con éxito en niños (23, 28 - 30), en estenosis secundarias (17, 28), en grupos con o sin experiencia previa laparoscópica (17, 31), con litiasis asociadas (32); y en todos ellos se ha demostrado como un procedimiento factible, preciso y con una curva de aprendizaje corta (Tabla I).
En un primer balance promediado y orientativo de la literatura evaluada, la PRA es un procedimiento que consume entorno a 3 horas y 20 minutos (199,10 minutos) con un rango entre 122 y 384 minutos. La duración de la intervención se acorta con la experiencia; así en grupos de contrastada experiencia en cirugía robótica y con series de 50 pacientes, el procedimiento se realiza en 2 horas (124 y 122 minutos respectivamente, incluyendo el tiempo de instalación y acoplamiento del robot al paciente) (21, 33). Autores con escasa o nula experiencia laparoscópica y robótica previa, arrojan tiempos quirúrgicos mayores alrededor de 271 y 324 minutos (17, 31). En este procedimiento conviene recordar la curva de aprendizaje para la instalación y acoplamiento del robot al paciente antes de iniciar la cirugía, lo que sin duda consume tiempo quirúrgico. Un apartado de sumo interés y donde la cirugía robótica ofrece ventajes es en la sutura intracorpórea. El tiempo medio para la realización de la sutura anastomótica de la unión ureteropiélica en las diferentes series revisadas, es de 40,18 minutos (16 y 115 min). Los grupos con experiencia ejecutan la sutura en 20 minutos frente a los 50-70 minutos de media de la pieloplastia laparoscópica convencional (33). De igual modo, la curva de aprendizaje para la sutura intracorpórea es más corta en la cirugía robótica (34). Otros aspectos destacados del abordaje robotasistido son: una hemorragia inferior a 60 ml (59,2 ml con rango de 10 a 100 ml), un menor consumo de analgésicos en el postoperatorio y una estancia hospitalaria media de 1,9 días (1,1 y 4,7 días).
Diferentes autores han sentido la inquietud de realizar estudios comparativos frente a otras alternativas como la cirugía abierta y la laparoscopia convencional. De modo y manera, que en un estudio que compara dos grupos de 33 pacientes de PRA frente a pieloplastia abierta se refleja que la cirugía robótica requiere 38 minutos más de tiempo quirúrgico (219 min versus 181 min); pero con menor estancia hospitalaria (2,3 días frente a 3,5 días) y menor consumo de analgésicos (29). En otro estudio de las mismas características en 8 niños, se objetiva un mayor tiempo quirúrgico (363 frente a 248 minutos) para la cirugía robótica, con menor pérdida hemática (13.1 ml frente a 53.8 ml) y estancia hospitalaria más corta (2,4 días frente a 3,3 días) (30). De estas series se desprende que las ventajas de la cirugía robótica sobre la cirugía abierta en la pieloplastia son las que aporta el abordaje laparoscópico (menor estancia, menor dolor, menor hemorragia). No obstante, son series iniciales donde el tiempo quirúrgico no es comparable a los resultados que se adquieren con la experiencia (122 min) (21, 33) y donde no se analizan las ventajas de la sutura intracorpórea y no se tiene en cuenta ni la amplia experiencia en cirugía abierta ni el nivel de experiencia laparoscópico en estos centros.
Los estudios que comparan la pieloplastia robótica frente al abordaje laparoscópico convencional reflejan tiempos quirúrgicos similares o discretamente superiores para la robótica, especialmente al comienzo. De igual modo, resaltan un menor tiempo para la sutura intracorpórea, con un volumen de hemorragia similar y una estancia hospitalaria ligeramente inferior en la pieloplastia robótica (16, 21, 23, 27, 33, 35, 36). No obstante, y como se comenta en párrafos posteriores, el balance de coste es claramente desfavorable a la cirugía robótica frente a la laparoscopia convencional. Así, autores como Gettman y cols comparan los resultados de la PRA con la pieloplastia laparoscópica convencional (PL) y obtiene ventajas en el tiempo quirúrgico (140 min vs 235 min) y en el tiempo de sutura (70 min vs 120 min); no así en la cuantía de hemorragia ni en la estancia hospitalaria, donde son equiparables (37).
Existen dos estudios comparativos entre PL y PRA de interés, donde se contrasta la experiencia inicial en ambos procedimientos. Así, Bernie y cols enfrentan su debut en la pieloplastia laparoscópica analizando dos series de 7 pacientes con ayuda robótica y sin ella. Los resultados de PL frente a PRA en tiempo quirúrgico (5,2 horas vs 5,4 horas); pérdida hemática (40 vs 60 ml) y estancia hospitalaria (3 días vs 2,5 días) fueron similares, si bien refieren dos fístulas urinarias en el grupo de PL resueltas de manera conservadora (31). En otro artículo, se comparan los dos procedimientos, sin experiencia previa, en 14 pacientes (PL) y 31 pacientes (PRA). El tiempo quirúrgico de la PL fue de 299 minutos frente a los 271 minutos de la PRA y la estancia media de 2 días en ambos grupos (17). Ambos estudios, concluyen que los parámetros operatorios de la PL y PRA son similares durante la curva de aprendizaje de ambas técnicas.
La experiencia documentada en PRA hace referencia a series cortas pero con un denominador común: la tasa de buenos resultados comparable con los procedimientos abiertos y laparoscópicos convencionales (85,7% a 100%) (Tabla I). De igual modo, se han documentado buenos resultados en las estenosis del a UPU secundarias por fracaso previo. En una serie de 44 pacientes, se comparaban resultados de PRA en estenosis primarias y secundarias, objetivando resultados similares en pérdidas hemáticas, complicaciones y estancia hospitalaria; aunque con un mayor tiempo quirúrgico (60 minutos más) en las estenosis secundarias (21).
La mayoría de la experiencia reflejada en la literatura se refiere a la PRA transperitoneal siguiendo la técnica, con pequeñas variaciones, descrita en apartados anteriores (15, 16, 17, 27, 28, 33, 35, 36). No obstante, algunos autores como Olsen y cols han presentado su experiencia en el abordaje extraperitoneal. En esta serie de 13 niños se realizó la PRA extraperitoneal con un tiempo quirúrgico de 173 minutos y 2 días de estancia hospitalaria. Presentaron complicaciones derivadas de la migración y oclusión de catéter ureteral en dos pacientes en probable relación a su inserción anterógrada (23).
Aunque la mayoría de las referencias en la literatura en PRA guardan relación con el sistema robótico da Vinci®, también han sido documentadas experiencias con el sistema Zeus. Al igual que en el modelo experimental animal, algunos autores han reflejado la utilidad del sistema robótico Zeus en la pieloplastia laparoscópica (26). Este sistema telequirúrgico fue aprobado por la FDA en el 2002. Autores como Luke y cols. presentan resultados de éste procedimiento en 5 pacientes con estenosis de la UPU. Este grupo aporta tiempos quirúrgicos de 225 min; tiempo de sutura de 71 minutos y pérdidas hemáticas inferiores a 100 ml; datos superponibles, aunque ligeramente superiores, a los referidos con el sistema da Vinci® en apartados anteriores (37).
De la revisión de la experiencia acumulada hasta la actualidad, se desprende que la PRA ofrece unas ventajas interesantes. Así, algunos autores refieren que la telerrobótica capacita a los urólogos sin experiencia laparoscópica para la realización de procedimientos reconstructivos complejos con una facilidad mayor y con mejores resultados que los que se pueden obtener mediante laparoscopia convencional (35). La curva de aprendizaje para la sutura intracorpórea se ha demostrado en modelos experimentales más corta con el sistema da Vinci que con la laparoscopia estándar (34). Una de las principales ventajas de la pieloplastia robotasistida es la precisión y rapidez en la realización de la anastomosis laparoscópica. No obstante, si se desarrollan los modelos de pegamentos tisulares químicos o de fibrina es probable que ésta ventaja carezca de sentido práctico. A pesar de algunos resultados preliminares en este campo, con la aparición de cálculos urinarios sobre el molde de fibrina en algunos casos; todavía la mayoría de autores prefiere las suturas convencionales (38, 39).
A pesar de las evidentes ventajas de los sistemas robóticos en la realización de la pieloplastia, esta tecnología presenta algunos inconvenientes. Aunque los resultados avalan una curva de aprendizaje más corta para la sutura intracorpórea (72,6 min vs 40,18 min), con reducción global del tiempo quirúrgico frente a la laparoscopia convencional, en general los dispositivos robóticos conllevan su propio aprendizaje y adaptación. Este aprendizaje conlleva un tiempo variable de instalación o acoplamiento del robot al paciente (trócares) que oscila entre 8 y 40 minutos (14 min). Por ello, algunos autores recomiendan aprovechar la experiencia previa en la instalación del robot en los procedimientos de prostatectomía radical robotasistida antes de aventurarse en otros procedimientos laparoscópicos urológicos. Con ello, un equipo familiarizado con la cirugía robótica minimiza el consumo de tiempo de quirófano y reduce el coste del proceso. De igual modo, la experiencia previa en laparoscopia reduce el tiempo de trocarización. Por otra parte, el cirujano y su asistente permanecen físicamente apartados haciéndose imperativo una exquisita coordinación y trabajo en equipo para garantiza un economía de movimientos. De igual modo, la robótica actual no ofrece información háptica de retroalimentación respecto a la resistencia tisular. Por ello, se hace necesario prestar más atención a la información visual que táctil.
Un inconveniente, de naturaleza técnica, para la realización de la PRA guarda relación con la necesidad de mantener una distancia mínima operativa de 7-10 cm entre los brazos robóticos y la cámara, con el fin de evitar colisiones y pérdida de operatividad. Por ello, el hábito corporal del paciente puede constituir una limitación. Así, pacientes con hábito corporal pequeño pueden reducir el espacio para la trocarización. No obstante, la PRA ha sido descrita con éxito en niños por diferentes autores sin que ello suponga una clara limitación técnica (23, 28-30).
Otra de las desventajas de la PRA y una de las limitaciones más importantes es su coste económico. La inversión inicial, el coste de mantenimiento y el empleo de instrumentos desechables hacen de la robótica un proceder atractivo pero poco rentable. Así autores como Link y cols, en un estudio comparativo entre pieloplastia laparoscópica y robótica en 10 pacientes de cada grupo, refleja pocas ventajas en el seno de un grupo de cirujanos con experiencia laparoscópica. En este estudio, la PRA suponía un coste 2,7 veces mayor. Todo ello debido a un mayor tiempo quirúrgico (19,5 minutos), incremento del consumible y la depreciación del coste del sistema robótico. Eliminándose éste último baremo, la PRA sigue superando en 1,7 veces el coste del abordaje laparoscópico convencional y sólo si se incrementase en 6,5 horas el tiempo quirúrgico de la pieloplastia laparoscópica el coste sería equivalente (40). En otro estudio del mismo grupo, concluían que la PRA sería coste-efectiva y equiparable a la laparoscopia convencional; si se pudiese reducir el tiempo de quirófano a menos de 130 minutos y se realizasen más de 500 casos al año; variables difíciles de obtener incluso en grandes centros de referencia (41). No obstante, es de esperar que la difusión de los sistemas robóticos en el mercado, el diseño de nuevos instrumentos robóticos que reduzcan el consumible, puedan disminuir el coste global de la telerrobótica. De igual modo, la oportunidad de no precisar dos urólogos (como en la pielopalstia laparoscópica convencional, salvo si se emplea el AESOP) puede abaratar el coste del proceso.
Conclusiones
La cirugía robótica se encuentra en su adolescencia y comienza a definir su papel en la cirugía urológica. Existen procedimientos asentados como la prostatectomía radical, resta por definir que tipo de intervenciones se van a beneficiar de la tecnología robótica, por ello los resultados están en continua evaluación. El avance imparable de la tecnología informática garantiza los futuros logros de la tecnología robótica. El objetivo es conseguir que el cirujano pueda realizar procedimientos quirúrgicos difíciles con un nivel de precisión y unos resultados clínicos difícilmente alcanzables con los métodos convencionales. Es probable que la cirugía robótica junto con la terapia génica y los abordajes de direccionamiento energético, formen parte del cambio de paradigma que está teniendo lugar en el tratamiento de la enfermedad, aportando mayor precisión y menor morbilidad.
La cirugía robótica ha demostrado su utilidad para realizar con buenos resultados la técnica de la pieloplastia en estenosis primarias y secundarias, en niños y adultos y en diferentes etiologías. La robótica permite disminuir las dificultades de la sutura intracorpórea y la curva de aprendizaje para cirujanos no habituados a la laparoscopia. No obstante, aunque la experiencia clínica inicial con la pieloplastia robótica es favorable, se hace necesaria una evaluación continua de los resultados para determinar si este proceder es tan eficaz a largo plazo como lo son la pieloplastia abierta y laparoscópica.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
1. KUSTER, F.: Ein Fall von Resektion des ureter. Arch Klin Chir. 44: 850; 1892. [ Links ]
2. RUPEL, E.; BROWN, R.: Nephroscopy with removal of stone following nephrostomy for obstructive calculous anuria. J Urol. 46: 177; 1941. [ Links ]
3. FERNSTROM, I.; JOHANSSON, B.: Percutaneous pyelolithotomy. A new extraction technique. Scand J Urol Nephrol. 10: 257, 1976. [ Links ]
4. RAMSAY, J.W.; MILLER, R.A.; KELLET, M.J. y cols.: Percutaneous pyelolysis: indications, complications and results. Br J Urol. 56: 586, 1984. [ Links ]
5. BADLANI, G.; ESHGHI, M.; SMITH, A.D.: Percutaneous surgery for ureteropelvic junction obstruction (endopyelotomy): technique and early results. J Urol. 135: 26-28; 1986. [ Links ]
*6. SCHUESSLER, W.W.; GRUNE, M.T.; TECUANHUEY, L.V. y cols.: Laparoscopic dismembered pyeloplasty. J Urol. 150: 1795, 1993. [ Links ]
7. SUNG, G.T.; GILL, I.S.; HSU, T.H.: Robotic-assisted laparoscopic pyeloplasty: a pilot study. Urology. 53:1099, 1999. [ Links ]
8. GUILLONEAU, B.; RIETBERGEN, J.B.; FROMONT, G. y cols.: Robotically assisted laparoscopic dismembered pyeloplasty: a chronic porcine study. Urology. 61(5): 1063, 2003. [ Links ]
9. HUBERT, J.; FEUILLU, B.; MANGIN, P. y cols.: Laparoscopic computer-assisted pyeloplasty: the results of experimental surgery in pigs. BJU Int.. 92: 437, 2003. [ Links ]
10. QUILLIN, S.P.; BRINK, J.A.; HEIKEN, J.P. y cols.: Helical (spiral) CT angiography for identification of crossing vessels at the ureteropelvic junction. AJR Am J Roentgenol. 166: 1125, 1996. [ Links ]
11. FRAUSCHER, F.; JANETSCHEK, G.; KLAUSER, A. y cols.: Laparoscopic pyeloplasty for UPJ obstruction with crossing vessels: contrast-enhanced color Doppler findings and long-term outcome. UROLOGY. 59: 500, 2002. [ Links ]
*12. PEREIRA, J.G.; IBARLUCEA, G.; CAPELASTEGUI, A.: Utilidad de la angioresonancia magnética en el diagnóstico del vaso polar en la estenosis de la unión pieloureteral. Arch Esp de Urol. 50: 983, 1997. [ Links ]
13. JANETSCHEK, G.; PESCHEL, R.; FRAUSCHER, F.: Laparoscopic pyeloplasty. Urol Clin North Am. 27: 695, 2000. [ Links ]
14. HEIDICAN, S.P.: Laparoscopic pyeloplasty. From Essential Urologic Laparoscopy: The Complete Clinical Guide p: 233-252. Edited by: S.Y. Nakada. Humana Press Inc.; Totowa, NJ, 2003. [ Links ]
15. MENDEZ-TORRES, F.; WOODS, M.; THOMAS, R.: Technical modifications for robot-assisted laparoscopic pyeloplasty. J Endourol. 19: 393, 2005. [ Links ]
16. SIDDIQ, F.M.; LEVEILLEE, R.J.; VILLICANA, P. y cols.: Computer-assisted laparoscopic pyeloplasty: University of Miami experience with the da Vinci surgical system. J. Endourol. 19: 387, 2005. [ Links ]
17. WEISE, E.S.; WINFIELD, H.N.: Robotic computer-assisted pyeloplasty versus conventional laparoscopic pyeloplasty. J Endourol. 20: 813, 2006. [ Links ]
18. NOUIRA, Y.; HORCHANI, A. How to insert a double J stent in laparoscopic retroperitoneal dismembered pyeloplasty: a new technique. Surg Laparosc Endosc Percutan Tech. 14: 306, 2004. [ Links ]
19. RODRÍGUEZ, H.: Dismembered laparoscopic pyeloplasty with antegrade placement of ureteral stent: simplificaction of the technique. Int Braz J Urol. 28: 439, 2002. [ Links ]
20. MANDHANI, A.; GOEL, S.; BHANDARI, M. Is antegrade stenting superior to retrograde stenting in laparoscopic pyeloplasty? J Urol. 171: 1440, 2004. [ Links ]
*21. PESCHEL, R.; NEURURER, R.; BARTSCH, G.; GETMAN, M.T. Robotic pyeloplasty: technique and results. Urol Clin of North Am. 31: 737, 2004. [ Links ]
**22. HEMAL, A.K.; EUN, D.; TEWARI, A. y cols.: Aspects in optimal position of port placement in pelvic and upper urinary tract surgery with the da Vinci Robotic System. Urol. Clin. North Am. 4:641, 2004. [ Links ]
*23. OLSEN, L.H.; JORGENSEN, T.M. Computer assisted pyeloplasty in children: the retroperitoneal approach. J Urol. 171: 2629, 2004 [ Links ]
24. WHELAN, J.P.; WIESENTHAL, J.D. Laparoscopic pyeloplasty with simultaneous pyelolithotomy using a flexible ureteroscope. Can J Urol. 11: 2207, 2004 [ Links ]
25. SUNG, G.T.; GILL, I.S. Robotic laparoscopic surgery: a comparison of the da Vinci and Zeus systems. Urology. 58: 893, 2001 [ Links ]
26. LORINCZ, A.; KNIGHT, C.G.; KANT, A.J. y cols.: Totally minimally invasive robot-assisted unstented pyeloplasty using the Zeus Microwrist Surgical System: an animal study. J Pediatr Surg. 40: 418, 2005 [ Links ]
*27. GETTMAN, M.T.; NEURURER, R.; BARTSCH, G. y cols.: Dismembered pyeloplasty performed using the da Vinci robotic system. Urology 60: 509, 2002. [ Links ]
*28. ATUG, F.; BURGESS, S.V.; CASTLE, E.P. y cols.: Role of robotics in the management of secondary ureteropelvic junction obstruction. Int J Clin Pract 2006. 60: 9, 2006 [ Links ]
29. LEE, R.S.; RETIK, A.B.; BORER, J.G. y cols.: Pediatric robot assisted laparoscopic dismembered pyeloplasty performed: comparison with a cohort of open surgery. J Urol. 175: 683, 2005. [ Links ]
*30. YEE. D.S.; SHANBERG, A.M.; DUEL, B.P. Initial comparison of robotic–asssisted laparoscopic versus open pyeloplasty in children. Urology. 67: 599, 2006. [ Links ]
*31. BERNIE, J.E.; VENKATESH, R; BROWN, J. Comparison of laparoscopic pyeloplasty with and without robotic assistance. JSLS. 9: 258, 2005. [ Links ]
**32. PATEL, V. Robotic-assisted laparoscopic dismembered pyeloplasty. Urology. 66: 45, 2005 [ Links ]
*33. YOHANNES, P.; ROTARIU, P.; PINTO, P. y cols.: Comparison of robotic versus laparoscopic skills: is there a difference learning curve? Urology. 60: 39, 2002. [ Links ]
*34. BENTAS, W.; WOLFRAM, M.; BRAUTIGAM, R. y cols.: Da Vinci robot assisted Anderson-Hynes dismembered pyeloplasty: technique and 1 year follow-up. World J Urol. 21:133, 2003 [ Links ]
*35. PALESE, M.A.; STIFELMAN, M.D.; MUNVER, R. y cols.: Robot-assisted laparoscopic dismembered pyeloplasty: a combined experience. J Endourol. 19: 382, 2005. [ Links ]
*36. GETTMAN, M.T.; PESCHEL, R.; NEURURER, R. y cols.: A comparison of laparoscopic pyeloplasty performed with the da Vinci robotic system versus standard laparoscopic techniques: initial clinical results. Eur Urol. 42: 453, 2002. [ Links ]
37. LUKE, P.P.; GIRVAN, A.R.; AL OMAR, M. y cols.: Laparoscopic robotic pyeloplasty using the Zeus Telesurgical System. Can J Urol. 11: 2396, 2004. [ Links ]
38. EDEN, C.G.; SULTANA, S.R.; MURRIA, K.H. y cols.: Extraperitoneal laparoscopic dismembered fibrin-glued pyeloplasty: medium-term results. Br J Urol. 80: 382, 1997. [ Links ]
39. CHIU, A.W.; LIN, C.H.; HUAN, S.K. y cols.: Creation of ureteropelvic juntion obstruction and its correction by chemical glue-assisted laparoscopic dismembered pyeloplasty. J Endourol. 17: 23, 2003. [ Links ]
*40. LINK, R.E.; BHAYANI, S.B.; KAVOUSSI, L.R. A prospective comparison of robotic and laparoscopic pyeloplasty. Ann Surg. 243: 486, 2006. [ Links ]
*41. BHAYANI, S.B.; LINK, R.E.; VARKARAKIS, J.M. y cols.: Complete da Vinci versus laparoscopic pyeloplasty: cost analysis. J Endourol. 19: 327, 2005. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Gregorio Pereira Arias
Urología Clínica S.L.
Clínica Virgen Blanca
Maestro Mendiri, 2-1ª Planta.
48006 Bilbao. Vizcaya. (España)
jpereira@urologiaclinica.biz