My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.62 n.1 Jan./Feb. 2009
Sólo indicamos la circulación extracorpórea cuando el trombo ocupa parte de la aurícula derecha y se introduce en el ventrículo derecho, con lo cual su práctica queda reducida a una proporción muy pequeña de enfermos
Ángel Escudero Barrilero
Servicio de Urología. Hospital Ramón y Cajal. Madrid. España.
Krone y cols. (J. Urol. 131. 945. 1984) decían que el trombo se extiende a la vena renal en el 33%, llega a la cava en el 5% y la aurícula el 1%. Se repiten las cifras de Skinner (1971) y de Marshall (1988): invasión de la vena renal 25 - 30%, alcanzan la cava entre el 4 - 10%, de estos entre el 10% y el 25% se extiende por encima de las suprahepáticas.
Todos nuestros esfuerzos han ido dirigidos a evitar al enfermo riesgos prescindibles, sobretodo los más serios, aplicando en cada caso la técnica más eficaz para tratar su proceso con el máximo de garantías y mínimo riesgo y muy en segundo plano, aunque factor nada despreciable cuando es el enfermo quien tiene que pagar, con el menor gasto.
Aplicando el principio al adenocarcinoma renal extendido hasta la cava hemos logrado librar a muchos pacientes de los riesgos inherentes al dúo cirugía extracorpórea-parada cardiaca-hipotermia/nefrectomía y extracción del trombo cuya asociación potencia el número y gravedad de las complicaciones propias de cada uno por separado.
La clasificación B1, B2, C1 es la menos apropiada para indicar la técnica idónea a cada caso concreto. Utilizamos la siguiente:
I. Vena renal.
II. Cava infrahepática.
III. Cava intrahepática.
IV. Entre el límite superior del hígado y la aurícula.
V. Ocupa aurícula derecha y ventrículo derecho.
Los estadios I y II, no plantean dudas: control por debajo del límite inferior del hígado, después de ligar las venas (2-3) que drenan el lóbulo caudado. Ni tampoco los estadio V, se hace imprescindible la parada cardiaca, aunque algunos se pueden librar de ellas con múltiples maniobras.
Los problemáticos: los estadios el III y IV, los veníamos resolviendo situando el lazo y ocluyendo con balón la cava intrapericárdica, inmediatamente por arriba del diafragma y últimamente lo hacíamos por vía abdominal utilizando el segmento hepato-diafragmático. Todas las maniobras presentan los mismos problemas:
1. Descenso considerablemente del flujo de sangre al corazón, que se traduce en disminución del gasto cardiaco y de la tensión arterial e hipoperfusión de órganos críticos. Recordemos que un tercio de la que llega, procede de la cava inferior.
2. Ingurgitación del lecho capilar por debajo del diafragma que incrementa la hemorragia en el campo quirúrgico.
3. Congestión hepática por obstrucción del drenaje venoso.
4. Hemorragia masiva por la cavotomía que, si bien arrastra los restos tumorales sueltos, no es suficiente para hacer que se desprendan los adheridos a la pared y menos los que la infiltran, con lo cual, el campo se convierte en un revoltijo de sangre, coágulos y trozos tumorales muy difícil de limpiar. Esta situación dificulta explorar el interior de la cava para extraer residuos adheridos en su pared.
Se ha propuesto el by-pass veno-venoso para resolver los dos primeros. Para luchar contra los dos últimos se recurre a la maniobra de Pringle.
Y unos pocos (1) recomiendan el by-pass cardiopulmonar: cánulas en la aorta y aurícula para circulación extracorpórea, hipotermia (temperatura rectal o vesical de 14o), solución cardiopléjica/parada cardiaca. Exanguinación al oxigenador "liberar el hígado mediante volteo para exponer la cava abdominal en toda su extensión".
Riesgos y complicaciones del by-pass aorto-auricular
Se dice que la mortalidad del by-pass cardiopulmonar con o sin exanguinotransfusión varía entre el 10 - 50% según diversas series. Glazer y Novick (J. Urol. 155.448.1996) en 18 enfermos con trombo en aurícula, refiere una muerte intraoperatoria 5,5%.
Montie y cols. (J. Urol. 139.25.1988). Mortalidad 1/13 (8%) por reacción a la protamina.
Pagano y cols. (2) utiliza el by-pass cardiopulmonar en solo 2 enfermos: 1 fallecido por coagulopatía al 4o día y otro a los 6 meses por metástasis cerebrales.
En la Clínica Universitaria de Navarra han utilizado el by-pass cardio-pulmonar en 25 enfermos, 12 con tumor a la altura de las suprahepáticas (su estadio B1) y 13 en que la supera (su estadio C). No dice en cuantos casos el tumor ocupa la aurícula, pero Sánchez Zolabardo y col en Actas Urol Esp 27-23-2003 definían sólo 3 casos de estadio pT3c (ocupa la aurícula derecha) y 63 de oclusión de vena renal y cava infradiafragmática (pT3b).
Refieren complicaciones mayores 10/25 (35%); entre las que incluyen:
- Muertes 2 (7%) ambos por embolia pulmonar masiva, una intra y otra al 4o día.
- Insuficiencia renal transitoria 3 casos, uno precisó diálisis.
- Psicosis temporal 1 caso.
- Pericarditis subclínica 1 caso.
- Hemianopsia transitoria por isquemia cerebral 1 caso
- Perforación intestinal por el separador 1 caso
- Reintervención por hemorragía 24 horas después 1 caso.
Se ha tratado de minimizar la agresividad de la técnica con la "mini-incisión" paraesternal (mini-invasiva) de 8 cm extirpando la cabeza de las costillas 3a y 4a, por la que se abre el pericardio y expone la aurícula derecha, aorta y vena pulmonar. Por una 2a incisión de 5 cm realizada por debajo de la clavícula derecha se canaliza la arteria subclávica derecha. Una vez más los problemas no vienen de la incisión, sino de lo que ocurre dentro del campo y su repercusión sistémica: anoxia cerebral, renal, hepática y sobre otros órganos, heparinización, hipotermia prolongada.
Aunque se han tomado como límite los 45 minutos, más allá de los cuales aumenta considerablemente la anoxia cerebral y la acidosis metabólica, debemos tener en cuenta que sobrepasando 29 minutos aumenta de forma exponencial el daño neuronal.
El By-pass veno-venoso, implantado antes de movilizar el tumor, hace descender la presión hidrostática en las colaterales y como consecuencia la congestión venosa y el sangrado. Permite mantener al enfermo hemodinámicamente estable. Lo único que podemos esperar es un ligero descenso del índice cardiaco con concentración de O2 en sangre venosa.
Se aduce como ventaja la posibilidad de explorar fácilmente el interior de la cava (falta de sangre), extraer completamente el trombo y suturar la cavotomía. La maniobra de Pringle no nos ha sido de gran ayuda: persiste hemorragia no despreciable por la incisión de la cava. Para mayor eficacia es preciso controlar vaso a vaso el pedículo hepático. Cuidaremos no sobrepasar el tiempo de isquemia caliente permitido por el hígado.
Siempre con menor riesgo que el cardiopulmonar más parada cardiaca más hipotermia, menor número de complicaciones y también más barato.
Boorjian y cols. (3) refieren que el 10% de los adenocarcinomas renales tienen trombo en cava y que los niveles II, III, IV requieren derivación.
Comparan el by-pass venoso (13 enfermos) con el cardiopulmonar (28 enfermos) y refieren supervivencia específica de cáncer del 29,8% y 36,4% respectivamente (Tabla I).
Con el by-pass veno-venoso son menores que con el cardiopulmonar, el porcentaje de complicaciones (repárese en coagulopatía) la duración de funcionamiento, el tiempo quirúrgico y el de anestesia.
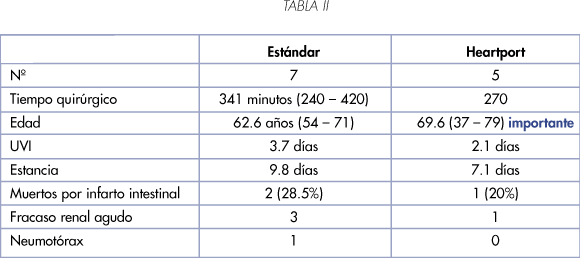
Graziotti y cols. (4) comparan 6 casos tratados con la técnica estándar (by-pass cardiopulmonar, hipotermia y parada cardiaca) con el sistema Heartport que permite extirpar por vía abdominal trombos sobre el papel extraíbles por esta vía.
De los 12 enfermos 3 murieron en el postoperatorio, 4 lo hicieron por metástasis con media de 14,2 meses (6 - 18) y 3 viven sin enfermedad entre 18 y 31 meses y 2 viven con progresión 36 y 52 meses respectivamente.
Uno de los manejados con el sistema Heartport fue reconvertido a la técnica estándar para extraer un fragmento de trombo auricular objetivado con transesofágica (Tabla II).
Staehlerg y cols. (5), utilizan by-pass veno-venoso sin heparinización sistémica en 2 estadio III e indican que no se debe utilizar salvo en casos con circulación colateral poco desarrollada.
Con by-pass cardiopulmonar, parada cardiaca e hipotermia profunda, manejan 5/26 estadio III en quienes no pueden excluir que sean estadio IV y los 10 estadio IV. En uno de estos últimos no llegan a practicarlo porque muere de embolia pulmonar durante la preparación de la cava.
Así, refieren 3 muertes en 14 enfermos manejados por este sistema: 2 a consecuencia de hemorragia masiva secundarias a la heparina y disfunción plaquetaria durante o inmediatamente después de la fase de calentamiento y el tercero por fracaso multiorgánico (sepsis prolongada).
Mortalidad perioperatoria en los grado IV 4/10 (40%) y mortalidad perioperatoria en enfermos manejados con by-pass aortopulmonar 3/14 (21.4%).
De estos trabajos se desprende que la circulación extracorpórea, hipotermia y parada cardiaca debe indicarse sólo cuando es absolutamente necesario.
No compartimos que el punto clave para recomendar las extracorpórea/hipotermia/parada cardiaca sea la altura de las venas suprahepáticas.
A nuestro juicio, la cirugía con extracorpórea, hipotermia y parada cardiaca se debe reservar para nuestro estadio V: trombo que ocupa la aurícula y se introduce en el ventrículo derecho. Una técnica con esa mortalidad y tal número de complicaciones graves no está justificada cuando ocupa el tramo de cava comprendido entre el hígado y la aurícula (estadio III y IV) y se puede evitar también en algunos en que el trombo se insinúa en el atrio auricular. Se pueden resolver con menores complicaciones y las que ocurran menos severas con nuestra técnica.
En nuestros niveles III - IV, los que invaden parte de la cava intrahepática, sin alcanzar las suprahepáticas, la infradiafragmática, intrapericárdica y aquellos que sólo se insinúan en el atrio auricular, hemos prescindido de la circulación extracorpórea, parada cardiaca e hipotermia, y en ningún caso hemos utilizado by-pass veno-venoso con las variantes siguientes:
Control de la cava intrapericárdica por esternotomía media (también se puede hacer por vía toracoabdominal, pero esta vía a mí no me gusta nada).
Oclusión de la cava inferior con balón, hinchado a voluntad por encima del límite superior del trombo. Disecando y por venotomía se canaliza la vena cefálica con sonda con balón que discurre a lo largo de la subclavia, vena innominada derecha, cava superior y después de pasar por la aurícula, situamos su extremo en la cava inferior. El balón se hincha en el momento y al nivel que más nos conviene en cada caso. La magnitud del balón nos dio un problema serio; no se vació y quedó enclavado ocluyendo la cava superior.
Oclusión con balón introducido a través de la pared auricular por esternotomía media. Ello nos permite controlar a 3 niveles, adaptándonos a la altura del trombo y también empujar su extremo distal para desplazarlo hacia abajo. Obstruir por debajo de las suprahepáticas resolvía todos los problemas, hinchado a nivel y por arriba persistían todos los inconvenientes descritos anteriormente. Por ello, añadimos después una bomba conectada a otra sonda que atravesando de nuevo la pared aurícular retorna la circulación hepática al corazón, By-pass cavo-auricular que requiere heparinización, con sus riesgos propios.
Este sistema permite aspirar el flujo de las suprahepáticas, hinchando el balón por encima de las mismas.
Para prescindir de la esternotomía, controlamos por vía abdominal la cava infradiafragmática en el trayecto comprendido entre el hígado y el diafragma. Este control nos parece peligrosísimo sin realizar las maniobras para exponerla que relatamos a continuación. Sin así disecarla, cualquier lesión del vaso es prácticamente imposible de suturar.
Tras seccionar el ligamento redondo entre dos ligaduras, continuamos cortando el ligamento falciforme formado por dos hojas perpendiculares a la superficie hepática. En el borde posterior se separan dejando al descubierto una zona triangular de superficie hepática muy adherida al diafragma. La maniobra consiste en disecar con bisturí eléctrico el hígado del diafragma, separar la cava del músculo por arriba de las suprahepáticas seccionando las adherencias que la fijan al orificio que le ofrece el centro frénico. Ampliando dicho orificio es posible acceder si fuera necesario al segmento supradiafragmático e incluso al intrapericárdico.
Obtenemos así un trayecto de vena cava perfectamente expuesto, de manejo cómodo y fácil de obstruir con lazo y de suturar en caso de lesión, la cual hay que evitar por todos los medios.
La técnica que resuelve satisfactoriamente todos los problemas.
Hemos comprobado que al conservar libre el retorno del flujo hepático a la circulación rara vez se necesita el by-pass veno-venoso para mantener inalterada la función cardiaca y la hemorragia por la cavotomía se reduce considerablemente, con lo cual se puede explorar fácilmente la cava.
Hemos perseguido una técnica que proporcione un campo que permita manejo fácil y seguro del segmento de cava inferior, comprendido entre las renales y el diafragma, con fácil acceso a su porción intrapericárdica e incluso maniobrar sobre el extremo de trombo que se insinua en la aurícula en determinados casos. Que permita controlar el vaso por arriba del extremo distal del trombo con las máximas posibilidades de impedir la tan justificadamente temida embolia pulmonar masiva que no se suprime con la circulación extracorpórea aún en equipos perfectamente compenetrados.
Que permita cavotomías largas para extraer completamente el trombo y explorar sin dificultades el interior de la cava para no dejar fragmentos adheridos a la pared y resecar las zonas de pared infiltrada e incluso segmentos completos de cava si fuera necesario.
¿Cómo actuar para obtener esos objetivos?
En primer lugar giraremos el hígado de derecha a izquierda alrededor del eje que le forma la cava intrahepática. Los ligamentos redondo y falciforme se manejan con hemos descrito más arriba. El coronario fija el borde posterior del hígado al diafragma. Lo forman dos hojas adosadas en sus extremos, desde los cuales se continúa con los ligamentos triangulares. Hacia la línea media están separados por una zona de 5 - 6 cm. Más ancha en lóbulo derecho especialmente a nivel de sus relaciones con la suprarrenal y el riñón. Entre ambas hojas, el hígado, desprovisto de peritoneo, se adhiere más o menos íntimamente al diafragma. En el lado derecho, tras seccionar el ligamento triangular, cortamos la hoja anterior del ligamento coronario, disecando el hígado del diafragma para encontrar la hoja inferior y seccionarla. Queda así el lóbulo hepático derecho separado del diafragma y movilizable.
Procedemos igual en el lado izquierdo y dejando el pedículo hepático preparado para disecar y ocluir vaso a vaso en el momento oportuno.
Con la cava disecada del hígado y del diafragma, procedemos a controlar las venas suprahepáticas mayores, para lo cual es preciso "sacarlas" del interior del parénquima hepático.
Ahora podemos voltear el hígado de derecha a izquierdo, alrededor del eje que le forma la cava intrahepática, pero perseguimos movilizarlo de abajo a arriba hasta quedar pendiente sólo de su pedículo y de las venas suprahepáticas.
A lo largo de todo el trayecto intrahepático la cava inferior está íntimamente adherida a la cápsula hepática y en su cara anterior desembocan entre 6 y 12 venas hepáticas menores que mantienen a ambos fijos entre sí. Para exponerla y disecarla de la cápsula hepática debemos ligar y seccionar dichas venas. Tarea nada fácil, por su corto trayecto. La hemorragía por ligadura defectuosa del cabo hepático es muy difícil de controlar.
Una vez seccionadas todas ellas queda perfectamente expuesta la cava en toda su longitud, desde las renales hasta el diafragma. En este campo, todo es fácil y permite ampliar el orificio del centro frénico y pasar al espacio supradiafragmático e incluso al intrapericárdico y manipular en la aurícula.
La cava, así disecada, es muy fácil de obstruir por debajo de las suprahepáticas dejando su flujo libre.
Cuando el trombo supera el límite de las suprahepáticas, es decir, asciende al segmento infradiafragmático, sobrepasa el diafragma invadiendo la porción intrapericárdica e incluso en algunos insinuados en la aurícula, se puede manipular su extremo hasta situarlo por debajo de las suprahepáticas y después ocluir la cava a ese nivel. Si esto no es posible, se puede controlar a nivel intrapericárdico y clampar el pedículo hepático: extraer el trombo, e inmediatamente después, recolocar el lazo o accionar el previamente colocado por debajo de las suprahepáticas. Así, podemos desobstruir a nivel intrapericárdico o infradiafragmático, lo cual permite desclampar el pedículo hepático y explorar cómodamente la cava en toda su extensión entre las suprahepáticas y las renales, liberar los fragmentos adheridos a la pared y resecar las porciones infiltradas.
En casos de trombos muy voluminosos, con muchas posibilidades de infiltración de la pared vascular se puede resecar el segmento de cava afectado sin dificultad alguna.
Nefrectomía en enfermos con metástasis (la denominada citorreductora).
La cirugía en los casos con metástasis, se justifica como tratamiento paliativo y "para disminuir carga tumoral como parte del tratamiento multidisciplinar".
Margulis y cols. (6) practican la denominada nefrectomía citorreductora en 55 enfermos y refieren complicaciones en 22 casos (40%) contabilizando en total 44, en el grupo tratado previamente con terapia molecular y en 16 enfermos (37.9%) de los manejados con nefrectomía sólo. Refieren: mortalidad peroperatoria, reintervención, enfermedad trombo-embólica, cardiovascular, pulmonar, gastrointestinal e infecciosa; y complicaciones relacionadas con la incisión.
Creemos que son mayores las posibilidades de muerte inmediata que el beneficio que aporta eliminar el riñón y el trombo. Sólo está indicada la cirugía como tratamiento sintomático, ni siquiera paliativo; cuando hay sintomatología causada por el cáncer renal o secundaria a la obstrucción de la cava que pueda remitir tras la cirugía.
El riesgo de embolia es casi igual durante el acto quirúrgico que espontáneo. Si ya ha ocasionado embolias pulmonares se puede implantar.