Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.63 no.4 may. 2010
Anatomía quirúrgica de la prostatectomía radical: fascias y esfínteres urinarios
Surgical anatomy of radical prostatectomy: Periprostatic fascial anatomy and overview of the urinary sphincters
Fernando P. Secin y Fernando J. Bianco
Urology Section. CEMIC. Buenos Aires. Argentina.
Columbia University Division of Urology. Mt. Sinai Medical Center. Miami Beach. USA.
Dirección para correspondencia
RESUMEN
Los avances en la comprensión de la anatomía de la próstata y de la pelvis en los años recientes han significado una contribución sustancial para mejorar la técnica quirúrgica en el tratamiento del cáncer de próstata (CaP), con la preservación potencial de las estructuras anatómicas responsables de las funciones eréctil y urinaria postoperatoria. El conocimiento de estas estructuras anatómicas es la llave para conseguir una extirpación completa de la próstata y las vesículas seminales preservando a la vez la mejor calidad de vida posible. Revisamos la literatura sobre la anatomía de la próstata y la pelvis y hacemos una puesta al día de la anatomía quirúrgica.
Palabras clave: Cáncer de próstata. Anatomía. Prostatectomía radical.
SUMMARY
Advances in the understanding of prostate and pelvic anatomy in recent years made a substantial contribution to improve the surgical technique for the treatment of prostate cancer (PC) with the potential preservation of anatomic structures responsible for erectile and urinary function postoperatively. Knowledge of these anatomic structures is key to achieve a complete removal of the prostate and seminal vesicles while preserving the best possible quality of life. The literature on prostate and pelvic anatomy has been reviewed and an updated notion of the surgical anatomy is herein provided.
Key words: Prostate cancer. Anatomy. Radical prostatectomy.
Introducción
"En general, los cirujanos que conocen la anatomía protegen al paciente por virtud de menos sangrado, mejores márgenes de resección y una mayor preservación funcional" Robert P. Myers (1).
La Prostatectomía Radical (PR) es la única modalidad de tratamiento primario del Cáncer de Próstata (CaP) localizado que ha demostrado su eficacia frente a la vigilancia expectante en un ensayo clínico aleatorizado (2). Los avances en el conocimiento de la anatomía prostática y pélvica en años recientes han contribuido a mejorías de la técnica quirúrgica que se han traducido en muy buenos resultados de supervivencia a largo plazo con resultados funcionales razonablemente buenos, aunque lejos de ser óptimos, independientemente de la técnica quirúrgica elegida, es decir prostatectomía radical abierta, (3-7) laparoscópica (8-10) o robótica (11-14).
Un aspecto crucial para entender la compleja anatomía de la pelvis masculina es la significativa variación individual. Algunas pelvis son anchas, haciendo la próstata fácilmente accesible, mientras que otras son profundas y estrechas, complicando el acceso, particularmente en el momento de realizar una cirugía con preservación nerviosa o una reconstrucción uretrovesical estanca (15). Las estructuras neurovasculares que rodean la próstata también pueden variar de un paciente a otro, y el cirujano debe estar preparado para entender estas variaciones y adaptar la técnica quirúrgica a los hallazgos intraoperatorios (16-18).
El objetivo de este artículo es ofrecer una revisión sistemática actualizada de la literatura sobre la anatomía periprostática y de las estructuras consideradas cruciales para conseguir los cinco objetivos principales de una prostatectomía radical ideal: extirpación completa del cáncer con márgenes quirúrgicos negativos, preservación de la continencia urinaria, recuperación temprana de la función eréctil, mínimo sangrado y ausencia de complicaciones perioperatorias. Sin embargo, en algunas ocasiones, conseguir uno de los objetivos va a afectar a la consecución de uno o más de los otros y viceversa. Por ejemplo, los pacientes con tumores localmente avanzados van a necesitar la resección de tejido periprostático adicional dificultando la recuperación de la función eréctil, y a veces de la continencia urinaria. Por el contrario, una excesiva obsesión con la preservación de los nervios cavernosos puede poner en peligro la extirpación completa del cáncer, con la posibilidad de dejar tejido canceroso. Adicionalmente, el cirujano puede tener que conceder un sangrado adicional para realizar una preservación adecuada de los nervios cavernosos.
El presente artículo esta primariamente enfocado al conocimiento de la anatomía de las fascias periprostáticas y de los diferentes tipos de disección de las bandeletas neurovasculares en relación con la localización y distribución de los nervios cavernosos. Damos, por lo tanto, una visión general de la configuración del esfínter urinario y sus estructuras de soporte.
Material y Métodos
Realizamos una búsqueda bibliográfica en inglés utilizando la base de datos de la Biblioteca Nacional de Medicina con las siguientes palabras clave: prostatectomía radical, anatomía, bandeleta neurovascular, nervios cavernosos, fascia, fascia de Denonvilliers, anatomía de la pelvis, músculo rectouretral, puboperineal, elevador del ano, y esfínter urinario. Se aplicó una estrategia de texto libre sin límite de año de publicación. Se consultaron también los libros de texto de anatomía.
Las listas de referencias de los artículos obtenidos fueron revisadas buscando artículos relevantes adicionales. Se seleccionaron 104 citas bibliográficas para la presente revisión basándose en su relevancia, tamaño del estudio, diseño y contribución global al campo.
Resultados y discusión
Tipo y extensión de la disección de los nervios cavernosos y las bandeletas neurovasculars (BNV)
Aunque la descripción anatómica de los nervios responsables de la función eréctil se remonta hasta el siglo XIX (19), Walsh y colaboradores fueron los primeros en introducir el término bandeleta como referencia macroscópica a utilizar intraoperatoriamente para identificar y preservar los nervios cavernosos (NC). Sin embargo, desde entonces los términos bandeletas neurovasculares y nervios cavernosos han sido usados en forma indistinta. Más recientemente, Costello y colaboradores enfatizaron que no era apropiado continuar con el intercambio de esos términos porque las bandeletas contienen no sólo los nervios cavernosos sino también parte del aporte neurovascular del recto, músculo elevador del ano, uretra, próstata y vesículas seminales (16).
Las bandeletas neurovasculares se componen tanto de fibras simpáticas como parasimpáticas que vienen del plexo pélvico (plexo hipogástrico inferior). Mientras que las primeras son responsables mayormente de la eyaculación y la continencia urinaria, las segundas contribuyen más a la función eréctil (21). El plexo pélvico está situado bilateralmente dentro del tejido fibroadiposo sobre la superficie lateral del recto a la altura de tercio distal de la vejiga urinaria, desplegándose en forma de abanico con una separación de hasta tres centímetros entre los nervios más anteriores y los más posteriores. Su longitud es aproximadamente 4 cm. Se extiende ventralmente desde el sacro hasta el fondo de saco rectovesical (21-23). Las fibras localizadas en el aspecto más anterior del plexo pélvico están a una distancia de sólo milímetros de la superficie lateral de las vesículas seminales, el cuello vesical y la base prostática (24, 25). Aunque es posible la lesión potencial de los NC en este área, las fibras parasimpáticas, responsables últimas de la función eréctil, se unen a la bandeleta neurovascular dos o tres centímetros por debajo de la unión del cuello vesical y la próstata en forma de ramillete (26, 27). Los nervios convergen en el nivel medio de la próstata y luego vuelven a separarse cuando se acercan al pico prostático (16, 28, 29).
No obstante, algunos autores describen que el área cerca del pedículo prostático y las vesículas seminales es la localización donde con mayor frecuencia se producen las lesiones de los NC (21, 25). Otros incluso proponen preservar las puntas de las vesículas seminales en pacientes altamente seleccionados, por tener muy bajo riesgo de progresión, como medida para obtener mejores resultados de función eréctil en el posoperatorio (30). Las puntas están en realidad contenidas en bolsillos fasciales; la bandeleta neurovascular se aproximan a la superficie lateral de la vesículas seminales justo distal a sus puntas.
Los estudios han demostrado una gran variación interindividual del número y distribución de las fibras nerviosas que rodean la próstata (31-33). El grueso de las estructuras neurovasculares tiende a localizarse posterolateralmente en la mayoría de los pacientes, pero puede que no siempre formen una bandeleta. Una proporción significativa de fibras puede estar lejos de los troncos nerviosos principales, a lo largo de los aspectos lateral y posterior de la próstata (34, 35). Persiste la controversia en la literatura sobre el papel de la preservación de las bandeletas neurovasculares en la recuperación de la continencia urinaria (36-40) (ver abajo).
Una vez descrita la localización de los nervios cavernosos en relación con las bandeletas neurovasculares y el area periprostática, comprender la localización y distribución de las fascias alrededor de la próstata y su relación con las bandeletas neurovasculares se convierte en la clave para conseguir el grado deseado de disección de los nervios cavernosos. Las siguientes fascias son referencias quirúrgicas que ayudan a determinar las capas que deben incidirse para extirpar o preservar diferentes cantidades de tejido de los nervios cavernosos durante la prostatectomía radical (41-44). Hay 4 fascias principales distintas rodeando la próstata y las bandeletas neurovasculares: (17) (Figura 1)
a. Fascia endopélvica, (fascia del elevador del ano lateral al arco tendíneo de la pelvis)
b. Fascia del elevador del ano (fascia pélvica lateral, originalmente descrita como un remanente de la fascia del elevador del ano sobre la superficie lateral de la próstata después de incidir la fascia endopélvica lateral a la fascia del arco tendíneo de la pelvis)
c. Fascia prostática
d. Fascia de Denonvilliers (fascia prostato seminovesicular)

a. Fascia endopélvica
La fascia endopélvica tiene dos componentes: parietal y visceral. La capa parietal (fascia endopélvica) cubre el elevador del ano lateralmente al arco tendíneo de la pelvis (45). Fascia visceral es cualquier fascia que cubre una víscera, a saber la fascia medial al arco tendíneo de la pelvis. Esta fascia cubre el musculo liso longitudinal vesical que forma una capa diferenciada cubriendo enteramente la superficie anterior de la próstata subyacente.
De acuerdo con Villers y cols. (45) la fascia pélvica visceral está compuesta por el tejido conectivo fibroadiposo y el aporte neurovascular localizados debajo de la fascia parietal. Cubre y se adhiere a todas las superficies de vejiga, próstata, vesículas seminales, recto y vasculatura pudenda. Su grosor varía en función de la cantidad de tejido adiposo, vasos y nervios que contiene. El arco tendíneo de la pelvis representa un engrosamiento de los componentes parietal y visceral de la fascia endopélvica que se extiende desde los ligamentos pubovesicales (puboprostáticos) hasta la espina isquiática bilateralmente (45) (ver abajo).
Sin embargo, Myers y cols. propusieron una definición más simple de la fascia (endo)pélvica, una definición que se ajusta a la Terminología Anatómica de 1998 y a las Nóminas Anatómicas precedentes. La fascia lateral al arco tendíneo fascial se denomina fascia (endo)pélvica parietal, y la fascia medial, al extenderse sobre la porción anterior de la vejiga y la próstata subyacente, forma la fascia (endo)pélvica visceral (1, 46).
Takenaka y cols. (17) han ilustrado elegantemente en estudios en cadáveres lo que los cirujanos pioneros de cirugía abierta y laparoscopistas han predicado tradicionalmente sobre la localización correcta donde incidir la fascia medial al arco tendíneo de la pelvis para acceder al aspecto lateral de la próstata sin denudar las fibras del elevador del ano (3, 42). Como muestra la Figura 1 (área sombreada), en algunas ocasiones, la parte de la fascia endopélvica que tapiza la próstata se fusiona (coalesencia) con la que descansa sobre la fascia del elevador del ano en el punto de reflexión más profundo. Es necesario separar tal fusión de las capas para llegar al punto más declive del fondo de saco y hacer una incisión adecuada de la fascia endopélvica. La contratracción en la próstata facilita la identificación y disección del contorno de la reflexión fascial donde la fascia endopélvica forma un fondo de saco entre la fascia del elevador del ano lateralmente y la fascia prostática medialmente (17). Es más fácil identificar e incidir correctamente este fondo de saco cuando la disección se inicia cerca de la base prostática, (en oposición a la disección cerca del ápex) donde la fascia endopélvica parece ser más fina y el espacio entre el elevador del ano y la fascia prostática es más amplio. Dicho lo anterior, no todas las próstatas tienen fascia prostática, algunas sólo tienen su pseudocápsula, y este tipo de apertura de la fascia pelviana medial al arco tendíneo de la pelvis tiene el riesgo de incidirla pudiendo dañar la superficie glandular. (Myers, en prensa)
Fascia del elevador del ano
Al tratarse de una fascia periprostática más externa, la fascia del elevador del ano (Fascia pélvica lateral) cubre el músculo elevador del ano subyacente distribuido lateralmente y, por lo tanto, forma el límite lateral del espacio axial triangular ocupado por el grueso de los nervios cavernosos y vasos, y cantidades variables de tejido adiposo. Los límites medial y posterior de este triángulo están formados por la pseudocápsula prostática (cubierta o no por la fascia prostática) y la fascia de Denonvilliers, respectivamente (16, 17, 47-49). La fascia del elevador del ano se extiende posteriormente sobre las fibras musculares y continua sobre el aspecto lateral del recto formando la así llamada fascia pararectal (16, 50, 51) que se fusiona posteriormente con la fascia presacra (48) (Figura 1). Como se ha dicho anteriormente, la fascia del elevador del ano está adherida de forma variable, aunque no completamente fundida, a la fascia prostática, así, pueden separarse generando un espacio entre ellas, donde la fascia endopélvica se refleja formando un fondo de saco. Abrir la fascia endopélvica medialmente a este fondo de saco y el arco tendíneo fascial de la pelvis dejará las fibras del elevador del ano cubiertas por su propia fascia. Ocasionalmente la fascia del elevador puede estar adherida a la unión uretroprostática (27).
Fascia Prostática
Por debajo de la fina fascia del elevador del ano, más externa, la próstata está cubierta de forma variable por una segunda fascia periprostática más interna, la fascia prostática. La fascia prostática se fusiona anteriormente con el estroma fibromuscular anterior, quedando en íntimo contacto con la pseudocápsula prostática más lateralmente. A veces, la fascia prostática está ausente (Myers, en prensa)
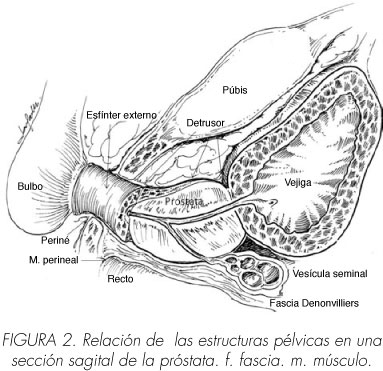
Fascia de Denonvilliers
La fascia de Denonvilliers (fascia prostato-semino-vesicular) (44, 52) está compuesta macroscópicamente por una capa única blanquecina de tejido que se extiende caudalmente sobre el aspecto posterior de las vesículas seminales y la próstata hasta unirse en la línea media con el tendón central del periné (44) (Figura 2). Aunque macroscópicamente es una sola capa, en la mayoría de los casos, aunque no siempre, la fascia de Denonvilliers está compuesta histológicamente de 2 capas distinguibles al microscopio. Algunos autores la describen como formada por múltiples capas, particularmente en su porción más distal (44, 49, 53). La Fascia de Denonvilliers está a menudo en íntimo contacto con el aspecto posterior de la próstata en la línea media. Más lateralmente, la fascia de Denonvilliers continúa su curso alrededor del recto separándose del aspecto posterior de la pseudocápsula prostática, formando el límite posterior del triángulo anteriormente descrito (Figura 1). Dependiendo de variaciones individuales, unas pocas fibras de la fascia Denonvilliers podrían estar unidas en parte a la pseudocápsula prostática en este área lateral (49). La fascia de Denonvilliers continúa alrededor del mesorecto donde puede adelgazarse e interrumpirse (48).
El origen de la fascia de Denonvilliers es controvertido. Mientras algunos autores defienden la teoría de la fusión de las vainas anterior y posterior del fondo de saco embriológico, otros simplemente proponen que la fascia Denonvilliers se origina de la condensación de tejido areolar laxo (54).
La descripción del espacio triangular, orientado axialmente, que contiene el grueso de la bandeleta neurovascular parece algo simplista e intenta ser más didáctico y reproducible que anatómicamente realista. La controversia en la literatura sobre la relación entre la fascia del elevador del ano, la fascia Denonvilliers y los componentes de la bandeleta neurovascular pone lo anterior en evidencia.
Por ejemplo, Villers and Myers describieron que la fascia de Denonvilliers se divide en el borde posterolateral de la próstata en una hoja anterior y otra posterior alrededor de la bandeleta neurovascular. Mientras que la hoja anterior se convierte en la fascia prostática, la posterior continúa su curso sobre el recto limitando el triángulo en su porción posterior (47). Basándose en esta representación esquemática, se describen tres tipos de disección de las bandeletas neurovasculares: (44, 45)
a. Plano intrafascial: La pseudocápsula prostática se deja desnuda de cualquier tejido. La anteriormente descrita hoja anterior de la fascia Denonvilliers (fascia prostática) se deja cubriendo el aspecto medial de la bandeleta neurovascular.
b. Plano interfascial: En este caso, la fascia prostática permanece cubriendo la superficie posterolateral de la próstata. La hoja anterior de la fascia de Denonvilliers o fascia prostática queda sobre la cara prostática y el aspecto medial de la bandeleta neurovascular queda expuesto sin ninguna fascia. Así, puede aumentar la probabilidad de lesión de la bandeleta neurovascular, pero ofrece al cirujano un margen oncológico más seguro, especialmente en el aspecto posterolateral de la próstata.
c. Plano extrafascial: es el que se lleva a cabo durante una disección posterior y lateral a la bandeleta neurovascular. Se extirpa, pues, la próstata con todas las capas de la vaina fibroadiposoa visceral presentes en el espécimen (resección amplia). Las bandeleta se extirpa completa o casi completamente.
Kourambas y colaboradores (50) difieren de esta versión en que la fascia de Denonvilliers se divide lateralmente en varias láminas y que no está claramente definida en sus bordes laterales. Demuestran cierta compartimentación de las bandeletas neurovasculares por tiras de fascia en cortes axiales. Describen que la fascia de Denonvilliers representa la barra horizontal de una estructura fascial en forma de H, que deja la próstata anterior y el recto posterior. La extensión anterior de la H. está representada por la fascia del elevador del ano izquierda y derecha y la extensión posterior por la fascia parietal (continuación de la fascia del elevador del ano). No obstante, hay fascia prostática anterior a la bandeleta neurovascular y una capa de fascia de Denonvilliers posterior, lo que significa que su esquema básico no difiere sustancialmente del que describen Villers y Myers. Villers y Myers simplemente han tratado de simplificar, sin preocuparse por la formación de hebras de fascia dentro de la bandeleta neurovascular.
Según Costello y colaboradores (16), los límites del área triangular no son tan claros como se ha mencionado previamente. En la confluencia de la fascia prostática, la fascia de Denonvilliers y la fascia pararectal hay numerosas hojas de tejido fibroso. Los aspectos posterior y lateral de la bandeleta corren a través de estas hojas (compartimentación). Las fascias de Denonvilliers y pararectal están separadas de las superficies anterior y lateral del recto por cantidades variables de tejido adiposo perirrectal (16).
La mayoría de los autores parecen estar de acuerdo en que hay variaciones anatómicas en el número y grosor de las capas colágenas que componen la fascia prostática y la fascia de Denonvilliers en el aspecto posterolateral de la próstata. De forma similar, la localización exacta de la bandeleta puede variar, con una tendencia de las próstatas más grandes a desplazar el grueso de las bandeletas más posteriormente (24, 25). Demás esta decir, que la recuperación de la función eréctil en el postoperatorio no dependerá solamente de la preservación anatómicas de los nervios cavernosos, sino también en su estado funcional (evitar la tracción, etc.), así como de otros factores anatómicos, como la preservación de las arterias pudendas accesorias, (55-59) la edad, la función eréctil preoperatoria (60) y aspectos sociales.
La hoja posterior de la fascia de Denonvilliers, citada a veces en la literatura colorectal, es en realidad la fascia propia del recto (serosa) (61). El mesorecto representa la capa grasa localizada entre la fascia propia del recto y la fascia de Denonvilliers, y éste es el plano de disección que debe seguirse durante la prostatectomía radical para minimizar el riesgo de tener un margen quirúrgico positivo en el aspecto posterior de la próstata (45, 62, 63). Este plano también es comúnmente seguido por los cirujanos colorectales durante la resecciones de recto (48, 61, 64).
De forma similar, la mal llamada hoja anterior de la fascia de Denonvilliers interpuesta entre el cuello vesical posterior y el aspecto anterior de la vesícula seminal y los conductos deferentes, corresponde de hecho a las fibras longitudinales posteriores del detrusor de Gil Vernet, y que transcurren entre los orificios ureterales para insertarse distalmente en el Veru Montanum (este fascículo muscular fue denominado músculo vesicoprostático por Dorscher y colaboradores, m. vesicoprostaticus, TA) (65-69). Está fascia longitudinal posterior del Detrusora está cubierta exteriormente por la adventicia vesical (66, 69, 70). Los remanentes vesicales de estas fibras longitudinales posteriores del detrusor son lo que Rocco y colaboradores parecen usar para fijar la fascia de Denonvilliers durante la reconstrucción posterior del rabdoesfinter justo antes de realizar la anastomosis uretrovesical (71, 72). Existe controversia en la literatura sobre la justificación y eficacia de esta técnica (73, 74) (ver abajo).
Pseudocápsula Prostática:
Como nos han enseñado los patólogos a menudo, la próstata no tiene una cápsula real. La parte más externa de la próstata está compuesta por capas variables de fascículos fibromusculares condensados inseparables del estroma prostático. Está pseudocápsula (47) está casi ausente en el aspecto anterior de la próstata, donde se identifica el estroma fibromuscular anterior (Figura 1). Adicionalmente, la pseudocápsula está ausente en el pico de la glándula y en la base de la próstata, donde la misma se fusiona respectivamente con el esfínter urinario y con el cuello vesical (49). Con respecto a la superficies laterales de la próstata, hay próstatas con cápsula pero no fascia prostática, y próstatas con fascia prostática sin cápsula, con un abanico de formas intermedias (Myers, en prensa).
Sería difícil recomendar áreas definidas en las que el cirujano debería enfocar predominantemente la preservación nerviosa. Basándose en las referencias anatómicas arriba mencionadas, algunos cirujanos han propuesto que una liberación alta de la fascia en la superficie lateral de la próstata en pacientes seleccionados da como resultado una mejoría de la recuperación de la función eréctil en el postoperatorio (24, 75-79). El objetivo es preservar tantas fibras nerviosas como sea posible (25, 26, 80). La potencia postoperatoria puede mejorar con el aumento del número de fibras nerviosas preservadas; sin embargo, ésta es una opción quirúrgica que puede comprometer la operación oncológica porque puede provocar un margen quirúrgico positivo (75).
Se debe poner especial cuidado en la región apical, donde las lesiones de la bandeleta neurovascular no son raras. En este área, la bandeleta neurovascular se localiza sólo a milímetros de distancia del aspecto posterolateral de la uretra membranosa y del pico de la próstata bilateralmente (25) (Figura 3). Está es la razón por la que la liberación temprana de la bandeleta neurovascular puede ayudar a minimizar el riesgo de lesión por tracción (75-77).

Esfínter urinario
El Esfínter urinario externo (en contraposición al esfínter interno del cuello vesical) es otra estructura, que podría lesionarse durante la prostatectomía radical con potenciales consecuencias deletéreas para la recuperación postoperatoria de la continencia urinaria y de la calidad de vida. Por lo tanto, el conocimiento detallado de su anatomía y función se hace esencial para obtener resultados aceptables de continencia postoperatoria.
Koraitim hizo recientemente una revisión exhaustiva de la anatomía y fisiología del esfínter uretral masculino (81). El esfínter uretral tiene dos componentes relacionados morfológicamente pero, posiblemente, no relacionados funcionalmente, que se extienden en forma de cilindro alrededor de la uretra desde el cuello vesical hasta el extremo distal de la uretra membranosa: (1, 32, 65, 82-85) (Tabla y Figuras 2 y 3)
1- Esfínter intrínseco de músculo liso o esfínter liso:
Se compone de una capa interna de músculo liso involuntario que tiene su parte principal en el cuello vesical y es más fino en su curso distal en la uretra. Forma un cilindro completo de fibras de músculo circulares alrededor de la uretra, y queda entre la mucosa uretral y el músculo estriado externo uretral, formando junto con el tejido conectivo y elástico el grueso de la pared de la uretra (Figura 3). Consiste en una capa diferenciada de músculo liso longitudinal rodeada por una capa más ancha de músculo liso circular. El esfínter intrínseco mantiene la continencia durante el reposo por medio de la contracción pasiva de sus fibras circulares, dando como resultado el cierre del orificio vesical y un estrechamiento concéntrico de la uretra posterior. El cierre máximo se asume que se da a nivel del orificio vesical, donde el esfínter intrínseco es más grueso (86) y en la uretra membranosa, donde la uretra es más estrecha. La contracción de las fibras longitudinales ensancha la uretra durante la evacuación de orina. No sería necesaria su preservación completa para asegurar la continencia pasiva posoperatoria, dado que una longitud mínima del esfínter de músculo liso sería suficiente para lograr tal coaptación. Ésta puede ser la justificación de unos mejores resultados de continencia después de la prostatectomía radical descritos en pacientes con uretras membranosas más largas (87).
2- Esfínter estriado uretral externo o rabdoesfinter:
Se compone de la capa externa de músculo estriado de fibras finas, predominantemente de contracción lenta (por contraposición al músculo esquelético voluntario de fibras gruesas, de contracción rápida), más marcado y más grueso alrededor de la uretra membranosa que se hace gradualmente menos diferenciado hacia la vejiga (Figuras 2 y 3). Desde el tendón central del periné hasta el pico de la próstata las fibras de músculo estriado se unen detrás de la uretra en un rafe central fibroso (82), mientras que más próximalmente rodean la cara anterolateral de la próstata (Figura 3). Aunque anatómicamente es indivisible, el rabdoesfinter consiste en dos componentes distintos funcionalmente:
a- Fibras centrales que se extienden en dirección cefálica sobre la uretra prostática.
b- Fibras caudales que se extienden sobre la uretra membranosa
a- Este músculo tiene que relajarse para permitir que el semen entre en la porción bulbar de la uretra de forma que el músculo bulboesponjoso (en tiempos llamado eyaculator uretrae) pueda eyacular el semen.
b- Aunque existe controversia, las fibras más caudales del rabdoesfínter compuestas por fibras estriadas mixtas de contracción lenta y quizás rápida (88, 89), pueden ser las responsables de la continencia urinaria activa al contraerse contra el rafe medio posterior fijo, dando como resultado el colapso de la pared anterior de la uretra contra la pared posterior. Adicionalmente, se especula que tanto la fascia de Denonvilliers como el músculo rectouretral pueden formar una placa posterior rígida contra la que la compresión de la pared uretral anterior pueda incrementar la superficie del área de coaptación; creando así una mayor resistencia uretral (90). Esto podría explicar en parte la mejoría en acortamiento del tiempo hasta la continencia encontrado en pacientes sometidos al conocido "punto de Rocco" (71-73, 91). No obstante, otros autores no han encontrado la utilidad de esta modificación técnica, aunque se puede argumentar que posiblemente no hayan reproducido con exactitud la reconstrucción de la placa uretral posterior descrita originalmente (74).
Rocco y cols. sostienen que "la fascia de Denonvilliers en su inserción distal actúa como un sistema de suspensión para la uretra prostato-membranosa y que su división durante la prostatectomía radical da como resultado la pérdida de la inserción posterior craneal del esfínter, el desplazamiento caudal del complejo esfinteriano, y un prolapso del periné "durante esta reconstrucción posterior" (72).
Desde el punto de vista embriológico, la fascia de Denonvilliers es una barrera entre el tracto urinario y la porción terminal del sistema digestivo (51, 92). El conocido como "prolapso del periné" puede ser más un artefacto visual y función de una presión intraperitoneal aumentada que realmente función de la sección de la fascia de Denonvilliers. Traccionar de la próstata mientras se seccionan la uretra y las fijaciones distales de la fascia de Denonvilliers, hace creer al cirujano que la sección extraprostática de la uretra membranosa es más larga (o más intrapélvica) de lo que realmente es (93). Adicionalmente, se puede establecer la hipótesis de que traccionar excesivamente de la próstata puede rasgar algunas fibras musculares esfinterianas impactando negativamente en su adecuada función postoperatoria. Se puede observar claramente durante la prostatectomía radical laparoscópica o robótica que la uretra se retrae después de su sección a pesar de que la fijación distal de la fascia de Denonvillers permanezca sin cortar. La sección de esta última fijación no tiene impacto sobre la retracción uretral o su longitud elástica.
La uretra está sujeta anterior y lateralmente, pero no existe evidencia anatómica de que esté sujeta cranealmente por ninguna otra estructura salvo, posiblemente, la próstata (1). Burnett and Mostwin (82) describieron que el complejo esfinteriano uretral masculino consistía en la uretra prostatomembranosa, la musculatura periuretral (rabdoesfínter), la musculatura parauretral extrinseca y las estructuras de tejido conectivo de la pelvis. Existe una estructura ligamentosa que fija el rabdoesfínter compuesta mayormente por los ligamentos pubouretrales anteriormente (porción más distal del ligamento pubovesical o delantal vesical), los ligamentos isquioprostáticos (ligamentos de Mueller) (1) y la fascia medial del elevador del ano, lateralmente. La fijación dorsal de la uretra membranosa está sujeta a controversia. Creemos que el rafe medio se inserta en el tendón central del periné (82), y no en el músculo rectouretral como otros han descrito. Porzionato y cols (94) corroboraron las observaciones anteriores (95) de que las fibras musculares a lo largo del aspecto anterior del músculo rectouretral no alcanzaban la pared posterior de la uretra membranosa. La distancia media entre el músculo rectouretral y la uretra membranosa era de 5,3 mm en adultos y 1,0 mm en niños (27, 96, 97).
Por lo tanto, no parece probable que la fascia de Denonvilliers ejerza un soporte cefálico de la uretra. De la misma forma, Soga y cols. (27) alertan contra el riesgo de lesión nerviosa durante la reconstrucción posterior de la placa retrouretral descrita por Rocco (71, 72).
El esfínter uretral está inervado por ramas del nervio pudendo y por ramas autonómicas del plexo pélvico, las cuales corren parcialmente con la bandeleta neurovascular (25, 98-101). Takenaka estimaba recientemente que la distancia entre el pico de la próstata y el punto donde la rama neural más cercana del pudendo entra en el esfínter era de 313 mm. (17, 85). La conservación de estas ramas puede mejorar la continencia urinaria postoperatoria (83), así, parece importante limitar la disección distal de la uretra membranosa. Las fibras nerviosas de la bandeleta neurovascular entran en la uretra en las posiciones 3 y 9 horarias (102). Existe controversia en la literatura sobre el papel de la preservación de las bandeletas en la recuperación de la continencia urinaria (36, 39, 103). Aunque no está claro si la responsable de la mejoría de la continencia después de la cirugía con preservación de bandeletas es la preservación de las bandeletas neurovasculares por sí misma o la meticulosa disección requerida para separar los nervios del pico prostático, deben hacerse todos los esfuerzos para preservar esas fibras nerviosas siempre que la seguridad oncológica no se vea comprometida. Un control cuidadoso del complejo vascular dorsal es la llave para obtener un campo exangüe y conseguir una adecuada visualización de la unión prostatouretral y de las estructuras de la bandeleta neurovascular posterolateral. Las lesiones de la bandeleta podrían estar causadas por traumatismo directo, por tracción o por inclusión accidental de la bandeleta en la sutura durante la ligadura del complejo de la vena dorsal o la anastomosis uretrovesical (4, 104).
Conclusión
La anatomía de la próstata es compleja y puede mostrar variaciones individuales, lo cual se añade a las dificultades técnicas de la prostatectomía radical. Comprender la anatomía de las fascias periprostáticas es la llave para conseguir una resección óptima de la glándula prostática y las vesículas seminales con márgenes quirúrgicos negativos, con vistas a maximizar el control oncológico. Una preservación precisa del esfínter uretral y su inervación autonómica dará lugar a unos buenos resultados de continencia urinaria en el postoperatorio. La recuperación temprana de la función eréctil en el postoperatorio dependerá tanto de la preservación anatómica como funcional de las estructuras neurovasculares y las arterias pudendas accesorias que rodean la próstata en pacientes adecuadamente seleccionados. El reconocimiento intraoperatorio de la vasculatura periprostática ayudará a disminuir el sangrado y reducir las complicaciones perioperatorias.
Agradecimientos
Los autores agradecen al Prof. Robert P. Myers no sólo la revisión del manuscrito sino también su inestimable enseñanza y tutoría. Adicionalmente, el primer autor agradece particularmente al Dr. Luis Alberto Aponte Tinao su ayuda y apoyo. Este manuscrito ha sido parcialmente subvencionado por Coloplast de Argentina SA y Gobbi Novag SA.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
**1. Myers R P. Male urethral sphincteric anatomy and radical prostatectomy. Urol Clin North Am, 1991; 18: 211. [ Links ]
**2. Bill-Axelson A, Holmberg L, Ruutu M. et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med, 2005; 352: 1977. [ Links ]
**3. Ohori M, Scardino P T. Localized prostate cancer. Curr Probl Surg, 2002; 39: 833. [ Links ]
**4. Catalona W J, Carvalhal G F, Mager D E, et al. Potency, continence and complication rates in 1,870 consecutive radical retropubic prostatectomies. J Urol, 1999; 162: 433. [ Links ]
**5. Hull G W, Rabbani F, Abbas F. et al. Cancer control with radical prostatectomy alone in 1,000 consecutive patients. J Urol, 2002; 167: 528. [ Links ]
**6. Michl U H, Friedrich M G, Graefen M, et al. Prediction of postoperative sexual function after nerve sparing radical retropubic prostatectomy. J Urol, 2006; 176: 227. [ Links ]
**7. Roehl K A, Han M, Ramos C G, et al. Cancer progression and survival rates following anatomical radical retropubic prostatectomy in 3,478 consecutive patients: long-term results. J Urol, 2004; 172: 910. [ Links ]
8. Touijer K, Romero Otero J, Secin F P et al. 750 Radical prostatectomy: a non-randomized comparative analysis of outcomes between the open and laparoscopic approach. European Urology Supplements, 2007; 6: 210. [ Links ]
9. Rassweiler J, Seemann O, Schulze M, et al. Laparoscopic Versus Open Radical Prostatectomy: A Comparative Study at a Single Institution. The Journal of Urology, 2003; 169: 1689. [ Links ]
10. Rassweiler J, Stolzenburg J, Sulser T, et al. Laparoscopic Radical Prostatectomy - the Experience of the German Laparoscopic Working Group. European Urology, 2006; 49: 113. [ Links ]
11. Menon M, Tewari A, Peabody J O, et al. Vattikuti Institute prostatectomy, a technique of robotic radical prostatectomy for management of localized carcinoma of the prostate: experience of over 1100 cases. Urologic Clinics of North America, 200431: 701. [ Links ]
12. Palmer K J, Shah K, Thaly R. et al. MP-18.04: Robotic-assisted laparoscopic radical prostatectomy: perioperative outcomes of 1500 consecutive cases. Urology, 2007; 70: 136. [ Links ]
13. Smith J J A. Robotically assisted laparoscopic prostatectomy: An assessment of its contemporary role in the surgical management of localized prostate cancer. The American Journal of Surgery, 2004; 188: 63. [ Links ]
14. Ficarra V, Novara G, Artibani W, et al. Retropubic, Laparoscopic, and Robot-Assisted Radical Prostatectomy: A Systematic Review and Cumulative Analysis of Comparative Studies. Eur Urol, 2009. [ Links ]
**15. Myers R P. Practical surgical anatomy for radical prostatectomy. Urol Clin North Am, 2001; 28: 473. [ Links ]
**16. Costello A J, Brooks M, Cole O J. Anatomical studies of the neurovascular bundle and cavernosal nerves. BJU Int, 2004; 94: 1071, [ Links ]
**17. Takenaka A, Hara R, Soga H, et al. A novel technique for approaching the endopelvic fascia in retropubic radical prostatectomy, based on an anatomical study of fixed and fresh cadavers. BJU Int, 2005; 95: 766. [ Links ]
**18. Walz J, Graefen M, Huland H. Basic principles of anatomy for optimal surgical treatment of prostate cancer. World J Urol, 2007; 25: 31. [ Links ]
19. Eckhardt C. Untersuchungen uber die Erektion des Penis beim Hunde. Beitr. Anat. Physiol, 1863; 3: 123. [ Links ]
**20. Walsh P C, Lepor H, Eggleston J C. Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations. Prostate, 1983; 4: 473. [ Links ]
21. Mauroy B, Demondion X, Drizenko A, et al. The inferior hypogastric plexus (pelvic plexus): its importance in neural preservation techniques. Surg Radiol Anat, 2003; 25: 6. [ Links ]
**22. Lepor H, Gregerman M, Crosby R, et al. Precise localization of the autonomic nerves from the pelvic plexus to the corpora cavernosa: a detailed anatomical study of the adult male pelvis. J Urol, 1985; 133: 207. [ Links ]
**23. Walsh P P C, Donker P P J. Impotence following radical prostatectomy: insight into etiology and prevention. The Journal of urology, 1982; 128: 492. [ Links ]
24. Lunacek A, Schwentner C, Fritsch H, et al. Anatomical radical retropubic prostatectomy: 'curtain dissection' of the neurovascular bundle. BJU Int, 2005 95: 1226. [ Links ]
25. Takenaka A, Murakami G, Matsubara A, et al.Variation in course of cavernous nerve with special reference to details of topographic relationships near prostatic apex: histologic study using male cadavers. Urol, 2005; 65: 136. [ Links ]
26. Takenaka A, Murakami G, Soga H, et al. Anatomical analysis of the neurovascular bundle supplying penile cavernous tissue to ensure a reliable nerve graft after radical prostatectomy. J Urol, 2004; 172: 1032. [ Links ]
27. Soga H, Takenaka A, Murakami G, et al. Topographical relationship between urethral rhabdosphincter and rectourethralis muscle: a better understanding of the apical dissection and the posterior stitches in radical prostatectomy. Int J Urol, 2008; 15: 729. [ Links ]
28. Costello A J. Editorial Comment. The Journal of Urol, 2007; 177: 1770. [ Links ]
**29. Walsh P C. Anatomical studies of the neurovascular bundle and cavernosal nerves. J Urol, 174: 566, 2005 [ Links ]
30. Zlotta A R, Roumeguere T, Ravery V, et al. Is seminal vesicle ablation mandatory for all patients undergoing radical prostatectomy? A multivariate analysis on 1283 patients. Eur Urol, 2004; 46: 42. [ Links ]
31. Eichelberg C, Erbersdobler A, Michl U, et al. Nerve distribution along the prostatic capsule. Eur Urol, 2007; 51: 105. [ Links ]
32. Ganzer R, Blana A, Gaumann A, et al. Topographical anatomy of periprostatic and capsular nerves: quantification and computerised planimetry. Eur Urol, 2008; 54: 353. [ Links ]
33. Sievert K D, Hennenlotter J, Laible I, et al. The periprostatic autonomic nerves-bundle or layer? Eur Urol, 2008; 54: 1109. [ Links ]
34. Raychaudhuri B, Cahill D. Pelvic fasciae in urology. Ann R Coll Surg Engl, 2008; 90: 633. [ Links ]
35. Kaiho Y, Nakagawa H, Saito H, et al. Nerves at the Ventral Prostatic Capsule Contribute to Erectile Function: Initial Electrophysiological Assessment in Humans. Eur Urol, 2008. [ Links ]
36. Eastham J A. Does neurovascular bundle preservation at the time of radical prostatectomy improve urinary continence? Nat Clin Pract Urol, 2007; 4: 138. [ Links ]
37. Stolzenburg J U, Liatsikos E N, Rabenalt R, et al. Nerve Sparing Endoscopic Extraperitoneal Radical Prostatectomy- Effect of Puboprostatic Ligament Preservation on Early Continence and Positive Margins. Europ Urol, 2006; 49: 103. [ Links ]
**38. Eastham J A, Kattan M W, Rogers E, et al. Risk factors for urinary incontinence after radical prostatectomy. J Urol, 1996; 156: 1707. [ Links ]
**39. Marien T P, Lepor H. Does a nerve-sparing technique or potency affect continence after open radical retropubic prostatectomy? BJU Int, 2008; 102: 1581. [ Links ]
40. Burkhard F, Kessler T, Fleischmann A, et al. Nerve sparing open radical prostatectomy-does it have an impact on urinary continence? J Urol, 2006; 176: 189. [ Links ]
41. Secin F P, Serio A, Bianco J F J, et al. Preoperative and Intraoperative Risk Factors for Side-Specific Positive Surgical Margins in Laparoscopic Radical Prostatectomy for Prostate Cancer. European Urol, 2007; 51: 764. [ Links ]
42. Secin F P, Touijer K, Karanikolas N T, et al. Laparoscopic Radical Prostatectomy: Lessons Learned in Surgical Technique. Eur Urol Sup, 2006; 5: 942. [ Links ]
43. Stolzenburg J U, Schwalenberg T, Horn L C, et al. Anatomical landmarks of radical prostatecomy. Eur Urol, 2007; 51: 629. [ Links ]
**44. Myers RP, Villers A. Prostate cancer: principles and practice. London: Taylor & Francis, 2006; pp. 701 -713. [ Links ]
**45. Villers A, Piechaud T. Surgical Anatomy of the Prostate for Radical Prostatectomy: Springer Berlin Heidelberg, 2008; pp. 11-18. [ Links ]
**46. Myers R P. Detrusor apron, associated vascular plexus, and avascular plane: relevance to radical retropubic prostatectomy-anatomic and surgical commentary. Urol, 2002; 59: 472. [ Links ]
47. Ayala A G, Ro J Y, Babaian R, et al. The prostatic capsule: does it exist? Its importance in the staging and treatment of prostatic carcinoma. Am J Surg Pathol, 1989; 13: 21. [ Links ]
48. Kinugasa Y, Murakami G, Uchimoto K, et al. Operating behind Denonvilliers' fascia for reliable preservation of urogenital autonomic nerves in total mesorectal excision: a histologic study using cadaveric specimens, including a surgical experiment using fresh cadaveric models. Dis Colon Rectum, 2006; 49: 1024. [ Links ]
49. Kiyoshima K, Yokomizo A, Yoshida T, et al. Anatomical features of periprostatic tissue and its surroundings: a histological analysis of 79 radical retropubic prostatectomy specimens. Jpn J Clin Oncol, 2004; 34: 463. [ Links ]
**50. Kourambas J, Angus D G, Hosking P, et al. A histological study of Denonvilliers' fascia and its relationship to the neurovascular bundle. Br J Urol, 1998; 82: 408. [ Links ]
**51. van Ophoven A, Roth S. The anatomy and embryological origins of the fascia of Denonvilliers: a medico-historical debate. J Urol, 1997; 157: 3. [ Links ]
**52. Denonvilliers C. Propositions et observation d'anatomie, de physiologie at de pathologie. These de l'Ecole de Medicine, 1837; 285: 23. [ Links ]
53. Fritsch H, Lienemann A, Brenner E, et al. Clinical anatomy of the pelvic floor. Adv Anat Embryol Cell Biol, 2004; 175: III. [ Links ]
54. Silver P H. The role of the peritoneum in the formation of the septum recto-vesicale. J Anat, 1956; 90: 538. [ Links ]
55. Matin S F. Recognition and preservation of accessory pudendal arteries during laparoscopic radical prostatectomy. Urol, 2006; 67: 1012. [ Links ]
56. Secin F P, Touijer K, Mulhall J, et al. Anatomy and Preservation of Accessory Pudendal Arteries in Laparoscopic Radical Prostatectomy. European Urol, 2007; 51: 1229. [ Links ]
57. Nehra A, Kumar R, Ramakumar S, et al. Pharmacoangiographic evidence of the presence and anatomical dominance of accessory pudendal artery(s). J Urol, 2008; 179: 2317. [ Links ]
58. Polascik T J, Walsh P C. Radical retropubic prostatectomy: the influence of accessory pudendal arteries on the recovery of sexual function. J Urol, 1995; 154: 150. [ Links ]
59. Mulhall J P, Secin F P, Guillonneau B. Artery sparing radical prostatectomy-myth or reality? J Urol, 2008; 179: 827. [ Links ]
**60. Rabbani F, Stapleton A M, Kattan M W, et al. Factors predicting recovery of erections after radical prostatectomy. J Urol, 2000; 164: 1929. [ Links ]
**61. Lindsey I, Guy R J, Warren B F, et al. Anatomy of Denonvilliers' fascia and pelvic nerves, impotence, and implications for the colorectal surgeon. Br J Surg, 2000; 87: 1288. [ Links ]
**62. Villers A, McNeal J E, Freiha F S, et al. Invasion of Denonvilliers' fascia in radical prostatectomy specimens. J Urol, 1993; 149: 793. [ Links ]
63. Dumonceau O, Delmas V, Toublanc M, et al. [Innervation of Denonvilliers' recto-vesical fascia. Anatomical study]. Prog Urol, 2000; 10: 53. [ Links ]
64. Aigner F, Zbar A P, Ludwikowski B, et al. The rectogenital septum: morphology, function, and clinical relevance. Dis Colon Rectum, 2004; 47: 131. [ Links ]
65. Dorschner W, Stolzenburg J U. A new theory of micturition and urinary continence based on histomorphological studies. 3. The two parts of the musculus sphincter urethrae: physiological importance for continence in rest and stress. Urol Int, 1994; 52: 185. [ Links ]
66. Secin F P, Karanikolas N, Gopalan A, et al. The anterior layer of Denonvilliers' fascia: a common misconception in the laparoscopic prostatectomy literature. J Urol, 2007; 177: 521. [ Links ]
67. Dorschner W, Stolzenburg J U, Dieterich F. A new theory of micturition and urinary continence based on histomorphological studies. 2. The musculus sphincter vesicae: continence or sexual function? Urol Int, 1994; 52: 154. [ Links ]
68. Cupedo R N. The ureterovesical junction and the musculature of the dorsal wall of the urinary bladder. Acta Anat (Basel), 1974; 89: 516. [ Links ]
**69. Gil Vernet S. Morphology and Function of Vesico-Prostato-Urethral Musculature. Treviso, 1968; p. 334. [ Links ]
70. Hutch J A, Ayres R D, Loquvam G S. The bladder musculature with special reference to the ureterovesical junction. J Urol, 1961; 85: 531. [ Links ]
**71. Rocco B, Gregori A, Stener S, et al. Posterior Reconstruction of the Rhabdosphincter Allows a Rapid Recovery of Continence after Transperitoneal Videolaparoscopic Radical Prostatectomy. Eur Urol, 2007; 51: 996. [ Links ]
72. Rocco F, Carmignani L, Acquati P, et al. Early continence recovery after open radical prostatectomy with restoration of the posterior aspect of the rhabdosphincter. Eur Urol, 2007; 52: 376. [ Links ]
73. Nguyen M M, Kamoi K, Stein R J, et al. Early continence outcomes of posterior musculofascial plate reconstruction during robotic and laparoscopic prostatectomy. BJU Int, 2008; 101: 1135. [ Links ]
74. Menon M, Muhletaler F, Campos M, et al. Assessment of early continence after reconstruction of the periprostatic tissues in patients undergoing computer assisted (robotic) prostatectomy: results of a 2 group parallel randomized controlled trial. J Urol, 2008; 180: 1018. [ Links ]
75. Eastham J A. Surgery Insight: optimizing open nerve-sparing radical prostatectomy techniques for improved outcomes. Nat Clin Pract Urol, 2007; 4: 561. [ Links ]
**76. Klein E A, Kupelian P A, Tuason L, et al. Initial Dissection of the Lateral Fascia Reduces the Positive Margin Rate in Radical Prostatectomy. Urol, 1998; 51: 766. [ Links ]
77. Masterson T A, Serio A M, Mulhall J P, et al. Modified technique for neurovascular bundle preservation during radical prostatectomy: association between technique and recovery of erectile function. BJU Int, 2008; 101: 1217. [ Links ]
78. Nielsen M E, Schaeffer E M, Marschke P, et al. High anterior release of the levator fascia improves sexual function following open radical retro-pubic prostatectomy. J Urol, 2008; 180: 2557. [ Links ]
79. Menon M, Kaul S, Bhandari A, et al. Potency following robotic radical prostatectomy: a questionnaire based analysis of outcomes after conventional nerve sparing and prostatic fascia sparing techniques. J Urol, 2005; 174: 2291. [ Links ]
80. Eichelberg C, Erbersdobler A, Haese A, et al. Frozen Section for the Management of Intraoperatively Detected Palpable Tumor Lesions During Nerve-Sparing Scheduled Radical Prostatectomy. Eur Urol, 2006 49: 1011. [ Links ]
**81. Koraitim M M. The male urethral sphincter complex revisited: an anatomical concept and its physiological correlate. J Urol, 2008; 179: 1683. [ Links ]
**82. Burnett A L, Mostwin J L. In situ anatomical study of the male urethral sphincteric complex: relevance to continence preservation following major pelvic surgery. J Urol, 1998; 160: 1301. [ Links ]
83. Karam I, Droupy S, Abd-Alsamad I, et al. The precise location and nature of the nerves to the male human urethra: histological and immunohistochemical studies with three-dimensional reconstruction. Eur Urol, 2005; 48: 858. [ Links ]
84. Koyanagi T. Studies on the sphincteric system located distally in the urethra: the external urethral sphincter revisited. J Urol, 1980; 124: 400. [ Links ]
85. Narayan P, Konety B, Aslam K, et al. Neuroanatomy of the external urethral sphincter: implications for urinary continence preservation during radical prostate surgery. J Urol, 1995; 153: 337. [ Links ]
86. Nyo M M. The musculature of the human urinary bladder and its sphincters. J Anat, 1969; 105: 191. [ Links ]
87. Paparel P, Akin O, Sandhu J S, et al. Recovery of Urinary Continence after Radical Prostatectomy: Association with Urethral Length and Urethral Fibrosis Measured by Preoperative and Postoperative Endorectal Magnetic Resonance Imaging. Eur Urol, 2008. [ Links ]
88. Elbadawi A, Mathews R, Light J K, et al. Immunohistochemical and ultrastructural study of rhabdosphincter component of the prostatic capsule. J Urol, 1997; 158: 1819. [ Links ]
89. Tokunaka S, Murakami U, Fujii H, et al. Coexistence of fast and slow myosin isozymes in human external urethral sphincter. A preliminary report. J Urol, 1987; 138: 659. [ Links ]
90. Lowe B A. Preservation of the anterior urethral ligamentous attachments in maintaining postprostatectomy urinary continence: a comparative study. J Urol, 1997; 158: 2137. [ Links ]
91. Coughlin G, Dangle P P, Patil N N et al. Surgery Illustrated-focus on details. Modified posterior reconstruction of the rhabdosphincter: application to robotic-assisted laparoscopic prostatectomy. BJU Int, 2008; 102: 1482. [ Links ]
92. Godlewski G, Prudhomme M. Embryology and anatomy of the anorectum. Basis of surgery. Surg Clin North Am, 2000; 80: 319. [ Links ]
93. Shafik A, Sibai O E, Shafik A A, et al. A novel concept for the surgical anatomy of the perineal body. Dis Colon Rectum, 2007; 50: 2120. [ Links ]
94. Porzionato A, Macchi V, Gardi M, et al. Histotopographic study of the rectourethralis muscle. Clin Anat, 2005; 18: 510. [ Links ]
**95. Myers R P, Cahill D R, Devine R M, et al. Anatomy of radical prostatectomy as defined by magnetic resonance imaging. J Urol, 1998; 159: 2148. [ Links ]
96. Sebe P, Oswald J, Fritsch H, et al. An embryological study of fetal development of the rectourethralis muscle-does it really exist? J Urol, 2005; 173: 583. [ Links ]
97. Uchimoto K, Murakami G, Kinugasa Y, et al. Rectourethralis muscle and pitfalls of anterior perineal dissection in abdominoperineal resection and intersphincteric resection for rectal cancer. Anat Sci Int, 2007; 82: 8. [ Links ]
98. Steiner M S. Continence-preserving anatomic radical retropubic prostatectomy. Urol, 2000; 55: 427. [ Links ]
99. Strasser H, Bartsch G. Anatomy and innervation of the rhabdosphincter of the male urethra. Semin Urol Oncol, 2000; 18: 2. [ Links ]
100. Tanagho E A, Schmidt R A, de Araujo C G. Urinary striated sphincter: what is its nerve supply? Urol, 1982; 20: 415. [ Links ]
101. Hollabaugh R S, Jr, Dmochowski R R, Steiner M S. Neuroanatomy of the male rhabdosphincter. Urol, 1997; 49: 426. [ Links ]
102. Baader B, Herrmann M. Topography of the pelvic autonomic nervous system and its potential impact on surgical intervention in the pelvis. Clin Anat, 2003; 16: 119. [ Links ]
103. KaihoY, Nakagawa H, Ikeda Y, et al. Intraoperative electrophysiological confirmation of urinary continence after radical prostatectomy. J Urol, 2005;173: 1139. [ Links ]
104. Graefen M, Michl U H G, Heinzer H, et al. Indication, Technique and Outcome of Retropubic Nerve-Sparing Radical Prostatectomy. EAU Update Series, 2005; 3: 77. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Fernando P. Secin
Hospital Universitario CEMIC
Av. Galvan 4120 C1431 FWO
Ciudad Autónoma de Buenos Aires (Argentina)
fsecin@yahoo.com
Aceptado para publicar: 30 de mayo 2009.














