My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.63 n.6 Jul./Aug. 2010
Efecto del arandano americano (Cysticlean®), sobre la adherencia de Escherichia colia células epiteliales de vejiga. Estudio in vitro y ex vivo
Effect of american cranberry (Cysticlean®) on Escherichia coli adherence to bladder epithelial cells. In vitro and in vivo study
Ester Risco1, Carlos Miguélez2, Eduardo Sánchez de Badajoz3 y Alberto Rouseaud4
1Facultad de Farmacia de la Universidad de Barcelona. Barcelona.
2Servicio de Urología Pediátrica Clínica Santa Elena. Málaga. Universidad de Málaga.
3Universidad de Málaga. Servicio de Urología Clínica Santa Elena. Málaga.
4Instituto Médico Tecnológico de Barcelona. España.
Dirección para correspondencia
RESUMEN
Objetivo: Las proantocianidinas (PACs) del arándano americano son las principales responsables de su eficacia en infecciones del tracto urinario. Su mecanismo de acción está relacionado con la inhibición de la adherencia de Escherichia coli a las células uroepiteliales. Cysticlean® contiene un extracto de arándano americano que proporciona 118 mg de PACs por comprimido o sobre. Se ha estudiado in vitro, la actividad de Cysticlean® comprimidos sobre la adherencia de Escherichia coli a células epiteliales de vejiga. Además, se ha comparado, ex vivo, la actividad de Cysticlean® sobres y comprimidos.
Métodos: Las ratas recibieron por vía oral los dos productos de Cysticlean®, y durante las 16 horas posteriores se recogió la orina de cada animal, que fue preincubada con E. coli. Posteriormente, las bacterias se incubaron con células T24. Después de una 1 hora, se calcula el número de bacterias adheridas por célula. Para el estudio in vitro, E. coli preincubadas con varias concentraciones de los diferentes productos, se incuban con células T24 y se sigue el proceso anterior.
Resultados: Las muestras de orina de ratas que habían ingerido Cysticlean® sobres y comprimidos (118 mg PACs/animal) muestran una importante inhibición de la adherencia de E.coli (83% y 52%, respectivamente). A la dosis inferior de 59 mg PACs/animal, también presenta una destacada inhibición (29% tras el consumo de Cysticlean® comprimidos y 40% tras el consumo de Cysticlean® sobres). In vitro, Cysticlean® ha mostrado inhibición de la adherencia bacteriana a todas las concentraciones ensayadas. A las concentraciones de 5, 25 y 75 mg de PACs/mL, disminuye un 25%, 36% y 34%, respectivamente, el número de bacterias adheridas a las células epiteliales.
Conclusiones: Cysticlean® muestra una importante inhibición de la adherencia de E. coli a las células uroepiteliales. Cysticlean® sobres es más efectivo que Cysticlean® comprimidos. Con el uso de Cysticlean® sobres, se ha observado buena tolerancia, fidelidad en el tratamiento y su uso es también muy recomendable en la profilaxis de infecciones urinarias en pediatría. Dada la heterogeneidad de productos a base de extractos de arándano americano en el mercado, y su diferente contenido declarado de proantocianidinas, resulta de interés la comparación de su actividad por métodos farmacológicos establecidos.
Palabras clave: Arándano americano. Vaccinium macrocarpon. Proantocianidinas. Infección urinaria. In vitro. Ex vivo.
SUMMARY
Objectives: The American cranberry proanthocyanidins (PACs) are the main responsible for its efficacy in urinary tract infections. Their mechanism of action is related to inhibition of Escherichia coli to urothelial cells. Cysticlean® contains an extract of American cranberry which provides 118 mg of PACs per dose. The activity of Cysticlean® tablets on Escherichia Coli adherence to bladder epithelial cells has been studied in vitro. Moreover, the activity of Cistyclean® both in powder for oral suspension and tablets has been compared ex-vivo.
Methods: The rats received both Cysticlean® preparations per orem, and urine from each animal was collected during the following 16 hours and pre-incubated with E. coli. Subsequently, bacteria were incubated with T24 cells. After 1 hour the number of bacteria adhered per cell was calculated. For the in vitro study, E. Coli pre-incubated at various concentrations of the products were incubated with T24 cells and the same process previously referred was carried out.
Results: Urine samples from rats taking Cysticlean® powder for oral suspension and tablets (118 mg PACs/ animal) showed an important inhibition of E. Coli adherence (83% and 52% respectively). The inferior dose of 59 mg PACs/animal also showed marked inhibition of E. Coli adherence (29% after Cysticlean® tablets intake and 40% for powder). In vitro, Cysticlean® showed inhibition of bacterial adherence in all tested concentrations: 5, 25 and 75 PACs mg/ml, diminishing the number og bacteria adhered to epithelial cells by 25%, 36% and 34% respectively.
Conclusions: Cysticlean® shows a significant inhibition of E. Coli adherence to urothelial cells. Cysticlean® powder for suspensión preparation is more effective tha tablets. Cysticlean® powder for suspensión is well tolerated, and compliance has been observed. Its use is very recommendable in pediatric urinary tract infection prophylaxis. Due to the variety of products with American cranberry extracts in the market, with different proanthocyanidins declared content, it would be interesting to compare their activity using established pharmacological methods.
Key words: American cranberry. Vaccinium macrocarpon. Proanthocyanidins. Urinary tract infection. In vitro. Ex vivo.
Introducción
Las infecciones del tracto urinario (ITUs) presentan una gran prevalencia y, en la mayoría de los casos, son causadas por la colonización ascendente de organismos de origen entérico, principalmente Escherichia coli, que suelen colonizar el introito vaginal y el área periuretral para ascender hasta la vejiga urinaria y, eventualmente, hasta la próstata o el riñón, provocando bacteriuria asintomática, cistitis o pielonefritis (1-2). El inicio de este proceso implica la adhesión de las bacterias al epitelio, lo que permite que se mantengan en el tracto urinario a pesar del efecto de arrastre del flujo urinario. Los responsables de esta adhesión son los apéndices filamentosos (fimbrias o pili) presentes en la superficie de las bacterias, si bien también existen estructuras adherentes, o adhesinas, no fimbriales. En E. coli la mayoría de estas estructuras adherentes son fimbrias. Las fimbrias están formadas por filamentos de polímeros constituidos por subunidades proteicas, donde se encuentran estructuras moleculares diferenciadas llamadas adhesinas, que se unen a receptores específicos situados en las membranas de las células epiteliales del huésped. Prácticamente, la totalidad de las cepas de E. coli presentan fimbrias tipo 1, que se unen a los residuos de α-D-manosa de la uroplaquina Ia y Ib, glucoproteínas del epitelio de la vejiga urinaria. Sin embargo, parecen tener una mayor importancia las fimbrias tipo P, o resistentes a la manosa, que se unen a residuos de galactosa presentes en los receptores glucoesfingolipídicos de las células uroepiteliales, y son críticas en el desarrollo de la infección del trato urinario superior (3-6).
El arándano americano, fruto de Vaccinium macrocarpon Aiton, ha demostrado un efecto beneficioso sobre el mantenimiento de la salud de las vías urinarias (7). La evidencia clínica demuestra que su consumo puede disminuir la recurrencia de ITUs (812), y este efecto ha sido estudiado principalmente en mujeres (13-18), aunque también se ha obtenido una importante reducción de la frecuencia de estas infecciones en hombres (19). Los principales componentes del arándano americano son las proantocianidinas (PACs), mayoritariamente del tipo A, las antocianinas, los flavonoles, ácidos fenólicos, ácidos quínico, málico y cítrico, iridoides, ácido ursólico, frutosa y otros azúcares.
De los diferentes posibles mecanismos de acción postulados hasta el momento: acidificación de la orina por la presencia de ácido hipúrico, excreción de salicilatos en orina, e inhibición de la adherencia de las bacterias al tejido uroepitelial, es éste último el que parece tener una mayor relevancia. La detección de una mayor excreción de ácido hipúrico tras el consumo de arándanos americanos (20) llevó a considerar que este ácido podía ser el responsable de una acción bacteriostática y de la acidificación de la orina (21). Sin embargo, se ha demostrado que la cantidad de ácido hipúrico no es suficiente para acidificar suficientemente la orina y ejercer el efecto bacteriostático (22). También se ha observado que tras la ingesta de arándanos aumentan las concentraciones de salicilatos en orina. Hasta el momento se desconoce su repercusión (23), aunque podría estar relacionado con un efecto antiinflamatorio local (24). Desde 1984, la acción del arándano americano se relacionó con la inhibición de la adherencia bacteriana (25). Posteriormente, se ha puesto de manifiesto que éste es el principal mecanismo implicado en la acción preventiva de las ITUs. Un ensayo clínico ha demostrado que se trata de un efecto dosis dependiente (26). Si bien, en un principio se había postulado que la fructosa presente en este fruto inhibía la adhesión de las fimbrias tipo 1 (27), este efecto únicamente se ha demostrado in vitro y no tiene repercusión clínica (7,26). Diferentes publicaciones identifican la proantocianidinas de tipo A como los principales compuestos responsables de la antiadherencia bacteriana, al impedir la adhesión de las fimbrias P de E. coli a las células uroepiteliales (28-30). Acción que podría estar relacionada con la capacidad que presentan las proantocianidinas de unirse a proteínas, como las adhesinas presentes en estas fimbrias de E. coli (7). En esta alteración de la conformación de las fimbrias P se produce también una disminución de la longitud, acompañada de una menor fuerza de adhesión entre la bacteria y las células uroepiteliales (31). Además, de la unión a las fimbrias, las PACs del arándano americano podrían unirse de forma irreversible a moléculas más pequeñas como los lipopolisacáridos bacterianos (32).
Recientemente, se ha demostrado también una acción antibacteriana más directa, relacionada con distintos grupos de constituyentes. Se ha observado in vitro que las tres fracciones constituida por azúcares y ácidos orgánicos, por los compuestos fenólicos o por las antocianinas, poseen acción antibacteriana frente a E. coli (33). La acción de los compuestos fenólicos y antocianinas se produce a través de una interacción específica que induce la desintegración localizada de la membrana exterior de la bacteria, y que podría estar relacionada con la quelación de iones metálicos y por la inducción de cambios en la expresión de diferentes genes (33-35). Sin embargo, la actividad de la fracción de azúcares y ácidos orgánicos parece estar relacionada con un efecto de shock osmótico.
Cysticlean®, es uno de los productos del mercado, a base de extracto de arándano americano, que contiene una mayor cantidad de PACs. El objetivo del presente trabajo es comparar la actividad, ex vivo, de dos presentaciones diferentes de Cysticlean®, (sobres y comprimidos), sobre la adherencia de cepas ATCC 10536 de E. coli que han crecido en muestras de orina, obtenidas de ratas que habían consumido este producto. Adicionalmente, se estudia también la actividad in vitro de Cysticlean®, comprimidos sobre la misma cepa de E. coli. En ambos casos, se han utilizado células T24 que han demostrado ser apropiadas para este tipo de ensayos (36-37).
Material y métodos
Muestras de Cysticlean®
Se han utilizado muestras de Cysticlean®, sobres (118 mg PACs/sobre) y comprimidos (118 mg PACs/comprimido) de los lotes EUDC210/C01 y EUDC208/C03, respectivamente, con fecha de caducidad correspondiente diciembre de 2011.
Para el ensayo ex vivo, se obtiene una mezcla homogénea con la cantidad necesaria de comprimidos o sobres de Cysticlean®, previamente molturada de forma manual, y agua para inyección. Las dosis utilizadas han sido de 118 mg PACs/animal y 59 mg PACs/animal.
Para el ensayo in vitro, se obtiene una mezcla homogénea con el contenido de una un comprimido, previamente molturado de forma manual, y la cantidad indicada de medio 5a de McCoy modificado. A partir de ésta, se realizan diluciones seriadas en medio 5a de McCoy modificado. Las concentraciones utilizadas han sido ajustadas de acuerdo a las dosis utilizadas en humanos (118 mg PACs/día), y son: 5, 25 y 75 (mg PACs/mL).
Ensayo de adherencia ex vivo
Se trata de un ensayo basado en la adaptación (38) del publicado por Di Martino et al., (26)
Animales
Se han utilizado ratas Wistar hembra (Harlan Laboratories), de aproximadamente 8-10 semanas y de 205-236 g de peso. Antes de realizar el experimento, los animales permanecen 6 días estabulados, con ciclos de luz/oscuridad de 12 horas y con control de la temperatura y humedad. Las ratas son alimentadas con una dieta estándar Harlan Teklad 2014, con agua ad libitum. Se mantienen en ayunas durante las 6 horas previas al experimento, con agua ad libitum.
Para realizar el ensayo, las ratas se distribuyen aleatoriamente en cinco grupos de tres animales. Se administra el vehículo a los animales control y al resto de animales los distintos tratamientos, por vía oral (20 mL/Kg) mediante sonda gástrica. A continuación, los animales son colocados individualmente en jaulas metabólicas, y aún se mantienen durante 6 horas más en ayunas. Se recoge la orina durante un período de 16 horas. Las muestras de orina recogidas son centrifugadas 15 minutos a 4000 x g, y se esterilizan por filtración (0.45 mm). Se mide el volumen de cada muestra.
Tras el experimento, los animales son sacrificados por sobredosis con pentobarbital sódico.
Preparación del cultivo celular
Se han utilizado células de carcinoma de vejiga humana (T24, ATCC HTB-4TM) cultivadas en medio 5a de McCoy modificado, suplementado con suero fetal bovino (10%), L-glutamina (10 M), penicilina (100 U/mL) y estreptomicina (100 μg/mL). Para obtener monocapas confluentes, las células crecen en portas con pocillos estériles (Chamber slide system, Lab Tek®) y se incuban a 37oC, durante 72 horas, con atmósfera de 5% de CO2.
Preparación de la suspensión de bacterias
Las cepas ATCC 10536 de E. coli crecen durante 27 horas, a 37oC, en las muestras de orina obtenidas, con un contenido de LB del 5% (v/v). Posteriormente, las bacterias se obtienen por centrifugación y son resuspendidas en medio 5a de McCoy modificado a una concentración aproximada de 108 bacterias/mL (26)
Procedimiento del ensayo
Para realizar en ensayo de adherencia, las monocapas de células obtenidas son lavadas tres veces con el tampón PBS. Posteriormente, se añaden las suspensiones de bacterias obtenidas, y se incuban durante una hora, a 37oC. Células tratadas únicamente con medio 5a de McCoy modificado se utilizan como control.
Tras el periodo de incubación, los sobrenadantes son descartados y las monocapas de células son lavadas cinco veces con PBS. A continuación, estas células son fijadas con metanol y teñidas con Giemsa 20% (v/v).
Se observa el número de bacterias adheridas por 10 células por pocillo. Se calcula la media del número de bacterias adheridas por célula, para cada grupo de tratamiento. Se calcula también el porcentaje de inhibición de cada concentración utilizada, de cada producto, respecto al grupo control.
El análisis estadístico de los resultado se realiza mediante el análisis de la varianza (ANOVA) de un factor y para las comparaciones entre grupos se ha aplicado el método Student-Newman-Keuls. Se consideran significativos valores de p<0.05
Ensayo de adherencia in vitro
Se trata de un ensayo basado en la adaptación (39) del publicado por Gupta et al., (40)
Preparación del cultivo celular
Se han utilizado células de carcinoma de vejiga humana (T24, ATCC HTB-4TM) (1.1 x 106 células/mL), cultivadas en medio 5a de McCoy modificado, suplementado con suero fetal bovino (10%), L-glutamina (10 M), penicilina (100 U/mL) y estreptomicina (100 μg/mL). Para obtener monocapas confluentes, las células crecen en portas con pocillos estériles (Chamber slide system, Lab Tek®) y se incuban a 37oC, durante 72 horas, con atmósfera de 5% de CO2.
Preparación de la suspensión de bacterias y preincubación
Las cepas ATCC 10536 de E. coli son sembradas en placas con base de TSA, a 37oC. Posteriormente, se recogen en medio 5a de McCoy modificado. Tras ser lavadas, son resuspendidas a una concentración aproximada de 4 x 108 cfu/mL (40). Esta suspensión de bacterias es resuspendida con 1 mL de cada grupo de tratamiento (por triplicado). Se realiza una preincubación durante 30 minutos, a 37oC, con agitación ocasional.
Procedimiento del ensayo
Para realizar en ensayo de adherencia, las monocapas de células obtenidas son lavadas tres veces con el tampón PBS. Posteriormente, se añaden las suspensiones de bacterias preincubadas con los diferentes tratamientos, y se incuban durante una hora, a 37oC. Células tratadas únicamente con medio 5a de McCoy modificado se utilizan como control.
Tras el periodo de incubación, los sobrenadantes son descartados y las monocapas de células son lavadas cinco veces con PBS. A continuación, estas células son fijadas con metanol y teñidas con Giemsa 20% (v/v).
Se observa el número de bacterias adheridas por 30 células. Se calcula la media del número de bacterias adheridas por célula, para cada grupo de tratamiento. Se calcula también el porcentaje de inhibición de cada concentración utilizada, de cada producto, respecto al grupo control.
El análisis estadístico de los resultado se realiza mediante el análisis de la varianza (ANOVA) de un factor y para las comparaciones entre grupos se aplicó el método Student-Newman-Keuls. Se consideran significativos valores de p<0.05.
Resultados
Inhibición ex vivo de la adherencia de E. coli
La Tabla I muestra la media del número de bacterias adheridas por células para cada grupo de tratamiento y el porcentaje de inhibición obtenido. Se observa un elevado número de bacterias adheridas por célula en el grupo control (29.5 ± 2.15) (38).

El menor número de bacterias adheridas por célula se ha producido en el grupo tratado con Cysticlean®, sobres (4.9 ± 0.89) a la dosis de 118 mg PACs/animal (Figura 1), que equivale a un 83% de inhibición (p<0.05). A esta misma dosis, Cysticlean®, comprimidos produce también una considerable inhibición de la adherencia bacteriana (52%, p<0.05), aunque menor que la obtenida con los sobres (Figura 2).


También es interesante destacar que a la mitad de la dosis recomendada (59 mg PACs/animal), la inhibición de la adherencia bacteriana observada es todavía significativa (p<0.05), tanto con los comprimidos como con los sobres (29% y 40%, respectivamente) (Figura 2).
Inhibición in vitro de la adherencia de E. coli
La Tabla II muestra la media del número de bacterias adheridas por células, para cada concentración de Cysticlean®, comprimidos, y el porcentaje de inhibición obtenido. En el grupo control se ha observado un elevado número de bacterias adheridas (36 bacterias por célula) (39).
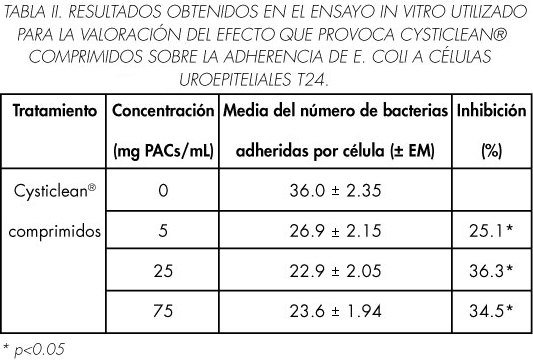
Cysticlean®, ha producido una inhibición estadísticamente significativa, respecto al grupo control, para todas las concentraciones ensayadas. El máximo efecto inhibitorio se observa con la concentración equivalente a 25μg de PACs/mL (36%, p<0.05), que produce un descenso de 36 bacterias adheridas por célula en el grupo control, a 23 en este grupo de tratamiento (Figura 3). A la concentración inferior (5 de PACs/mL) la inhibición producida ha sido del 25% (p<0.05). La concentración superior (75 mg de PACs/mL) produce una inhibición muy similar a la obtenida con la concentración de 25 mg de PACs/ mL (35%, p<0.05), y sin embargo, provoca cambios en la morfología de las células. Este último efecto no se observa con ninguna de las otras dos concentraciones. Estos cambios morfológicos están de acuerdo con los datos obtenidos por otros autores, a partir de concentraciones de PACs superiores a 75 μg/mL, y que habían relacionado con una posible autoaglutinación de las bacterias (40).

Discusión
Cysticlean®, presenta una importante inhibición de la adherencia bacteriana, relacionada con la acción de las proantocianidinas presentes en el arándano americano. Las muestras de orina recogidas de ratas, que previamente habían sido tratadas con Cysticlean®, muestran una considerable inhibición de la adherencia de E. coli a células uroepiteliales. A las dosis utilizadas en humanos, el número de bacterias adheridas a células uroepiteliales (T24), disminuye en un 83% respecto el grupo control cuando a las ratas se les administra Cysticlean®, sobres. A la misma dosis, Cysticlean®, comprimidos produce una reducción del número de bacterias adheridas del 52%. Hecho que podría sugerir una importancia considerable de la formulación del producto. A la dosis inferior (59 mg PACs/animal), ambos productos también presentan una destacada inhibición, 29% tras la administración de Cysticlean®, comprimidos y 40% tras el consumo de Cysticlean®, sobres.
Cuando se valora in vitro la actividad Cysticlean®, comprimidos, utilizando la misma cepa de E. coli y la misma línea de células uroepiteliales, las inhibiciones obtenidas a las concentraciones valoradas son inferiores (25-36%). Siendo máxima a la concentración de 25 μg de PACs/mL (36%). Se ha de tener en cuenta que, la concentración mayor probada (75 mg de PACs/mL) es la más elevada que podría ser valorada, ya que a partir de ésta se observan cambios morfológicos producidos en las células, que indicarían un posible daño celular. Además, la concentración de 75μg de PAsC/mL no produce una mayor inhibición. Esta observación está de acuerdo con trabajos publicados anteriormente, donde a partir de una cierta concentración de zumo de arándano americano no se obtienen mejores resultados, y la disminución de la adherencia de E. coli sobre las células epiteliales se mantiene (31). La diferente actividad observada al comparar los resultados del ensayo in vitro y del ex vivo, pone de manifiesto la importancia de las PACs, u otras sustancias excretadas en orina, como los ácidos fenólicos (41), pero también de sus metabolitos.
Con el uso de Cysticlean® sobres, el preparado que ha mostrado la mayor inhibición de la adherencia bacteriana al urotelio, se ha observado buena tolerancia, fidelidad en el tratamiento y buena efectividad para prevenir la infección urinaria por E. coli.
El efecto inhibidor de la adherencia del E. coli al urotelio es muy deseable en la edad pediátrica, ya que la infección urinaria es especialmente frecuente y recidivante en estos años, agravándose cuando existe reflujo vesicoureteral. En estos casos, la profilaxis antibiótica continua y prolongada durante meses o incluso años provoca efectos indeseables, sobretodo en el tracto intestinal, y aumenta la resistencia bacteriana. Es, por tanto un gran avance el disponer de una fitoterapia eficaz con que sustituir la profilaxis antibiótica tradicional.
La presencia de un extracto de arándano americano con la cantidad de PACs que presenta Cysticlean®, es suficiente para producir una destacable actividad sobre la adherencia bacteriana, sin la necesidad de añadir otras sustancias, como por ejemplo vitamina C. Si bien la vitamina C no ha mostrado un efecto profiláctico en la reducción de las ITUs en todos los estudios realizados, la cantidad recomendada se encuentra por encima de los 100 mg diarios (42). Hecho que contrasta con la presencia de bajas cantidades vitamina C en algunos de los productos comercializados que aportan cantidades diarias muy inferiores a las recomendadas.
Además, diferentes estudios han demostrado que la actividad de la PACs es dosis-dependiente (26,37,40,43). Por este motivo, es importante comprobar que los productos a base de extracto de arándano americano contienen la suficiente cantidad de PACs para conseguir un efecto en la profilaxis y tratamiento de las UTIs. Sin embargo, los diferentes métodos utilizados para la cuantificación de las PACs no permiten una comparación adecuada entre diferentes productos. Los ensayos farmacológicos sobre la adherencia de E. coli podrían ser una buena alternativa para comparar distintos productos a base de arándano americano.
Conclusiones
El presenta estudio muestra la inhibición de Cysticlean®, sobre adherencia bacteriana al urotelio, gracias a la acción de las proantocianidinas presentes en el arándano americano. Cysticlean® proporciona 118 mg de PACs por sobre o por comprimido. El efecto sobre la adherencia de E. coli ha sido demostrado in vitro y ex vivo. Cysticlean®, sobres es el preparado que ha mostrado mayor inhibición de la adherencia bacteriana al urotelio. Con el uso de Cysticlean®, sobres, se ha observado buena tolerancia, fidelidad en el tratamiento y buena efectividad para prevenir la infección urinaria por E. coli. Por todo ello, el uso de Cysticlean®, sobres es también muy recomendable para evitar la infección urinaria en pediatría.
Dada la heterogeneidad de los productos a base de arándano americano existentes en el mercado, por su diferente contenido en PACs y por los distintos métodos analíticos utilizados para su valoración, es interesante considerar la comparación experimental de su actividad farmacológica.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
1. Blanco J, Alonso MP, Blanco M, González EA. Mecanismos patogénicos de Escherichia coli causantes de infecciones extraintestinales. Enferm Infecc Microbiol Clin, 1991; 9(10): 640-651. [ Links ]
2. Kaper HB, Nataro JP, Mobley HL. Pathogenic Escherichia coli. Nat Rev Microbiol, 2004; 2: 123-140. [ Links ]
3. Domingue GJ, Roberts JA, Laucirica R, Ratner MH, Bell DP, Suárez GM. Pathogenic significance of P-fimbriated Escherichia coli in urinary tract infections. J Urol, 1985; 133: 983-989. [ Links ]
4. Wullt B. The role of P fimbriae for Escherichia coli establishment and mucosal inflammation in the human urinary tract. Int J Antimicrob Agents, 2003; 21 (6): 605-621. [ Links ]
5. Bergsten G, Wullt B, Svanborg C. Escherichia coli, fimbriae, bacterial persistence and host response induction in the human urinary tract. Int J Med Microbiol, 2005; 295 (6-7): 487-502. [ Links ]
6. Bergsten G, Wullt B, Schembri MA, Leijonhufvud I, Svanborg C. Do type 1 fimbriae promote inflammation in the human urinary tract?. Cell Microbiol, 2007; 1766-1781. [ Links ]
*7. Howell AB. Bioactive compounds in cranberries and their role in prevention of urinary tract infections. Mol Nut Food Res, 2007; 51: 732-737. [ Links ]
8. Raz R, Chazan B, Dan M. Cranberry juice and urinary tract infection. Clin Infect Dis 2004; 38: 1413-1419. [ Links ]
*9. Jepson RG, Craig J. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev, 2004. CD001321. [ Links ]
10. Nowack R, Schmitt W. Cranberry juice for prophylaxis or urinary tract infections. Conclusions from clinical experience and research. Phytomedicine, 2008; 15: 653-667. [ Links ]
*11. Pérez-López F, Haya J, Chedraui P. Vaccinium macrocarpon: an interesting option for women wiht recurrent urinary tract infections and other health benefits. J Obstet Gynaecol 2009; 35 (4): 630-6309. [ Links ]
12. ESCOP (European Scientific Cooperative on Phytotherapy). ESCOP Monographs: The scientific foundation for herbal medicinal products. Cranberry (Vaccinii macrocarpi fructus). 2a Edición. Suplemento 2009. New York: ESCOP (Exeter), Georg Thieme Verlarg (Stuttgart), Thieme New York, 2009: 255-269. [ Links ]
*13. Avorn J, Monane M, Gurwitz JH, Glynn RJ, Choodnovskiy I, Lipsitz LA. Reduction of bacteriuria and pyuria after ingestión of cranberry juice. JAMA, 1994; 271: 751-754. [ Links ]
14. Walker EB, Barney DP, Mickelsen JN, Walton RJ, Mickelsen RA. Cranberry concentrate. UTI prophylaxis. J Family Pract 1997; 45 (2):167-168. [ Links ]
15. Kontiokari T, Sundqvist K, Nuutinen M, Pokka T, Kostela M, Uhari M. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. Brit Med J, 2001; 322: 1571-1573. [ Links ]
*16. Stothers L. A randomized trial to evaluate effectiveness and cost effectiveness of naturopathic cranberry products as prophylaxis against urinary tract infection in women. Can J Urol, 2002; 9: 1558-1562. [ Links ]
17. Bailey DT, Dalton C, Joseph Daugherty FJ, Tempesta MS. Can a concentrated cranberry extract prevent recurrent urinary tract infections in women? A pilot study. Phytomedicine, 2007; 14: 237-241. [ Links ]
*18. Wing DA, Rummey PJ, Preslicka CW, Chung JH. Daily cranberry juice for the prevention of asymptomatic bacteriuria in pregnancy: a randomized, controlled pilot study. J Urol, 2008; 180:1367-1372. [ Links ]
*19. Hess MJ, Hess PE, Sullivan MR, Nee M, Yalla SV. Evaluation of cranberry tablets for the prevention of urinary tract infections in spinal cord injured patients with neurogenic bladder. Spinal Cord, 2008; 46: 622-626. [ Links ]
20. Blatherwick NR. The specific role of foods in relation to the composition of urine. Arch Inter Med,1914; 14: 409-450. [ Links ]
21. Moen DV. Observations on the effectiveness of cranberry juice in urinary infections. Wisconsin Med J, 1962; 61: 282-283. [ Links ]
22. Monroy-Torres R, Macías AE. ¿Es bacteriostatics el jugo de arándanos? Rev Invest Clin, 2005; 57: 442-446. [ Links ]
23. Duthie GG, Kyle JA, Jenkinson AM, Duthie SJ, Baxter GJ, Paterson JR. Increased salicylate concentrations in urine of human volunteers after consumption of cranberry juice. J Agric Food Chemm, 2005; 53: 2897-2900. [ Links ]
24. Fanos V, Atzei A, Zaffanello M, Piras A, Cataldi L. Cranberry and prevention of urinary tract infections in children. J Chemother, 2006; 18 (3):21-24. [ Links ]
**25. Sobota AE. Inhibition of bacterial adherence by cranberry juice: potential use for the treatment of urinary tract infections. J Urol, 1984; 1: 159-169. [ Links ]
**26. Di Martino P, Agniel R, David K, Templer C, Gaillard JL, Denys P, et al.. Reduction of Escherichia coli adherence to uroepithelial bladder cells after consumption of cranberry juice: a double-blind randomized placebo-controlled cross-over trial. World J Urol, 2006; 24 (1): 21-27. [ Links ]
**27. Zafriri D, Ofek I, Adar R, Pocino M. Inhibitory activity of cranberry juice on adherence of type 1 and type P fimbriated Escherichia coli to eukaryotic cells. Antimicrob Agents Chemother, 1989; 33: 92-98. [ Links ]
**28. Howell AB, Vorsa N, Marderosian AD, Foo LY. Inhibition of the adherence o P-fimbriated Escherichia coli to uroepithelia-cell surfaces by proanthocyanidins extracts from cranberries: N England J Med, 1998; 339 (15): 1085-1086. [ Links ]
**29. Howell AB, Reed JD, Krueger CG, Winterbottom R, Cunningham DG, Leahy M. A-type cranberry proanthocyanidins and uropathogenic bacterial anti-adhesion activity. Phytochemistry, 2005; 66 (18): 2281-2291. [ Links ]
**30. Fo LY, Lu Y, Howell AB, Vorsa N. A-type proathocyanidin trimers from cranberry that inhibit adherence of uropathogenic P-fimbriated Escherichia coli. J Nat Prod, 2000; 63: 1225-1228. [ Links ]
*31. Liu Y, Gallardo-Moreno AM, Pinzón-Arango OA, Reynolds Y, Rodríguez G, Camesano TA. Cranberry changes the physicochemical surface properties of E. coli and adhesión with uroepithelial cells. Colloids Surf B Biointerfaces, 2008; 65 (1): 35-42. [ Links ]
*32. Pinzón-Arango PA, Liu Y, Camesano TA. Role of cranberry on bacterial adhesión forces and implications for Escherichia coli. Uroepithelial cell attachment. J. Med Food, 2009; 12 (2). [ Links ]
33. Lacombe A, Wu WCH, Tyler S, Edwards K. Antimicrobial action of the American cranberry constituents: phenolics, anthocyanins, and organics acids, against Escherichia coli O157:H7. Int J Food Med, 2010; 139 (1-2):102-107. [ Links ]
34. Johnson BJ, Lin B, Rubin RA, Malanoski AP. Media acidification by Escherichia coli in the presence of cranberry juice. BMC Res Notes, 2009; 2: 226. [ Links ]
35. Wu VCH, Qiu X, de los Reyes B, Lin CS, Pan Y. Application of cranberry concentrate (Vaccinium macrocarpon) to control Escherichia coli O157: H7 in ground beef and its antimicrobial mechanim related to the downregulated slp, hdeA and cfa. Food Microbiol, 2009; 26: 32-38. [ Links ]
36. Miyazaki J, Ba-Thein W, Kumao T, Yasuoka MO, Akaza H, Ayshi H. Type 1, P and S fimbria, and afimbrial adhesión I are not essential for uropathogenic Escherichia coli to adhere to and invade bladder epitelial cells. FEMS Immunol Med Microbiol, 2002; 33: 23-26. [ Links ]
*37. Turner A, Chen SN, Joike MK, Pendland SL, Pauli GF, Farnsworth NR. Inhibition of uropathogenic Escherichia coli by cranberry juice: a new antiadherence assay. J Agric Food Chem, 2005; 53 (23): 8940-8947. [ Links ]
38. Sallés M. Cysticlean®. In vivo evaluation study of E. coli adhesión to T24 cells. Informe de Harlam Laboratories (Estudio S24640). [ Links ]
39. Sallés M. Cysticlean®. In vitro evaluation study of E. coli adhesión to T24 cells. Informe de Harlam Laboratories (Estudio S24212). [ Links ]
**40. Gupta K, Chou MY, Howell A, Wobbe C, Grady R, Stapleton AE. Cranberry products inhibit adherence of P-fimbriated Escherichia coli to primary cultured bladder and vaginal epitelial cells. J Urol, 2007; 177 (6): 2357-2360. [ Links ]
41. Prior RL, Rogers TR, Khana RC, Wilkes SE, Wu X, Howard LR. Urinary escretion of phenolic acids in rats fed cranberry. J Agric Food Chem, 2010; 58 (7): 3940-3949. [ Links ]
42. Ochoa-Brust GJ, Fernández AR, Villanueva-Ruíz GJ, Velasco R, Trujillo-Hernández B, Vásquez C. Daily intake of 100 mg ascorbic acid as urinary tract infection prophylactic agent during pregnancy. Acta Obstet Gynecol 2007; 86 (7): 783-787. [ Links ]
43. Lavigne JP, Bourg G,Combescure C, Botto H, Sotto A. In vitro and in vivo evidence of dose-dependent decrease of uropathogenic Escherichia coli virulence after consumption of comercial Vaccinium macrocarpon (cranberry) capsules. Clin Microbiol Infect 2008; 14: 350-355. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Ester Risco
Unidad de Farmacología
Facultad de Farmacia
Universidad de Barcelona
Av Diagonal, 643
08080 Barcelona (España)
erisco@ub.edu.
Aceptado para publicar: 30 de abril 2010.














