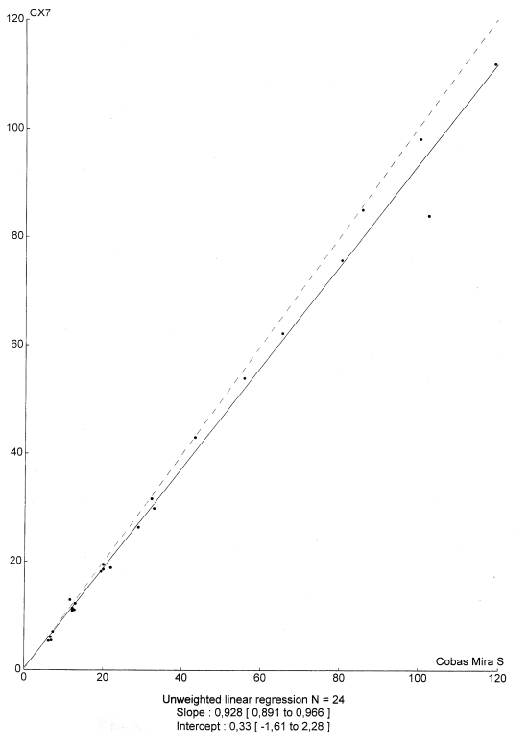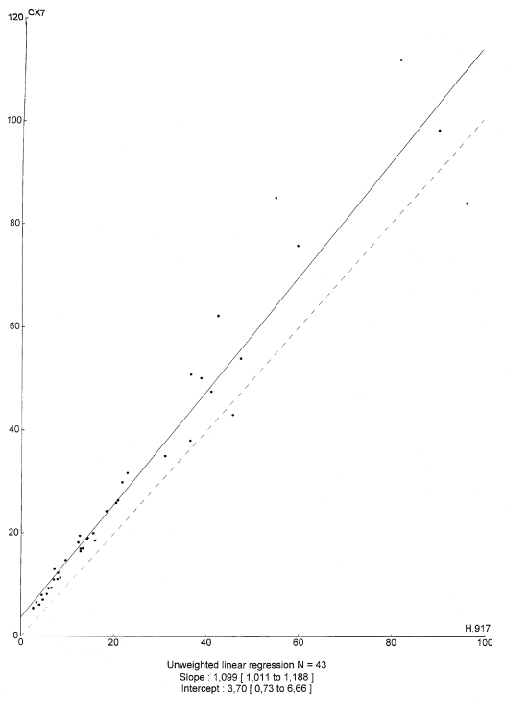My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista de Diagnóstico Biológico
Print version ISSN 0034-7973
Rev Diagn Biol vol.50 n.2 Apr./Jun. 2001
ORIGINAL
Nuevo procedimiento colorimétrico para la determinación
de adenosina desaminasa en líquidos biológicos
A. Bengoa, M. P. Sanz, A. Rus, L. Borque
Servicio de Análisis Clínicos. C. H. San Millán-San Pedro. Logroño. La Rioja.
Palabras clave: adenosina desaminasa, isoenzimas, método colorimétrico, derrame pleural, tuberculosis, automatización.
Key Words: adenosine desaminase, isoenzymes, colorimetric method, pleural effusion, tuberculosis, automation.
Resumen
Se ha evaluado un nuevo reactivo para la determinación del enzima adenosina desaminasa (ADA) en los analizadores Cobas Mira S (Roche) y Synchron CX7 (Beckman), utilizando un método cinético colorimétrico basado en la cuantificación de inosina.
La precisión expresada como coeficientes de variación fue menor del 3% (intradía) y menor del 2.7% (interdía) para valores de ADA entre 15.4 y 112 U/L. El método resultó lineal hasta valores de 395 U/L y presentó un límite de detección menor de 0.5 U/L. No se han observado interferencias debidas a bilirrubina (hasta 25 mg/dL), ni lípidos (Ivelip® hasta 2%), pero sí se observan aumentos significativos en la actividad de ADA debidos a hemolisis. Al comparar este método con un método comercial basado en la detección del amoniaco liberado, se obtuvieron coeficientes de correlación superiores a 0.97 en todos los casos.
En conclusión, el nuevo procedimiento evaluado presenta una buena practicabilidad junto con una precisión y sensibilidad satisfactorias; por lo que resulta adecuado para las determinaciones urgentes y de rutina de adenosina desaminasa en fluídos biológicos.
Summary
A new improved reagent for ADA (adenosine deaminase ) has been evaluated in COBAS Mira S (Roche) and Synchron CX7 (Beckman) autoanalyzers, using a kinetic colorimetric method based in the inosine determination.
The precision expressed as of coefficients of variation was lower than 3% (intra assay) and lower than 2.7% (inter assay) for ADA between 15.4 and 112 U/L.
The method was linear up to 395 U/L and it presented a detection limit lower than 0.5 U/L.
Interferences have not been observed due to bilirrubin (up to 25 mg/dl) and lipid (Ivelip® up to 2%), but hemoglobin interferred with ADA increasing it.
The comparison of the present method with the commercially method based on the detection of liberated NH3, obtained correlation coefficients greater than 0.97 in all cases.
In conclusion, this new reagent evaluated demonstrated a good practicability together with a satisfactory precision and sensitivity; its appears to be suitable for the stat and the routine determinations of adenosine deaminase in body fluids.
Recibido: 11-IX-00
Aceptado: 27-I-01
Correspondencia: Luis Borque de Larrea
Servicio de Análisis Clínicos. C.H. San Millán-San Pedro
C/Autonomía de La Rioja 3. 26003. Logroño
Introducción
La adenosina desaminasa (adenosina aminohidrolasa, EC 3.5.4.4, ADA) es una enzima de la vía de la recuperación de las purinas que cataliza la desaminación irreversible de la adenosina (y desoxiadenosina) para formar inosina (y desoxiinosina) y amonio1.
La determinación de ADA en líquido pleural resulta útil en el diagnóstico de tuberculosis pleural2,3,4 presentando la ventaja de
ser un método rápido y sencillo, en comparación con otros métodos habitualmente empleados para el diagnóstico, como son la bacteriología e histología. Aunque no existe una estandarización universal, se considera que concentraciones catalíticas de ADA superiores a 45 U/L en líquido pleural en una persona joven con intradermorreacción de Mantoux positiva, hacen el diagnóstico de tuberculosis pleural tan probable que no precisa de biopsia pleural5. No obstante, en los últimos años se han descrito algunas causas capaces de incrementar la actividad de este enzima, como son las neoplasias linfoides, ciertas enfermedades autoinmunes y el empiema6. Por otro lado, un valor de ADA inferior al punto de corte permite descartar de forma casi absoluta el origen tuberculoso del derrame. Aunque en individuos inmunodeprimidos la medida de esta enzima puede presentar cierta limitación por la presencia de un número no despreciable de falsos negativos.
Se han descrito numerosos métodos6,7,8,9,10 para la determinación de la actividad de ADA.
Existen métodos radiométricos que utilizan como sustrato adenosina marcada con 14C o 3H. Pero se trata de métodos que, aunque son muy sensibles, requieren instrumental del que no siempre se dispone en los laboratorios clínicos. Además son métodos lentos.
Entre los métodos espectrofotométricos cinéticos destacan aquellos en los que se determina el amoniaco liberado en la reacción de desaminación catalizada por el ADA11. El método en que se determina el amoniaco mediante la reacción de deshidrogenación del ácido 2-cetoglutárico presenta la ventaja de ser fácilmente automatizable. Sin embargo, hay que tener en cuenta que es necesario un blanco de muestra para eliminar interferencias por amoniaco endógeno y exógeno.
En otro tipo de métodos se calcula la actividad del ADA mediante la determinación de la inosina12 liberada en la reacción de desaminación a través de una serie de reacciones enzimáticas acopladas.
En el presente trabajo, se presenta la adaptación de un nuevo reactivo comercial (ADA ref. 760550 LIQUO-Chem. Reactivos ITC Diagnostics. IZASA S.A. Barcelona. España) para la determinación colorimétrica de ADA, basado en la cuantificación de inosina, a los analizadores Cobas Mira S (Roche) y Synchron CX7 (Beckman-Coulter).
El procedimiento es evaluado para la medida de ADA en líquido pleural y los resultados se comparan con los obtenidos por un procedimiento comercial utilizado habitualmente en los laboratorios para la medida del ADA.
Material y métodos
Instrumentación, reactivos y principios de medida
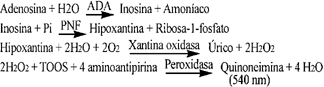
La actividad del enzima ADA fue determinada con los reactivos Adenosin Deaminasa (ADA) LIQUO. Chem. (ADA ref. 760550), suministrados por ITC Diagnostics, Barcelona (IZASA S.A.). Se trata de un método cinético colorimétrico basado en la acción hidrolítica del enzima ADA sobre la adenosina para formar inosina, sobre la que actúa la purina nucleósido fosforilasa (PNF) para dar lugar a hipoxantina y ribosa-1-fosfato. La hipoxantina es oxidada a ácido úrico y peróxido de hidrógeno por acción de la xantina oxidasa. Se determina el peróxido de hidrógeno formado mediante la 4-amino-antipirina y la N-etil-N-(2-hidroxi-3-sulfopropil)-3-metilanilina (TOOS) en presencia de peroxidasa produciendo un compuesto coloreado, según el siguiente esquema:
Este método se adaptó a los analizadores Cobas Mira S (Roche) y Synchron CX7 (Beckman), según las programaciones que se muestran en la Tabla 1.
Tabla 1. Parámetros de medición
| Tipo de reacción | CINÉTICA | CINÉTICA | |
| Unidades | U/L | U/L | |
| Precisión decimal | X.X | X.X | |
| Calibradores | 21.0 U/L | Calibrador 1:0.00 U/L Calibrador 2:21.00 U/L | |
| Longitud de onda | 550 mm | Primaria 560mm Secundaria 700 mm | |
| Muestra | Volumen | 10µL | 8µL |
| Tiempo de adición | 25 seg | 2 seg | |
| R1 | Volumen | 180µL | 200µL |
| Tiempo de adición | 25 seg | 2 seg | |
| R2 | Volumen | 90µL | 75µL |
| Tiempo de adición | 250 seg | 592 seg | |
| Blanco de reactivo (lectura) | 375 seg | Iniciar lectura: 500 seg Fin lectura: 520 seg | |
| Reacción (lectura) | 625 seg | Iniciar lectura: 820 seg Fin lectura: 1020 seg | |
Muestras:
Líquidos pleurales almacenados a -20ºC hasta el momento de su análisis.
Calibración:
Calibrador específico para ADA, AUTO-Plus (Ref. 767664), de origen humano, liofilizado.
Precisión:
La determinación de la precisión se realizó para 3 mezclas de líquidos pleurales con niveles diferentes de ADA (alto, medio y bajo).
La precisión intradía se obtuvo realizando 20 medidas a cada uno de los 3 niveles, el mismo día. Mientras que la precisión interdía se calculó midiendo alícuotas de cada uno de los niveles durante 20 días, realizando una única calibración al comienzo del ensayo.
Linealidad:
Para el estudio de la linealidad se emplearon 4 líquidos pleurales con actividades de ADA comprendidas entre 19.1 U/L y 556.4 U/L. A partir de esos cuatro líquidos se prepararon diluciones seriadas, empleando como diluyente suero fisiológico.
Límite de detección:
Para establecer el límite de detección de la técnica, se analizaron diez replicados de un blanco de solución salina, calculándose la media y la desviación estándar de las medidas de absorbancia obtenidas.
Correlación:
El estudio de comparación de métodos se realizó con 52 líquidos pleurales obtenidos de pacientes de nuestro hospital con valores de ADA entre 2 y 115 U/L. Los resultados obtenidos con el método adaptado en los analizadores Cobas Mira S y CX7 se compararon con los encontrados mediante un procedimiento comercial ADA Test Combination® (Roche. Mannheim) en un analizador Hitachi 917 siguiendo las instrucciones del fabricante.
Interferencias:
Se evaluaron las posibles interferencias producidas por bilirrubina, hemólisis y lipemia13. Para ello se utilizó una mezcla de líquidos pleurales cuya concentración de ADA era 58.3 U/L a la que se le añadieron cantidades crecientes de las sustancias interferentes a ensayar.
- Bilirrubina: se añadió bilirrubina (SIGMA.Chemical.CO.St Louis.USA B 4126). previamente disuelta con dimetilsulfóxido y NaOH, ajustando a un pH adecuado con HCl 0,1 N.
- Hemoglobina: se obtuvo un hemolizado a partir de un tubo de sangre con valores hematológicos normales.
- Lipemia: Se utilizó el Ivelip® 20% (RF 693440, Baxter. S.A, Valencia, España). Se trata de una emulsión grasa vegetal de aceite de soja (20 g/100 mL).
Resultados
Calibración:
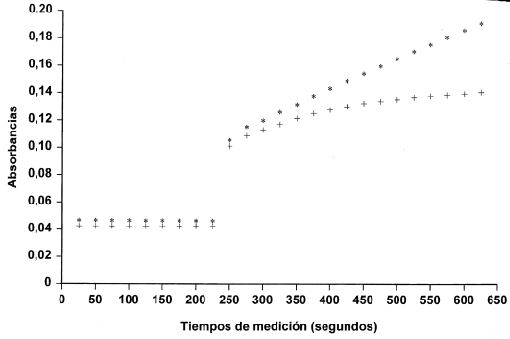
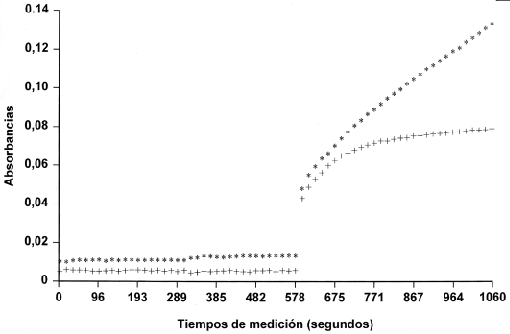
En las figuras 1A y 1B se representan las cinéticas de reacción del blanco y del calibrador utilizados en la calibración de ADA en el analizador Cobas Mira S y Synchron CX-7.
Figura 1A. Cinéticas de reacción para el Suero Fisiológico (+) y para el Calibrador (*) en el Cobas.
Figura 1B. Cinéticas de reacción para el Suero Fisiológico (+) y para el Calibrador (*) en el Syncrhon CX7.
Precisión:
Los resultados de los estudios de imprecisión intra e interdía se muestran en la tabla 2. En todos los casos la imprecisión fue menor del 3%.
Tabla 2: Estudio de precisión:
Precisión intradía (N=20)
| MEDIA (U/) | D.S. | C.V. (%) | ||||
| NIVEL | COBAS MIRA | CX7 | COBAS MIRA | CX7 | COBAS MIRA | CX7 |
| BAJO | 15.4 | 15.2 | 0.13 | 0.39 | 0.8 | 3.0 |
| MEDIO | 33.3 | 33.2 | 0.16 | 0.27 | 0.5 | 1.0 |
| ALTO | 112.0 | 83.6 | 0.58 | 0.45 | 0.5 | 1.0 |
| MEDIA (U/L) | D.S. | C.V. (%) | ||||
| NIVEL | COBAS MIRA | CX7 | COBAS MIRA | CX7 | COBAS MIRA | CX7 |
| BAJO | 16.5 | 14.5 | 0.44 | 0.42 | 2.7 | 2.6 |
| MEDIO | 38.0 | 32.3 | 0.99 | 0.47 | 2.6 | 0.8 |
| ALTO | 83.8 | 82.1 | 1.31 | 0.87 | 1.6 | 0.5 |
Linealidad:
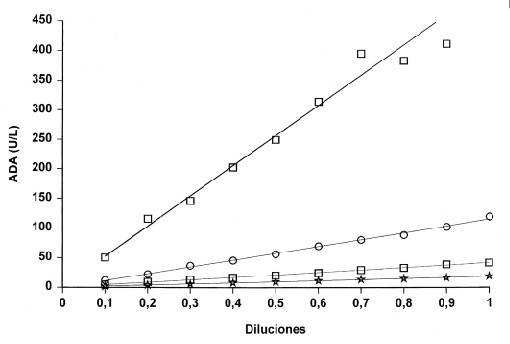
Los resultados se muestran en la figura 2.
Figura 2.Estudio de linealidad para 4 niveles de ADA.
Para los niveles de concentración de ADA muy bajo, bajo, medio y alto, los coeficientes de determinación r2 fueron 0.9986, 0.9977, 0.9964 y 0.978, respectivamente. Siendo la linealidad presentada con el nuevo reactivo en el analizador Cobas Mira S buena en el intervalo de concentraciones estudiado.
Correlación:
Los resultados de la comparación de las concentraciones catalíticas de ADA obtenidos con los analizadores Cobas Mira S, Synchron CX7 (ambos con el procedimiento colorimétrico) e Hitachi 917 (por un método UV) se expresan en las figuras 3A y 3B.
Figura 3A. Correlación entre Cobas Mira y Syhnchron CX7
Figura 3. Correlación entre Hitachi 917 y Synchron CX7
Para calcular las rectas de regresión se utilizó el método de Passing-Bablok con un intervalo de confianza del 95 % para la ordenada en el origen y la pendiente, obteniéndose los resultados que se muestran en la tabla 3.
Tabla 3: Resultados del estudio de correlación de Passing-Bablok para
los analizadores Synchron CX7, Cobas Mira S e Hitachi 917.
| Correlación | m | OO | r |
| CX7-COBAS MIRA S | 0.957 | -0.32 | 0.996 |
| CX7-H917 | 1.200 | 1.86 | 0.969 |
m: pendiente de la recta de regresión. OO: ordenada en el origen. r: coeficiente de correlación
Interferencias:
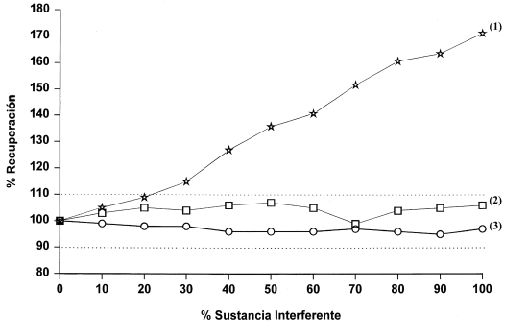
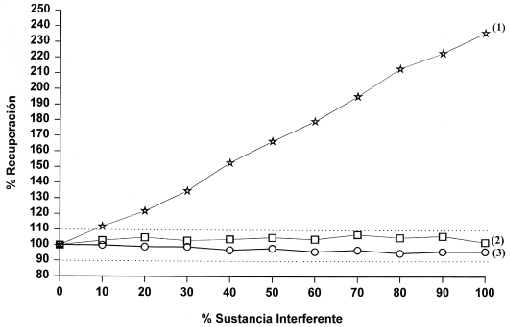
Para observar las posibles interferencias se representa el porcentaje de recuperación frente al porcentaje de sustancia interferente (figuras 4A y 4B). En ambas, se observa que concentraciones de bilirrubina hasta 25 mg/dl (427 mmol/l) e Ivelip® hasta 2% no afectaron la determinación de ADA ( diferencias en el % de recuperación <10%). En el caso de la hemoglobina se observaron aumentos significativos en la actividad de ADA a partir de una concentración de hemoglobina de 4.2 g/l en el analizador Cobas Mira S o de 2.1 g/l , en el CX7.
Figura 4A. Estudio de interferencias por hemoglobina (1), lípidos (2) y bilirrubina (3) en el Cobas Mira S.
Figura 4B. Estudio de interferencias por hemoglobina (1) , lípidos (2) y bilirrubina (3) en el CX7
Límite de detección:
Calculando la media de las absorbancias más 3 desviaciones estándar de la señal del blanco (solución salina) se obtuvo para ambos analizadores un valor de ADA menor de 0.5 U/L.
Discusión
La isoenzima 2 del enzima ADA, se considera un indicador del recambio de la línea monocito/macrófago y por lo tanto, la determinación de la actividad del ADA en fluídos biológicos se emplea en el diagnóstico de la tuberculosis pleural y peritoneal, así como en la meningitis tuberculosa. La medida de la actividad de ADA se realiza habitualmente mediante métodos espectrofotométricos que pueden ser fácilmente utilizados en los analizadores de bioquímica clínica. A pesar de que los líquidos biológicos se reciben en el laboratorio de urgencias, es frecuente que la determinación de ADA se efectúe posteriormente como una prueba de bioquímica no urgente y que el resultado se entregue de forma separada al resto de las determinaciones bioquímicas realizadas en el líquido.
El método estudiado en el presente trabajo, consiste en un sistema birreactivo en el que, tras una incubación inicial de la muestra con el primer reactivo (R1), la reacción se inicia al adicionar el sustrato de adenosina presente en el segundo reactivo (R2). Este procedimiento permite eliminar algunas posibles interferencias debidas a la presencia de inosina o hipoxantina en la muestra, gracias a la xantina oxidasa, la purina nucleósido fosforilasa y la catalasa presentes en el reactivo R1. Cuando se adaptan estas condiciones a los analizadores Cobas Mira S y Synchron CX7, los blancos de reacción obtenidos en ausencia de ADA, presentaban un significativo desarrollo de color a 550 nm. Una posible solución para estabilizar el blanco de reacción podría ser iniciar la reacción con la adición de la muestra, tras la mezcla de los dos reactivos. En estas condiciones, el blanco obtenido resultó estable y los resultados obtenidos correlacionaban bien con el método de comparación ( r=0.998). Sin embargo, la reproducibilidad interserie no fue aceptable, especialmente cuando se utilizaron líquidos pleurales previamente congelados. Todo ello sugiere que el periodo de incubación del ADA en el medio de reacción es importante para que se alcance un estado estable; de ahí la necesidad de realizar la medición tras un tiempo de incubación de la muestra con el reactivo. Por ello, finalmente, se recomienda usar la programación propuesta por el fabricante, con ligeras variaciones en la relación de los volúmenes de reactivos y tiempos de adición de los mismos, para ajustarlos a las características concretas de cada analizador. Para minimizar el efecto de la inestabilidad del blanco de muestra, se eligieron unos periodos de lectura lo más alejados posible del momento de adición del segundo reactivo.
Los procedimientos presentaron una adecuada reproducibilidad, en ambos analizadores, con unos coeficientes de variación que oscilaron entre el 0,5% y el 3% (reproducibilidad intradía) y el 0,5% al 2,7% (interdía, tras calibración única). Los rangos de medida resultaron superiores a 395 U/L y los límites de detección inferiores a 0,5 U/L.
Las muestras hemolizadas presentan valores falsamente elevados, probablemente debidos a un aumento del isoenzima 1 del ADA o también llamado eritrocitario, por ser la única forma que posee el hematíe.
Las muestras lipémicas o ictéricas, sin embargo, pueden ser cuantificadas mediante este método sin interferencias significativas.
Los resultados obtenidos en los analizadores Cobas Mira S y CX7 correlacionan bien entre sí pero se observan diferencias con los encontrados mediante el método de comparación empleado, sobre todo a concentraciones altas. Así, para líquidos pleurales con actividad de ADA elevada, se observaron valores superiores con el método a evaluar que los obtenidos con el de referencia. Probablemente esto se deba a que este nuevo método que se evalúa presenta un rango analítico superior (hasta 395 U/L), mientras que el de comparación sólo es lineal hasta 100 U/L, teniendo que realizar una dilución a partir de dicho valor.
En conclusión, la medida de ADA en los analizadores CX7 y Cobas Mira S mediante el método espectrofotométrico estudiado, presenta unas buenas características analíticas, y los reactivos son estables y no requieren preparación. Por todo ello, estos procedimientos pueden ser utilizados para la determinación de ADA en líquidos biológicos, como un parámetro de bioquímica en el momento de recibir la muestra en el laboratorio de urgencias.
Bibliografía
1. Sociedad Española de Bioquímica Clínica y Patología Molecular. Isoenzimas y formas múltiples de las enzimas en Bioquímica Clínica. Monografía del Comité de Publicaciones de la SEQC. 1996; 11: 13-15. [ Links ]
2. Villena V, Navarro Gonzalez JA, García-Benayas C, Manzanos JA, Echave J, López-Encuentra A, Arenas Barbero J. Rapid automated determination of adenosine deaminase and lysozime for differentiating tuberculous and nontuberculous pleural effusions. Clin Chem 1996; 42: 218-221. [ Links ]
3. Sánchez Hernandez IM, Usseti Gil P, Melero Moreno C, Rey Duran R. Tuberculosis: aspectos epidemiológicos. Etiopatogenia. Manifestaciones clínicas. Diagnóstico. Medicine (Barc) 1998; 7: 3666-3671 [ Links ]
4. Martínez JM, Ocaña I. Eficacia diagnóstica de la adenosina desaminasa (ADA) en las serositis tuberculosas. Enf Infec Microbiol Clin 1989; 7: 48-53. [ Links ]
5. Segura RM, Pascual C, Ocaña I, Martinez-Vázquez JM, Ribera E, Ruiz I, Pelegrí D. Adenosine Deaminase in body fluids: a useful diagnostic tool in tuberculosis. Clin Biochem 1989; 22: 141-148. [ Links ]
6. Ena j, Valls V, Pérez de Oteyza C, Enriquez de Salamanca R. Utilidad y limitaciones de la adenosina desaminasa en el diagnóstico de la pleuresía tuberculosa. Estudio metaanalítico. Med Clin 1990; 95: 333-335. [ Links ]
7. Sociedad Española de Química Clínica. Adenosina desaminasa. Monografía de la Comisión de Educación de la SEQC 1990; 3: 81-97. [ Links ]
8. Kaplan NO. Specific Adenosine Deaminase from Intestine. Methods Enzymol 1955; 2:473-5. [ Links ]
9. Heinz F. Adenosine Deaminase: UV-method. Bergmeyer HU, ed. Methods in Enzymatic Analysis. Vol 4, 3rd ed. Weinheim: Verlag Chemie, 1984: 308-315. [ Links ]
10. Ellis G, Goldberg DM. A reduced nicotinamide adenine dinucleotide-linked kinetic assay for adenosine deaminase activity. J Lab Clin Med 1970; 76:507-17. [ Links ]
11. Giusti G. Adenosine deaminase. Bergmeyer HU, Ed.:Methods of enzymatic analysisis. Vol II. New York: Academic Press, 1974; 1092-1099. [ Links ]
12. Oosthuizen HM, Ungerer JPJ, Bissbort SH. Kinetic Determination of Serum Adenosine Deaminase. Clin Chem 1993; 39: 2182-2185 [ Links ]
13. Sociedad Española de Bioquímica Clínica. Estudio de la interferencias analíticas endógenas en química clínica. Quim Clin 1994; 13: 84-92. [ Links ]