Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista de Diagnóstico Biológico
versión impresa ISSN 0034-7973
Rev Diagn Biol vol.50 no.3 jul./sep. 2001
Premio AEBM-Menarini 2001
Caracterización biomolecular del cáncer de laringe:
relación entre ploidia, actividad proliferativa y LOH en la región 9p21
I. Zanna**, M.T. Sanz-Casla, M.L. Maestro, V. Bazan**, S. Corsale**, P.L. Quintana**, N. Gebbia***,
R. Bernáldez****, J.A. Campillo, D. S-Rueda, S. Valor, A. Russo**
Servicio de Análisis Clínicos. Sección Biología Tumoral. Hospital Clínico San Carlos. Madrid.
**Laboratorio de Oncobiología, Departamento de Oncología, Universidad de los Estudios de Palermo, Italia.
*** Servicio de Quimioterapia, Departamento de Oncología, Universidad de los Estudios de Palermo, Italia.
**** Servicio de ORL. Hospital La Paz. Madrid.
Palabras clave: Cáncer, Laringe, 20H, p16
Key words: Cancer, Laryngeal, 20H, p16
Resumen
El carcinoma escamoso de laringe o LSCC (Laryngeal Squamous Cell Carcinoma) representa más del 95% de las neoplasias de laringe. Representa cerca del 2% de todos los cánceres humanos en el mundo Occidental y es una importante causa de muerte entre los tumores de cabeza y cuello. A pesar de los avances en el estudio de LSCC los indicadores pronóstico "clasicos" no permiten identificar los pacientes con elevado riesgo de recaída o muerte. En los últimos años se intentan identificar nuevos factores biológicos para predecir la evolución del tumor. El objetivo de este trabajo es el estudio de los factores biológicos implicados en el carcinoma escamoso de laringe: actividad proliferativa (SPF), contenido celular de DNA y la determinación de posibles alteraciones genéticas en el gen supresor p16, pérdida de heterocigosidad (LOH) y mutaciones puntuales.
Este estudio se realizó en 56 pacientes intervenidos quirúrgicamente de cáncer de laringe. Se realizó la evaluación de la ploidía y de la SPF mediante citometría de flujo. Para la valoración de la LOH en el gen p16 se realizó extracción de DNA, electroferesis en un gel de poliacrilamida al 8% y coloración con nitrato de plata. Las mutaciones en el gen p16 fueron detectadas mediante análisis SSCP después de la amplificación mediante PCR del exón 1.
Se detectó aneuploidía en el 63% de los pacientes y de ellos el 9% presentaban multiclonalidad. En nuestra serie de pacientes, el 21% presentaba LOH en la región 9p21 (locus D9S1747). El análisis mutacional del exón 1 se realizó con DNA genómico. La LOH en la región 9p21 estaba asociada a SPF (p<0.05) y a la aneuploidía del DNA (p<0.05) Además observamos una asociación significativa entre aneuploidia y SPF (p<0.01). No se encontró ninguna asociación entre LOH, ploidía, de DNA, SPF y las otras características clinicopatológicas estudiadas.
Este estudio demuestra la existencia de aneuploidía y de SPF en LSCC y también evidencia la estrecha relación entre las variables citométricas estudiadas y la LOH de p16. Por lo tanto, en las células aneuploides de LSCC, en las cuales está aumentada la actividad proliferativa, la pérdida de este gen supresor p16 estimularía dicha proliferación celular favoreciendo la aparición de otras alteraciones geneticas.
Correspondencia: Mª Luisa Maestro de las Casas
Hospital Clínico San Carlos
Servicio de Análisis Clínicos. Sección de Biología Tumoral
C/Martín Lago s/n. 28040 - Madrid
Introducción
El carcinoma escamoso de laringe o LSCC (Laryngeal Squamous Cell Carcinoma) representa más del 95% de las neoplasias de laringe. Representa cerca del 2% de todos los cánceres humanos en el mundo Occidental y es una importante causa de muerte entre los tumores de cabeza y cuello1. Esta enfermedad se caracteriza por su elevada morbi-mortalidad y el tratamiento generalmente implica alteraciones estéticas, por lo tanto, es uno de los tumores de mayor interés social2. LSCC es más frecuente en los hombres con hábito tabáquico y bebedores y el pico de incidencia se observa a los 60 años. Distintos estudios epidemiológicos realizados han demostrado que el tabaco es la causa principal de cáncer de laringe. Otros factores implicados son: mal uso de la voz, laringitis crónicas, factores dietéticos, reflujo gástrico, etc3. Parece que existe una asociación entre cáncer de laringe y abuso de alcohol, aunque distintos autores afirman que el alcohol sólo aumenta el riesgo atribuido a otros factores y que, por lo tanto, no existe una asociación directa. Por todo ello, es de gran interés prevenir este tipo de tumores, diagnosticarlos en estadios precoces y disminuir su morbimortalidad. Clásicamente se han considerado como factores pronóstico la clasificación TNM, establecida por la AJCC-American Joint Committee on Cancer Staging for Laryngeal Cancer 4,5, el grado de diferenciación6,7, el tipo histológico8-10 y el tipo de invasión microscópica. La localización anatómica del tumor también ha sido indicada como un importante criterio en el pronóstico del LSCC. Según este criterio, los tumores de la supraglotis son más agresivos y presentan un peor pronóstico4,6,11,12, los tumores de la glotis son menos agresivos y los de la subglotis son más raros, representando sólo del 1-2% de todos los casos de cáncer de laringe. A pesar de los avances en el estudio de LSCC estos indicadores pronóstico no permiten identificar los pacientes con elevado riesgo de recaída o muerte y no se ha conseguido mejorar la supervivencia a los 5 años, siendo todavía ésta inferior al 50% aproximadamente11.
Sería interesante conocer mejor el comportamiento biológico del cáncer de laringe, lo que nos permitiría aplicar nuevas estrategias terapéuticas para mejorar la supervivencia. En los últimos años se intentan identificar nuevos factores biológicos para predecir la evolución del tumor13. Esta información nos orientaría en el tratamiento, seguimiento posterior y detección temprana de recidiva tumoral, además de ayudarnos a facilitar una mejor información al paciente y sus familiares. Entre los factores de valor pronóstico, nos interesan aquellos que nos den información sobre el posible comportamiento biológico del tumor, ya que tumores con el mismo tipo histológico e idéntico TNM pueden presentar evoluciones diferentes. Esto es debido a las distintas características biológicas de las células tumorales. En los últimos años son muchos los factores pronóstico estudiados en el LSCC entre los que se encuentran: índice de proliferación celular, ploidía de DNA, expresión de proteínas, oncogenes y genes supresores de tumores14,15.
Revisando la literatura hay publicaciones que muestran que la mayoría de los tumores, incluyendo los de cabeza y cuello con elevada actividad proliferativa y con un contenido celular aneuploide tienen una evolución más agresiva. Las técnicas tradicionales para medir la actividad proliferativa incluyen el índice mitótico y el índice de timidina tritiada (ITT)16, que es un método autoradiográfico para medir las células durante la fase de síntesis del DNA.
Otro parámetro ampliamente estudiado es la medida del porcentaje de células en la fase S del ciclo celular mediante citometría de flujo que, también, nos da información sobre la existencia de anomalías clonales de DNA. La gran cantidad de estudios clínicos realizados hasta la fecha han puesto de manifiesto que, además de proporcionar una información de gran valor sobre la biología de las células, la cuantificación del DNA celular mediante citometría de flujo podría contener información clínica útil tanto para el diagnóstico como para la evaluación pronóstica y el seguimiento de los pacientes, siendo la aneuploidía del DNA característica de las neoplasias malignas. Aunque el valor pronóstico de la ploidía celular ha sido demostrado para muchos tumores sólidos, su papel en LSCC sigue siendo controvertido17.
En los tumores de cabeza y cuello están implicados oncogenes como c-myc, erbB-2, EGFR y ciclina D y genes supresores de tumores como p16 y p5318-21. Sin embargo, en estos tumores las alteraciones moleculares que inducen el desarrollo y la progressión de LSCC no son todavía conocidas.
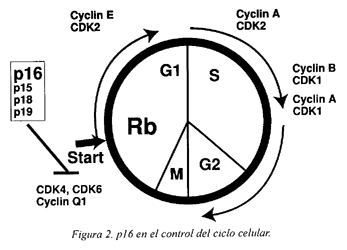
Estudios de citogenética han mostrado frecuentes deleciones en la región cromosómica 9p21. Esta región es una zona de frecuente pérdida alélica (LOH) en la mayoría de los tumores humanos22. Se ha demostrado que en esta región esta localizado el gen supresor de tumores llamado p16. El gen p16 esta situado en el locus INK4a y está formado por tres exones: el exón 1 tiene 125 pb, el exón 2, 307 pb y el exón 3, 12 pb23. Este gen codifica las proteínas p16 y p16b (Figura 1). La proteína p16 para el ciclo celular en la fase G1 mediante la inhibición de los complejos ciclina D/CDK4-624 (Figura 2). Los mecanismos de inactivación de p16 son pequeñas deleciones (LOH), mutaciones puntuales e hipermetilación a nivel de las regiones reguladoras (promotores). La metilación representa el mecanismo más frecuente de represión transcripcional.
El objetivo de este trabajo es el estudio de los factores biológicos implicados en el carcinoma escamoso de laringe: actividad proliferativa, contenido celular de DNA y la determinación de posibles alteraciones genéticas en el gen supresor p16, pérdida de heterocigosidad (LOH) y mutaciones puntuales.
Pacientes y Método
Periodo de estudio.
Este trabajo se ha realizado durante el periodo comprendido entre Abril de 1990 y Marzo del 2001. Los pacientes que entraron a formar parte del estudio fueron intervenidos quirúrgicamente durante los años 1990 a 1998.
Población de estudio.
Se trata de un estudio de cohortes prospectivo. La población objeto de nuestro estudio se compone de un total de 56 pacientes. Dichos pacientes fueron intervenidos quirúrgicamente por carcinoma de laringe, cuyo diagnóstico fue confirmado por el análisis histológico de la pieza de resección y/o biopsia obtenida durante el acto quirúrgico en todos los casos.
Metodología clínica.
Se realizó sistemáticamente en todos los pacientes una detallada historia clínica, estudios radiológicos, estudios ecográficos y determinaciones analíticas básicas. De los 56 pacientes, ninguno había recibido tratamiento previo de quimioterpia ni de radioterapia.
Durante el acto quirúrgico se procedió a la exeresis del tumor y a la obtención de dos tipos de muestras, una de la zona macroscópicamente afectada por el tumor y otra de la zona no afectada por el tumor. A continuación se procedió al lavado de las mismas con abundante suero fisiológico, con objeto de limpiar los restos de sangre y moco, y se eliminó de grasa. Cada muestra se dividió en dos fragmentos, uno para los distintos parámetros a analizar en el laboratorio y otro destinado al estudio histopatológico. El primero se introdujo en tubos de plástico y se congeló en el mismo quirófano, introduciéndolo en un termo de nitrógeno líquido (N2 líquido) o nieve carbónica. En ningún caso el tiempo transcurrido entre la extracción de la pieza quirúrgica y la congelación sobrepasó los 5 minutos. Una vez transportada la muestra, se procedió a su almacenamiento en un ultracongelador de -800C, hasta el momento de su procesamiento definitivo.
A todos los pacientes se les realizó un seguimiento posterior. La mediana del tiempo de seguimiento fue de 50 meses. No fue posible realizar el seguimiento en tres pacientes. De los 56 pacientes, en el momento de realizar este análisis habían fallecido 22 pacientes (39%), 20 de ellos como consecuencia de su patología tumoral y 2 por otras causas diferentes. Con respecto a la recidiva tumoral, durante el periodo de nuestro estudio se detectó recidiva en 21 pacientes (38%).
Metodología analítica
* Extracción de DNA El tejido fue digerido en una solución (SDS al 10%, EDTA 1mM TRIS 50 mM y 0,5mg/ml de proteinasa K) durante 12 horas a 37°C. La extracción de DNA se realizó mediante un método convencional con fenol-cloroformo. El precipitado de DNA se rehidrató y su calidad y concentración se verificó en un gel de agarosa al 1,5 % y coloración con bromuro de etidio.
* Estudio de la pérdida de heterocigosidad en la región 9p21 (LOH)
Amplificación de DNA. La amplificación de la secuencia se realizó en un volumen final de 50 ml que contenía 50 ng de DNA genómico, 8ml de tampón estándar para PCR (10x PCR buffer II de Roche), 1.25 mM de MgCl2 20 pmol de cada primer del marcador D9S1747 (Progenetic), 200 mM de dNTP (Perkin Elmer) y 0.5 U de Taq DNA polimerasa (Amplitaq Roche). La amplificación se realizó en un termociclador (Gene Amp PCR system 9600 de Perkin Elmer) con un ciclo inicial de 5 min a 95°C para desnaturalizar el DNA. Después de la desnaturalización a 95ºC 5 min., se añadieron 2,5 U de Taq DNA polimerasa a cada muestra . Se realizaron 30 ciclos (30 seg. a 94ºC, 60 seg. a 55ºC, 60 seg. a 70ºC) seguidas de 10 min. a 72ºC. En cada amplificación se incorporó un control negativo. En todas las amplificaciones se utilizaron puntas con filtro para evitar contaminación.
Electroforesis y revelado. Se realizó una electroforesis en un gel de poliacrilamida al 8% en TBE al 0.5%. Además de las muestras se cargaron un blanco y un leader (Phi 174/Hae II markers de Promega) para comparar el tamaño de los fragmentos de la amplificación. El gel se reveló con una disolución de nitrato de plata al 0.1%.
* Análisis SSCP (Single Strand Conformation Polimorphysm). Las mutaciones en el gen p16 fueron detectadas mediante análisis SSCP después de la amplificación mediante PCR del exón 1 (17).
Amplificación de DNA. La amplificación de la secuencia se realizó en un volumen final de 100ml que contenía: 0,5 mg de DNA genómico, 200mM dNTPs y 50 pmoles de cada primer in 1,5 mM MgCl2 , 50 mM KCl, 10 mM Tris HCl (pH 8,3). La amplificación se realizó en un termociclador (Gene Amp PCR system 9600 de Perkin Elmer). Después de la desnaturalización a 94ºC 5 min., se añadieron 2,5 U de Taq DNA polimerasa a cada muestra . Se realizaron 30 ciclos (30 seg. a 94ºC, 30 seg. a 58ºC, 60 seg. a 72ºC) seguidas de 10 min. a 72ºC. En cada amplificación se incorporó un control negativo. En todas las amplificaciones se utilizaron puntas con filtro para evitar contaminación. La calidad y la concentración de los productos de amplificación se verificó en un gel de agarosa al 1,5 % y coloración con bromuro de etidio.
Análisis SSCP. Se desnaturalizaron alícuotas de 100 ng del producto de amplificación, purificado y concentrado después de filtración a través columnas Microcon 50, y se analizaron mediante electroforesis (a una temperatura de 22ºC) en un gel de poliacrilamida al 20% en buffer TBE (90mM Tris-borato, 2mM EDTA) a 400V durante 1,5h-2h. Para mantener la temperatura constante la electroforesis se realizó en un sistema DGGE (C.B.S. Scientific Company Del Mar, CA) equipado con un KR-50ª refrigerador de inmersión. Después el gel se reveló con bromuro de etidio (0,5 mg/ml). El análisis PCR-SSCP se realizó por duplicado en cada muestra para minimizar la posibilidad de contaminación o errores de la polimerasa. El DNA de tejido normal de laringe de cada paciente fue amplificado y se valoró con el correspondiente tejido tumoral en gel SSCP, para comprobar la presencia de mutaciones germinales o polimorfismos.
* Análisis de Citometría de Flujo. La citometría de flujo del DNA se realizó en muestras de tejido congelado disgregadas mecánicamente y después de la incorporación de yoduro de propidio como describió Russo et al. (25). El análisis de los histogramas de DNA se realizó mediante Multicycle Software Program (Phoenix Flow Systems, San Diego CA) (26,27). Para medir la cuantía de la alteración se ha acordado utilizar el termino índice de DNA. Este índice representa el cociente entre la cantidad de fluorescencia detectada para la medida estadística de la moda de las células tumorales en las fases G0/G1 de ciclo celular y la moda de la fluorescencia obtenida para las células normales diploides en las mismas fases del ciclo célular.
La ploidía del DNA, el DI (índice de DNA) y el SPF se determinaron como se ha descrito previamente (25). Por cada muestra tumoral de laringe se utilizó tejido normal como control interno de DNA diploide. Los tumores con DI=1 se definieron como DNA diploides (Figura 3a) y los tumores con valor de DI mayores o menores se consideraron DNA aneuploides, siempre que la muestra tuviese más del 10% de células aneuploides (Figura 3b ). En este último supuesto, cuando el índice de DNA es superior a 1, estamos ante una hiperploidía de DNA, y cuando es inferior a 1 ante una hipoploidía de DNA. Muestras con más de un clon aneuploide se definieron como multiclonales (Figura 3c).
Metodología estadística
Se obtuvieron los porcentajes totales de LOH, aneuploidía, SPF, y mutaciones puntuales y se realizó la comparación entre la frecuencia de las alteraciones y las distintas variables clínicas cualitativas por el método del c2 o mediante el test de Fisher cuando no se pudo aplicar el primero. Las variables cuantitativas se compararon mediante la prueba de la t de Student. Se calcularon los riesgos relativos como magnitud de la asociación y sus intervalos de confianza del 95%.
Resultados
Se estudió una serie de 56 pacientes diagnosticados de carcinoma de laringe (55 varones /1 mujer). La edad media fue de 64,2 ± 8.3 años, con un rango entre 42 y 80 años. De los 56 pacien tes 46 eran bebedores (82%) y 25 fumadores (45%).
Según el estadio, los tumores se clasificaron en estadio II (7%), estadio III (55%) y estadio IV (38%) (Figura 4a). Con relación al grado de diferenciación se distribuyeron los tumores en tres grupos,: tumores bien diferenciados 20 (36%); tumores moderadamente diferenciados 26 (46%) y poco diferenciados 10 (18%) (Figura 4b). Según el tamaño tumoral se clasificaron en: 7 T2 (13%); 32 T3 (57%) y 17 T4 (30%) (Figura 4c). Con relación a la afectación tumoral de los ganglios se clasificaron en tres grupos: 38 sin afectación ganglionar (68%); 8 con afectación de menos de 2 ganglios (14%) y 10 con invasión de 2 o más de 2 ganglios (18%) (Figura 4d). Con respecto a la localización, 27 eran tumores de la supraglotis (49%), 26 de la glotis (46%) y 3 de la subglotis (5%) (Figura 4e ).
Evaluación del contenido celular de DNA y de la actividad proliferativa (SPF)
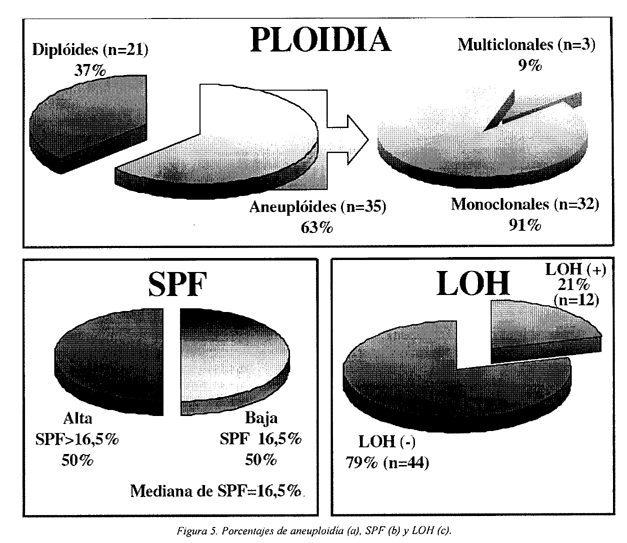
Se detectó aneuploidía en el 63% de los pacientes (35/56) y de ellos el 9%(3/35) presentaban multiclonalidad (Figura 5a).
Según la localización el 63% (17/27) de los tumores de la supraglotis y el 54% (14/26) de los tumores de la glotis mostraban aneuploidía. Con respecto al grado de diferenciación, el 54% (10/20) de los pacientes con grado G1, el 58% (15/26) de los pacientes con grado G2 y el 100% (10/10) de los pacientes con grado G3 presentaban aneuploidía.
En relación al estadio tumoral, el 50% (2/4) de los pacientes con estadio II, el 55% (17/31) de los pacientes con estadio III y el 76% (16/21) de los pacientes con estadio IV mostraban aneuplodía.
El 70% (32/46) de los fumadores y el 72% (18/25) de los alcohólicos mostraban aneuploidia
La mediana de SPF fue de 16.5% (rango 3.2%-38,3%). rango interquartílico 7,5%-19,8%. Utilizando este valor como valor umbral los tumores han sido clasificados como tumores con baja actividad proliferativa si presentaban una SPF £16,5 (50%) y tumores con alta actividad proliferativa si tenían una SPF >16,5 (50%) (Figura 5b).
Según la localización, el 63% (17/27) de los tumores de la supraglotis y el 39% (10/26) ) de los tumores de la glotis mostraban una alta actividad proliferativa.
Con respecto al grado de diferencicación, el 30% (6/20) de los pacientes con grado G1, el 58% (15/26) de los pacientes con grado G2 y el 100% (10/10) de los pacientes con grado G3 mostraban una alta actividad proliferativa.
En relación al estadio el 25% (1/4) de los pacientes con estadio II, el 52% (16/31) de los pacientes con estadio III y el 52% (11/21) de los pacientes con estadio IV mostraban una alta actividad proliferativa.
El 65% (30/46) de los fumadores y el 60% (15/25) de los alcohólicos mostraba alta actividad proliferativa.
LOH del gen p16.
En nuestra serie de pacientes, el 21% (12/56) presentaba LOH en la región 9p21 (locus D9S1747) (Figura 5c y Fotografia 1).
Según la localización el 63% (6/27) de los tumores de la supraglotis y el 39% (10/26) ) de los tumores de la glotis mostraban LOH..
Según el grado el 22% (4/20) de los pacientes con grado G1, el 19% (5/26) de los pacientes con grado G2 y el 10% (1/10) de los pacientes con grado G3 mostraban LOH.
Con respecto al estadio el 16% (5/31) de los pacientes con es tadio III y el 33% (7/21) de los pacientes con estadio IV mostraban LOH. Ningún paciente en estadio II presentaba pérdida.
El 20% (9/46) de los fumadores y el 28% (7/25) de los alcohólicos mostraba LOH.
Análisis mutacional del gen p16 .
El análisis mutacional del exón 1 se realizó con DNA genómico en una serie de 56 pacientes y en su correspondiente tejido sano.
La presencia de un fragmento con diferente movilidad electroforética se observó en 1 caso (<5%) (Fotografia 2) .
Estudio de la relación de los factores biológicos con las variables clínicopatológicas.
La LOH en la región 9p21 estaba asociada a la aneuploidía del DNA (p<0.05) (Tabla I). Además observamos una asociación significativa entre aneuploidía y SPF (p<0.01) y entre LOH y SPF (p<0.05) (Tabla II). No se encontró ninguna asociación entre LOH, ploidía, de DNA, SPF y las otras características clinicopatológicas estudiadas.
Discusión
Hasta la fecha, la estadificación clínica, la histología y el grado de diferenciación del tumor (factores pronóstico clásicos), así como el estado físico del paciente han sido considerados los principales factores pronóstico en el cáncer de laringe, pero frecuentemente se encuentran pacientes con una evolución desfavorable4-10. Por lo tanto, es aceptado por la comunidad científica que las características morfológicas de los tumores no pueden explicar el diferente comportamiento, así como la respuesta al tratamiento, en pacientes con el mismo estadio. Surge entonces la necesidad de encontrar nuevos indicadores biológicos de progresión tumoral que nos ayuden a comprender el porqué de una mayor o menor supervivencia y las posibilidades de recaída de la enfermedad para, al final, elegir un tratamiento más individualizado. Dentro de estos denominados "nuevos factores", que pretenden explicar el comportamiento y la biología del tumor, se encuentran el contenido celular de DNA y la actividad proliferativa (SPF), los genes supresores de tumores y los oncogenes.
La ploidía y la SPF han sido estudiadas en diferentes tumores de cabeza y cuello28 y en la mayoría aparecen como factores pronóstico independientes. Entre estos tumores, sin embargo, su papel en LSCC sigue siendo controvertido29,30. En estos estudios el porcentaje de aneuploidía varía entre un 20% y un 87% 31,33 dependiendo principalmente de el diferente método utilizado en la determinación de las variables citométricas.
De hecho en la técnica influye el tipo de conservación de la muestra tumoral, (tejido rápidamente congelado o tejido fijado en parafina), la heterogeneidad tumoral y las características de la cohorte de pacientes en particular el tipo histológico y el grado de diferenciación. En nuestra serie la aneuploidía se encontró en el 63% de los casos de acuerdo con otros autores34,35. Este valor es uno de lo más altos encontrados en la literatura, probablemente por dos razones: 1) en todas las muestras examinadas el análisis se realizó utilizando partes distintas del mismo tumor, que reduce, la probabilidad de perder clones celulares aneuploides; 2) La conservación de las muestras a -80°C en lugar de la fijación en parafina. Aunque el análisis de muestras en parafina permite una evaluación retrospectiva de un gran numero de muestras, este método podría comprometer la fiabilidad de los resultados a causa de la presencia de una gran cantidad de detritus, de una escasa resolución de los histogramas y de un alto coeficiente de variación.
En nuestra serie la SPF era significativamente mayor (p<0.01) en tumores aneuploides respecto a los diploides; esta asociación podría ser explicada de dos maneras distintas: los clones celulares aneuploides tienen una mayor actividad proliferativa o, al contrario, en células con una fase S más larga aumenta la probabilidad que se encuentren alteraciones genéticas y se formen clones celulares aneuploides.
Además se observó que la aneuploidía era más frecuente en tumores de la supraglotis, más agresivos, sin que esto fuera significativo.
Los tumores de cabeza y cuello se caracterizan por presentar un acúmulo de alteraciones moleculares las cuales conducen a un crecimiento descontrolado y a una diseminación metastática. Todavía, en el cáncer escamoso de laringe las alteraciones genéticas presentes en los tumores no han sido tan ampliamente estudiadas. En nuestro trabajo nos hemos centrado en el estudio de uno de los genes supresores de tumores implicados en la aparición del LSCC: el gen p16 cuya pérdida alélica parece ser muy importante36. Sin embargo, a lo largo de estos años se han publicado distintos trabajos en tumores de cabeza y cuello con porcentajes de LOH tan dispares como del 16% hasta el 85% 37-40. Recientemente se encontró LOH en el locus 9p21 en lesiones preinvasivas de tumores de cabeza y cuello sugiriendo que esta alteración genetica es un evento precoz en la progresión de estos tumores. Con respecto al LSCC en la literatura encontramos muy pocos trabajos que valoren la LOH de p16 y los porcentajes varían desde un 23% hasta un 57%. Estas diferencias se deben al tipo de tumor analizado, al numero de pacientes incluidos en el estudio y al locus específico examinado37-39.
En nuestra serie de 56 LSCC que, hasta la fecha, representa la serie más numerosa encontrada en la literatura, el porcentaje de pérdida fue del 21% estando asociada significativamente con la ploidía (p<0.05) y con la SPF (p<0.05). Además observamos un mayor porcentaje de pérdida en los estadios III y IV sin que esto fuera significativo. Estos resultados sugieren que en LSCC las pérdidas alélicas del gen p16 representan un evento tardío en el desarrollo del tumor de laringe.
Sin embargo, muchos autores han demostrado que en la mayoría de los tumores, incluyendo los de cabeza y cuello, la presencia de mutaciones puntuales en el gen p16 no es muy frecuente siendo el porcentaje inferior a un 5%41. De acuerdo con estos datos, en nuestra serie sólo hemos encontrado un paciente con una mutación en el exón 1. Esto confirmaría que las mutaciones puntuales no son el principal mecanismo de inactivación de p16.
Concluyendo, este estudio demuestra la existencia de aneuploidía y de SPF en LSCC y también evidencia la estrecha relación entre las variables citométricas estudiadas y la LOH de p16. Por lo tanto, en las células aneuploides de LSCC, en las cuales está aumentada la actividad proliferativa, la pérdida de este gen supresor p16 estimularía dicha proliferación celular favoreciendo la aparición de otras alteraciones geneticas.
Este estudio nos demuestra la necesidad de aumentar la casuística para confirmar los resultados obtenidos y para intentar clasificar los tumores de laringe según parámetros biológicos el cual podría reflejar un determinado comportamiento biológico. Por todo esto estamos estudiando, en la misma serie de pacientes, el estado de metilación de p16, que se propuso como otra forma más de alteración del gen, y también las mutaciones puntuales en el exón 2.
Es importante comprobar, si todas estas alteraciones genéticas presentan relación con las variables clínico-patológicas y con los factores pronóstico de los pacientes con LSCC.
Por lo tanto nuestro objetivo final será valorar si existe una asociación entre estos indicadores biomoleculares y el intervalo libre de enfermedad y la supervivencia global.
Bibliografía
1. Batsakis JK: Tumours of head and neck: clinical and pathological considerations. Baltimore, William and Wilkins, 1979. [ Links ]
2. Field JK and Spandidos DA: Expression of oncogenes in human tumours with special reference to the head and neck region. J Oral Pathol 1987, 16: 97-107. [ Links ]
3. Spitz MR: Epidemiology and risk factors for head and neck cancer. Seminars in Oncology 1994, 21: 281-288. [ Links ]
4. Tomasino RM, Daniele E, Bazan V, Morello V, Tralongo V, Nuara R, Nagar C, Salvato M, Ingria F, Restivo S, Dardanoni G, Vecchione A and Russo A: The prognostic significance of cell kinetics in laryngeal squamous-cell carcinoma: clinico-pathological associations. Clin Cancer Res 1996, 12: 608-611. [ Links ]
5. Vaupel P, Kallinowski F and Okunieff P: Blood flow, oxygen and nutrient supply and metabolic microenvironment of human tumours: a review. Cancer Res 1989, 49: 6449-6465. [ Links ]
6. Tera E, Moreno A and Galindo L: Prognostic factors in laryngeal carcinoma. A multifactorial study of 416 cases. Cancer 1986, 58: 928-934. [ Links ]
7. Eiband JD, Elias EG, Suter CM, Gray WC and Didolkar MS: Prognostic factors in squamous-cell carcinoma of the larynx. Am J Surg 1989, 158: 314-317. [ Links ]
8. Broders AC: Carcinoma grading and practical application. Arch Pathol 1926, 2: 376-381. [ Links ]
9. Kashima HK: The caracteristicts of laryngeal cancer correlating with cervical lymph node metastasis. Workshops from the Centennial Conference on Laryngeal Cancer. Toronto, Canada. Appleton. Century Crofts, 1974: 855-864. [ Links ]
10. Sala O and Ferlito A: Morphological observations of immunology of laryngeal cancer. Acta Otolaryngol (Stockh) 1976, 81: 353-363. [ Links ]
11. Sessions RB, Harrison LB and Hong WK: Tumours of the larynx and hypopharynx. Cancer principles and practic of oncology (De vita V jr, Hellman S and Rosenberg SA, eds). Philadelphia, JB Lippincott Company, 1993: 631-654. [ Links ]
12. Fracchiolla NS, Pignataro L, Capaccio P, Trecca D, Boletini A, Ottaviani A, Polli E, Maiolo AT and Neri A: Multiple genetic lesions in laryngeal squamous-cell carcinomas. Cancer 1995, 75: 1292-1301. [ Links ]
13. Fielding LP, Fonoglio-Preseir CM, Fredman LS: The future of prognostic factors in outcome prediction for patients with cancer. Cancer 1992, 70: 2367-2377. [ Links ]
14. Tennvall J, Wennerberg J, Willen R, Ask A, Baldertorp B and Ferno M: T3N0 glottic carcinoma: DNA S-phase as a predictor of the outcome after raditherapy. Acta Otolaryngol (Stockh) 1993, 113: 220-224. [ Links ]
15. Munck-Wikland E, Edstrm S, Jungmark E and Auer G: Nuclear DNA content, proliferating-cell nuclear antigen (PCNA) and p53 immunostaining in predicting progression of laryngeal cancer in situ lesions. Int J Cancer 1994, 56: 95-99. [ Links ]
16. Silvestrini R, Daidone MG, Di Fronzo G, Morabito A, Valagussa P and Bonadonna G: Prognostic implication of labelling index versus-oestrogen receptors and tumour size in node-negative breast cancer. Breast Cancer Res Treat 1986, 7: 161-167. [ Links ]
17. Russo A, Bazan V, Gebbia N, Tumminello FM, Dardanoni G, Pizzolanti G, Ingria F, Restivo S, Tomasino RM, and Leto G: Flow cytometric DNA analysis and lysosomal cathepsins B and L in locally Advanced laryngeal cancer: relationship with clinico-pathological parameters and prognostic significance. Cancer 1995, 6: 345-349. [ Links ]
18. Nagai MA: Genetic alterations in head and neck squamous cell carcinomas. Braz J Med Biol Res 1999, 32(7): 897-904. [ Links ]
19. Field JK, Spandidos DA, Stell PM, Vaughan ED, Evan GI and Moore JP: Elevated expression of the c-myc oncoprotein correlates with poor prognosis in head and neck squamous cell carcinoma. Oncogene 1989, 4: 1463-1468. [ Links ]
20. Greenblatt MS, Bennet WP, Hollstein M and Harris CC: Mutations in the p53 tumor suppressor gene: Clues to cancer etiology and molecular pathogenesis. Cancer Res 1994, 54: 4855-4878. [ Links ]
21. Burns JE, Baird MC, Clarck LJ, Burns PA, Edigton K, Chapman C, Mitchell R, Robertson G, Soutar D and Parkinson EK: Gene mutation and increased levels of the p53 protein in human squamous cell lines. Brit J Cancer 1993, 67: 1774-1784. [ Links ]
22. CairnsP, Poladcik TJ, Eby Y et al: Frequency of homozygous deletion at p16/CDKN2 in primary human tumors. Nature Genet 1995, 11: 210. [ Links ]
23. Ligget WH et al: Role of the p16 tumor suppressor gene in cancer. J. Clin. Onc 1998, 16 (3): 1197-1206. [ Links ]
24. Serrano M, Hannon GJ and Beach D: A new regulatory motif in cell-cycle control causing specific inhibitor of cyclin D/CDK4. Nature 1993, 366: 704-707. [ Links ]
25. Russo A, Bazan V, Morello V, Tralongo V, Nagar C, Nuara R, Dardanoni G, Bazan P and Tomasino RM: Vimentin expression, proliferating cell nuclear antigen and flow cytometric factors. Anal Quant. Cytol. Histol 1994, 16: 365-374. [ Links ]
26. Dean PN and Jett JH: Mathematical analysis of DNA distribution derived from flow cytometry. J Cell Biol 1974, 60: 523-527. [ Links ]
27. Rabinovitch PS: Numerical compensation for the effects of cell clumping on DNA histograms. Cytometry 1990, 4: 27. [ Links ]
28. Milroy CM, Devaney KO, Ferlito A and Rinaldo A: Role of DNA measurements of head and neck tumours. Annals of Otology, Rhinology and Laryngology 1997, 106: 801-804. [ Links ]
29. Welkoborsky HJ, Dienes HP, Hini M and Mann WJ: Predicting recurrence and survival in patients with laryngeal cancer by means of DNA cytometry, tumor front grading and proliferation markers. Annals of Otology, Rhinology and Laryngology 1995, 104: 503-510. [ Links ]
30. Del Valle-Zapico A, Fernandez FF, Suarez AR, Angulo CM and Quintela JR: Prognostic value of histopathologic parameters and DNA flow-cytometry in squamous cell carcinoma of the pyriform sinus. Laryngoscope 1998, 108: 269-272. [ Links ]
31. Sakr W, Hussan M, Zarbo R, Enesly J and Crissman J: DNA quantitation and histologic characteristic of squamous cell carcinoma of the upper aerodigestive tract. Archives of Path Lab Med 1989, 113: 1009-1014. [ Links ]
32. Danic D, Milicic D, Prgomet D and Leovic D: Prognostic factors in carcinoma of the larynx: relevance of DNA-ploidy, S-phase fractions and localization of the tumour. J of Laryngology and Otology 1999, 113: 538-541. [ Links ]
33. Sampredo A, Alvarez C, Martinez JA, Suarez C, Alonso-Guervos M and Ramon J: Cell proliferation activity and kinetic profile in the prognosis and therapeutic management of carcinoma of the pharynx and larynx. Otolaryngol Head Neck Surg 1999, 121: 476-481. [ Links ]
34. Goldsmith M, Cresson D, Postma D et al: Significance of ploidy in laryngeal cancer. Am J Surg 1986, 152: 396-402. [ Links ]
35. Lampe HB: DNA analysis of head and neck squamous carcinoma by flow cytometry. Laryngoscope 1993, 103: 637-644. [ Links ]
36. Jares P, Fernandez PL, Nadal A, Cazorla M, Hernandez L, Pinyol M, Hernandez S, Traserra J, Cardesa A and Campo E: p16MTS1/CDK4I mutations and concomitant loss of heterozygosity at 9p21-23 are frequent events in squamous cell carcinoma of larynx. Oncogene 1997, 15: 1445-1453. [ Links ]
37. Wu D, Fu W, Jiang L, Zhang X, Li F, Guo X and Sun K: Loss of heterozygosity and microsatellite instability in laryngeal carcinoma near p16 gene. Zhonghua Yi Xue Yi Chuan Xue Za Zhi 1999, 16: 99-102. [ Links ]
38. Jares P, Nadal A, Fernandez PL, Pinyol M, Hernandez L, Cazorla M, Hernandez S, Bea S, Cardesa A and Campo E: Disregulation of p16MTS1/CDK4I protein and mRNA expression is associated with gene alterations in squamous-cell carcinoma of the larynx. Int J Cancer 1999, 81: 705-711. [ Links ]
39. Rizos E, Sourvinos G and Spandidos DA: Loss of heterozygosity at 8p, 9p and 17q in laryngeal cytological specimens. Oncol 1998 34: 519-523. [ Links ]
40. Kiaris H, Spanakis N, Ergazaki M, Sourvinos G and Spandidos DA: Loss of heterozygosity at 9p and 17q in human laryngeal tumors. Cancer Lett 1995 97: 129-134. [ Links ]
41. Okamoto A, Hussain SP, Hagiwara K et al: Mutations in the p16INK4 and p15INKB in primary and metastatic lung cancer. Cancer Res 1995, 55:1448. [ Links ]