Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.29 no.4 abr. 2005
ORIGINAL
Innovaciones en la compresión de los efectos de la isquemia fría en el injerto renal
E. Lledó García, I. Berenguer García*, D. Rodríguez Martínez*, G. Pedemonte,
C. Hernández Fernández, J.F. Del Cañizo López*
Servicio de Urología. Unidad de Preservación Renal Experimental.
*Laboratorio de Circulación Artificial. Dpto. de Medicina y Cirugía Experimental.
Hosp. Univ. Gregorio Marañón. Madrid.
|
En el trasplante renal es frecuente la presencia de un período postoperatorio de disfunción inicial del injerto. Este hecho puede asociarse, como ha sido demostrado en algunas series, con una peor evolución funcional del riñón trasplantado a medio y largo plazo. La presencia de isquemia normotérmica y conservación en hipotermia así como las lesiones producidas en el momento de la reperfusión del órgano son eventos que pueden condicionar, mediante la interacción de factores inmunológicos e isquémicos esos trastornos. Algunas maniobras técnicas y farmacológicas, así como la optimización de las condiciones de preservación del órgano pueden aumentar el porcentaje de órganos con función inmediata, lo que tendría consecuencias económicas significativas (menor número de sesiones complementarias de diálisis, acortamiento del ingreso hospitalario). Estos avances pueden mejorar la supervivencia tanto del injerto como del paciente a medio y largo plazo.
En este artículo resumimos algunos avances actuales en la comprensión de la lesión renal por isquemia. La perfusión de órgano aislado puede posibilitar, no solamente la conservación del mismo, sino también el diseño de pruebas de viabilidad que permitan seleccionar los mejores riñones. Actualmente, la única selección a la que se puede someter al injerto es el propio trasplante.
INTRODUCCIÓN
El trasplante renal de donante cadáver implica la existencia de períodos variables de isquemia fría (IF). La IF se relaciona en algunos trabajos con peor supervivencia tanto del injerto como del paciente. La distribución nacional de los injertos intenta mejorar el tipaje de los trasplantes. Esta maniobra prolonga la isquemia fría y aumenta las lesiones en el órgano. La preservación se realiza más frecuentemente mediante hipotermia simple por inmersión del injerto en solución de conservación. La isquemia fría es capaz de producir en tiempos prolongados lesiones específicas.
La isquemia afecta al injerto en varias fases (Figura 1-Tabla 1). Designaremos como A: agresión (estímulos físicos o circulatorios que pueden alterar la función o estructura celular renal) y C: cambios térmicos. Durante el período de donante potencial pueden existir períodos de hipotensión que inducen cuadros de hipoperfusión renal (A1), incluso con deterioros agudos de la función renal. Ya en el momento de la extracción, desde el inicio de la perfusión intraaórtica existe un período de tiempo hasta que el órgano se enfría de forma eficaz. Este enfriamiento no suele ser, evidentemente, tan intenso como el que conseguiremos mediante la inmersión del injerto. Podríamos hablar de un paso sucesivo por estados de "isquemia normotérmica" (C1)-"isquemia tibia" (C2) e "isquemia fría" (C3). Esto, junto con la práctica frecuente de llenar el campo quirúrgico de hielo que entra directamente en contacto con el órgano (A2), produce lesiones del injerto variables, tanto más intensas cuanto más subóptimo sea el donante, con necrosis celular. Por otro lado, la perfusión no suele realizarse en muchas ocasiones por gravedad, sino con una maniobra de aplicación de presión positiva forzada. Esta práctica habitual es muy lesiva para la microcirculación renal, como ha demostrado nuestro grupo experimentalmente1 (A3). Produce hipoperfusiones segmentarias y oclusión de los pequeños vasos. Durante la fase de disección quirúrgica del órgano post-perfusión la temperatura vuelve a ascender (C4), lo que intentamos muchas veces contrarrestar añadiendo más hielo al campo (A4). Tras la nefrectomía realizamos la cirugía de banco: en esta fase podemos suponer que se utiliza un medio frío (4ºC) y protegiendo adecuadamente al órgano del contacto con hielo (C5). Finalmente, el riñón es lavado mediante nueva canulación arterial con solución de preservación. En algunas ocasiones vuelve a repetirse la maniobra de forzar la perfusión con presurizador, en lugar de perfundir por gravedad a 100 cm de altura (A5). Una vez completado el lavado, se procede a inmersión en una cantidad variable de la misma: en este momento se inicia, realmente, la fase de isquemia fría estable (C6-C7).
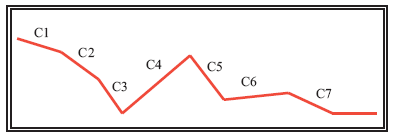
FIGURA 1. Modificaciones térmicas del órgano en el donante hasta su extracción y conservación.
C1: Inicio perfusión intraaórtica; C2-C3: perfusión intraaórtica; C4: disección órgano;
C5: hielo en campo quirúrgico; C6: cirugía banco; C7: inmersión hipotérmica definitiva.
EFECTO PARADÓJICO DE LA ISQUEMIA FRÍA
La hipotermia es la única situación que permite mantener al órgano con opciones de viabilidad al ser trasplantado. El lavado rápido de los órganos con su posterior inmersión en medio de preservación a 4ºC intenta prolongar la viabilidad celular. La hipotermia sin embargo, prolonga la isquemia, manteniendo o aumentando las lesiones celulares. Este estado, que posibilita la movilidad del injerto de una ciudad a otra o, incluso entre países, no sólo protege el órgano, también puede dañarlo. La isquemia fría produce unas lesiones celulares específicas, que son más importantes cuanto más tiempo tarde el riñón en ser trasplantado2,3. Una compleja cascada de procesos, como la pérdida de ATP, acumulación de hipoxantina, disfunción de la bomba Na+-K+, edema celular o acúmulo de calcio citosólico van a desencadenarse4.
Existen dos efectos combinados que inducen lesión del órgano por isquemia: el primero, la isquemia-hipotermia (período que comprende la extracción del riñón y su preservación a 4ºC). El segundo, la isquemia-reperfusión (que abarca el tiempo de sutura vascular y revascularización del injerto)2. La primera fase produce alteraciones en la producción energética de la célula, con pérdida del ATP, paso de metabolismo aerobio a anaerobio con acidosis láctica intracelular, acúmulo de calcio citoplásmico, destrución mitocondrial. En el segundo período (isquemia reperfusión), los cambios del órgano se relacionan con el calentamiento del mismo, con producción masiva de radicales libres de oxígeno5 (por reacción del oxígeno con la hipoxantina produciéndose aniones superóxido y peróxido de hidrógeno), lesiones por células inflamatorias –leucocitos, linfocitos activados-, activación de enzimas proteolíticas calcio-dependientes e independientes y, en último término, disfunción endotelial con hipoperfusión del órgano6-8.
SOLUCIONES PARA PRESERVACIÓN
La preservación hipotérmica (inmersión simple o perfusión en máquina) es la forma más efectiva de disponer de órganos válidos para trasplante. Permite conseguir el tiempo preciso para el transporte del órgano hasta el lugar donde se encuentre el receptor con mejor condición inmunológica, o bien preparar al paciente para la recepción del trasplante. La preservación de injertos para trasplante es un proceso que depende de tres aspectos importantes: hipotermia, prevención del edema celular y efecto bioquímico de la solución. El objetivo de estos factores, junto con unos tiempos de isquemia cortos, es conseguir el mayor porcentaje de riñones funcionantes de forma inmediata. La composición de la solución de preservación parece ser un factor limitante crítico del proceso. Aunque no se dispone aún de un líquido ideal, sí hemos aprendido mucho en las dos últimas décadas sobre la composición del mismo y los requerimientos del órgano.
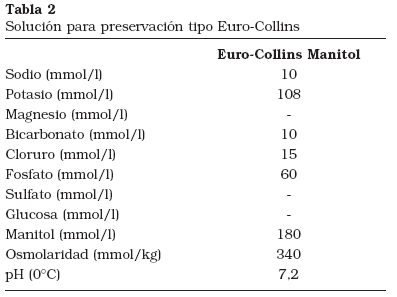
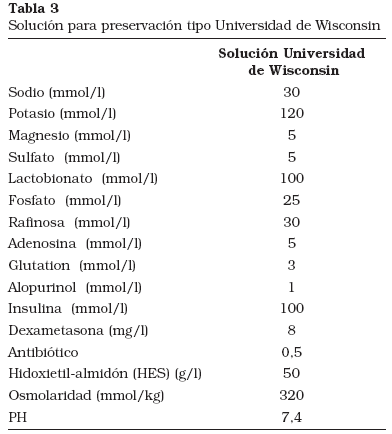
Las dos soluciones históricamente más utilizadas para la preservación del injerto renal mediante hipotermia simple han sido Eurocollins (EC) y Universidad de Wisconsin-Viaspan® (UW) (Tablas 2 y 3). La solución EC fue desarrollada por G. Collins en 19699. Su composición era sencilla, basándose en altas concentraciones de glucosa y una concentración de iones similar al medio intracelular. Pudo observarse que la utilización de esta solución a 4ºC permitía aumentar el tiempo de conservación previo al trasplante. Sin embargo, no resultaba efectiva para otros órganos distintos al riñón, ni tampoco en tiempos prolongados de preservación. En 1983 Belzer y Southard presentan la composición de una nueva y compleja solución de preservación, la solución de Wisconsin-Viaspan®10. Este líquido permitió, en el caso del riñón, prolongar el tiempo de hipotermia simple a nivel experimental hasta 72 horas11. Por otro lado, los resultados en la conservación del páncreas y el hígado mejoraron espectacularmente12. Como las soluciones de Collins y EC, UW es una formulación con elevada concentración de potasio. Contiene sulfato magnésico (MgSO4), pero en menores concentraciones que Collins. La mayor parte del PO3-4 y todo el Cl- de esas soluciones es sustituido por el anión orgánico lactobionato13. La rafinosa, en una concentración moderada, es incluida como azúcar impermeable. El almidón sintético HES (hydroxyethilstarch, hidroxietil-almidón) es usado como coloide. Los aditivos farmacológicos incluyen glutatión, adenosina, alopurinol, insulina, dexametasona y antibiótico. Esta composición permitía superar algunos de los problemas que ocurrían con EC. UW demostró ser mejor que el resto de soluciones existentes. Sin embargo, aunque extiende el período seguro de preservación hipotérmica, la prolongación excesiva del tiempo de preservación sigue relacionándose con lesiones importantes en el órgano. Algunos trabajos han demostrado cómo UW experimenta deterioro en su composición con el transcurso de las horas. El glutatión reducido (GSH) que se añade a UW en el momento de su fabricación disminuye por oxidación; por otro lado, se han detectado iones metálicos libres en la composición14,15. La limitación de UW en clínica está también documentada. El análisis de datos de la United National Organ Sharing muestra altos índices de fracaso renal en los injertos con tiempos de preservación mayores de 24 horas2. Con todas estas evidencias parece claro que la estrategia de diseño que se adoptó para UW, en relación al objetivo que pretendemos acometer, es aún insuficiente. Otras soluciones de preservación, como Celsior o HTK (histidina-triptófano-ketoglutarato) han sido también utilizadas cada vez más en los últimos años, incluso aplicándose no sólo al riñón, sino también al hígado, con resultados aún en discusión16.
La perfusión hipotérmica del órgano aislado constituye un planteamiento diametralmente distinto. Los objetivos, en este caso, son tres: optimizar la preservación, conocer las características del ógano que vamos a trasplantar y atenuar farmacológicamente las consecuencias de la isquemia. La solución para perfusión más utilizada es la de F.O. Belzer (Universidad de Wisconsin) (Tabla 4). En 1989 Hoffmann17 subraya la eficacia clínica de la solución para perfusión basada en HES (hidroxi-etil-almidón) como coloide en preservaciones renales prolongadas. Como hechos peculiares citaremos la utilización de adenina y ribosa como sustratos metabólicos más estables para la producción de ATP y la adición de calcio en bajas concentraciones18. Se añade gluconato como anión impermeable19, manitol por su efecto osmótico, sodio como catión más importante19, elevadas concentraciones de potasio y fosfato, glutatión como agente reductor y limitante de la lesión secundaria a radicales libres de oxígeno20, HEPES como tampón, hidróxido sódico para conseguir neutralidad del pH y magnesio y dexametasona como sustancias estabilizadoras de membrana.
Un reciente trabajo21 que lleva a cabo un excelente metaanálisis comparativo entre las técnicas de hipotermia simple (HS) y preservación hipotérmica de órgano aislado (PH) mostraba conclusiones interesantes. En primer lugar, la utilización de PH resulta beneficiosa al compararla con HS, asociándose con un riesgo relativo de disfunción inicial del injerto de 0.804 (intervalo confianza 95% de 0.672-0.961). No se halló evidencia de que este efecto fuera distinto en riñones que provenían de donantes en parada cardiaca o a corazón batiente (donante clásico en muerte cerebral). Existían evidencias de que las características del flujo de la perfusión durante la PH podía ser un indicador de viabilidad del órgano; sin embargo, los datos resultaban inadecuados para calcular la especificidad y sensibilidad de cualquier test basado en estos hallazgos. La concentración de α- glutatión-S-transferasa (un marcador de daño celular) en la perfusión puede constituir la base de un test sólido. Un límite de 2800 µg/100 g proporciona una sensibilidad de 93% y una especificidad de 33%. La evidencia económica publicada es aún de calidad baja. Los datos basales sugieren que a largo plazo la PH puede resultar más barata y más efectiva que la HS tanto en injertos convencionales como en aquellos con isquemia normotérmica inicial prolongada.
NUEVOS CONCEPTOS EN ISQUEMIA FRÍA Y DAÑO RENAL
En los últimos años algunos autores han investigado cuál es la sucesión de procesos que acompaña a la isquemia, y que condicionarán la aparición tras el implante de una fase más o menos prolongada y/o reversible de disfunción inicial del injerto. En estos nuevos conceptos intrínsecos de la lesión por isquemia parece esencial el papel de la mitocondria. Es en esa estructura donde se desarrollará la lesión diana celular que producirá el fallo funcional inicial del órgano. Los procesos que referiremos a continuación han sido principalmente estudiados por el grupo de AK Salahudeen en la Universidad de Mississipi. Este autor ha presentado unos magníficos trabajos donde se aportan datos tanto moleculares como microscópicos2,3,22-24.
Podemos ver esquemáticamente la sucesión de hechos lesivos en las Figuras 2 y 3. La isquemia (normotérmica e hipotérmica) induce necrosis celular, más o menos importante según la duración de la misma, las características del donante y del propio riñón. Es decir, estamos hablando de una población celular que se pierde definitivamente. Durante la preservación hipotérmica se desarrollan también alteraciones mitocondriales relacionadas directamente con el frío: es un estado celular de apoptosis latente o pre-apoptosis. En el momento de la revascularización del injerto (reperfusión), esas células pasan a una fase activa de apoptosis debido a la activación de una cascada de sucesos bioquímicos, perdiéndose otro porcentaje celular de modo irreversible. Nuevamente las características del donante, del órgano y de la calidad de preservación serán esenciales. Es decir, la isquemia se relaciona con destrucción celular directa por necrosis. La revascularización o reperfusión con pérdida celular por apoptosis25.

FIGURA 2. Sucesión cronológica de procesos lesivos producidos
por la isquemia en el injerto renal.

FIGURA 3. Edema mitocondrial inducido por la isquemia fría y la reperfusión: proceso molecular
(de Salahudeen AK. Cold ischemic injury of transplanted kidneys: new insights from experimental studies.
Am J Physiol Renal Physiol 287: F181-F187, 2004).
Veamos con más detenimiento qué ocurre exactamente en la mitocondria celular durante la fase de isquemia hipotérmica. El frío inducirá la elevación del calcio intracelular, la aparición de radicales libres de oxígeno en el medio así como la inversión de la relación BCL-2/BAX (proteínas de membrana) en la mitocondria. Estos cambios producen la apertura de unos poros de la membrana mitocondrial (pore) con edema mitocondrial secundario. La alteración de la membrana de la mitocondria facilita la salida de citocromo-C al medio extramitocondrial. Este citocromo- C, en el momento de la reperfusión del órgano puede estimular la agregación de determinadas moléculas pro-apoptóticas con activación final de la enzima pro-caspasa 3 y de la vía proteolítica de las caspasas. Ello permitirá el desarrollo de la apoptosis de forma completa. Ese edema mitocondrial progresivo puede observarse en microscopía electrónica durante la fase de hipotermia (Fig. 4) y constituye el hecho clave a partir del cual se producirá la apoptosis celular en la revascularización del injerto. No ha sido aún extensamente estudiado y constituye el punto fundamental en que se centran la mayoría de investigaciones actuales. Toda manipulación farmacológica debería llevarse a cabo durante la fase de hipotermia. El objetivo será reducir la lesión mitocondrial, y por tanto, aumentar la población celular viable en el momento de la reperfusión al atenuar la apoptosis25.
POSIBILIDADES EXPERIMENTALES Y CLÍNICAS DE MODULAR LA LESIÓN CELULAR POR HIPOTERMIA
Los sucesivos procesos que tienen lugar en el interior de la célula durante la fase de hipotermia constituyen los puntos diana de una posible modulación farmacológica. La atenuación de estos cambios se relacionan en diversos trabajos experimentales con una disminución significativa del porcentaje de apoptosis celular en la reperfusión del órgano25. ¿Cuáles son estos cambios moleculares relacionados con el frío y susceptibles de atenuación? (Tabla 5):
1) Activación de vías calcio-dependientes. La hipotermia altera la regulación estricta que existe en los niveles de calcio citosólico, produciéndose una elevación significativa de los mismos26. Esta alteración puede inducir activación de algunos enzimas proteolíticos calcio-dependientes, como la calpaína. Esta enzima activada es capaz de generar destrucción de la proteína del citoesqueleto celular espectrina durante la revascularización del órgano, lo que se relacionaría con pérdida de la estructura y polaridad celulares. La PKC (proteína-quinasa C) es una molécula proteica reguladora del ciclo celular y relacionada con la capacidad de recuperación celular tras isquemia normotérmica27. Dispone de varias isoenzimas (d,e). La isoforma e podría ser protectora, mientras que la d sería destructora. La utilización de EGTA (quelante cálcico) añadido en la solución de preservación26 o de inhibidores inespecíficos de PKC28 son maniobras que han demostrado, experimentalmente reducir las lesiones celulares relacionadas con el frío.
2) Lesión por radicales libres de oxígeno (RLO) durante la hipotermia. La utilización de antioxidantes en la solución de UW tenía como objetivo la prevención del efecto de los RLO producidos durante la revascularización del órgano. Trabajos experimentales han demostrado que los RLO intervienen en la lesión celular por frío29. Se ha podido comprobar cómo en el órgano en hipotermia, especialmente en aquellas células que expresan genéticamente la enzima Mn-SOD mitocondrial, se producen RLO por lo que la propia mitocondria sería una fuente significativa de producción de estas moléculas29. La adición de desferrioxamina (DFO) a la solución UW puede aumentar significativamente su capacidad antioxidante durante la hipotermia, reduciendo de manera clara las lesiones celulares secundarias al frío23,29.
3) Liberación de iones metálicos durante la fase de hipotermia. En las células normales, no existe producción o liberación de iones metálicos. Sin embargo, en la célula sometida a isquemia fría se ha detectado experimentalmente la liberación de metales libres, especialmente de origen microsomal29. Estas moléculas metálicas pueden inducir una reacción que resulta en la producción de radicales tóxicos hidroxilo. La administración de DFO a la solución de preservación ha demostrado, en algunos trabajos2,3 un efecto citopotector frente a estos metales libres. Las causas que explicarían esto podrían ser diversas: la quelación directa de metales, así como un teórico efecto estimulador de la expresión del gen regulador de la síntesis de ferritina. Esta molécula puede actuar como agregante de iones metálicos. Su disminución en el medio, estimulado por el frío, sería perjudicial para la célula30.
4) Producción de isoprostanos-F2 vasoconstrictores inducida por el frío. La administración de DFO en la solución de preservación o la inclusión de otros antioxidantes puede disminuir la presencia de F2-isoprostanos en el medio29. Usualmente, la producción de prostaglandinas vasoconstrictoras se relaciona con la peroxidación lipídica estimulada por la acción de RLO durante la fase de revascularización del injerto. Sin embargo, en trabajos experimentales con conservación de plasma a –20°C ha podido detectarse la aparición de F2-isoprostanos en el medio31. Estas moléculas se vio que provenían de la peroxidación de lípidos que contenían grupos araquidónicos y que se encontraban en el plasma y en los tejidos. Los efectos biológicos son idénticos a las prostaglandinas, con vasoconstricción y disminución del flujo vascular renal. Este efecto podría relacionarse con un efecto directo de los isoprostanos F2-a sobre la arteriola aferente, produciendo disminución concomitante del filtrado glomerular32. Nuestro grupo ha demostrado recientemente que, en condiciones experimentales, durante la perfusión hipotérmica del riñón aislado, el incremento de resistencia vascular renal cursa concomitante a un mantenimiento de las cifras de aclaramiento de creatinina, lo que se relacionaría más bien con un efecto vasoconstrictor sobre la arteriola eferente33.
5) Inducción de proteínas de estrés en la membrana celular: HO-1 inducida. HO-1 es una proteína de estrés que produce degradación de proteínas de grupo hemo, liberando en el proceso metales libres, monóxido de carbono y bilirrubina. Son varios los trabajos experimentales que demuestran que la sobreexpresión de esta enzima en la membrana de las células tubulares se relaciona, a través de una mayor producción de metales libres, con una inducción de síntesis de ferritina, con liberación colateral de bilirrubina y CO34. La ferritina, agregante de iones metálicos, actuaría como protector celular. Se podría intentar estimular la sobrexpresión de HO-1 mediante transferencia genética o induciendo su síntesis con grupos hemina.
6) La desferrioxamina como agente protector aplicable en clínica. Han sido publicados varios artículos sobre el papel de la DFO en la modulación de la agresión celular por la isquemia fría en el injerto. Este agente farmacológico puede reducir el grado de necrosis celular, apoptosis secundaria e incluso producción de isoprostanoides relacionados con la fase de hipotermia. Su acción se desarrollaría exclusivamente tras su adición a la solución de conservación, no como medicación inyectada en el sistema vascular en el momento de la reperfusión.
CONCLUSIONES
En los últimos años se están realizando importantes avances en la comprensión de los mecanismos a través de los cuales la isquemia lesiona el injerto renal y condiciona una fase posttrasplante de disfunción inicial. Existen dos agresiones principales: la necrosis celular directa, producida igualmente por la isquemia normotérmica e hipotérmica; la apoptosis celular, facilitada durante la fase de isquemia (estado latente celular) y activada definitivamente en el momento de la revascularización. El elemento celular diana de estas lesiones es la mitocondria. La administración de ciertos fármacos en la solución de preservación durante el período de hipotermia en trabajos experimentales, como la desferrioxamina, ha demostrado su utilidad. En cuanto a las técnicas de preservación deberemos diseñar nuevas soluciones teniendo en cuenta las lesiones específicas celulares. Parece que la perfusión de órgano aislado puede mostrar ventajas frente a la hipotermia simple, reduciendo el período de disfunción inicial lo que mejora el pronóstico del injerto y reduce los costes del procedimiento. El futuro aparece, por tanto, apasionante. Queda mucho por hacer. Debemos trasplantar no sólo órganos en número, sino manteniendo y aumentando el nivel de calidad de los mismos35.
REFERENCIAS
1. Lledó-García E, Hernández C, Díez-Cordero JM, García-Barreno P, del Cañizo-López JF. Hydrodynamic and biochemical effects of isolated hypothermic renal perfusion depending on the pump model and perfusion solution. Transpl Proc 35 2003;1661-1663. [ Links ]
2. Salahudeen AK, Haider N, May W. Cold-ischemia and the reduced long-term survival of cadaveric renal allografts. Kidney Int 2004;65:713-718. [ Links ]
3. Salahudeen AK. Cold ischemic injury of transplanted kidneys: new insights from experimental studies. Am J Physiol Renal Physiol 2004;287:F181-F187. [ Links ] 399 E. Lledó Garcia, et al./Actas Urol Esp 2005; 29 (4): 392-400
4. Weinberg JM. The cell biology of ischemic renal injury. Kidney Int 1991;39:476-500. [ Links ]
5. Shoskes DA, Halloran PF. Delayed graft function in renal transplantation: etiology, management and long-term significance. J Urol 1996;155(6):1831-1840. [ Links ]
6. Sakon M, Ariyoshi H, Umeshita K, Monden M. Ischemiareperfusion injury of the liver with special reference to calcium-dependent mechanisms. Surg Today 2002;32:1-12. [ Links ]
7. Rabb H, Daniels F, O'Donnell M, Haq M, Saba SR, Keane W, Tang WW. Patophysiological role of T lymphocites in renal ischemia reperfusion injury in mice. Am J Physiol Renal Physiol 2000;279: F525-F531. [ Links ]
8. Molitoris BA, Sandoval R, Sutton TA. Endothelial injury an dysfunction in ischemic acute renal failure. Crit Care Med 2002;30:S235-S240. [ Links ]
9. Collins GM, Bravo-Suugarman M, Terasaki PI. Kidney preservation for transportation. Initial perfusion and 30 hours'ice storage. Lancet 1969;2:1219-1222. [ Links ]
10. Belzer FO, Southard JH. Principles of solid organ preservation by cold storage. Transplantation 1988;45:673-676. [ Links ]
11. Ploeg RJ, Gloossens D, McAnulty JF. Succesful 72-hour cold storage of dog kidneys with UW solution. Transplantation 1988;46:191-196. [ Links ]
12. Todo S, Tzakis A, Starzl TE. Preservation of livers with UW or Euro-Collins solution. Transplantation 1988;46:925-927. [ Links ]
13. Moen J, Claesson K, Pienaar H, Lindell S, Ploeg RJ. Preservation of dog liver, kidney and pancreas using the Belzer-UW solution with a high-sodium and low potassium content. Transplantation 1989;47:940-945. [ Links ]
14. Evans PJ, Tredger JM, Dunne JB, Halliwell B. Catalytic metal ions and the loss of reduced glutathione from University of Wisconsin preservation solution. Transplantation 1996; 62:1046-1049. [ Links ]
15. Huang H, Salahudeen AK. Cold induces catalytic iron release of cytochrome P-450 origin: a critical step in cold storage-induced renal injury. Am J Transplant 2002;2:631-639. [ Links ]
16. Nardo B, Bertelli R, Montalti R, Beltempo P, Puviani L, Pacile V, Cavallari A. Preliminary results of a clinical randomized study comparing Celsior and HTK solutions in liver preservation for transplantation. Transplant Proc 2005 Jan-Feb;37(1):320-322. [ Links ]
17. Hoffmann RM, Stratta RJ, D'Alessandro AM, Sollinger HW, Kalayoglu M, Pirsch JD, Southard JH, Belzer FO. Combined cold storage-perfusion preservation with a new synthetic perfusate. Transplantation 1989;47(1):32-37. [ Links ]
18. McAnulty JF, Ploeg RJ, Southard JH, Belzer FO. Succesful five-day perfusion preservation of the canine kidney. Transplantation 1989;47:37-41. [ Links ]
19. McAnulty JF, Vreughdenhil PK, Southard JH, Belzer FO. Use of UW cold storage solution for machine perfusion of kidneys. Transpl Proc 1990;22(2):458-459. [ Links ]
20. Vreughdenhil PK, Evans W, Belzer FO, Southard JH. Glutathione depletion in cold-stored organs. Transpl Proc 1990;22 (2):455-457. [ Links ]
21. J Wight, J Chilcott, M Holmes, N Brewer. The clinical and cost-effectiveness of pulsatile machine perfusion versus cold storage of kidneys for transplantation retrieved from heartbeating and non-heart-beating donors. Health Technology Assessment 2003;Vol 7:No 25. [ Links ]
22. Salahudeen AK, Joshi M, Jenkins JK. Apoptosis versus necrosis during cold storage and rewarming of human renal proximal tubular cells 1. Transplantation 2001;72(5):798-804. [ Links ]
23. Huang H, Salahuden AK. Cold induces catalytic iron release of cytochrome P-450 origin: a critical step in cold storageinduced renal injury. Am J Transplant 2002;2 (7): 631-639. [ Links ]
24. Huang H, He Z, Roberts LJ 2nd, Salahudeen AK. Deferoxamine reduces cold-ischemic injury in a syngeneic kidney transplant model. Am J Transplant 2003;3(12):1531-1537. [ Links ]
25. Salahudeen AK, Joshi M, Jenkins JK. Apoptosis versus necrosis during cold storage and rewarming of human renal proximal tubular cells S1. Transplantation 2001;72(5):798-804. [ Links ]
26. Joshi M, Salahudeen AK. PKC and calcium, but not PKA, play a crucial roles in cold-storage-induced human renal tubular cell injury (Abstract). J Am Soc Nephrol 2002;13: 547A. [ Links ]
27. Padanilam BJ. Induction and subcellullar localization of protein kinase C isozymes following renal ischemia. Kidney Int 2001;59:1789-1797. [ Links ]
28. Fagbemi OS, Northover BJ. Effect of protein kinase C inhibitors and 2,3-butenadenione monoxime on the long-term hypothermic preservation of isolatd rat hearts. Clin Sci (Lond) 2000; 91:674-683. [ Links ]
29. Salahudeen AK, Huang H, Patel P, Jenkins JK. Mechanism and prevention of cold-storage-induced human renal tubular cell injury. Transplantation 2000;70:1424-1431. [ Links ]
30. Rauen U, Petrat F, Li T, De Groot H. Hypothermia injury/cold-induced apoptosis- evidence of an increase in chelatable iron causing oxidative injury in spite of low O2-H2O2. FASEB J 2000;14:1953-1964. [ Links ]
31. Morrow JD, Harris TM, Roberts LJ. Noncyclooxigenase oxidative formation of a series of novel prostaglandins: analytical ramifications for measurement of eicosanoids. Anal Biochem 1990;184:1-10. [ Links ]
32. Takahashi K, Nammour TM, Fukunaga M, Ebert J, Morow JD, Badr KF. Glomerular actions of a free radical-generated novel prostaglandin, 8-epi-prostaglandin F2 alpha in the rat. Evidence fo interaction with thromboxane A2 receptors. J Clin Invest 1992;90:136-141. [ Links ]
33. Berenguer I, Hernández C, del Cañizo JF, Lledó-García E. Real-time hemodynamic evaluation of kidney grafts by experimental model of ischemia and hypothermic preservation: Computerised system. Int J Artif Organs 2004;27(7):569. [ Links ]
34. Salahudeen AA, Jenkins JK, Huang H, Ndebele K, Salahudeen AK. Overexpression of heme oxygenase protects renal tubular cells against cold storage injury: studies using hemin induction and HO-1 gene transfer. Transplantation 2001b;72:1498-1504. [ Links ]
35. Southard JH. Coffee creamer, the bionic man, and organ preservation. Surgery. 2002 Feb;131(2):228-229. [ Links ]
Dr. E. Lledó García
Servicio de Urología
Hospital General Universitario Gregorio Marañón
Doctor Esquerdo, 46
28007 Madrid
(Trabajo recibido el 30 de noviembre 2004)