Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.33 no.9 oct. 2009
Diagnóstico fotodinámico (PDD) en el cáncer vesical no músculo-invasivo. Revisión bibliográfica
Photodynamic diagnosis (PDD) in non-muscle invasive bladder cancer. Literature review
José Oliva Encina y Carlos Rioja Sanz
Servicio de Urología, Hospital Royo Villanova, Zaragoza, España
Dirección para correspondencia
RESUMEN
El cáncer vesical no músculo-invasivo es una de las neoplasias de mayor incidencia y prevalencia en el medio occidental. Su control clínico origina un gasto importante a los sistemas de salud. El diagnóstico y el tratamiento se basan en la visión directa de éste y en la detección de formas planas que no presentan una expresión morfológica característica y que, en ocasiones, pasan inadvertidas. El pronóstico de este proceso depende en muchos casos de la calidad de la resección transuretral y en la detección temprana de formas planas indiferenciadas.
La cistoscopia con empleo de sustancias fotosensibilizantes, como el ácido 5- aminolevulínico (5-ALA) o el ácido hexil-amino-levulínico (HAL), consigue tasas de sobredetección de neoformaciones vesicales del 29%, y en el caso concreto del carcinoma in situ, del 59%.
Esta capacidad de sobredetección lleva consigo un aumento de supervivencia libre de enfermedad y del tiempo a la primera recidiva, entre otros parámetros analizados.
El incremento en el coste al emplear estos recursos se compensa, ya que se disminuye o retrasa en número de cistectomías, el número de resecciones y el de instrumentaciones. Concluimos que debe de universalizarse el empleo de sustancias fotosensibles, no sólo empleándolas en aquellos casos de riesgo alto.
Palabras clave: Cáncer vesical, Diagnóstico fotodinámico, Hexaminolevulinato.
ABSTRACT
Non-muscle invasive bladder cancer is one of the most prevalent and incident neoplastic conditions in the Western world. Its clinical management involves significant costs for health systems. Diagnosis and treatment are based on direct visualization of the disease and on detection of flat forms having no specific morphology and which are sometimes overlooked. Prognosis of NMIBC often depends on quality of transurethral resection and on early detection of undifferentiated flat forms.
Cystoscopy using photosensitive substances such as 5-aminolevulinic acid (5-ALA) or hexyl aminolevulinic acid (HAL) achieves overdetection rates of 29 % for bladder neogrowths and 59% for carcinoma in situ.
This overdetection ability results in an increased disease-free survival and a longer time to the first relapse.
Increased costs resulting from use of these resources are compensated by a lower numer of or delayed performance of cystectomies, resections, and instrumentations.
It is concluded that PDD should be universally used, rather than in high risk patients only.that has been shown in both animal studies and human tumors.
Key words: Bladder cáncer, Photodynamic diagnosis, Hexaminolevulinate.
Introducción
El tumor vesical urotelial es la neoplasia urológica más frecuente en nuestro medio. Se estima que, actualmente, en el ámbito internacional es la cuarta neoplasia más frecuente en el varón y la octava más frecuente en la mujer1,2.
El 75-80% de los tumores uroteliales vesicales se presentan inicialmente como enfermedad no músculo-invasiva (cáncer vesical no músculo-invasivo [NMIBC]) y cursan de modo recidivante durante la vida del paciente. Este hecho condiciona que el NMIBC sea un proceso de gran prevalencia, cuyo diagnóstico y tratamiento determina un ingente gasto a los sistemas públicos de salud.
Objetivos del diagnóstico y tratamiento del cáncer vesical no músculo-invasivo
El NMIBC se presenta morfológicamente de modo papilar; es decir, exofítico y relativamente patente, o de modo plano, sin un relieve sobre el tapiz urotelial y sin ninguna morfología característica por más que haya querido buscarse una imagen propia del tumor vesical plano2.
Este aspecto sobre la presentación histológica del NMIBC es de especial relevancia, ya que las formas exofíticas son fácilmente visibles atendiendo a su tamaño y localización, pero las formas planas (carcinoma in situ [CIS]) son invisibles a la cistoscopia, sólo son diagnosticadas por medio de la realización de biopsias aleatorias o dirigidas, y característicamente son lesiones que, si bien representan el 5-10% de los NMIBC, tienen un gran potencial de progresión, lo que convertiría a este proceso en músculo-invasivo.
El diagnóstico del NMIBC consiste en la identificación de la totalidad de las formaciones exofíticas y la confirmación o no de la existencia de lesiones planas de alto grado (CIS), seguido de la resección endoscópica de todas las lesiones. A posteriori, se procederá a una adyuvancia con instilación intravesical de fármacos citotóxicos, como la mitomicina C, o de inmunomoduladores como el bacilo de Calmette-Guérin (BCG) hasta la fecha única terapia adyuvante efectiva en el tratamiento y control de los tumores de alto grado.
Múltiples estudios clásicos han puesto de manifiesto que la calidad de la resección endoscópica varía dependiendo del centro, de la experiencia del cirujano, del tamaño del tumor, de su multifocalidad, de las condiciones de visibilidad, etc. Se ha demostrado que esa variabilidad en la calidad de la resección condicionará la historia natural de la enfermedad en ese paciente, determinando una tasa mayor o menor de tumores residuales y una falsa tasa de redivivas tempranas3.
Expuestos los anteriores conceptos, podemos establecer que el reto del urólogo en el diagnóstico y el tratamiento del NMBIC es doble: en primer lugar, erradicar toda neoformación existente a nivel vesical, y hacerlo del modo más completo, y un segundo reto, confirmar o no la presencia de carcinoma in situ (CIS) y la de otras lesiones planas de potencial neoplásico incierto (displasias).
Fundamentos físicos y biológicos del diagnóstico fotodinámico
El diagnóstico fotodinámico (PDD) pretende poner de manifiesto, es decir, hacer más patentes al ojo humano, las lesiones neoplásicas, sean planas o exofíticas.
Este efecto se consigue por medio del fenómeno de la fluorescencia. La fluorescencia consiste en la obtención de una respuesta lumínica característica por parte de un tejido cuando este es iluminado por un haz de luz de una determinada longitud de onda. La fluorescencia puede ser autofluorescencia, cuando esta se produce por sustancias propias del tejido, o fluorescencia exógena, cuando la fluorescencia es inducida por un compuesto extraño al organismo, como es al caso que nos ocupa4,5.
Los dos fármacos empleados en PDD en urología son el 5-aminolevulinato (5-ALA), empleado en Europa desde los años noventa y de empleo anecdótico en España, y el hexaminolevulinato (HAL), que es un hexil-éster del anterior, con propiedades farmacocinéticas y farmacodinámicas superiores a 5-ALA.
Vamos a hacer especial hincapié en HAL, fármaco de reciente aparición en nuestro medio. HAL no es una sustancia fotosensible, es una sustancia que es captada con especial avidez por las células neoplásicas del urotelio debido a que compite con los betaaminoácidos y los aminoácidos gammaaminobutíricos. En su interior induce la acumulación de protoporfirina IX, que es la sustancia fotosensible. Esta acumulación de protoporfirina IX es favorecida por un aumento de la actividad de la enzima profobilinógena deaminasa y un descenso de la actividad de la ferroquelatasa, con lo que se consigue una ratio de concentración respecto al tejido sano de 20/16-8.
La protoporfirina IX acumulada en el interior de las células neoplásicas, al ser incidida por un haz de luz de determinada longitud de onda (380-470 nm), es activada, es decir, que le es trasmitida energía de tal modo que esa energía determina el paso de un electrón a una órbita energética superior. Este estado de activación es un estado inestable e inmediatamente el electrón regresa a su nivel energético habitual, liberando un paquete de energía en forma de luz roja fluorescente de una longitud de onda de 600-700 nm, que es el efecto que al final nos pone en evidencia la lesión neoplásica (fig. 1).

Figura 1 - Mecanismo de acción de hexaminolevulinato en diagnóstico fotodinámico.
Ficha técnica
El fármaco fotosensibilizante más comúnmente empleado en nuestro medio desde 2007 es el HAL, es el hexil-éster del ácido aminolevulínico. Se comercializa con el nombre de Hexvix®, distribuido en España por General Electric Healthcare.
Se presenta en viales y cada uno contiene 85 mg de HAL o en forma de 100 mg de clorhidrato de hexaminolevulinato. Tras su reconstitución en 50 ml de disolvente, 1 ml de solución contiene 1,7 mg de HAL, lo que corresponde a 8 mmol/l de solución de HAL.
El fármaco está contraindicado en edad infantil, en gestantes, en pacientes con alergia a componentes de Hexvix® y en pacientes que presenten cualquier tipo de porfiria. No existen datos respecto al empleo en mujeres en edad fértil.
Otro fármaco fotosensibilizante sobre el que existe una importante documentación bibliográfica y una larga experiencia es el 5-ALA. Es un fármaco fotosensibilizante de empleo anecdótico en España, pero en países centroeuropeos es común su empleo, lo que hace que existan series de NMIBC tratados con 5-ALA y con períodos largos de seguimiento.
Respecto a HAL, 5-ALA tiene unas características farmacocinéticas peores; 5-ALA es más hidrofílico, atraviesa peor las barreras celulares y su distribución en el espesor epitelial es más heterogénea. HAL consigue luminiscencias 2 veces mayores que 5-ALA con concentraciones 40 o 50 veces inferiores9.
Ejecución
La realización del estudio cistoscópico fotodinámico requiere un equipo endoscópico específico. Precisa de una fuente de luz que sea capaz de emitir en el espectro de luz de longitud de onda de 480-370 nm. Este emisor de luz debe de conmutarse con facilidad con un haz de luz blanca convencional. Además, precisa una óptica que nos permita ver y magnifique el rojo fluorescente, cuya longitud de onda es de 600-700 nm y que es 10 veces menos intensa al ojo humano que la luz blanca convencional.
Previamente a la ejecución de la endoscopia, habremos instilado 1 vial de fármaco fotosensibilizante entre 1 y 3 h antes, lo realizaremos a vejiga vacía y favoreceremos los movimientos del paciente para garantizar una correcta y total impregnación vesical.
No se recomienda el empleo de esta técnica en pacientes que presenten hematuria activa, instilación reciente de quimioterapia o inmunoterapia intravesical, litiasis vesicales, infecciones activas o cualquier proceso causantes de inflamaciones de la mucosa vesical.
El desarrollo de la exploración cistoscópica debe de realizarse a media-total repleción, con un flujo de entrada y salida continuo y minimizando el sangrado. La visión ha de ser perpendicular a la pared vesical para evitar visiones tangenciales que puedan darnos zonas falsamente positivas, como las que aparecen en pliegues, barra trigonal y orificios ureterales.
La exploración debe de enlentecerse para detectar las imágenes fluorescentes; no obstante, no debe de ser muy prolongada en el tiempo, ya que el exceso de exposición de la mucosa tanto a la luz tanto como a la luz de PDD, genera un agotamiento de la fluorescencia conocido como photobleaching.
Capacidad diagnóstica de hexaminolevulinato en el diagnóstico fotodinámico
Los estudios iniciales sobre diagnóstico fotodinámico tienen todos un diseño muy similar. Consisten en la realización de una exploración cistoscópica con luz blanca convencional (WL) y en el mismo acto la realización de una cistoscopia con fluorescencia, previa instilación de la sustancia fotosensibilizante (PDD). Se realizan un mapeo vesical y una resección de las lesiones anotando si estas eran visibles sólo con WL, sólo con PDD o con ambas. Algún estudio lo combina con toma de biopsias aleatorizadas10-15.
Todos los estudios están realizados en pacientes con diagnóstico positivo o de sospecha de NMIBC; estos presentan una latencia de 3 meses respecto a la última instilación de BCG o quimioterápicos intravesicales, y se excluyó a los pacientes con sangrado activo, porfiria o alergia a la sustancia fotosensibilizante.
Los resultados de estos estudios comparan de este modo la sensibilidad de PDD frente a WL en hiperplasias, displasias, CIS y tumores exofíticos, ya sean no invasores de la lámina propia, estadio pTa o invasores de esta pT1.
En el caso del CIS, se comunica que PDD, empleando como agente fotosensibilizante HAL, puede llegar a detectar el 97, el 95 y el 92% de las lesiones frente al 58, el 68 y el 66,6% por WL10,12,13 (tabla 1).
Las diferencias entre PDD y WL se reducen cuando se trata de identificar lesiones de fácil identificación con luz blanca convencional, como es el caso de los tumores exofíticos donde PDD diagnostica, sólo en el mejor de los casos, un 11% más lesiones que WL cuando hacemos referencia a tumores en estadio pTa10, mientras que si nos referimos a tumores en estadio pT1 la máxima diferencia a favor de PDD es del 8%13 (tablas 2 y 3).
Merece especial mención el estudio de Jichliiski et al14. Este estudio añade al diseño básico de los previos, la toma de biopsias aleatorizadas; de este modo nos permite la determinación del valor predictivo negativo de la prueba, cuestión que será de vital importancia a la hora de determinar la validez de la prueba en el control del CIS post-BCG, ya que la negatividad con alto valor predictivo negativo indicará la preservación vesical (tabla 4).
De todo lo expuesto, podemos concluir que el diagnóstico fotodinámico del NMIBC empleando como agente fotosensibilizante HAL tiene una sensibilidad global del 96 frente al 79% de la luz blanca convencional y que en el 24% de los casos se diagnostican más lesiones con diagnóstico fotodinámico15. Se estima que la repercusión clínica es importante, pues esta superioridad diagnóstica es la causante de que la actitud terapéutica tras la resección cambie atendiendo a los hallazgos diagnósticos de PDD: será más agresiva en el 17,85% de los casos y menos agresiva en el 8% de los casos, entendiendo como agresividad a la instilación o no de BCG, o la realización o no de cistectomía13.
Evaluando los estudios iniciales de sensibilidad de PDD con HAL, podemos inferir que empleando HAL, y sobre una muestra de 553 pacientes, se obtiene una tasa media de sobredetección del 29%; esta tasa de sobredetección es del 59% en el caso de CIS, del 17% en el caso de tumor en estadio pTa y del 12% en el caso de tumor en estadio pT1. El precio que se debe pagar es una tasa de falsos positivos del 30%11-15.
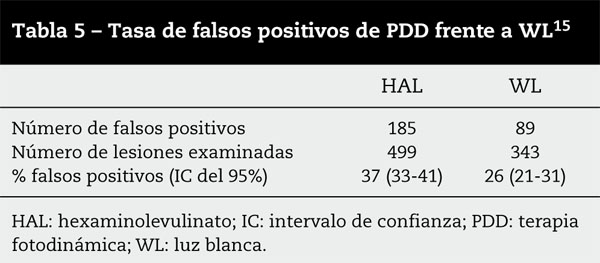
Uno de los puntos por donde es atacado el diagnóstico fotodinámico es la alta tasa de falsos positivos; esta se estima en torno al 30-40%, mientras que la tasa de falsos positivos de la WL convencional oscila entre el 21 y el 31%15 (tabla 5).
No obstante, esto debería de someterse a discusión, pues la tasa de falsos positivos con WL no incluye la alta tasa de falsos positivos de las biopsias aleatorias. Estas, en ortodoxia, no pueden llamarse positivas, pues son una prueba aleatoria, pero hasta ahora han sido la herramienta principal en la búsqueda de CIS y su tasa de falsos positivos puede aproximarse al 80%. En concreto, la posibilidad de hallar CIS en mucosa normal es del 4%, del 14% en áreas hiperémicas y del 42% en zonas rugosas o afelpadas16. Con lo expuesto queremos expresar que el ojo humano en cistoscopia convencional, y en el mejor de los casos, tiene una tasa de falsos positivos del 63%16.
Continuando con el aspecto de la tasa de falsos positivos, se ha demostrado que los procesos que condicionan una inflamación en el espesor de la mucosa serán los causantes de una alta tasa de imágenes falsamente positivas. Entre estas causas destacaremos los procesos infeccioso-inflamatorios agudos y crónicos, las instrumentaciones, la litiasis vesical y, en especial, la administración previa de quimioterápicos, como la mitomicina y de inmunomoduladores como la BCG; en concreto, se estima que el antecedente de instilación de BCG eleva la tasa de falsos positivos hasta el 47%17. Este aspecto es uno de los puntos más criticados por los detractores del empleo de PDD, ya que los pacientes tipo en el empleo de PDD están, en su mayor parte, sometidos a tratamientos de inducción o mantenimiento con BCG.
No obstante, no debemos de olvidar que la administración de inmunomoduladores y quimioterápicos intravesicales puede originar lesiones inflamatorias a nivel vesical que, mediante exploración con WL, pueden aparecer como neoformaciones. Para ilustrar este concepto, haremos referencia a una serie de 114 pacientes con diagnóstico histopatológico de NMIBC (pT1 G3) tratados con 6 instilaciones de BCG; de ellos, el 53% presentaba CIS asociado. Se revaluó a los pacientes por medio de cistoscopia a los 3 meses de la resección y el 61% de los pacientes presentaban lesiones macroscópicamente neoplásicas, de las cuales sólo el 56% fueron tumorales. A los 6 meses se repitió el control cistoscópico y el 39% presentaba lesiones sospechosas, de las cuales sólo el 64% de las lesiones fueron de naturaleza neoplásica. Esto representa tasas de falsos positivos de WL con antecedente de instilación de BCG del 36-44%. El estudio se completó con toma de 20 biopsias de zonas eritematosas, de las cuales el 5% fueron positivas, y 98 biopsias aleatorias con una positividad del 10%18.
Los estudios de sensibilidad y especificidad con HAL se han realizado en pacientes con un período de lavado post-BCG o quimioterápicos intravesicales de 90 días11-15; asumiendo que el antecedente de instilación de BCG determinará una mayor tasa de falsos positivos, quedaría pendiente la determinación del tiempo óptimo de lavado post-BCG para poder emplear PDD, minimizando así el tiempo de espera y disminuyendo la tasa de falsos positivos.
Repercusiones del diagnóstico fotodinámico en la historia natural del tumor vesical no músculo-invasivo
Está demostrada la superioridad de PDD sobre WL en el diagnóstico de lesiones planas (CIS y displasias). Un estudio reciente de Fradet et al19 presentan una serie de 196 pacientes con sospecha o diagnóstico de NMIBC que fueron sometidos a cistoscopia con PDD (HAL) y WL; se diagnosticó CIS en 58 (29,6%) pacientes: en 5 casos fue diagnosticado sólo con biopsias aleatorias, en 7 pacientes fue diagnosticado sólo con WL y en 9 pacientes fue diagnosticado únicamente con PDD. A la hora de valorar el número de lesiones diagnosticadas, PDD diagnosticó al menos una lesión más que la WL en el 41,5% de los pacientes, mientras que la WL superó al PD D en el diagnóstico del número de lesiones en el 15% de los casos19.
Sabemos que el PDD es capaz de diagnosticar un mayor número de lesiones en cada actuación cistoscópica, lo que conlleva una disminución de la tasa de tumores que pasan inadvertidos (overlooked).
En una serie Grosman et al20, con un total de 196 casos, el PDD fue capaz de diagnosticar por lo menos una lesión más en el 29% de los pacientes cuando el estadio del tumor era pTa, mientras que si el estadio era pT1 diagnosticó por lo menos una lesión más que la WL en el 15% de los casos; a la inversa, la WL diagnosticó en el estadio pTa y pT1 una lesión más en el 9% de los casos. La tasa de detección del PDD fue del 95% en estadios Ta y T1, mientras que la de la WL fue del 83 y el 86% para estadios Ta y T1, respectivamente20.
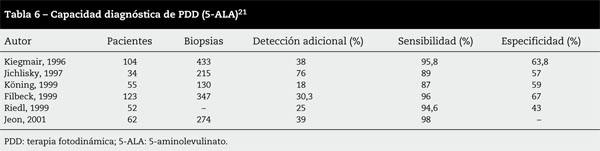
Una vez valorada la capacidad diagnóstica del PDD en el control del NIMBC, debemos preguntarnos qué repercusión tiene el empleo del PDD en la historia natural y en el pronóstico de los pacientes. Actualmente, no existen seguimientos a medio y largo plazo con empleo de HAL. Los estudios a largo plazo se refieren a series de tamaño considerable y con tiempos de seguimiento relativamente largos, pero se han realizado con 5-ALA. El empleo de 5-ALA como sustancia fotosensible en España es anecdótico, pero en países centroeuropeos existe una asentada experiencia en el empleo de este fotosensibilizador. Sus características, en cuanto a capacidad diagnóstica, son superponibles a las conseguidas con HAL, pero con unas propiedades farmacocinéticas inferiores21 (tabla 6).
La rentabilidad diagnóstica de 5-ALA viene avalada por las series antes expuestas y por otras series muy extensas de reciente publicación, como la de Hungerhuber et al22, donde obtiene una sensibilidad en la detección de CIS del 92% con PDD y del 56% con WL; se debe destacar el hecho de que la tasa de CIS representaba el 3% de los NIMBC en el registro de tumores de 1997, en su serie representa el 17%. Esto, además de confirmar la superioridad del PDD sobre la WL y sobre las biopsias aleatorias, confirma la sospecha clínica habitual del urólogo de que la incidencia del CIS es directamente proporcional a la intensidad de su búsqueda.
Una de las series más representativas que valora la repercusión a largo plazo empleando 5-ALA es el estudio de Denzinger et al23. En esta serie de 191 pacientes distribuidos desde un primer momento en 2 brazos, uno controlado por medio de endoscopia con WL y otro con PDD, se valora la presencia de tumor residual a las 6 semanas. En el grupo de WL presentan tumor residual el de 25,2% los pacientes, mientras que en el grupo sometido a resección con PDD era del 4,5%. Los autores realizan un seguimiento de la serie durante 8 años y comprueban el mayor porcentaje de supervivencia libre de recidiva en el grupo sometido a control con PDD23-26 (tabla 7; fig. 2).

Figura 2 - Curvas de Kaplan-Meier que estiman tasas de supervivencia libre de recidiva,
estratificado por tratamiento. En ordenadas, porcentaje libre de recidiva. En abscisas,
tiempo en años. Tomada de Dezinger et al23.
Ahondando en el concepto de tumor residual tras resección, la superioridad del PDD sobre la WL en la disminución de la tasa de residuales viene también avalada en trabajos como el de Kriegmair et al27, donde se evidencian tasas de tumor residual en el 38% de los pacientes resecados con PDD y del 59% de los pacientes resecados con WL, hecho que, a medio plazo, condicionará un aumento de tiempo a la primera recidiva, y a largo plazo, una supervivencia libre de recidiva mayor, hecho que se constata en el trabajo de Daniltchenko et al28, que comparan dos brazos: uno de ellos sometido a control con PDD empleando 5-ALA y el otro con WL; se evalúa el tiempo a la primera recidiva y la supervivencia libre de recidiva con seguimiento de 60 meses (tabla 8), (fig. 3).

Figura 3 - Curvas de Kaplan-Meier que estiman tasas de supervivencia libre de recidivas,
estratificado por tratamiento. En ordenadas, porcentaje libre de recidivas. En abscisas,
tiempo en meses. Tomada de Daniltchenko et al28.
Diagnóstico fotodinámico en el cáncer vesical no músculo-invasivo. Indicaciones actuales y argumentos en contra
De todo lo expuesto hasta ahora podemos deducir que el PDD en NMIBC, tanto con empleo de 5-ALA como con empleo de HAL, es superior a la WL en el diagnóstico del CIS, las lesiones planas no neoplásicas (displasias) y las lesiones papilares. Esta superioridad diagnóstica condicionará una resección transuretral más completa, de mayor calidad, que a su vez será la responsable de una disminución de la tasa de tumores residuales y de una mayor tasa de supervivencia libre de recidiva21,29,30,31.
Con la evidencia de la que se dispone actualmente, la Asociación Europea de Urología (EAU) indica el empleo de PDD en el tratamiento del NMIBC con grado de recomendación B y un nivel de evidencia IIb en el diagnóstico del CIS vesical. Por otro lado, la Austrian Association of Urology consensúa su empleo en el diagnóstico de NMIBC en casos de citologías positivas con hallazgos cistoscópicos negativos y en el control y seguimiento del NMIBC de riesgo alto, especialmente en CIS21,32.
Las guías clínicas de la EAU hacen referencia al posible efecto del empleo de PDD en la disminución de residuales y la disminución de la tasa de recurrencias, pero alegan que las series que demuestran este hecho no son lo suficientemente extensas y que además habría que valorar el coste-beneficio32.
El uso de PDD en el NMIBC para el control del CIS está respaldado por la evidencia y por las guías de práctica clínica, pero no su uso sistemático en pacientes de riesgo alto, y mucho menos en resecciones iniciales de tumor vesical32.
Existen publicaciones que cuestionan su uso. Citaremos la reciente publicación de Brausi33. El autor se plantea si es preciso diagnosticar todos los tumores papilares. Arguye que el hecho de que algún tumor papilar de pequeño tamaño pase inadvertido no tiene implicación pronóstica alguna y que la tasa de progresión de un tumor papilar de riesgo bajo al cabo de 10 meses es apenas del 1-3%. Afirma, ante la posibilidad de que un tumor de alto grado pase inadvertido, que la mitad de los tumores papilares que pasan inadvertidos pueden erradicarse con la instilación de BCG. Por otro lado, en cuanto al CIS, afirma que el infradiagnóstico del CIS asociado a tumor de riesgo alto y grado no tiene relevancia clínica, ya que este se tratará igualmente con BCG. Por último, se plantea si el diagnóstico y el tratamiento temprano del CIS disminuirán su tasa de progresión, poniendo en entredicho la capacidad curativa de BCG, sobre la que hoy existen evidencias a favor32,34,35.
Estudios coste-beneficio
El empleo de PDD en el diagnóstico del NMIBC implica un aumento del gasto en material y en fármaco fotosensibilizante, ya sea 5-ALA o HAL. Esto implica una sobrecarga económica para los sistemas de salud, pero que a medio y largo plazo representará un ahorro en actuaciones médicas, en gasto monetario por paciente y en calidad de vida para los beneficiarios de los sistemas de salud.
Existen varios sistemas predictivos de evaluación del coste-beneficio para el empleo de 5-ALA y de HAL, pero merece la pena comentar un completo estudio de Burger et al36, que evalúa dos grupos de pacientes, uno de ellos de 88 pacientes controlado con PDD (5-ALA) y el otro de 103 pacientes controlado con WL, con un seguimiento medio de 7,1 años. En el grupo controlado con PDD recidivó el 18% de los pacientes, mientras que en el grupo controlado con WL recidivó el 42%. El grupo controlado con PDD fue sometido a 0,8 resecciones por pacientes, con confirmación histopatológica de 0,3 recidivas por paciente, lo que supuso un coste en resecciones de 420 € por paciente en 7 años. Por otro lado, en el brazo WL cada paciente fue sometido a una media de 2 resecciones; se confirmó la existencia de tumor en 1 ocasión por paciente y el coste de las resecciones por paciente en 7 años fue de 1.750 €. La diferencia entre el coste de las resecciones del grupo WL y del grupo PDD fue de 1.330 € a favor del grupo PDD, si de esta cantidad sustraemos el coste del fármaco fotosensible, que fue de 135 €, resulta que el ahorro por paciente en 7 años fue de 1.195 €, lo que significa un ahorro de 168 € por paciente y año a favor del PDD (fig. 4).

Figura 4 - Coste de los recursos asistenciales empleados en cada brazo y diferencia de
coste final entre ambos brazos. Tomada de Burger et al36.
Otros autores muestran modelos predictivos donde, evaluando el comportamiento de las series con el empleo de PDD (5-ALA), valoran el ahorro monetario y en recursos. Así Zaak et al37 citan una serie de Stenzl donde se estima que de 392 resecciones transuretrales con un coste por cada una de ellas de 2.073 €, si estas se hubiesen realizado con PDD hubiese originado un sobrecoste de 51.042 €, pero el ahorro en cistoscopias hubiese representado 161.710 €, lo que cubriría sobradamente el sobrecoste en sustancia fotosensibilizante.
Del mismo modo, Daniltchenko et al28 valoran un grupo de 115 pacientes seguidos durante 5 años; el empleo de PDD (5-ALA) hubiese evitado 32 cistoscopias y 0,25 resecciones por paciente y año, lo que significaría un ahorro de 425 $ por paciente y año.
Hasta ahora hemos citado estudios de coste-beneficio con 5-ALA; respecto de HAL no hay publicados estudios a medio y largo plazo, por lo que es difícil inferir su repercusión económica. No obstante, se han realizado estudios económicos aplicando modelos predictivos basados en 5-ALA, pero ajustado a los costes de HAL, que son discretamente superiores. Hemos analizado 3 estudios, uno sobre el sistema sueco, otro sobre el alemán y el último sobre el sistema sanitario de Gran Bretaña, basándose en sus peculiaridades asistenciales, administrativas y epidemiológicas, y tomando como referencia temporal el total de NMIBC diagnosticados en 1 año.
El primer estudio es el sueco38; estima que el empleo de HAL en un año evitaría 23 cistectomías de un total de 52 posibles y condicionaría evitar 182 resecciones de un total de 2.149; ello representaría un ahorro de 212 $ por paciente y año.
Otro estudio sueco39, asumiendo una incidencia anual de NMIBC de 1.720 casos al año, estratificados en riesgo alto (15%), riesgo medio (35%) y riesgo bajo (50%), estima un ahorro de 500.000 € si se emplea HAL sólo en el grupo de riesgo alto, de 405.000 € si se emplea en los grupos de alto y riesgo medio, y de 365.000 € si se aplica a los tres grupos.
El lector no debe asombrarse de las cifras de incidencia; la población de suecia es apenas de 9 millones de habitantes, el hábito tabáquico está prácticamente erradicado y las emisiones de las centrales térmicas no existen ya que la mayoría de la energía procede de fuentes renovables.
El siguiente estudio está basado en el sistema alemán40; en este estudio se aplica sobre la incidencia del tumor vesical de 25.000 casos nuevos por año en 2002, de los cuales el 80% fueron NMIBC; se estratifican en 3 grupos, atendiendo a criterios de las Guías Clínicas de la EAU, en riesgo alto 25%, riesgo bajo 25% y riesgo medio 50%. Se establece el coste de la dosis de Hexvix® (HAL) en 412,50 € y el coste del equipo en 10.000 €, útil para el empleo con 100 pacientes en 1 año. Con todo esto, y estimando que el empleo de HAL reportará una disminución de la tasa de recidivas del 21%; siendo de este modo conservadores, reportaría una disminución de 80 cistectomías de un total de 881, una disminución en el número de resecciones de 2.089 de un total de 33.823 y un aumento de 388 cistoscopias sobre 50.010; este último hecho lo analizaremos más adelante. En la misma serie se estima el ahorro monetario que originaría, estimando una tasa de reducción de recidivas del 20%, el sobrecoste para el sistema de salud alemán: sería de 6.300.000 €, con un incremento del coste del 5,76% en el manejo del NMIBC por año. En las tablas 9 y 10 puede apreciarse que el empleo de HAL originaría un ahorro monetario sensible cuando este consiguiese una tasa de reducción de recidivas cercana al 40%.
En este estudio no se han cuantificado monetariamente aspectos como calidad de vida o mejora de la supervivencia, pero un hecho que se debe destacar es el aumento en el número de cistoscopias; el empleo de PDD determina un aumento de diagnósticos de CIS ya reseñado por otros autores22; este sobrediagnóstico de CIS hace que el grupo de pacientes de riesgo alto crezca, por lo que el número de pacientes sometidos a control estricto por medio de cistoscopia aumenta. Algo similar ocurre con la tasa de disminución de cistectomías; ello hace que pacientes que, en condiciones normales, hubiesen sido cistectomizados, la cistectomía no se realiza o se retrasa, pero se incluyen en el grupo de riesgo alto y engrosan el grupo de pacientes que precisan controles cistoscópicos más frecuentes. Por último, se aprecia una disminución del número de cistoscopias realizadas en el grupo de riesgo bajo; esto se debe a que los pacientes de riesgo bajo que realmente presentan una muy baja tasa de recidivas son resecados en primera resección de modo completo; se comportan como verdaderos tumores de riesgo bajo y no como falsos tumores de riesgo alto, con falsas recidivas precoces que en realidad son resecciones incompletas. Este concepto avala el empleo de PDD en toda primera resección de cualquier paciente, ya que ofrece un verdadero beneficio clínico y económico, contrapuesto a la actitud clásica del empleo de esta técnica sólo en pacientes de riesgo alto.
En último lugar, analizamos el estudio económico sobre el empleo de Hexvix® en el sistema sanitario de Gran Bretaña41. Se basa en el mismo esquema que el anterior, pero con una incidencia de 12.000 nuevos casos al año; se estratifica de igual modo a los pacientes y con la misma distribución; se estima la tasa de reducción de recidivas directamente en el 40%, que es la cifra que la literatura científica estima para la PDD con 5-ALA28. Se determina el coste de Hexvix® en 286 £, y el coste del equipo en 6.875 £. De este modo, se da una disminución en el número de cistectomías de 103 de un total de 561, un descenso del número de resecciones de 678 de un total de 15.882, y un aumento de 1.281 cistoscopias sobre 43.698. El impacto clínico es similar al originado en Alemania, pero el impacto económico es mayor, debido a las peculiaridades del sistema sanitario británico; el coste de una cistoscopia en el sistema británico es de 620 $ frente a 61 $ en el alemán, mientras que una resección transuretral en el sistema británico tiene un coste de 21.344 $ frente a 2.967 $ en Alemania42. Todo ello resulta en un sobrecoste de 2.770.000 £, lo que supone un incremento del gasto anual en el control de NMIBC del 3,95%.
Discusión: ¿cuándo debemos emplear diagnóstico fotodinámico?
En los últimos años se ha generalizado en nuestro medio el empleo de PDD, ya sea con 5-ALA o con HAL, en el diagnóstico de CIS y en su control posterior, de acuerdo con las recomendaciones de las guías clínicas de la EAU21,32. A medida que el urólogo ha ido familiarizándose con la técnica, ha ampliado su uso hacia situaciones en las que una completa resección de los tumores o el diagnóstico de lesiones planas de alto grado eran una prioridad. Así se ha generalizado el empleo en casos de tumores de riesgo alto y tumores multifocales; hoy esa indicación no está s respaldada por ninguna guía de práctica clínica32.
Queremos valorar en qué situaciones podríamos beneficiarnos del empleo de PDD y para ello plantearemos 6 teóricas situaciones de presentación del NMBIC, justificando en cada una de ellas el empleo o no de PDD.
Resección inicial de tumor vesical con citologías urinarias negativas
En este caso, el lector inicialmente puede opinar que no debemos emplear la PDD, ya que teniendo citologías negativas la posibilidad de hallar lesión plana de alto grado es remota, y ni tan siquiera en condiciones normales realizaríamos biopsias aleatorias16,43. No obstante, si privamos a este paciente del empleo de PDD, estamos privándole de una resección de calidad, ya que la PDD es capaz de detectar un mayor número de lesiones19,20; de una baja tasa de residuales27; estamos favoreciendo la presentación de una falsa recidiva temprana y a largo plazo le privaremos de una supervivencia libre de recidiva mayor23-26.
Resección inicial de tumor vesical con citologías urinarias positivas
A lo descrito en el epígrafe anterior habría poco que añadir; nos encontramos ante una situación igual, pero con un aspecto que añade aún más argumentos para el empleo de PDD: es la presencia de citologías positivas. Este hecho significa que existe una alta posibilidad de que halla lesiones planas de alto grado cuya existencia hay que evidenciar10-15, situación en la que la PDD se ha demostrado claramente superior a la WL y recomendada por las guías de práctica clínica de la EAU32. Además, la presencia de citologías positivas nos indica la posibilidad de existencia de lesiones papilares de alto grado, cuya erradicación incompleta puede tener consecuencias pronósticas importantes19-26.
Recidiva de tumor vesical de riesgo bajo
La mayoría de las series que evidencian una mejora en la supervivencia libre de enfermedad a medio y largo plazo están realizadas con 5-ALA y no distinguen entre tumores de riesgo alto o bajo24-28. Tampoco someten a los pacientes de cada brazo a intercambios entre ellos, es decir, los pacientes del brazo PDD son controlados con PDD a lo largo de su evolución sin tener en cuenta la influencia que podría tener en su evolución que las resecciones posteriores a la primera se realizasen con WL. Un hecho que se debe tener en cuenta en este epígrafe es que en los estudios de coste-beneficio el mayor a horro en cistoscopias con el empleo de PDD es en el grupo de tumores de riesgo bajo40,41.
Recidiva de tumor vesical de riesgo alto
En este caso, nos encontramos en una situación muy similar a la del epígrafe anterior, pero tenemos un sólido estudio donde en tumor papilar de alto grado se consigue claramente a los 8 años una supervivencia libre de recidiva23. Al igual que en la situación anterior, las series publicadas no intercambian a los pacientes de brazo y el beneficio clínico se obtiene manteniendo a los pacientes en cada uno de los brazos36.
Citologías sospechosas con hallazgos cistoscópicos normales
La búsqueda de CIS en pacientes con sospecha citológica y con indemnidad de la mucosa vesical es y ha sido siempre un reto para el urólogo y una de las primeras indicaciones de PDD, de tal modo que se ha convertido en la indicación principal y su empleo en esta situación está fuera de toda controversia10,12,13,19,44. Un hecho que se debe destacar es que el empleo de PDD ha aumentado la incidencia de CIS en algunas series19.
Para ilustrar la capacidad en el diagnóstico de CIS, citaremos una serie de 77 pacientes con citologías positivas y sin hallazgos cistoscópicos: con PDD se diagnosticó patología en 68 pacientes, lo que representó el 83% de los pacientes (27 CIS, 18 pTa-1 G 1-3 y 18 displasias)45.
Control del carcinoma in situ post-BCG
Dada la importancia clínica del diagnóstico del CIS, el urólogo ha aplicado PDD al control del CIS postratamiento con BCG. Nos encontramos con dos aspectos muy importantes: Vamos a tener una alta tasa de falsos positivos17, que también se obtendrá con WL18, pero no está determinado cuál es el tiempo óptimo de lavado post-BCG para minimizar esa tasa de falsos positivos. La mayoría de los estudios están realizados con antecedente de instilación de BCG de un mínimo de 3 meses. El otro aspecto que se debe considerar es la escasa rentabilidad diagnóstica de PDD en esta situación; escasa rentabilidad diagnóstica porque se añade a la baja incidencia del CIS, en torno al 5% (22); si a esto sumamos que la respuesta a las 6 primeras instilaciones de BCG condicionará la desaparición de éste en el 60-80% de los casos46,47, muy pocas veces en este contexto encontraremos CIS. Esta negatividad ha sido algo que, en la práctica inicial con PDD, ha frustrado al urólogo, pero dado su alto valor predictivo negativo14, el hecho de la negatividad tiene una implicación clínica muy importante, ya que ofrece preservación vesical.
Conclusiones
Podemos concluir afirmando que recomendamos el empleo de PDD en toda primera resección de cáncer vesical no músculo-invasivo, presente o no citologías positivas, en el diagnóstico de neoplasia vesical con citologías positivas sin hallazgos cistoscópicos, en el tratamiento de las recidivas de tumores de riesgo alto y en la evaluación de la respuesta a BCG del CIS. En el caso de recidivas de tumores de riesgo medio, no desaconsejamos su empleo, pero creemos que futuros estudios cruzados entre brazos con PDD y WL pueden apoyar más su empleo.
Conflicto de intereses
El autor declara que no existe ninguna relación comercial con la empresa responsable de los fármacos citados que pueda haber influido en la realización de este artículo.
Bibliografía
1. Ferlay J, Bray F, Pisani P, Parkin DM. Globcan 2002, cancer incidence, mortality and prevalence worldwide, IARC. Cancer Base N.o 5, version 2.0. Lyon: IARCC Press; 2004. [ Links ]
2. Kirkali Z, Chan T, Manoharan M, Algaba F, Busch C, Cheng L, et al. Bladder cancer: epidemiology, staging and grading, and diagnosis. Urology. 2005;66 Suppl 1:4-34. [ Links ]
3. Brausi M, Collette L, Kurth K, Van der Meijden AP, Oosterlinck W, Witjes JA, et al; EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol. 2002;41:523-31. [ Links ]
4. Marti A, Jichlinski P, Lange N, Ballini JP, Guillou L, Leisinger HJ, et al. Comparison of aminolevulinic acid and hexylester aminolevulinate induced protoporphyrin IX distribution in human bladder cancer. J Urol. 2003;170:428-32. [ Links ]
5. Kriegmair M, Baumgartner R, Knuchel R, Stepp H, Hofstädter F, Hofstetter A. Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence. J Urol. 1996;155:105-9. [ Links ]
6. Jichlinski P, Forrer M, Mizeret J, Glanzmann T, Braichotte D, Wagnières G, et al. Clinical evaluation of a method for detecting superficial surgical transitional cell carcinoma of the bladder by light-induced fluorescence of protoporphyrin IX following the topical application of 5-aminolevulinic acid: preliminary results. Lasers Surg Med. 1997;20:402-8. [ Links ]
7. Koenig F, McGovern FJ, Larne R, Enquist H, Schomacker KT, Deutsch TF. Diagnosis of bladder carcinoma using protoporphyrin IX fluorescence induced by 5-aminolaevulinic acid. BJU Int. 1999;83:129-35. [ Links ]
8. Kloek J, Akkermans W, Beijersbergen van Henegouwen GM. Derivatives of 5-aminolevulinic acid for photodynamic therapy: enzymatic conversion into protoporphyrin. Photochem Photobiol. 1998;67:150-4. [ Links ]
9. Lange N, Jichlinski P, Zellweger M, Forrer M, Marti A, Guillou L, et al. Photodetection of early human bladder cancer based on the fluorescence of 5-aminolaevulinic acid hexylesterinduced protoporphyrin IX: a pilot study. Br J Cancer. 1999;80:185-93. [ Links ]
10. Jocham D, Witjes F, Wagner S, Zeylemaker B, Van Moorselaar J, Grimm MO, et al. Improved detection and treatment of bladder cancer using hexaminolevulinate imaging: a prospective, phase III multicenter study. J Urol. 2005;174:862-6. [ Links ]
11. Witjes JA, Moonen PM, Van der Heijden AG. Comparison of hexaminolevulinate based flexible and rigid fluorescence cystoscopy with rigid white light cystoscopy in bladder cancer: results of a prospective Phase II study. Eur Urol. 2005;47:319-22. [ Links ]
12. Loidl W, Schmidbauer J, Susani M, Marberger M. Flexible cystoscopy assisted by hexaminolevulinate inducedfluorescence: a new approach for bladder cancer detection and surveillance? Eur Urol. 2005;47:323-6. [ Links ]
13. Schmidbauer J, Witjes F, Schmeller N, Donat R, Susani M, Marberger M. Improved detection of urothelial carcinoma in situ with hexaminolevulinate (HAL) fluorescence cystoscopy. J Urol. 2004;171:135-8. [ Links ]
14. Jichlinski P, Guillou L, Karlsen SJ, Malmström PU, Jocham D, Brennhovd B, et al. Hexyl aminolevulinate fluorescence cystoscopy: new diagnostic tool for photodiagnosis of superficial bladder cancer-a multicenter study. J Urol. 2003;170: 226-9. [ Links ]
15. Durek C, Wagner S, Zeylemaker B, Van Moorselaar J, Witjes F, Grimm MO, et al. The significance of hexyl 5-aminolevulinate hydrochloride based fluorescence cystoscopy in treatment decisions.- Results of a prospective phase 3 multicenter study. Eur Urol Suppl. 2004;3:95. [ Links ]
16. Wallace D, HindmarshJ, Webb J. The role of multiple mucosal biopsies in the management of patients with bladder cancer. Br J Urol. 1979;51:535-40. [ Links ]
17. Grlmberegen M, Jonges T, Lock T, Van Swol C, Van Moorselaar J. Previous intravesical therapy increases the number of false positive biopsies in photodynamic diagnosis (PDD) of bladder cancer. Eur Urol Suppl. 2002;1:121. [ Links ]
18. Pieras Ayala E, Palou J, Rodríguez-Villamil L, Millán Rodríguez F, Salvador Bayarri J, Vicente Rodríguez J. Cytoscopic follow-up of initial G3T1 bladder tumors treated with BCG. Arch Esp Urol. 2001;54:211-7. [ Links ]
19. Fradet Y, Grossman HB, Gomella L, Lerner S, Cookson M, Albala D, et al, and PC B302/01 Study Group. A comparison of hexaminolevulinate fluorescence cystoscopy and white light cystoscopy for the detection of carcinoma in situ in patients with bladder cancer: a phase iii, multicenter study. J Urol. 2007;178:68-73. [ Links ]
20. Grossman HB, Gomella L, Fradet Y, Morales A, Presti J, Ritenour C, et al; PC B302/01 Study Group. A phase III, multicenter comparison of hexaminolevulinate fluorescence cystoscopy and white light cystoscopy for the detection of superficial papillary lesions in patients with bladder cancer. J Urol. 2007; 178:62-7. [ Links ]
21. Jocham D, Stepp H, Waidelich R. Photodynamic diagnosis in urology: state-of-the-art. Eur Urol. 2008;53:1138-48. [ Links ]
22. Hungerhuber E, Stepp H, Kriegmair M, Stief C, Hofstetter A, Hartmann A, et al. Seven years´experience with 5-Aminolevulinic acid in detection of transitional cell carcinoma of the bladder. J Urol. 2007;69:260-4. [ Links ]
23. Denzinger S, Wieland WF, Otto W, Filbeck T, Knuechel R, Burger M. Does photodynamic transurethral resection of bladder tumour improve the outcome of initial T1 high-grade bladder cancer? A long-term follow-up of a randomized study. BJU Int. 2008;101:566-9. [ Links ]
24. Denzinger S, Burger M, Walter B, Knuechel R, Roessler W, Wieland WF, et al. Clinically relevant reduction in risk of recurrence of superficial bladder cancer using 5-aminolevulinic acid-Induced fluorescence diagnosis: 8-year results of prospective randomized study. Eur Urol Suppl. 2007;51:1320-5. [ Links ]
25. Filbeck T, Pichlmeier U, Knuechel R, Wieland WF, Roessler W. Clinically relevant improvement of recurrence-free survival with 5-aminolevulinic acid induced fluorescence diagnosis in patients with superficial bladder tumors. J Urol. 2002;168:67-71. [ Links ]
26. Filbeck T, Pichlmeier U, Knuechel R, Wieland W, Roessler W. 5aminolevulinic acid induced fluorescence endoscopy decreases recurrence rate of superficial bladder carcinoma. Eur Urol Suppl. 2002;1:121. [ Links ]
27. Kriegmair M, Zaak D, Rothenberger KH, Rassweiler J, Jocham D, Eisenberger F, et al. Transurethral resection for bladder cancer using 5-aminolevulinic acid induced fluorescence endoscopy versus white light endoscopy. J Urol. 2002;168:475-8. [ Links ]
28. Daniltchenko D, Riedl C, Sachs MD, Kurosch FK, Pflueger DH, loaning S, et al. Long-term benefit of 5-aminolevulinic acid fluorescence assisted transurethral resection of superficial bladder cancer: 5-year results of a prospective randomized study. J Urol. 2005;174:2129-33. [ Links ]
29. Witjes JA, Douglass J. The role of hexaminolevulinate fluorescence cystoscopy in bladder cancer. Nat Clin Pract Urol. 2007;4:542-9. [ Links ]
30. Witjes A. Fluorescence cystoscopy in bladder cancer: the case pro. Eur Urol Suppl. 2008;7:426-9. [ Links ]
31. Jichlinski P, Jacqmin D. Photodynamic diagnosis in nonmuscle-invasive bladder cancer. Eur Urol Suppl. 2008;7:529-35. [ Links ]
32. Babjuk M, Oosterlinck W, Sylvester R, Kaasinen E, Böhle A, Palou J. EAU Guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol. Suppl. 2008;54:303-14. [ Links ]
33. Brausi MA. Arguments against the use of fluorescence for the diagnosis of non-muscle-invasive bladder tumours (NMIBT). Eur Urol. Suppl. 2008;7:430-3. [ Links ]
34. García Rodríguez J, Fernández Gómez JM, Escaf Barmadah S, González Álvarez RC, Rodríguez Robles L, Miranda Aranzubia O. [Pronostic factors in recurrence and progression of superficial bladder cancer. Risk groups (part I)]. Actas Urol Esp. 2006;30:998-1008. [ Links ]
35. García Rodríguez J, Fernández Gómez JM, Escaf Barmadah S, Jalón Monzón A, Álvarez Múgica M, Regadera Sejas J. [Pronostic factors on recurrence and progression of superficial bladder cancer. Risk groups (part II)]. Actas Urol Esp. 2006;30:1009-16. [ Links ]
36. Burger M, Zaak D, Stief CG, Filbeck T, Wieland WF, Roessler W, et al. Photodynamic diagnostics and noninvasive bladder cancer: is it cost-effective in long-term application? A Germany-based cost analysis. Eur Urol. 2007;52:142-7. [ Links ]
37. Zaak D, Wieland F, Stief CG, Burger M. Routine use of photodynamic diagnosis of bladder cancer: practical and economic issues. Eur Urol Suppl. 2008;7:536-41. [ Links ]
38. Thompson G, Durrant H, Kloster Y. Hexvix fluorescence cytoscopy for superficial bladder cancer diagnosis: analysis of budget impact on the Swedish Health Service. Value Health. 2006;9:A277. [ Links ]
39. Malmstrom PU, Hedelin H. Potential cost savings through the use of fluorescence cystoscopy in superficial bladder cancer: development of an economic model. Urology Suppl. 2006;68:40-1. [ Links ]
40. Sievert KD, Zyczynski T, Sweet A, Rößler DW, Stenzl A. Hexvix fluorescence cystoscopy for non-invasive bladder cancer management: an economic model of the impact on german healthcare costs. Value Health. 2007;10:40. [ Links ]
41. Zyczynski T, Sweet A, Wallace DM. Hexvix fluorescence cystoscopy for non-invasive bladder cancer management: an economic model of the impact on healthcare costs in the UK. Value Health. 2007;10:41. [ Links ]
42. Sievert KD, Amend B, Nagele U, Schilling D, Bedke J, Horstmann M, et al. Economic aspects of bladder cancer: what are the benefits and costs? World J Urol. 2009;27:295-300. [ Links ]
43. Fujimoto N, Harada S, Terado M, Sato H, Matsumoto T. Multiple biopsies of normal-looking urothelium in patients with superficial bladder cancer: Are they necessary? Int J Urol. 2003;10:631-5. [ Links ]
44. Ray ER, Chatterton K, Khan MS, Thomas K, Chandra A, O¿Brien TS. Hexylaminolaevulinate «blue light» fluorescence cystoscopy in the investigation of clinically unconfirmed positive urine cytology. BJU Int. 2009;103:1363-7. [ Links ]
45. Karl A, Tritschler S, Stanislaus P, Gratzke C, Tilki D, Strittmatter F, et al. Positive urine cytology but negative white-light cystoscopy: an indication for fluorescence cystoscopy? BJU Int. 2009;103:484-7. [ Links ]
46. Bretton PR, Herr HW, Kimmel MJ. The response of patients with superficial bladder cancer to a second course of intravesical bacillus Calmette-Guérin. Urol. 1990;143:710-13. [ Links ]
47. Uekado Y, Kohjimoto Y, Iba A, Kikkawa K, Shintani Y, Shinka T. Efficacy of intravesical bacillus Calmette-Guérin for carcinoma in situ of bladder. Hinyokika Kiyo. 2006;52:439-44. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: jolivaencina@ono.com
(J. Oliva Encina).
Recibido: 15 de abril de 2009
Aceptado: 23 de julio de 2009