My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actas Urológicas Españolas
Print version ISSN 0210-4806
Actas Urol Esp vol.34 n.4 Apr. 2010
Crioterapia de tumores renales: estado actual y desarrollos contemporáneos
Cryotherapy for renal tumors: Current status and contemporary developments
J. Riojaa, V. Tzortzisb, C. Mamoulakisa y M.P. Lagunaa
aDepartment of Urology, AMC University Hospital, University of Amsterdam, Holanda
bDepartment of Urology, University of Thessaly Medical School, Larissa, Grecia
Dirección para correspondencia
RESUMEN
La proporción de tumores renales incidentales ha incrementado drásticamente en la ultima década, siendo diagnosticados en más de la mitad de los casos en pacientes mayores de 70 años, población con una alta comorbilidad asociada. Las técnicas ablativas mínimamente invasivas conservadoras de parénquima están destinadas a tratar a pacientes con tumores renales pequeños y múltiple comorbilidad. La crioterapia destaca sobre otras técnicas ablativas por sus mejores resultados oncológicos a medio plazo.
Realizamos una revisión no sistemática de la literatura médica analizando la crioterapia como tratamiento de los tumores renales, analizando sus indicaciones, las técnicas de aplicación actuales y las perspectivas de futuro, los resultados y las complicaciones.
Palabras clave: Crioterapia. Tumor renal. Laparoscopia.
ABSTRACT
The proportion of renal tumors found incidentally dramatically increased in the past decade. More than half of them were diagnosed in patients over 70 years of age, a population with high associated comorbidity. Nephron-sparing minimally invasive surgical procedures are aimed at treating patients with small renal tumors and multiple comorbidities. Cryotherapy stands out among all other ablative procedures because of its better mid-term oncological outcome.
A non-systematic review of the literature on cryotherapy as a treatment for renal tumors was made, analyzing its indications, actual and future application techniques, results, and complications.
Key words: Cryotherapy. Renal tumor. Laparoscopy.
Introducción
Durante la última década, y debido al incremento del uso de las técnicas de imagen, se ha producido un incremento de la incidencia de masas renales pequeñas incidentales. Entre 1982-1997, la proporción de tumores renales diagnosticados de manera incidental aumentó de un 13 a un 66%1. Más de la mitad de los pacientes diagnosticados de masas renales eran mayores de 70 años. Es en esta población de pacientes en la que se espera una asociación con una mayor comorbilidad2. La cirugía conservadora fue desarrollada inicialmente para pacientes monorrenos o con compromiso de la función renal. Sin embargo, la evidencia de las tasas de recurrencia y supervivencia a largo plazo son similares a otras observadas después de hacer una cirugía radical, lo que hace que la cirugía conservadora sea una opción terapéutica para pacientes con tumores inferiores a 4cm, incluso con la presencia de un riñón normal contralateral3,4.
Las técnicas ablativas mínimamente invasivas conservadoras de parénquima están destinadas a tratar a pacientes con tumores renales pequeños y múltiple comorbilidad. Las técnicas ablativas destruyen el tejido, al contrario que con la cirugía que se reseca, con la ventaja de una menor morbilidad y una estancia hospitalaria más breve así como una mejor preservación de la función renal. La crioterapia es la técnica ablativa más estudiada y clínicamente probada de todas las técnicas ablativas.
Indicaciones y contraindicaciones
El caso óptimo para crioterapia es una lesión periférica, captadora de contraste, bien circunscrita y menor de 4cm. En general, todos los pacientes con un tumor renal pequeño son candidatos para crioterapia. Especialmente, además de las características tumorales, ciertas poblaciones de pacientes, como los pacientes añosos con comorbilidad, hipertensión particularmente, diabetes, piedras renales, insuficiencia renal, accidentes cerebrovasculares y fallo cardíaco congestivo se pueden beneficiar de la crioterapia renal. Otras indicaciones incluyen situaciones únicas como lesiones menores de 4cm en riñones únicos o transplantados, con enfermedades hereditarias como el síndrome de Von Hippel-Lindau, la esclerosis tuberosa y el carcinoma de células renales papilar hereditario5. Las contraindicaciones relativas para crioterapia son pacientes jóvenes, tumores mayores de 4cm, tumores del seno, intrarrenales y tumores quísticos (tabla 1). La única contraindicación absoluta es una coagulopatía intratable o irreversible6.
Mecanismo de ablación tisular de crioterapia
Los mecanismos de daño tisular como consecuencia de la congelación no están completamente descritos, pero actualmente se describen como agudos y tardíos7. El daño tisular agudo es provocado por la formación de hielo en el tejido. Inicialmente, a tasas bajas de congelación, alrededor de -5oC/min, el hielo se forma en el espacio extracelular debido a que la membrana celular de doble capa lipídica inhibe el crecimiento de los cristales. La formación de hielo extracelular aumenta la concentración osmótica, causando un movimiento del agua intracelular al compartimiento extracelular. Esto, eventualmente, conlleva cambios en la composición de la solución intracelular, el pH y la desnaturación proteica. Más adelante, la formación de cristales extracelulares puede causar una ruptura de la membrana celular y, por tanto, la formación de hielo intracelular8,9. Sin embargo, cuando la tasa de congelación alcanza los -20oC/min el hielo se forma de manera sincrónica en el espacio intracelular y extracelular, el gradiente transmembrana no ocurre y el hielo intracelular rompe la membrana celular, causando un daño celular irreversible10. Chosy et al describieron que para conseguir necrosis en el tejido renal era necesaria la exposición a temperaturas de -19,4oC11. Este trabajo fue confirmado por Campbell et al, quienes observaron la presencia de una necrosis completa en el interior del borde de la bola de hielo, que se correlacionaba con una temperatura de -19,4oC12.
El daño tisular tardío ocurre en las horas y días posteriores a la crioterapia, siendo el resultado de un daño indirecto de la microvasculatura del tejido diana13. Las células endoteliales son dañadas durante la fase aguda por los mecanismos antes mencionados. A lo largo del tiempo, la integridad de la microvasculatura se va perdiendo produciéndose una extravasación de fluido de los capilares dañados, así como una extensión de la trombosis en el lecho vascular. Esta combinación de eventos lleva a una disminución de la perfusión del tejido y una muerte celular retrasada14. Éste es, probablemente, el más importante de los mecanismos de muerte celular que se producen durante la crioterapia. Estudios in vitro han demostrado que la apoptosis inducida por la crioterapia juega un papel importante en la muerte celular15.
La destrucción celular se consigue por medio de ambos procesos de congelación y descongelación. Las técnicas de crioterapia renal han evolucionado sobre la base de los datos disponibles del tratamiento de los pacientes con tumores hepáticos, pioneros en el uso de un doble ciclo de congelación. Se ha demostrado que el doble ciclo de congelación, cuando se compara con el ciclo simple, produce un área de necrosis mucho más larga en el animal de experimentación. El hecho de que el ciclo de descongelación confiera alguna ventaja sobre el ciclo de descongelación rápida en el contexto clínico no está del todo claro pero, por lo general, se prefiere usar un ciclo doble de congelación y descongelación16,17.
Equipo de crioterapia
La primera generación de máquinas de crioterapia fue probada en 1960 con unas agujas de congelación que utilizaban nitrógeno líquido. La primera aplicación fue en la próstata. La segunda generación de criocirugía fue desarrollada en la década de 1990, incluyendo agujas de congelación de 3mm, y congelaban con nitrógeno líquido. Desde el año 2000 se ha desarrollado la tercera generación de criotecnología. La tecnología actualmente utilizada se basa en la liberación de gases de argón y helio, a través de unas finas agujas de 1,5mm (la segunda y la tercera generación de agujas son utilizadas indistintamente en los diferentes centros). Los avances tecnológicos nos han llevado al desarrollo de crioagujas de distintos diámetros y longitudes con el objetivo de producir la deseada criolesión basándonos en una planificación pretratamiento.
La crioablación se realiza utilizando sistemas basados en la utilización de gas argón funcionando sobre la base del principio Joule-Thompson. Basados en el mismo principio, el gas de helio es utilizado para la descongelación activa18. Actualmente, están disponibles tres versiones de agujas de tercera generación de 17 gauges, que producen distintos tamaños y formas de la bola de hielo. La crioaguja elíptica (IceRod®) genera una bola de hielo elíptica de 32-56mm en los estudios ex vivo. La crioaguja con forma de bombilla (IceBulb®) genera una bola de hielo con forma de bombilla con un tamaño de 32-60mm. Finalmente, la crioaguja estándar (IceSeed®) es la aguja estándar de 17 gauges, que genera un bola de hielo de 18-27mm19.
Técnica
Se han descrito técnicas de crioterapia abierta, laparoscópica o percutánea para crioablación renal. Cada una de ellas tiene unas ventajas y unos inconvenientes, aunque el concepto de procedimiento mínimamente invasivo se aplica generalmente a procedimientos laparoscópicos o percutáneos.
El abordaje laparoscópico transperitoneal está indicado en aquellas lesiones situadas en la cara ventral del riñón, mientras que el abordaje retroperitoneal está más indicado en aquellos casos en los que la lesión está en la cara dorsal del riñón. El abordaje percutáneo está, hasta la fecha, indicado sólo para aquellos tumores localizados en la cara dorsal del riñón por problemas de inclusión con los órganos vecinos, incluso cuando se han usado maniobras de distanciamiento.
Crioablación laparoscópica
Normalmente se utiliza una técnica clásica de abordaje transperitoneal o retroperitoneal. El protocolo se debe seguir paso a paso. Los pasos incluyen movilización del riñón, visualización de la lesión medianteecografía, incisión de la grasa prerrenal y visualización de la masa y colocación de las agujas bajo visualización directa. Antes de colocar las agujas, si no se ha realizado previamente, se debe tomar una biopsia con aguja del tumor, para estudio histológico. Previamente a la cirugía, se habrá medido la configuración exacta del tamaño de la lesión. El número y el tipo de crioagujas dependen de la localización y del tamaño exacto de la lesión.
La elección del diseño de aguja, el número y el tamaño depende de las características anatómicas de la masa renal. Cuando procedemos a la colocación de las crioagujas, la correcta colocación de estas deberá ser comprobada con la ayuda de ecografía intraoperatoria. Se pueden colocar termosensores (thermosensors) en el centro de la lesión o en la periferia de esta, en el parénquima normal (sano) para monitorizar las temperaturas del objetivo (fig. 1).

Figura 1. Técnica de crioterapia laparoscópica. A) Visualización de la masa y toma de biopsia con aguja.
B) Colocación de las crioagujas y del termosensor. C) Monitorización de la crioablación mediante ecografía
laparoscópica (nótese la presencia de dos termosensores: uno central y otro periférico, como agujas sin hielo).
D) Visualización de la bola de hielo que incluye la totalidad del tumor más un margen amplio de seguridad.
Generalmente, se aconseja cubrir el tumor con un margen de 10mm en exceso de la bola de hielo. La crioterapia empieza con un ciclo de congelación en el tejido diana de 20 a -40oC. La criolesión se hace visible como una bola de hielo, y en la ecografía como una lesión hipoecoica. La tendencia actual es esperar hasta cubrir completamente el tumor con la criolesión en la ecografía y congelar por unos 2-3min más. Si la imagen ecográfica no es clara, se recomienda descongelar hasta alcanzar una temperatura de 0oC en todos los termosensores (fig. 2). A la finalización del ciclo de congelación y descongelación, se requiere paciencia por parte del cirujano para retirar las agujas. Las agujas se sueltan por sí mismas con el tiempo, y una manipulación precoz de la aguja previa a un calentamiento adecuado podría resultar en un sangrado del tracto de la aguja20.
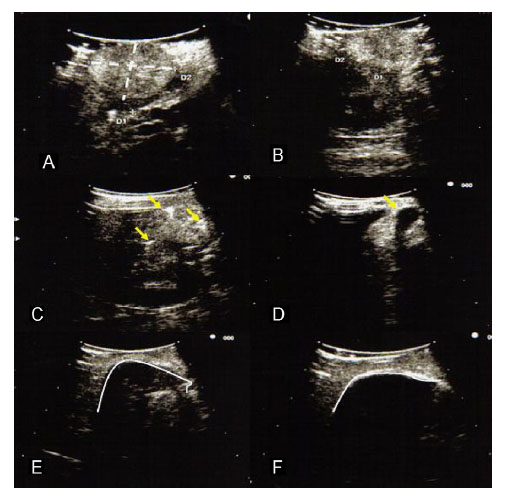
Figura 2. Ecografía laparoscópica. A y B) Visualización y medición de los diámetros
tridimensionales del tumor. C) Colocación de las crioagujas (flecha amarilla, crioagujas).
D) Inicio de la crioterapia y monitorización de la formación de las bolas de hielo.
E) Visualización de la formación de una «única» bola de hielo. F) Cobertura con margen
de seguridad del tumor por parte de la bola de hielo.
Crioterapia mediante acceso con puerto único
Un avance en la técnica de laparoscopia es la técnica de crioterapia mediante acceso con puerto único. Este abordaje podría permitir la realización completa de la crioterapia a través del ombligo, permitiendo básicamente la cirugía abdominal sin cicatrices con la consiguiente reducción de la morbilidad de la cicatriz. Recientemente, Goel y Kaouk21 reportaron el primer intento en seis pacientes. Utilizaron un único puerto con múltiples canales de trabajo especialmente designados para instrumentos laparoscópicos curvos. Para el abordaje retroperitoneal, el puerto multicanal se colocaba en la punta de la 12.a costilla utilizando la técnica abierta de Hasson, y, para el abordaje transperitoneal, el puerto se colocaba mediante una incisión de 1,5cm semicircular en el borde interno del ombligo. Después de la exposición del tumor, realizaban una biopsia intraoperatoria e insertaban una crioaguja de 3,8mm mediante control ecográfico. En un paciente con un tumor de más de 1cm se utilizaron dos crioagujas. Todos los procedimientos fueron completados de manera satisfactoria. No hubo ninguna complicación intraoperatoria. Tan sólo se desarrolló una complicación postoperatoria en paciente con un fallo cardíaco congestivo.
Cirugía endoscópica a través de los orificios naturales
La cirugía endoscópica a través de los orificios naturales (NOTES) es una tecnología emergente que puede reducir la morbilidad y proporcionar una cirugía sin cicatrices, ayudando a reducir la invasión de las técnicas estándares de laparoscopia y robótica aceptadas hoy22. La NOTES representa el siguiente paso en una cirugía de mínima invasión. Se realiza a través de orificios naturales, con una recuperación potencialmente mejor y menos complicaciones, como hernias23. Los abordajes transgástricos y transvaginales se han utilizado con éxito para el acceso a la cavidad peritoneal24. Pero, hasta hoy, sólo se han realizado en modelos animales. Croutzet et al presentaron su experiencia con crioablación renal guiada por NOTES. La operación fue realizada de manera exitosa a través de un abordaje bien transgástrico o transvaginal para cada riñón, respectivamente. Reportaron que todos los procedimientos fueron desarrollados de manera exitosa, sin complicaciones intraoperatorias. No se precisó de colocación adicional de ningún puerto laparoscópico, ni conversión a cirugía abierta. La visión del riñón y de la bola de hielo fue adecuada en todos los casos y el tiempo medio de operación fue de 83min25.
Crioterapia percutánea guiada por imagen
Las ventajas del abordaje percutáneo, a parte de ser menos invasivo, incluyen una hospitalización más corta, excelente monitorización de la bola de hielo mediante imagen (resonancia magnética [RM] o tomografía computarizada [TC]), disminución de la necesidad de calmantes y una efectividad coste superior al abordaje laparoscópico26. Puede realizarse guiado por ecografía, TC o RM. Las ventajas de la ecografía son su capacidad de visualización en tiempo real y su ausencia de radiaciones ionizantes. Sin embargo, la imagen ecográfica es altamente tecnicodependiente y puede estar comprometida en diversos escenarios, como en el caso de los pacientes obesos, presencia de abundante grasa abdominal, así como cuando el tumor se encuentra próximo a una asa intestinal, para evitarla27. La TC no es tecnicodependiente y es razonablemente accesible. Su amplio campo de visión es excelente para cubrir los órganos críticos y las estructuras que necesitan ser evitadas. La TC es mucho menos sensible a los hábitos humanos que la ecografía; la TC no se ve afectada por el gas intestinal. Si se elije la TC como método de guía, la lesión diana debería ser visible en la fase sin contraste. La ablación percutánea puede realizarse mediante TC convencional o mediante TC con capacidad fluoroscópica en tiempo real28. La RM es la menos utilizada de las técnicas de imagen para crioablación percutánea, debido a la necesidad de realizar unos ajustes especiales para acomodar el equipo de crioterapia a la habitación de la RM. Sin embargo, permite unos campos de visión tridimensionales excepcionales con ausencia de radiaciones ionizantes29. La crioterapia percutánea guiada por RM puede ser realizada bien utilizando un equipo magnético intervencionista o uno convencional con amplio gantry. La bola de hielo puede ser visualizada como una zona de baja intensidad en la secuencia T130.
Actualmente, la mayoría de los procedimientos percutáneos con agujas son realizados con intubación endotraqueal y ventilación mecánica estándar, con el consiguiente movimiento del riñón durante la ventilación. Este movimiento puede ser contrarrestado, si tenemos al anestesista, aguantando la respiración durante fases específicas del escáner, así como durante el período de inserción de las agujas. Aguantar la respiración de manera repetida parece complicado y prolonga el procedimiento y, si no está perfectamente sincronizado, puede producir imágenes inadecuadas que puede que tengan que ser repetidas, requiriendo una mayor exposición radiactiva, así como una errónea colocación de las agujas o un fallo de la biopsia. Una alternativa potencial a la ventilación mecánica incluye la utilización de ventilación oscilatoria de alta frecuencia (HFOV). La HFOV entrega un volumen tidal bajo, con una presión media alta en la vía respiratoria y con altas frecuencias (180-600rpm)31. Esta alta frecuencia y un bajo volumen tidal eliminan ampliamente el movimiento del diafragma, quedando el riñón en una posición estable. Recientemente, Beck et al publicaron su experiencia utilizando la HFOV. Encontraron que ésta puede reducir el tiempo actual requerido para realizar la crioablación, posiblemente debido a la eliminación del movimiento renal durante el procedimiento, facilitando, por ello, la planificación y el acceso a la masa renal. Por otro lado, los pacientes aguantaron HFOV sin incidentes, así como los cirujanos encontraron más sencilla la realización del procedimiento32.
Seguimiento
Las crio-lesiones requieren una estrecha monitorización para asegurarse la reducción del tumor. La masa renal no desaparece por completo hasta meses o años después, porque puede ser reemplazada por fibrosis, pero la masa debería progresivamente reducirse en tamaño. A un angiomiolipoma de 4cm le costó más de 2 años resolverse, aunque progresivamente disminuyó de tamaño33. No existe ningún algoritmo para monitorizar el seguimiento posprocedimiento, pero se considera que los pacientes necesitan un seguimiento estrecho (cada 3 meses) durante 12-18 meses, seguido de una vigilancia a largo plazo, bien hasta la reducción completa, o bien si la lesión permanece estable, de manera anual, para asegurarse la ausencia de una potencial recidiva del margen34. La captación de gadolinio en la imagen de RM es un medio efectivo de seguimiento postratamiento. Sin embargo, la TC con contraste es el método más utilizado35.
La captación de contraste de una lesión 30 días después de un tratamiento puede ser un signo ominoso. Criterios importantes para establecer el diagnóstico de recurrencia tumoral con TC o RM son el tamaño de la lesión y la captación nodular. La captación en anillo con un incremento del tamaño es más preocupante que la captación en anillo por sí sola36 (fig. 3).

Figura 3. Seguimiento de un paciente tras crioterapia por tumor renal.
A) Tomografía computarizada a los tres meses postratamiento; se observa una
imagen de captación en anillo, que ha desaparecido en B) Control a los 6 meses.
El papel de la biopsia en el seguimiento está cuestionado debido a su baja sensibilidad y a que no lleva a diagnóstico definitivo37. Nuestros resultados muestran que la presencia de captación en anillo en los primeros meses después de la crioablación es relativamente común y no justifica la toma de biopsias sistemáticas; primero, porque esta captación desaparece espontáneamente (de acuerdo con nuestros resultados), y, segundo, porque resulta muy difícil obtener biopsias de ese fino anillo38. Recientemente, en un estudio de la Cleveland Clinic39, los autores mostraron que la biopsia no añadía información substancial a la TC o la RM (captación de contraste) en los seis primeros meses, y que podría ser evitada.
La utilización de ecografía con contraste en la evaluación renal después de crioablación supone otra alternativa. La ecografía con contraste combina contraste con microburbujas con imágenes de secuencia pulsada (contrast pulse sequence). Esta tecnología permite al cirujano controlar la perfusión de la zona tratada en tiempo real40.
Resultados
En los últimos años, se han publicado resultados a medio y largo plazo de crioterapia renal, mediante distintos abordajes. (tablas 2 y 3)4-41. Más aun, resultados de dos recientes metaanálisis han mostrado que la recurrencia local (fallo del tratamiento) varía entre un 4,655 - 5,2%56 y la progresión entre un 1 - 1,2%55,56.
Complicaciones
El objetivo de la crioterapia por carcinoma renal es disminuir la morbilidad del tratamiento de los tumores renales in situ, eliminando la necesidad de su extirpación; sin embargo, tiene unas potenciales complicaciones.
Frecuentemente se observan desgarros renales menores de la zona crioablada. Éstos son fácilmente tratables mediante presión directa con agente hemostático durante 10min, seguido de observación durante 10-15min (con reducción de la presión de insuflación)57. La fractura del parénquima renal y la posterior hemorragia pueden ser evitadas mediante la colocación perpendicular de las agujas de crioterapia en el riñón, manteniendo esta posición cuidadosamente durante todo el procedimiento, y retirando las agujas de manera cuidadosa (especialmente con las agujas grandes) después de una descongelación del tejido renal que rodea a la crioaguja58. Para evitar contacto inadvertido y el consiguiente daño, los órganos adyacentes necesitan protección de la criolesión. Se han publicado diversas lesiones iatrogénicas, como lesiones pancreáticas estenosis de la unión pieloureteral y obstrucción intestinal completa59,60. Cuando la bola de hielo o criolesión incluye el sistema colector, los resultados no están claros. Estudios en animales, con contacto intencionado de la criolesión con el sistema colector, han revelado una mínima cicatriz de la lámina propia y del músculo liso, así como un recrecimiento del urotelio circundante61. La relación de la bola de hielo con el sistema colector ha sido descrita en series humanas con cirugía abierta y en modelos animales, sin observarse fuga urinaria62. Los resultados de un estudio retrospectivo multicéntrico con experiencia combinada (radiofrecuencia y crioterapia) en 139 casos han revelado que la tasa de complicaciones mayores y menores atribuible a la crioterapia oscila entre un 1,8 y un 9,2%, respectivamente. Las cinco complicaciones mayores incluían íleo, hemorragia, reconversión a cirugía abierta, cicatrización con obstrucción de la unión pieloureteral y fuga de orina. La complicación más común de todas, así como sobre las complicaciones menores, fue la presencia de dolor o parestesia en el área de inserción de las agujas63. Más recientemente se han publicado los resultados de un estudio prospectivo multicéntrico con el empleo de crioterapia (agujas de tercera generación) utilizando el sistema Clavien para la estratificación de las complicaciones; esto ha puesto de manifiesto la presencia de complicaciones o resultados desfavorables en un 15,5 y un 17%, respectivamente. La mayoría de ellas era Clavien grado 1 o 2. La presencia de problemas cardíacos, el sexo femenino y el tamaño tumoral eran factores pronósticos independientes para la presencia de complicaciones64.
Gill et al publicaron un estudio con un seguimiento de 3 años en el que la creatinina del paciente ascendía de 1,2 a 1,4mg/dl. Diez pacientes con riñón único presentaron una creatinina media de entre 2,2 y 2,6mg/dl antes y después de la cirugía, respectivamente. Trece pacientes con una insuficiencia renal de base tenían unos niveles de creatinina de 3,0 y 2,7mg/dl antes y después de la cirugía, respectivamente. La presión sanguínea media no cambió significativamente, con unas lecturas de la tensión sistólica antes y después de 135,6 y 131,2mmHg, respectivamente, y unas presiones diastólicas de 78 y 72,7mmHg, respectivamente65.
Conclusión
La crioterapia renal ha sido un procedimiento bien investigado, los resultados a 5 años han demostrado que es un procedimiento seguro y eficaz. La principal indicación en el riñón es para lesiones periféricas menores de 4cm en pacientes que se puedan beneficiar de una cirugía conservadora. Futuros avances en crioterapia renal incluirán la mejora de abordajes (puerto único, NOTES), la mejora de la criotecnología y la administración de criopotenciadores, con el objetivo de maximizar la muerte celular.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Luciani LG, Cestari R, Tallarigo C. Incidental renal cell carcinoma-age and stage characterization and clinical implications: Study of 1092 patients (1982-97). Urology. 2001; 57:206-7. [ Links ]
2. Chow WH, Devesa SS, Warren JL, Fraumeni JF. Rising incidence of renal cell cancer in the United States. JAMA. 1999; 281:1628-31. [ Links ]
3. Lee CT, Katz J, Shi W, Thaler HT, Reuter VE, Russo P. Surgical management of renal tumors 4cm or less in a contemporary cohort. J Urol. 2000; 163:730-6. [ Links ]
4. Uzzo RG, Novick AC. Nephron-sparing surgery for renal tumors: Indications, techniques and outcomes. J Urol. 2001; 166:6-18. [ Links ]
5. Delworth MG, Pisters LL, Fornage BD, Von Eschenbach AC. Cryotherapy for renal cell carcinoma and angiomyolipoma. J Urol. 1996; 155:252-4. [ Links ]
6. Janzen N, Zisman A, Pantuck A, Perry K, Schulam P, Belldegrun AS. Minimally invasive ablative approaches in the treatment of renal cell carcinoma. Curr Urol Rep. 2002; 3:13-20. [ Links ]
7. Baust J, Gage AA, Ma H, Zhang CM. Minimally invasive cryosurgery-technological advances. Cryobiology. 1997; 34:373-84. [ Links ]
8. Bischof JC, Smith D, Pazhayannur PV, Manivel C, Hulbert J, Roberts K.P. Cryosurgery of dunning AT-1 rat prostate tumor: Thermal, biophysical, and viability response at the cellular and tissue level. Cryobiology. 1997; 34:42-69. [ Links ]
9. Acker JP, Larese A, Yang H, Petrenko A, McGann LE. Intracellular ice formation is affected by cell interactions. Cryobiology. 1999; 38:363-71. [ Links ]
10. Kaouk JH, Aron M, Rewcastle JC, Gill IS. Cryotherapy: Clinical end points and their experimental foundations. Urology. 2006; 68:38-44. [ Links ]
11. Chosy SG, Nakada SY, Lee FT, Warner TF. Monitoring kidney cryosurgery: Predictors of tissue necrosis in swine. J Urol. 1998; 159:1370-4. [ Links ]
12. Campbell SC, Krishnamurthi V, Chow G, Hale J, Myles J, Novick AC, et al. Renal cryosurgery: Experimental evaluation of treatment parameters. Urology. 1998; 52:29-33. [ Links ]
13. Hoffmann NE, Bischof JC. The cryobiology of cryosurgical injury. Urology. 2002; 60:40-9. [ Links ]
14. Daum PS, Bowers WD, Tejada J, Morehouse D, Hamlet MP. Vascular casts demonstrate microcirculatory insufficiency in acute frostbite. Cryobiology. 1987; 24:65-73. [ Links ]
15. Baust JM, Van B, Baust JG. Cell viability improves following inhibition of cryopreservation-induced apoptosis. In Vitro Cell Dev Biol Anim. 2000; 36:262-70. [ Links ]
16. Lowry PS, Nakada SY. Kidney cryotherapy. Clinical status. Curr Opin Urol. 2003; 13:193-7. [ Links ]
17. Woolley ML, Schulsinger DA, Durand DB, Zeltser IS, Waltzer WC. Effect of freezing parameters (freeze cycle and thaw process) on tissue destruction following renal cryoablation. J Endourol. 2002; 16:519-22. [ Links ]
18. Rewcastle JC, Sandison GA, Saliken JC, Donnelly BJ, McKinnon JG. Considerations during clinical operation of two commercially available cryomachines. J Surg Oncol. 1999; 71:106-11. [ Links ]
19. Rehman J, Landman J, Lee D, Venkatesh R, Bostwick DG, Sundaram C, et al. Needle-based ablation of renal parenchyma using microwave, cryoablation, impedance- and temperature-based monopolar and bipolar radiofrequency, and liquid and gel chemoablation: Laboratory studies and review of the literature. J Endourol. 2004; 18:83-104. [ Links ]
20. Gill IS, Novick AC. Renal cryosurgery. Urology. 1999; 54:215-9. [ Links ]
21. Goel RK, Kaouk JH. Single port access renal cryoablation (SPARC): A new approach. Eur Urol. 2008; 53:1204-9. [ Links ]
22. Gettman MT, Cadeddu JA. Natural orifice translumenal endoscopic surgery (NOTES) in urology: Initial experience. J Endourol. 2008; 22:783-8. [ Links ]
23. Kantsevoy SV, Hu B, Jagannath SB, Vaughn CA, Beitler DM, Chung SS, et al. Transgastric endoscopic splenectomy: Is it possible?. Surg Endosc. 2006; 20:522-5. [ Links ]
24. Marescaux J, Dallemagne B, Perretta S, Wattiez A, Mutter D, Coumaros D. Surgery without scars: Report of transluminal cholecystectomy in a human being. Arch Surg. 2007; 142:823-7. [ Links ]
25. Crouzet S, Haber GP, Kamoi K, Berger A, Brethauer S, Gatmaitan P, et al. Natural orifice translumenal endoscopic surgery (NOTES) renal cryoablation in a porcine model. BJU Int. En prensa 2008. [ Links ]
26. Silverman SG, Tuncali K, Morrison PR. MR-imaging guided percutaneous tumor ablation. Acad Radiol. 2005; 12:1100-9. [ Links ]
27. Solomon SB, Chan DY, Jarrett TW. Percutaneous cryoablation of kidney tumors. Am J Urol Rev. 2004; 2:1-3. [ Links ]
28. Maybody M, Solomon SB. Image-guided percutaneous cryoablation of renal tumors. Tech Vasc Interv Radiol. 2007; 10:140-8. [ Links ]
29. Silverman SG, Tuncali K, Van Sonnenberg E, Morrison PR, Shankar S, Ramaiya N, et al. Renal tumors MR imaging-guided percutaneous cryotherapy-initial experience in 23 patients. Radiology. 2005; 236:716-24. [ Links ]
30. Morrison PR, Silverman SG, Tuncali K, Tatli S. MRI-guided cryotherapy. J Magn Reson Imaging. 2008; 27:410-20. [ Links ]
31. Ritacca FV, Stewart TE. Clinical review: High-frequency oscillatory ventilation in adultsa review of the literature and practical applications. Crit Care. 2003; 7:385-90. [ Links ]
32. Beck SM, Finley DS, Box GN, Vajgrt DJ, Wong AB, Morrison DE, et al. High-frequency oscillatory ventilatory support during CT-guided percutaneous cryotherapy of renal masses. J Endourol. 2008; 22:923-6. [ Links ]
33. Lee DI, McGinnis DE, Feld R, Strup SE. Retroperitoneal laparoscopic cryoablation of small renal tumors: Intermediate results. Urology. 2003; 61:83-8. [ Links ]
34. Bolte SL, Ankem MK, Moon TD, Hedican SP, Lee FT, Sadowski EA, et al. Magnetic resonance imaging findings after laparoscopic renal cryoablation. Urology. 2006; 67:485-9. [ Links ]
35. Remer EM, Weinberg EJ, Oto A, O´Malley CM, Gill IS. MR imaging of the kidneys after laparoscopic cryoablation. AJR Am J Roentgenol. 2000; 174:635-40. [ Links ]
36. Anderson JK, Shingleton WB, Cadeddu JA. Imaging associated with percutaneous and intraoperative management of renal tumors. Urol Clin North Am. 2006; 33:339-52. [ Links ]
37. Chen VH, Mayes JM, Madden JF, Stein AJ, Mouraviev V, Polascik TJ. The effect of cryoablation on the histologic interpretation of intraoperative biopsy of small clear cell renal carcinoma and renal oncocytoma. J Endourol. 2008; 22:1617-21. [ Links ]
38. Beemster P, Phoa S, Wijkstra H, De la Rosette J, Laguna P. Follow-up of renal masses after cryosurgery using computed tomography; enhancement patterns and cryolesion size. BJU Int. 2008; 101:1237-42. [ Links ]
39. Weight CJ, Kaouk JH, Hegarty NJ, Remer EM, O´Malley CM, Lane BR, et al. Correlation of radiographic imaging and histopathology following cryoablation and radio frequency ablation for renal tumors. J Urol. 2008; 179:1277-81. [ Links ]
40. Wink MH, Lagerveld BW, Laguna MP, De la Rosette JJ, Wijkstra H. Cryotherapy for renal cell cancer: Diagnosis, treatment, and contrast-enhanced Ultrasonography for follow-up. J Endourol. 2006; 20:456-9. [ Links ]
41. Cestari A, Guazzoni G, Dell´Acqua V, Nava L, Cardone G, Balconi G, et al. Laparoscopic cryoablation of solid renal masses: Intermediate term follow up. J Urol. 2004; 172:1267-70. [ Links ]
42. Ankem MK, Nakada SY. Needle-ablative nephron-sparing surgery. BJU Int. 2005; 95:46-51. [ Links ]
43. Gill IS, Remer EM, Hasan WA, Strzempkowski B, Spaliviero M, Steinberg AP, et al. Renal cryoablation: Outcome at 3 years. J Urol. 2005; 173:1903-7. [ Links ]
44. Lawatsch EJ, Langenstroer P, Byrd GF, See WA, Quiroz FA, Begun F.P. Intermediate results of laparoscopic cryoablation in 59 patients at the Medical College of Wisconsin. J Urol. 2006; 175:1225-9. [ Links ]
45. Davol PE, Fulmer BR, Rukstalis DB. Long-term results of cryoablation for renal cancer and complex renal masses. Urology. 2006; 68:2-6. [ Links ]
46. Schwartz BF, Rewcastle JC, Powell T, Whelan C, Manny T, Vestal JC. Cryoablation of small peripheral renal masses: A retrospective analysis. Urology. 2006; 68:14-8. [ Links ]
47. Hegarty NJ., Gill IS, Desai MM, Remer EM, O´Malley CM, Kaouk JH. Probe-ablative nephron-sparing surgery: Cryoablation versus radiofrequency ablation. Urology. 2006; 68:7-13. [ Links ]
48. Desai MM, Aron M, Gill IS. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for the small renal tumor. Urology. 2005; 66:23-8. [ Links ]
49. Weld KJ, Figenshau RS, Venkatesh R, Bhayani SB, Ames CD, Clayman RV, et al. Laparoscopic cryoablation for small renal masses: Three-year follow-up. Urology. 2007; 69:448-51. [ Links ]
50. Bandi G, Wen CC, Hedican SP, Moon TD, Lee FT, Nakada SY. Cryoablation of small renal masses: Assessment of the outcome at one institution. BJU Int. 2007; 100:798-801. [ Links ]
51. Shingleton WB, Sewell PE. Percutaneous renal tumor cryoablation with magnetic resonance imaging guidance. J Urol. 2001; 165:773-6. [ Links ]
52. Silverman SG, Tuncali K, Van Sonnenberg E, Morrison PR, Shankar S, Ramaiya N, et al. Renal tumors: MR imaging-guided percutaneous cryotherapy-initial experience in 23 patients. Radiology. 2005; 236:716-24. [ Links ]
53. Gupta A, Allaf ME, Kavoussi LR, Jarrett TW, Chan DY, Su LM, et al. Computerized tomography guided percutaneous renal cryoablation with the patient under conscious sedation: Initial clinical experience. J Urol. 2006; 175:447-52. [ Links ]
54. Atwell TD, Farrell MA, Callstrom MR, Charboneau JW, Leibovich BC, Frank I, et al. Percutaneous cryoablation of large renal masses: Technical feasibility and short-term outcome. AJR Am J Roentgenol. 2007; 188:1195-200. [ Links ]
55. Kunkle DA, Engleston BL, Uzzo RG. Excise, ablate or observe: The small renal mass dilemma-A meta-analysis and review. J Urol. 2007; 179:1227-34. [ Links ]
56. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass. A meta-analysis. Cancer. 2008; 113:2671-80. [ Links ]
57. Gill IS, Novick AC, Meraney AM, Chen RN, Hobart MG, Sung GT, et al. Laparoscopic renal cryoablation in 32 patients. Urology. 2000; 56:748-53. [ Links ]
58. Hruby G, Edelstein A, Karpf J, Durak E, Phillips C, Lehman D. Risk factors associated with renal parenchymal fracture during laparoscopic cryoablation. BJU Int. 2008; 102:723-6. [ Links ]
59. Lee DI, McGinnis DE, Feld R, Strup SE. Retroperitoneal laparoscopic cryoablation of small renal tumors: Intermediate results. Urology. 2003; 61:83-8. [ Links ]
60. Desai MM, Gill IS. Current status of cryoablation and radiofrequency ablation in the management of renal tumors. Curr Opin Urol. 2002; 12:387-93. [ Links ]
61. Remer EM, Sung GT, Meraney AM. Effect of intentional cryoinjury to the renal collecting system (abstract). J Urol. 2000; 163:113. [ Links ]
62. Rukstalis DB, Khorsandi M, García FU, Hoenig DM, Cohen JK. Clinical experience with open renal cryoablation. Urology. 2001; 57:34-9. [ Links ]
63. Johnson DB, Solomon SB, Su LM, Matsumoto ED, Kavoussi LR, Nakada SY, et al. Defining the complications of cryoablation and radiofrequency ablation of small renal tumors: A multi-institutional study. J Urol. 2004; 172:874-7. [ Links ]
64. Laguna MP, Beemster P, Kumar P, Klingler HC, Wyler S, Anderson C, et al. Perioperative morbidity of laparoscopic cryoablation of small renal masses with ultrathin probes: A European multicentre experience. Eur Urol. 2009; 56:355-361. [ Links ]
65. Carvalhal EF, Gill IS, Meraney AM, Desai MM, Schweizer DK, Sung GT, et al. Laparoscopic renal cryoablation: Impact on renal function and blood pressure. Urology. 2001; 58:357-361. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
jriojazu@gmail.com
(J. Rioja)
Recibido: 15 Diciembre 2009
Aceptado: 23 Diciembre 2009















