Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Actas Urológicas Españolas
versão impressa ISSN 0210-4806
Actas Urol Esp vol.35 no.1 Jan. 2011
Retrasplante renal: factores de riesgo y resultados
Renal retransplantation: risk factors and results
J. Arcea, A. Rosalesa, J. Caffarattia, M. Montlleóa, L. Guiradob, J.M. Díazb, y H. Villavicencioa
aServicio de Urología, Fundació Puigvert, Barcelona, España
bServicio de Nefrología, Fundació Puigvert, Barcelona, España
Dirección para correspondencia
RESUMEN
Objetivo: Revisar nuestra experiencia en retrasplantes renales.
Material y métodos: Se realizó un estudio retrospectivo de 71 pacientes retrasplantados entre 1980 y 2005. Se analizaron: características del receptor e injerto, datos de la intervención, causas de pérdida del injerto, número de rechazos y trasplantectomías y supervivencia del injerto.
Resultados: La causa más frecuente de pérdida del injerto fue el rechazo crónico. Las causas de pérdida del primer injerto no se asociaron con una mayor pérdida del segundo (p>0,05). El porcentaje de anticuerpos anti-HLA incrementó en el segundo trasplante respecto del primero (17,23±27,91% vs 1,21±7,43%) (p=0,001), pero no se correlacionó con un aumento significativo de pérdida del segundo injerto (p=0,320). No existieron diferencias significativas entre las complicaciones del primer y segundo trasplante (p>0,05) y no se asociaron con una pérdida del injerto (p>0,05). Los pacientes con una trasplantectomía en el primer trasplante presentaban un riesgo 8,5 veces mayor de sufrir una segunda (p=0,0001; OR: 8,54; IC 95%: 0,941 - 77,501). La causa más frecuente de trasplantectomía en el segundo trasplante fue el rechazo agudo. El rechazo agudo como causa de trasplantectomía en el primer trasplante se mostró como factor de riesgo independiente de trasplantectomía del segundo trasplante (p=0,009). La supervivencia media del segundo injerto fue de 5,08±4,81 años, superior al primer trasplante (p=0,133). La supervivencia del injerto a 1, 5 y 10 años fue del 83, 75 y 52%, respectivamente.
Conclusiones: La supervivencia del segundo trasplante no es inferior al primero y tampoco existe incremento en el número de complicaciones.
Palabras clave: Retrasplante. Factores de riesgo. Supervivencia injerto.
ABSTRACT
Objective: To review our experience in renal retransplantations.
Materials and methods: We carried out a retrospective study on 71 patients with retransplantation performed between 1980 and 2005. We studied: the characteristics of the recipient and graft, surgery data, causes of loss of the graft, number of rejects and transplantectomies and, survival of the graft.
Results: The most frequent cause of graft loss was chronic rejection. The causes of first graft loss were not associated with a greater loss of the second graft (p>0.05). The percentage of anti-HLA antibodies increased in the second transplant in comparison to the first (17.23±27.91% vs. 1.21±7.43%) (p=0.001), however, it was not correlated with a significant increase in loss of the second graft (p=0.320). There were no significant differences between the complications of the first and second transplants (p>0.05) and they were not associated with graft loss (p>0.05). The patients with a transplantectomy in the first transplant presented a risk 8.5 times higher of undergoing a second one (p=0.0001; OR: 8.54; CI: 95% 0.941 - 77.501). The most frequent cause of transplantectomies in the second transplant was acute rejection. Acute rejection as a cause for transplantectomy in the first transplant proved to be an independent risk factor of transplantectomy of the second transplant (p=0.009). The mean survival of the second graft was 5.08±4.81 years, higher than the first transplant (p=0.133). The survival of the graft at 1.5 and 10 years was 83%, 75% and 52%, respectively.
Conclusions: The survival of the second transplant was not lower than the first, neither was there an increase in the number of complications.
Key words: Retransplantation. Risk factors. Graft survival.
Introducción
Las opciones terapéuticas de los pacientes con enfermedad renal terminal incluyen la diálisis peritoneal, la hemodiálisis y el trasplante renal, considerándose este último el tratamiento de elección en aquellos pacientes candidatos a cirugía. Se ha demostrado que el trasplante renal mejora de forma significativa la calidad de vida de los pacientes y reduce la tasa de mortalidad1,2. Sin embargo, a pesar de la mejora en la supervivencia de los injertos renales trasplantados, muchos pacientes pierden la función del mismo y son reintroducidos en un programa de diálisis3-5. De éstos, el 32% de los pacientes vuelven a la lista de espera para un nuevo trasplante y el 17% serán finalmente retrasplantados. Una quinta parte de los pacientes que pierden la función de su injerto fallecen de forma temprana principalmente por causas cardiovasculares, infecciosas o por neoplasias6,7. El resto de pacientes que no son incluidos en la lista de espera se debe a múltiples causas como la propia negación del paciente o una situación clínica desfavorable. A pesar del incremento del gasto sanitario que supone la realización de un procedimiento médico-quirúrgico repetido como el retrasplante renal, sigue siendo la mejor opción terapéutica en este tipo de pacientes, puesto que presenta una buena relación coste-efectividad, sobre todo para la población joven8.
La literatura muestra una inferior supervivencia de los retrasplantes comparados con la supervivencia del primer trasplante renal5,9-11, sin embargo algunas series no han observado diferencias significativas en la supervivencia a corto y largo plazo entre ellos6,12-16. La asociación de diferentes factores de riesgo que afecten a la supervivencia del injerto renal en los retrasplantes ha sido estudiada por diferentes autores14,16-20, sin embargo hay que considerar que existen variables del retrasplante que no aparecen en el primer trasplante renal, como puede ser la duración del primer injerto, el intervalo hasta el nuevo trasplante, la procedencia del injerto del anterior trasplante, la formación de anticuerpos anti-HLA tras la pérdida del injerto o el antecedente de trasplantectomía.
Pacientes y método
En el período comprendido entre 1980 y 2005 fueron intervenidos de trasplante renal en la Fundació Puigvert un total de 1.170 pacientes. Se realizó un estudio retrospectivo de aquellos pacientes que habían sido sometidos a un trasplante renal en más de una ocasión a lo largo de su vida. La descripción de las variables categóricas a estudio se facilita con frecuencia absoluta y porcentaje, y las variables cuantitativas con la media y desviación típica. La comparación de las variables categóricas entre el primer y segundo trasplante se realizó mediante el test de McNemar, estimando el riesgo con la Odds ratio con un intervalo de confianza del 95%. El análisis de variables cuantitativas entre el primer y segundo trasplante se realizó mediante un análisis "t"-Student para datos apareados. El análisis de factores de riesgo se realizó mediante el estadístico Chi-cuadrado y el análisis de factores pronósticos mediante un modelo de regresión logística binaria forward conditional. Para el estudio de supervivencia del primer y segundo trasplante se realizó un análisis de supervivencia de Kaplan-Meier, expresando el resultado en media y desviación típica con un intervalo de confianza del 95%. En todos los casos la aproximación fue bilateral y el nivel de significación el usual del 5% (α=0,05). El software empleado en el análisis ha sido el paquete estadístico SPSS (V 11.5).
Resultados
De los 1.170 pacientes intervenidos en el periodo a estudio 71 recibieron un trasplante en más de una ocasión. El 69% de los receptores eran hombres y la edad media fue de 35,28±13,44 años. La etiología de la insuficiencia renal crónica que condujo al primer trasplante renal en estos pacientes fue por orden de frecuencia: glomerulonefritis (54,5%), enfermedad tubulointersticial (25,8%), nefroesclerosis (16,7%), poliquistosis renal en un paciente (1,5%) y otros en un paciente (1,5%). En 5 casos no se pudo recoger la causa de la insuficiencia renal crónica. El número de incompatibilidades HLA en estos pacientes fue 3,31±1,17 y el porcentaje de anticuerpos anti-HLA de 1,21±7,43%. Las características del donante, del riñón trasplantado y las referentes a la intervención quirúrgica se describen en la Tabla 1.
Existió rechazo agudo en 52/71 pacientes (73,2%) y rechazo crónico en 37/71 (52,1%). Las complicaciones del primer trasplante se describen en la Tabla 2. Cuatro de los 8 pacientes que presentaron hematuria requirieron revisión hemostática endoscópica para su resolución. De los pacientes con fístula urinaria, en 3 de ellos se resolvió con un manejo conservador. Dos pacientes con estenosis ureteral requirieron cirugía abierta para su resolución tras el fracaso de la dilatación con balón. El segundo trasplante renal se realizó en un intervalo de tiempo de 7,16±4,90 años. Las causas de pérdida del injerto fueron: rechazo crónico en 35 pacientes (49%), rechazo agudo en 16 (22,5%), trombosis de vasos en 12 (17%), recidiva de la enfermedad en 3 (4%), estenosis de vasos y hemorragia en 2 pacientes cada uno (3% respectivamente) y la presencia de un riñón no viable en uno (1,4%) (Figura 1). De los 71 pacientes 29 (41%) requirieron trasplantectomía antes del segundo trasplante. Las causas fueron trombosis de vasos (31%), rechazo crónico (31%), rechazo agudo (24%), estenosis de vasos (7%) y hemorragia del lecho quirúrgico (7%).
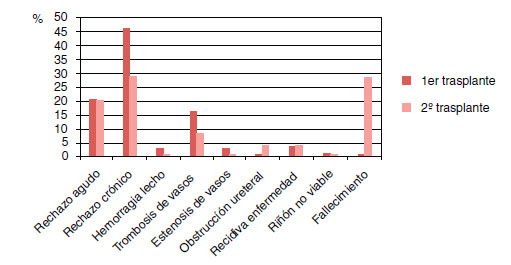
Figura 1. Causas de pérdida del injerto.
El intervalo de tiempo transcurrido hasta la pérdida del injerto fue 3,80±4,56 años. El análisis de Kaplan-Meier muestra una supervivencia del injerto funcionante al año del 59%, a los 5 años del 32% y a los 10 años del 12%. El intervalo de tiempo transcurrido hasta el segundo trasplante fue de 3,36±3,23 años. El número de incompatibilidades HLA en el segundo trasplante fue de 3,15±1,24 sin presentar diferencias significativas respecto al primer trasplante (p=0,316) y el porcentaje de anticuerpos anti-HLA fue de 17,23±27,91%, objetivándose un incremento estadísticamente significativo respecto al primer trasplante (p=0,001); aunque no se correlacionó con un aumento significativo de pérdida del segundo injerto (p=0,320). Las características del donante se describen en la Tabla 1. No existieron diferencias estadísticamente significativas respecto del primer trasplante (p>0,05), excepto en un predominio de donación multiorgánica y de la implantación en la fosa ilíaca izquierda en el segundo trasplante (p=0,009 y p=0,0001, respectivamente). Se observó rechazo agudo en 24 de 71 pacientes (34%), objetivándose una reducción estadísticamente significativa respecto del primer trasplante (p=0,0001). Igualmente la presencia de rechazo crónico se observó en 15 de 71 pacientes (21%), reduciéndose también respecto al primer trasplante (p=0,0001).
Las complicaciones del segundo trasplante se describen en la Tabla 2, sin que se observaran diferencias estadísticamente significativas con respecto a las complicaciones del primer trasplante (p>0,05). En el análisis univariante las complicaciones no se asociaron con la pérdida del injerto (p>0,05). Cinco de las 10 hematurias en el segundo trasplante requirieron revisión hemostática endoscópica para su resolución. Todas las fístulas urinarias se resolvieron sin cirugía abierta. Cuatro de los pacientes con estenosis ureteral requirieron cirugía abierta como tratamiento definitivo.
De los 71 pacientes sometidos al segundo trasplante renal 22 (30%) presentaron pérdida del injerto, siendo la causa más frecuente el rechazo crónico en 7 pacientes (32%),al igual que el primer trasplante (p=1), y por orden de frecuencia: fallecimiento del paciente en 6 sujetos (27%), rechazo agudo en 5 pacientes (23%), trombosis de vasos en 2 pacientes (9%) y recidiva de la enfermedad y obstrucción ureteral en un paciente cada uno (4,5% respectivamente). No se observaron diferencias estadísticamente significativas respecto de las pérdidas del injerto del primer trasplante (p>0,05) (Figura 1). En el análisis univariante las diferentes causas de pérdida del injerto del primer trasplante no se asociaron con una mayor pérdida del segundo injerto (p>0,05). Seis de los 22 pacientes (36%) requirieron trasplantectomía. Los pacientes que habían sido sometidos a una primera trasplantectomía presentaban un riesgo 8,5 veces mayor de sufrir una segunda (p=0,0001; OR: 8,54; IC 95%: 0,941-77,501), aunque no se asoció con una mayor pérdida del injerto en el análisis univariante (p=0,85). La causa más frecuente de la segunda trasplantectomía fue el rechazo agudo en 4 pacientes (67%) a diferencia de la primera trasplantectomía, donde la causa más frecuente fue el rechazo crónico (Figura 2). El rechazo agudo como causa de trasplantectomía en el primer trasplante se mostró como factor de riesgo de trasplantectomía del segundo trasplante en el análisis univariante (p=0,001; OR: 28,00; IC 95%: 2,29-342,15), asimismo la regresión logística binaria observó que el rechazo agudo como causa de trasplantectomía en el primer trasplante fue un factor pronóstico de una segunda trasplantectomía (p=0,009).
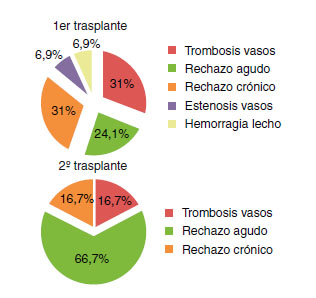
Figura 2. Causas de trasplantectomía.
El intervalo de tiempo transcurrido hasta la pérdida del segundo injerto fue de 3,36±4,65 años sin diferencias estadísticamente significativas respecto del primer trasplante (p=0,926). La pérdida precoz del primer injerto no se asoció con una menor supervivencia del segundo injerto (p=0,423). La supervivencia media del segundo injerto fue de 5,08±4,81 años, superior al primer trasplante con 3,80±4,56 años, aunque no estadísticamente significativa (p=0,133). El análisis de Kaplan-Meier muestra una supervivencia del injerto al año del 83%, a los 5 años del 75% y a los 10 años del 52% (Figura 3).

Figura 3. Supervivencia del segundo trasplante.
De los 22 pacientes que presentaron pérdida del segundo injerto 5 fueron sometidos a un tercer trasplante en un intervalo de tiempo de 3±2,79 años y un único paciente requirió un cuarto trasplante. Se objetivó un incremento en el porcentaje de anticuerpos similar al segundo trasplante. En la mayoría de los casos se escogió la fosa ilíaca derecha para su implantación, optando por una anastomosis a nivel de vasos ilíacos externos. En el 33% de los terceros trasplantes se optó por una anastomosis con los vasos ilíacos comunes. El rechazo agudo fue, al igual que en el segundo trasplante, la causa de pérdida del injerto en el tercer trasplante. En ninguno de los terceros y cuartos trasplantes se requirió una trasplantectomía.
Discusión
Los pacientes sometidos a trasplante renal que presentan pérdida del injerto se incluyen de nuevo en un programa de diálisis. El 32% de estos pacientes vuelven a la lista de espera para un nuevo trasplante y el 17% son finalmente retrasplantados6. La mortalidad de los pacientes que entran en diálisis tras la pérdida del injerto renal se iguala a la mortalidad de los pacientes en diálisis que no han sido previamente trasplantados, incrementándose la razón de mortalidad de 10-25 muertes por 1.000 pacientes-año a 80 muertes por 1.000 pacientes-año21. La supervivencia de los retrasplantes en relación con el primer trasplante presenta resultados dispares según las series publicadas; así, algunos estudios observan una menor supervivencia de los retrasplantes5,9-11 que contrasta con una supervivencia similar en otras series12-16. La realización de un nuevo trasplante supone una reducción en el riesgo de mortalidad con una mejoría de la calidad de vida1,21 y una buena relación coste-efectividad, sobre todo en población joven8.
Diversos factores de riesgo se han relacionado con una peor supervivencia de los sucesivos trasplantes, entre ellos el tipo de inmunosupresión, el número de incompatibilidades HLA, el porcentaje de anticuerpos anti-HLA circulantes, el tipo de donante, la presencia de rechazo agudo, el antecedente de trasplantectomía y la duración del primer injerto14,16-20,22. Aunque algún estudio muestra asociación entre la reexposición a antígenos HLA no compatibles y menor supervivencia del injerto16, la mayoría de las series no aprecian diferencias en el número de incompatibilidades entre los diversos trasplantes18,20,23.
En nuestro estudio la media de anticuerpos anti-HLA previo al segundo trasplante fue del 17%, aumentando significativamente respecto al primero24,25. Aunque clásicamente el incremento del porcentaje de anticuerpos anti-HLA previo a cada trasplante se asocia con una disminución de la supervivencia de los sucesivos trasplantes26,27, en nuestra experiencia el incremento en el porcentaje de anticuerpos anti-HLA no influye en la supervivencia del segundo injerto. A diferencia de otras series26 este incremento tampoco se asocia con un aumento del número de rechazos agudos. La frecuencia de rechazo es en nuestra serie similar a la de la literatura11,13, menor que en el primer trasplante, y no constituye un factor de riesgo de pérdida del injerto. Posiblemente el uso de nuevos regímenes immunoterapéuticos explique esta diferencia respecto a series más antiguas.
El análisis de las características del donante, del receptor y del riñón trasplantado no muestra diferencias significativas entre el primer y segundo trasplante, salvo predominio en donación multiorgánica y mayor utilización de la fosa ilíaca izquierda en el segundo11,28. La mayor tendencia al empleo de los vasos ilíacos para la anastomosis vascular del injerto renal en los sucesivos trasplantes se asocia con un incremento en la frecuencia de trombosis de vasos en estos retrasplantes28, aunque en nuestra serie tampoco existen diferencias significativas en cuanto a la frecuencia de trombosis29.
No se observa un incremento en la frecuencia de complicaciones en el segundo trasplante ni de causa urológica, vascular o relacionada con la herida quirúrgica16,28,29. La complicación urológica más frecuente en el segundo trasplante fue la hematuria macroscópica, que precisó revisión endoscópica en el 50% de los casos; le sigue en frecuencia la estenosis ureteral y la fístula ureteral, localizada siempre a nivel distal y que requiere cirugía abierta en el 80% de los casos. La complicación vascular más frecuente en el segundo trasplante es la hemorragia del lecho quirúrgico (29%), seguida de trombosis de vasos que condiciona la pérdida del injerto. Tanto la trombosis venosa como el resto de complicaciones del primer trasplante no se asocian con mayor pérdida del segundo injerto.
Las causas de pérdida del primer injerto en nuestro estudio no fueron factores de riesgo para la pérdida del segundo injerto, que se produjo con una frecuencia del 30% acorde a lo descrito en la literatura14,30. La causa más frecuente de pérdida del segundo injerto fue el rechazo crónico (31%) y la segunda el fallecimiento del paciente (27%)5,14,31. No se observaron diferencias significativas del resto de causas de pérdida del injerto entre los pacientes que no fallecieron. La trasplantectomía del segundo injerto se realizó en un 36%, con frecuencia similar al primer trasplante. Esta frecuencia es superior a la publicada por Stratta et al en segundos trasplantes32, pero no se asoció con una mayor pérdida del injerto. Además, la trasplantectomía del primer injerto no fue un factor de riesgo en la pérdida del segundo injerto, tal y como se refleja en la literatura18,30,33,34.
El rechazo agudo y la trombosis de vasos fueron las causas más frecuentes de trasplantectomía en el segundo injerto, mientras que en el primer trasplante la causa más frecuente fue el rechazo crónico35,36. Al analizar las diferentes causas que condujeron a la primera trasplantectomía como factores de riesgo de pérdida del segundo injerto, el rechazo agudo se comportó en el análisis multivariante como factor de riesgo independiente para una nueva trasplantectomía en el segundo trasplante.
Se admite que el intervalo de tiempo hasta la pérdida de función del primer injerto disminuye la supervivencia de los sucesivos retrasplantes14,17,19,20,30,37; ahora bien, en nuestra experiencia el intervalo hasta la pérdida de función en el primer y segundo trasplante fue similar. Además, la pérdida precoz del primer injerto no se asoció con una menor supervivencia del segundo injerto, a diferencia de lo publicado previamente18,22,30,37. La experiencia muestra datos confusos respecto a la supervivencia del retrasplante, que ronda entre el 81-96% al año, el 69-88% a los 5 años y el 52-58% a los 10 años5,9,10-16,38. En nuestro estudio la supervivencia del injerto fue del 83% al año, del 75% a los 5 años y del 52% a los 10 años, acorde con la literatura. Curiosamente la supervivencia media del segundo trasplante fue superior a la del primero, aunque sin alcanzar significación estadística.
Conclusiones
La realización de retrasplantes no conlleva un aumento del número de complicaciones. En pacientes retrasplantados, a pesar del incremento de anticuerpos anti-HLA, no existe una reducción de su supervivencia media, sin que existan tampoco diferencias entre las causas de pérdida del injerto. Aquellos pacientes sometidos a una trasplantectomía por rechazo agudo tendrán un riesgo significativo de una nueva trasplantectomía en sucesivos trasplantes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Wolfe R.A., Ashby V.B., Milford E.L., Ojo A.O., Ettenger R.E., Agodoa L.Y., Held P.J., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 1999; 341:1725-30. [ Links ]
2. Oniscu G.C., Brown H., Forsythe J.L. Impact of cadaveric renal transplantation on survival in patients listed for transplantation. J Am Soc Nephrol. 2005; 16:1859-65. [ Links ]
3. Hariharan S., Johnson C.P., Bresnahan B.A., Taranto S.E., McIntosh M.J., Stablein D. Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med. 2000; 342:605-12. [ Links ]
4. Cecka JM. The OPTN/UNOS renal transplant registry. En: Cecka, J.M., Terasaki, P.I., editors. Clin Transplant. Los Angeles (Calif): UCLA tissue typing laboratory; 2005;1-16. [ Links ]
5. Moss A, Najarian JS, Sutherland DE, Payne WD, Gruessner RWG, Humar A, et al. 5000 kidney transplantsa single center experience. En: Cecka, J.M., Terasaki, P.I., editors. Clin Transplant. 2000. Los Angeles: UCLA Immunogenetics Center; 2001. [ Links ]
6. Gallichio MH, Hudson S, Young CJ, Diethelm AG, Deierhoi MH. Renal retransplantation at the University of Alabama at Birmingham: incidence and outcome. En: Cecka JM, Terasaki PI, eds. Los Angeles, CA: UCLA Tissue typing laboratory. Clin Transplant. 1998;14:169-75. [ Links ]
7. Howard R.J., Reed A.I., Van Der Werf W.J., Hemming A.W., Patton P.R., Scornik J.C. What happens to renal transplant recipients who lose their grafts?. Am J Kidney Dis. 2001; 38:31-5. [ Links ]
8. Hornberger J.C., Best J.H., Garrison L.P. Cost-effectiveness of repeat medical procedures: kidney transplantation as an example. Med Decis Making. 1997; 17:363-72. [ Links ]
9. Pour-Reza-Gholi F., Nafar M., Saeedinia A., Farrokhi F., Firouzan A., Simforoosh N., et al. Kidney retransplantation in comparison with first kidney transplantation. Transplant Proc. 2005; 37:2962-4. [ Links ]
10. Etienne T., Goumaz C., Ruedin P., Jeannet M. Renal retransplantation in Switzerland: poor HLA matching of first and subsequent allografts does not appear to affect overall graft survival. Transpl Int. 1992; 5(Suppl 1):S65-66. [ Links ]
11. Mazzucchi E., Danilovic A., Antonopoulos I.M., Piovesan A.C., Nahas W.C., Lucon A.M., et al. Surgical aspects of third and subsequent renal transplants performed by the extraperitoneal Access. Transplantation. 2006; 81:840-4. [ Links ]
12. Rigden S., Mehls O., Gellert R. Factors influencing second renal allograft survival. Scientific Advisory Board of the ERA-EDTA Registry. European Renal Association-European Dialysis and Transplant Association. Nephrol Dial Transplant. 1999; 14:566-9. [ Links ]
13. Mouquet C., Benalia H., Chartier-Kastler E., Sylla C., Coriat P., Bitker M.O., et al. Renal retransplantation in adults. Comparative prognostic study. Prog Urol. 1999; 9:239-43. [ Links ]
14. El-Agroudy A.E., Wafa E.W., Bakr M.A., Donia A.F., Ismail A.M., Shokeir A.A., et al. Living-donor kidney retransplantation: risk factors and outcome. BJU Int. 2004; 94:369-73. [ Links ]
15. Delmonico F.L., Tolkoff-Rubin N., Auchincloss H., Farrell M.L., Fitzpatrick D.M., Saidman S., et al. Second renal transplantations. Ethical issues clarified by outcome; outcome enhanced by a reliable crossmatch. Arch Surg. 1994; 129:354-60. [ Links ]
16. Loupy A., Anglicheau D., Suberbielle C., Méjean A., Martinez F., Zuber J., et al. Long-term outcome of third kidney transplants. Nephrol Dial Transplant. 2007; 22:2693-700. [ Links ]
17. Abouljoud M.S., Deierhoi M.H., Hudson S.L., Diethelm A.G. Risk factors affecting second renal transplant outcome, with special reference to primary allograft nephrectomy. Transplantation. 1995; 60:138-44. [ Links ]
18. Ishikawa N., Tanabe K., Tokumoto T., Shimmura H., Yagisawa T., Nakajima I., et al. Risk factors affecting the long-term results of renal retransplantation. Transplant Proc. 1999; 31:2858-9. [ Links ]
19. Arndorfer J.A., Meier-Kriesche H.U., Ojo A.O., Gruber S.A., Cibrik D.M., Lake K.D., et al. Time to first graft loss as a risk factor for second renal allograft loss. Transplant Proc. 2001; 33:1188-9. [ Links ]
20. Gjertson D.W. A multi-factor analysis of kidney regraft outcomes. Clin Transpl. 2002; 335-49. [ Links ]
21. Rao P.S., Schaubel D.E., Saran R. Impact of graft failure on patient survival on dialysis: a comparison of transplant-naive and post-graft failure mortality rates. Nephrol Dial Transplant. 2005; 20:387-91. [ Links ]
22. Almond P.S., Matas A.J., Gillingham K., Troppmann C., Payne W., Dunn D., et al. Risk Factors for second renal allografts immunosuppressed with cyclosporine. Transplantation. 1991; 52:253-8. [ Links ]
23. Farney A.C., Matas A.J., Noreen H.J., Reinsmoen N., Segall M., Schmidt W.J., et al. Does re-exposure to mismatched HLA antigens decrease renal re-transplant allograft survival?. Clin Transplant. 1996; 10:147-56. [ Links ]
24. Worthington J.E., Martin S., Al-Husseini D.M., Dyer P.A., Johnson R.W. Posttransplantation production of donor HLA-specific antibodies as a predictor of renal transplant outcome. Transplantation. 2003; 75:1034-40. [ Links ]
25. Akalin E., Pascual M. Sensitization after kidney transplantation. Clin J Am Soc Nephrol. 2006; 1:433-40. [ Links ]
26. McKenna R.M., Takemoto S.K., Terasaki P.I. Anti-HLA antibodies after solid organ transplantation. Transplantation. 2000; 69:319-26. [ Links ]
27. Cho Y.W., Cecka J.M. Cadaver-donor renal retransplants. Cin Transplant. 1993; 469-84. [ Links ]
28. Gutiérrez Baños J.L., Rodrigo Calabia E., Rebollo Rodrigo M.H., Portillo Martín J.A., Roca Edreira A., Gómez Correas M.A., et al. Surgical aspects in the third and fourth kidney retransplant. Actas Urol Esp. 2005; 29:212-6. [ Links ]
29. Noorbala M.H., Gholamrezaie H.R. Study of surgical complications between primary and secondary renal transplants. Transplant Proc. 2005; 37:2154-6. [ Links ]
30. Sumrani N.B., Miles A.M., Daskalakis P., Hong J.H., Markell M.S., Friedman E.A., et al. Intermediate-term outcome of renal retransplants in the cyclosporine era. ASAIO J. 1993; 39:47-50. [ Links ]
31. Hagan C., Hickey D.P., Little D.M. A single-center study of the technical aspects and outcome of third and subsequent renal transplants. Transplantation. 2003; 75:1687-91. [ Links ]
32. Stratta R.J., Oh C.S., Sollinger H.W., Pirsch J.D., Kalayoglu M., Belzer F.O. Kidney retransplantation in the cyclosporine era. Transplantation. 1988; 45:40-5. [ Links ]
33. Doudjian V., Rice J.C., Carson R.W., Gugliuzza K.K., Fish J.C. Renal retransplants: effect of primary allograft nephrectomy on early function, acute rejection and outcome. Cin Transplant. 1996; 10:203-8. [ Links ]
34. Yagmurdur M.D., Emiroglu R., Ayvaz I., Sozen H., Karakayali H., Haberal M. The effect of graft nephrectomy on long-term graft function and survival in kidney retransplantation. Transplant Proc. 2005; 37:2957-61. [ Links ]
35. Secin F.P., Rovengo A.R., del Rosario Brunet M., Marrugat R.E., Dávalos Michel M., Fernandez H. Cumulative incidence, indications, morbidity and mortality of transplant nephrectomy and the most appropriate time for graft removal: only nonfunctioning transplants that cause intractable complications should be excised. J Urol. 2003; 169:1242-6. [ Links ]
36. Lechevallier E. Kidney transplantectomy: a multicenter study of the committee of transplantation of the French urology Association. Prog Urol. 1995; 5:204-10. [ Links ]
37. Hirata M., Terasaki P.I. Renal retransplantation. Clin Transpl. 1994; 419-33. [ Links ]
38. Coupel S., Giral-Classe M., Karam G., Morcet J.F., Dantal J., Cantarovich D., et al. Ten-year survival of second kidney transplants: impact of immnulogic factors and renal functions at 12 months. Kidney Int. 2003; 64:674-80. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
jacobo1976@hotmail.com
(J. Arce)
Recibido 8 Febrero 2010
Aceptado 19 Septiembre 2010














