Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.35 no.3 mar. 2011
Detección y estadificación molecular del cáncer vesical mediante RT-PCR a tiempo real para gelatinasas (MMP-2, MMP-9) y TIMP-2 en sangre periférica
Detection and Molecular Staging of Bladder Cancer Using Real-Time RT-PCR for Gelatinases (MMP-2, MMP-9) and TIMP-2 in Peripheral Blood
J.C. Angulo, A. Ferruelo, J.M. Rodríguez-Barbero, C. Núñez, F.R. de Fata y J. González
Servicio de Urología, Hospital Universitario de Getafe, Universidad Europea de Madrid, Fundación para la Investigación Biomédica del Hospital Universitario de Getafe, Servicio Madrileño de Salud, Madrid, España
Este trabajo ha sido financiado exclusivamente mediante una Beca de la Fundación para la Investigación en Urología del año 2007.
Dirección para correspondencia
RESUMEN
Introducción: La estadificación molecular del cáncer vesical basada en la detección de ARNm de genes específicos de urotelio no ha sido concluyente. Analizamos si la evaluación de gelatinasas (MMP-9, MMP-2) y TIMP-2 en sangre periférica mediante RT-PCR a tiempo real permite diagnosticar y caracterizar pacientes con neoplasia vesical.
Material y método: Se ha extraído ARN total a partir de células sanguíneas circulantes en 42 individuos (11 controles sanos, 31 pacientes con cáncer vesical en diversos estadios) y se ha llevado a cabo RT-PCR a tiempo real empleando cebadores específicos para MMP-9, MMP-2, TIMP-2 y 18S ribosomal. Los valores de cuantificación del ARNm se describen como relativos a ARNm 18S (método ΔΔCt comparativo) y los resultados se comparan de forma ciega con los datos obtenidos mediante diagnóstico histológico y estadificación clínica.
Resultados: Los niveles normalizados de ARNm de MMP-9 y MMP-2 son más altos en pacientes con cáncer que en controles (1,82±0,6veces y 2,7±0,6veces, respectivamente; p<0,05). Los pacientes con enfermedad metastática también tienen niveles mayores de ARNm de MMP-9, MMP-2 y TIMP-2 (9,6±0,20veces, 5,22±0,26veces y 1,97±0,22veces, respectivamente; p<0,05). MMP-9 y MMP-2 también se asocian con estadio clínico y grado avanzado (p<0,05). Se propone un índice entre variables que aumenta la habilidad para segregar pacientes con tumores Ta, T1, T2-4M0 y T2-4M1.
Conclusiones: La identificación de tumor vesical y la estadificación molecular de la enfermedad resulta posible mediante la detección de gelatinasas y TIMP-2 en sangre periférica empleando RT-PCR a tiempo real. La capacidad de distinguir enfermedad metastásica es mayor para MMP-9, pero MMP-2 discrimina mejor los niveles de invasión tumoral. La investigación futura en este campo podría aportar resultados prometedores en la evaluación molecular de la neoplasia vesical.
Palabras clave: Neoplasia vesical, Estadificación molecular, RT-PCR, MMP-2, MMP-9, TIMP-2.
ABSTRACT
Introduction: Molecular staging of bladder cancer based on the detection of mRNA of urothelial specific genes in circulating cancer cells has been inconclusive. We analyze whether real-time RT-PCR evaluation of gelatinases (MMP-9, MMP-2) and TIMP-2 in peripheral blood to diagnose and characterize patients with bladder neoplasm.
Material and method: Total RNA is extracted from circulating blood cells in 42 individuals (11 healthy controls, 31 patients with bladder cancer of different stages) and real-time RT-PCR performed using specific primers for MMP-9, MMP-2, TIMP-2 and ribosomal 18S. The quantification values of mRNA are described as relative to 18S mRNA (ΔΔCt method) and the results are blindly compared with data obtained from histological diagnosis and clinical staging.
Results: Normalized levels of MMP-9 and MMP-2 mRNA are higher in patients with cancer than controls (1.82±0.6-fold and 2.7±0.6-fold, respectively; P<.05). Patients with metastatic disease also have increased MMP-9, MMP-2 and TIMP-2 mRNA levels (9.6±0,20-fold, 5.22±0.26-fold and 1,97±0,22-fold, respectively; P<.05). MMP-9 and MMP-2 are also associated with advanced clinical stage and grade (P<.05). A ratio between variables that increases the ability to segregate patients with Ta, T1, T2-4M0 and T2-4M1 tumours is proposed.
Conclusions: Both non-invasive bladder tumor recognition and molecular staging of the disease is possible using real-time RT-PCR-based detection of gelatinases and TIMP-2 in peripheral blood. The ability to distinguish metastatic disease is higher for MMP-9 but MMP-2 discriminates better levels of tumour invasion. Further investigation in this field could yield promising results regarding molecular evaluation of bladder neoplasia.
Key words: Bladder neoplasia, Molecular staging, RT-PCR, MMP-2, MMP-9, TIMP-2.
Introducción
El fracaso terapéutico de metástasis distante en neoplasia vesical apenas ha cambiado en décadas, debido a que la diseminación de enfermedad oculta se presenta a menudo en el momento del tratamiento primario, y muchos tumores invasivos de alto grado desarrollan metástasis tempranas durante el seguimiento. Por supuesto, los mejores pronosticadores de control del cáncer y supervivencia en el cáncer vesical son la magnitud de la enfermedad y el grado histológico1, sin embargo muchos marcadores moleculares están siendo investigados en profundidad en el tejido neoplásico, la orina o la sangre para una supuesta correlación con la mayor probabilidad de diseminación distante.
Un aspecto importante de la cascada metastásica es el proceso de degradación de la matriz extracelular (MEC) por enzimas proteolíticas específicas. Las células tumorales tienen la capacidad de juntar sus mecanismos proteolíticos con la motilidad de una manera altamente organizada para conseguir invasión en lugares inapropiados. Un papel fundamental en este proceso de degradación se atribuye a las metaloproteasas de matriz (MMP), una familia de endopeptidasas dependientes de zinc que regulan la integridad y composición de la MEC. La actividad de MMP-2 y MMP-9 (gelatinasas) se regula a varios niveles, incluyendo la transcripción, secreción, activación e inhibición por inhibidores de tejido de metaloproteinasas (TIMP). La sobreproducción de MMP por tumores que interactúan con los sistemas vascular y linfático podría dar lugar a niveles más altos de MMP y TIMP, no sólo en los tejidos sino también en otros fluidos biológicos, tales como la sangre o la orina. Muchos estudios han subrayado la sobreexpresión de MMP y TIMP en la neoplasia vesical (tabla 1)2-24. Hemos investigado un nuevo abordaje para evaluar la actividad de MMP empleando RT-PCR a tiempo real en células mononucleares de sangre periférica, con énfasis especial sobre la amplificación génica de MMP-9, MMP-2 y TIMP-2 en controles sanos y pacientes con neoplasia vesical.
Materiales y métodos
Población de estudio
El estudio se llevó a cabo con 42 sujetos (36 varones, 6 mujeres), con edad media de 64 años (IC 95%: 59,7-68,3; rango: 29-90), que incluye controles de edad y género emparejados por individuos sanos (n=11) y pacientes con neoplasia vesical (n=31) diagnosticados y tratados en nuestro centro. Todos los pacientes recibieron resección transureteral primaria de la neoplasia vesical y 8 también cistectomía. Un estudio preoperatorio reveló diseminación metastásica en 5 casos (16%) y un estudio histopatológico definió 2 tumores de grado 1, 6 de grado 2 y 23 de grado 3 (criterios de la OMS). Los estadios tumorales son Ta (n=7), T1 (n=8), T2 (n=7), T3 (n=4) y T4 (n=5), según los criterios de la AJCC 2006. Todos los pacientes dieron su consentimiento para donar material biológico, de acuerdo con los requisitos del Comité ético de Investigación Clínica del centro.
Muestras y aislamiento del ARN
Se toman muestras de sangre periférica de pacientes intraoperatoriamente en el momento de la inducción anestésica y en la extracción rápida matinal en el caso de los controles (9-12ml), recogida en tubos que contienen EDTA, trasportada al laboratorio y procesada en menos de 2 horas. Se aísla la fracción de célula mononuclear como una capa intermedia por centrifugación en gradiente de densidad en presencia de Ficoll-Paque (Pharmacia Biotech AB, Uppsala, Suecia) durante 20 minutos a 2.100rpm a 4oC. El ARN total se prepara de células muestra usando Rneasy (Qiagen, Valencia, CA, EE.UU.), según las instrucciones propuestas por el fabricante. La producción de ARN se determina espectrofotométricamente a 260 y 280nm y las relaciones de densidad (OD260/OD280) son medidas para asegurar la calidad de ARN aislado empleando el espectrofotómetro ND-100 (Nanodrop Technology). La relación media ha sido de 1,8 a 2,1 para todas las muestras. Para TI, una alícuota con 1-2µg de ARN total de cada muestra se usa para la primera cadena de ADNc en un volumen total de 20-40µl usando 0,75µl (0,5mg) de cebadores aleatorios (Promega, Madison, WI) y 0,5µl (12,5 mmol/ l) mezcla dNTPs (Ecogen, España), incubado a 70oC durante 10 minutos y enfriado inmediatamente sobre hielo para evitar la renaturalización. La siguiente mezcla TI se prepara en 10-20µl para cada muestra: 4-8µl buffer TI VLMM (5x) (Sigma), 0,5µl (20 U) del inhibidor del RNase (RNasin, Promega) y 1µl (100 U) del virus de la leucemia murina de Moloney (VLMM) transcriptasa inversa e incubado a 25oC durante 5 minutos y 37oC durante 50 minutos, la reacción se para a 95oC durante 5 minutos para inactivar la TI.
RT-PCR cuantitativa a tiempo real
Se llevó a cabo análisis PCR empleando el iCycler Real-Time PCR Detection System (Bio-Rad Laboratories, Hercules, CA, USA). Se emplearon ensayos de expresión génica (TaqMan Assay, Applied Biosystems): MMP2, Hs00234422_m1; MMP9, Hs00234579_m1; TIMP2, Hs00234278_m1; y 18S, Hs99999901_s1. Cien ng de plantilla ADNc se añaden a 10µl TaqMan Universal PCR Master Mix (Applied Biosystems) y 1µl TaqMan Assay específico para los genes indicados, para un volumen final de 20µl. Las reacciones PCR se incuban durante 10 minutos a 95oC, después de lo cual se lleva a cabo la amplificación del objetivo con 45 ciclos de dos fases, con 15 segundos a 95oC y un minuto a 60oC. Cada muestra se analiza por triplicado para verificar los resultados. Los niveles de transcripción, normalizados a aquellos de 18S (usados como estándar interno) para dar cuenta de la variabilidad en la cantidad de ADNc en cada muestra y niveles de expresión relativa, son calculados aplicando el método ΔΔCT. El nivel de expresión relativa del gen objetivo se da por 2 -ΔΔCT, donde ΔΔCT=ΔCT target gene-ΔCT18S. El cálculo comparativo CT es válido cuando la eficacia de la amplificación objetivo tiende a igualar la amplificación de referencia. Todos los ensayos de expresión génica TaqMan tienen eficiencias de amplificación muy cercanas a 1.
Método estadístico
La comparación de las escalas ponderadas entre grupos se realizó con la prueba U de Mann-Whitney y la prueba de probabilidad exacta de Fisher. Los análisis se realizaron empleando SPSS 13.0 para Windows (SPSS, Chicago, IL) y se consideró la significación estadística a nivel 0,05.
Resultados
Expresión de MMP-9, MMP-2 y TIMP-2 ARNm en sangre periférica
La muestra analizada en este estudio muestra los niveles en estado constante de MMP-9, MMP-2 y TIMP-2. En sangre periférica de pacientes con neoplasia vesical los niveles normalizados de ARNm de MMP-9 y MMP-2 son respectivamente 1,82±0,6 y 2,7±0,6 veces más altos en pacientes con cáncer que controles (p<0,05); sin embargo, los niveles normalizados de TIMP-2 no muestran las diferencias entre controles y pacientes con neoplasia (fig. 1).
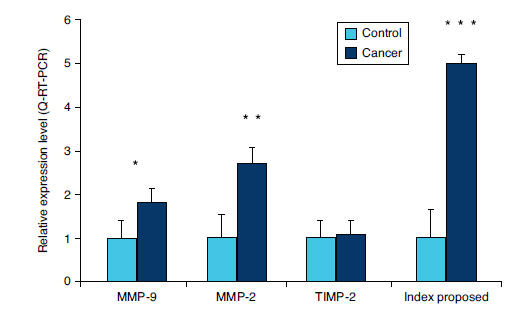
Figura 1. Comparación entre expresión MMP-2, MMP-9 y TIMP-2 por RT-PCR
cuantitativa en células de sangre periférica de pacientes con o sin cáncer
vesical. El índice propuesto fue definido como [(MMP-9+MMP-2)-TIMP-2 /
(MMP-9+MMP-2)]. El ARN total se empleó para síntesis de primera cadena de
ADNc. Los resultados se expresan como niveles de expresión relativos (unidades
arbitrarias) contra control (sin cáncer). Las medias±DE para los 4 grupos fueron
comparadas empleando la prueba U Mann-Whitney. *p<0,05; **p<0,01;
***p<0,001.
En relación con la población de pacientes con carcinoma de células transicionales de la vejiga confirmado histológicamente, tanto los niveles ARNm de MMP-9 y MMP-2 se correlacionan con el grado histológico asignado. MMP-9 es significantemente más alto en tumores de grado 3 (1,97±0,34veces) en comparación con grado 1, sin embargo no existe diferencia entre el nivel ARNm de grado 2 (0,89±0,37veces) y grado 1 (fig. 2). El nivel MMP-2 es más alto tanto en tumores de grado 3 (8,31±0,38veces) y grado 2 (8,80±0,33veces) respecto al grado 1 (fig. 3). Niveles normalizados de TIMP-2 no muestran las diferencias relativas en cuanto a las diferentes clasificaciones de grados, aunque se mostró una tendencia a expresión disminuida en tumores G3 en comparación a G1 y/o G2 (p=0,09) (fig. 4).
En relación con el estadio clínico, tanto el grado de invasión mural en la vejiga (T) como la presencia de metástasis visceral (M) han sido analizados y correlacionados con niveles ARNm de MMP-9, MMP-2 y TIMP-2. En cuanto a la clasificación T, el nivel de MMP-9 es significantemente más alto en pacientes con tumores T4 (13,6±0,36veces) y T3 (2,3±0,3veces), sin embargo no en T2 (1,15±0,38veces) ni en T1 (1,43±0,27veces) al compararlo con lesiones Ta no invasivas (fig. 2). La expresión de MMP-2 se correlaciona mejor con la profundidad de invasión, ya que el nivel de MMP-2 fue significantemente más alto en T4 (8,44±0,38 veces), T3 (7,7±0,32 veces), T2 (4,45±0,4) y T1 (2,21±0,34) respecto a Ta (fig. 3). Niveles normalizados de TIMP-2 no muestran diferencias relativas entre clasificaciones (fig. 4). En cuanto a la clasificación M, un incremento estadísticamente significativo se observa en la expresión de MMP-9 (9,6±0,2veces), MMP-2 (5,22±0,27veces) y TIMP-2 (1,97±0,22veces) al comparar enfermedad metastásica (M1) con enfermedad no metastásica (M0) (fig. 2-3-4).
Por razones prácticas se pueden definir 4 niveles diferentes desde una perspectiva clínica:
1. Ta (no invasivo).
2. T1 invasivo de la lámina propia (microinvasivo);
3. T2-4M0 invasivo del músculo o más allá (profundamente invasivo) no metastático.
4. T2-4M1 (metastático).
La capacidad que tienen los niveles de ARNm de distinguir entre estos 4 niveles diferentes de invasión tumoral también se ha investigado. MMP-9 es significativamente más alto en T2-4 M1 (12,72±0,2veces), pero no en pacientes T2-4 M0 (1,5±0,21-veces) y T1 (1,43±0,27veces) al compararlo con Ta no invasivo (fig. 2). MMP-2 es significativamente más alto en T2-4 M1 (12,62±0,25veces), T2-4 M0 (4,44±0,26veces) y T1 (2,21±0,34veces) respecto a Ta (fig. 3). El nivel TIMP-2 es significativamente más alto en T2-4 M1 (1,8±0,22veces) en comparación con la enfermedad T2-4 M0. No obstante, no se observa diferencia entre niveles TIMP-2 de enfermedad T2-4 M0, T1 oTa (fig. 4).
Propuesta de índice para aumentar la capacidad de estadificación molecular
Se puede proponer un índice basado en el efecto aditivo de gelatinasas MMP-9 y MMP-2 y el efecto inhibitorio de TIMP-2, que contrarresta la actividad de MMP-2: (MMP-9+MMP-2)-TIMP-2 / (MMP-9+MMP-2). Por supuesto, cada expresión génica individual debe ser corregida en relación con la expresión del gen de mantenimiento, 18S. Empleando esta relación la expresión génica combinada relativa es significativamente más alta en neoplasia que en controles (4,95±0,21veces; p<0,05).
Además, la cuantificación relativa usando el método CT comparativo para este índice aumenta la capacidad de segregar pacientes con tumores de diferentes grados y que afectan a todos los niveles de invasión mural, y también para distinguir enfermedad metastásica. El índice también se correlaciona con el grado tumoral, ya que es más alto tanto en tumores de grado 3 (25,2±0,26-veces) como de grado 2 (2,98±0,18-veces) respecto a grado 1 (fig. 5). La profundidad de la invasión es significativamente más alta en T4 (120,1±0,36-veces), T3 (18,12±0,1-veces), T2 (5,14±0,36-veces) y T1 (3,1±0,07-veces) respecto a Ta (fig. 5), y la diferencia es aún mayor en cuanto a la presencia de enfermedad metastásica (51,7±0,24 -veces) frente a enfermedad no metastática (M0) (fig. 5). En definitiva, el índice es significativamente más alto en T2-4 M1 (166±0,15-veces), T2-4 M0 (6,76±0,36-veces) y T1 (3,06±0,08-veces) respecto a Ta (fig. 5).
Discusión
Varios autores han estudiado el papel de MMP y más específicamente de gelatinasas y TIMP-2 en la neoplasia vesical2-24. Se han aplicado abordajes diferentes para estudiar la actividad de estas enzimas de degradación de MEC. A menudo se han buscado en tejidos cancerosos de la vejiga, otras veces en muestras de barbotage de orina, y más recientemente en el suero de pacientes. Según nuestro conocimiento, este es el primer estudio que analiza la expresión de metaloproteinasa ARNm en sangre periférica de pacientes con y sin carcinoma de células transicionales de la vejiga.
Marguiles et al fueron pioneros al sugerir que la neoplasia vesical se correlaciona con un aumento en la actividad colagenasa2. Después, Davies et al reportaron la expresión pro-MMP-9 y pro-MMP-2 significativamente relacionada con el grado de tumor vesical utilizando zimografía en gelatina cuantitativa e hibridización in situ3. También detectaron que los niveles de MMP-9 eran significativamente más altos en el cáncer vesical que en los controles. Colaboramos para realizar el primer análisis inmunohistoquímico de gelatinasas en el cáncer vesical y observamos inmunotinción en aproximadamente 3 de 4 neoplasias vesicales invasivas5. Estaban localizadas predominantemente, pero no exclusivamente, en células cancerosas. De hecho, la tinción difusa débil se mostró dentro del estroma. No pudimos identificar una correlación entre expresión y estadio MMP-2 o MMP-9. Sin embargo, las lesiones eran uniformemente carcinomas músculo-invasivos de alto grado. Además, la expresión de gelatinasa no se pudo correlacionar con la supervivencia. Se detectó TIMP-2 tanto en células neoplásicas como en el estroma, y asociado a la ausencia de inmunotinción de colágeno del tipo IV y con bastante peor supervivencia5. El alto nivel de TIMP-2 estromal relacionó con baja supervivencia y fue asociado a la pérdida extensiva de membrana basal. Muchos otros trabajos han evaluado las implicaciones pronósticas de la determinación inmunohistoquímica de componentes MEC en la neoplasia vesical, y básicamente han confirmado los hallazgos de Grignon et al12,17-20. La expresión incrementada de MMP-2 y TIMP-2 puede determinar el pronóstico3-5,9,13,17,19,20. De hecho, un estudio que analiza 1.176 genes relacionados con el cáncer por RT-PCR en tejidos vesicales cancerosos ha demostrado que MMP-2 y TIMP-2 se expresaron en el 100% de los pacientes que fallecieron como consecuencia de la enfermedad25. Investigaciones sobre otros MMP como matrilisina (MMP-7) también parecen prometedoras para pronosticar el resultado de pacientes con cáncer de vejiga26, aunque no se puede decir lo mismo para colagenasa 3 (MMP-13)27.
Bianco et al midieron la expresión de gelatinasas en células vesicales exfoliadas y descubrieron una correlación significativa entre expresión de pro-MMP-9 y presencia de neoplasia7. Otros autores han investigado MMP-2 y MMP-9 como marcadores de neoplasia vesical, bien empleando zimografía en gelatina, técnicas de inmunotransferencia o ELISA en orina2,6,12,18. También se han llevado a cabo estudios serológicos de MMP. Nauro et al descubrieron que pacientes con tumores avanzados o metastásicos tenían casi el doble del nivel TIMP-1 en comparación con controles28. Gohji et al no hallaron ninguna diferencia en niveles circulantes de MMP-2 entre neoplasia superficial y controles4. Más tarde este grupo refirió un riesgo más alto de recurrencia y progresión cuando la relación MMP-2/TIMP-2 era elevada8.
No hay duda de que existe un proceso regulatorio entre metaloproteinasas e inhibidores de tejido en la progresión tumoral y desarrollo de metástasis. Numerosos informes evidencian que la expresión génica de MMP y la activación están relacionadas con el potencial de invasión de células cancerosas. Inicialmente se consideraba que las MMP eran producidas exclusivamente por células tumorales. Este concepto muy pronto fue sustituido por la más extendida creencia de que algunas MMP son producidas principalmente por el estroma, por ejemplo, estromelisina (MMP-3) producida por fibroblastos tumorales. De manera similar, TIMP-1 y TIMP-2 parecen ser producidos como respuesta en el receptor, contrarrestando la actividad de colagenasa y gelatinasa, y han sido detectados tanto en células neoplásicas como estromales. La expresión de TIMP-2 parece tener funciones contradictorias, como factor de crecimiento. Por una parte, puede facilitar el desarrollo de la metástasis, pero por otro lado puede inhibir la angiogénesis como respuesta homeostática a alta expresión MMP-2, limitando por tanto el desarrollo de la metástasis. Hoy día es cada vez más evidente que tanto MMP-2 como TIMP-2 son producidos no solamente en las células intratumorales estromales, sino también en las células peritumorales estromales y en tejidos no neoplásicos. De hecho, la función de MMPs en condiciones no neoplásicas con mayor angiogénesis como la gestación, curación de lesiones o enfermedades inflamatorias ha sido bien documentada29.
Por supuesto, las discrepancias entre los niveles MMP-2 ARNm en estado constante y actividad enzimática se pueden explicar por diferente regulación a nivel postranscripcional. La expresión de ambas gelatinasas ARNm que confirmamos en sangre periférica de controles sanos sugiere producción no neoplásica. Varios tipos de células podrían actuar como fuentes para la producción de MMP, no sólo linfocitos, y posiblemente linfocitos asociados a tumores, pero también monocitos circulantes y macrófagos tisulares. La reacción local inflamatoria que se suele asociar a neoplasia avanzada también podría estimular la sobreexpresión de MMP-2, MMP-9 y TIMP-2 ARNm. Existen dudas de que la presencia de micrometástasis o células tumorales circulantes podría contribuir al aumento de expresión de gelatinasa en casos avanzados; sin embargo, esta circunstancia no se puede esperar en controles sanos o en neoplasia vesical intraepitelial no invasiva.
La expresión de RT-PCR ARNm en sangre periférica de MMP se debe investigar en ambiente clínico. Nuestros resultados sugieren que se puede emplear como marcador de la actividad de remodelación de MEC asociado a la presencia de neoplasia vesical, y también se puede correlacionar con grado tumoral, profundidad de la invasión y presencia de metástasis. El aumento de actividad de la gelatinasa podría contribuir a la agresividad tumoral, no necesariamente a través de la invasividad tumoral directa, sino por otros efectos como la neoangiogénesis30. Las implicaciones pronósticas de esta técnica para la estadificación molecular en cáncer vesical parecen ser muy prometedoras.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses
Agradecimientos
Los autores expresan su agradecimiento a Carlos Pascual Mateo por el trabajo realizado.
Bibliografía
1. Angulo J.C., López J.I., Flores N., Toledo J.D. The value of tumor spread, grading and growth pattern as morphologic predictive parameters in bladder carcinoma. A revision of 1987 TNM Classification. J Cancer Res Clin Oncol. 1993; 119:578-93. [ Links ]
2. Margulies I.M., Hoyhtya M., Evans C., Stracke M.L., Liotta L.A., Stetler-Stevenson W.G. Urinary type IV collagenase: elevated levels are associated with bladder transitional cell carcinoma. Cancer Epidemiol Biomarkers Prev. 1992; 1:467-4674. [ Links ]
3. Davies B., Waxman J., Wasan H., Abel P., Williams G., Krausz T., et al. Levels of matrix metalloproteases in bladder cancer correlate with tumor grade and invasion. Cancer Res. 1993; 53:5365-9. [ Links ]
4. Gohji K., Fujimoto N., Fujii A., Komiyama T., Okawa J., Nakajima M. Prognostic significance of circulating matrix metalloproteinase-2 to tissue inhibitor of metalloproteinases-2 ratio in recurrence of urothelial cancer after complete resection. Cancer Res. 1996; 56:3196-8. [ Links ]
5. Grignon D.J., Sakr W., Toth M., Ravery V., Angulo J., Shamsa F., et al. High levels of tissue inhibitor of metalloproteinase-2 (TIMP-2) expression are associated with poor outcome in invasive bladder cancer. Cancer Res. 1996; 56:1654-9. [ Links ]
6. Moses M.A., Wiederschain D., Loughlin K.R., Zurakowski D., Lamb C.C., Freeman M.R. Increased incidence of matrix metalloproteinases in urine of cancer patients. Cancer Res. 1998; 58:1395-9. [ Links ]
7. Bianco F.J., Gervasi D.C., Tiguert R., Grignon D.J., Pontes J.E., Crissman J.D., et al. Matrix metalloproteinase-9 expression in bladder washes from bladder cancer patients predicts pathological stage and grade. Clin Cancer Res. 1998; 4:3011-6. [ Links ]
8. Gohji K., Fujimoto N., Ohkawa J., Fujii A., Nakajima M. Imbalance between serum matrix metalloproteinase-2 and its inhibitor as a predictor of recurrence of urothelial cancer. Br J Cancer. 1998; 77:650-5. [ Links ]
9. Kanayama H., Yokota K., Kurokawa Y., Murakami Y., Nishitani M., Kagawa S. Prognostic values of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 expression in bladder cancer. Cancer. 1998; 82:1359-66. [ Links ]
10. Hamasaki T., Hattori T., Kimura G., Nakazawa N. Tumor progression and expression of matrix metalloproteinase-2 (MMP-2) mRNA by human urinary bladder cancer cells. Urol Res. 1998; 26:371-6. [ Links ]
11. Furukawa A., Tsuji M., Nishitani M., Kanda K., Inoue Y., Kanayama H., et al. Role of the matrix metalloproteinase and tissue inhibitor of metalloproteinase families in non-invasive and invasive tumors transplanted in mice with severe combined immunodeficiency. Urology. 1998; 51:849-53. [ Links ]
12. Ozdemir E., Kakehi Y., Okuno H., Yoshida O. Role of matrix metalloproteinase-9 in the basement membrane destruction of superficial urothelial carcinomas. J Urol. 1999; 161:1359-63. [ Links ]
13. Kanda K., Takahasi M., Murakami Y., Kanayama H., Kagawa S. The role of the activated form of matrix-metalloproteinase-2 in urothelial cancer. Br J Urol Int. 2000; 86:553-7. [ Links ]
14. Monier F., Mollier S., Guillot M., Rambeaud J.J., Morel F., Zaoui P. Urinary release of 72 and 92 kDa Gelatinases, TIMP-2. N-GAL and conventional prognostic factors in urothelial carcinomas. Eur Urol. 2002; 42:356-63. [ Links ]
15. Guan K., Ye H., Yan Z., Wang Y., Hou S. Serum levels of endostatin and matrix metalloproteinase-9 associated with high stage and grade primary transitional cell carcinoma of the bladder. Urology. 2003; 61:719-23. [ Links ]
16. Eissa S., Labib R.A., Mourad S., Kamel K., El-Ahmady O. Comparison of telomerase activity and matrix metalloproteinase-9 in voided urine and bladder wash samples as a useful diagnostic tool for bladder cancer. Eur Urol. 2003; 44:687-94. [ Links ]
17. Gakiopoulou H., Nakopoulou L., Siatelis A., Mavrommatis I., Panayotopoulou E.G., Tsirmpa I., et al. Tissue inhibitor of metalloproteinase-2 as a multifunctional molecule of which the expression is associated with adverse prognosis of patients with urothelial bladder carcinomas. Clinical Cancer Res. 2003; 9:5573-81. [ Links ]
18. Durkan G.C., Nutt J.E., Marsh C., Rajjayabun P.H., Robinson M.C., Neal D.E., et al. Alteration in urinary matrix metalloproteinase-9 to tissue inhibitor of metalloproteinase-1 ratio predicts recurrence in nonmuscle-invasive bladder cancer. Clin Cancer Res. 2003; 9:2576-82. [ Links ]
19. Vasala K., Pääkkö P., Turpeenniemi-Hujanen T. Matrix metalloproteinase-2 immunoreactive protein as a prognostic marker in bladder cancer. Urology. 2003; 62:952-7. [ Links ]
20. Sumi T., Yoshida H., Hyun Y., Yasui T., Matsumoto Y., Hattori K., et al. Expression of matrix metalloproteinases in human transitional cell carcinoma of the urinary bladder. Oncology Reports. 2003; 10:345-9. [ Links ]
21. Chaffer C.L., Dopheide B., McCulloch D.R., Lee A.B., Moseley J.M., Thompson E.W., et al. Upregulated MT1-MMP/TIMP-2 axis in the TSU-Pr1-B1/B2 model of metastatic progression in transitional cell carcinoma of the bladder. Clin Exper Metastases. 2005; 22:115-25. [ Links ]
22. Vasala K., Turpeennniemi-Hujanen T. Serum tissue inhibitor of metalloproteinase-2 (TIMP-2) and matrix metalloproteinase-2 in complex with the inhibitor (MMP-2:TIMP-2) as prognostic markers in bladder cancer. Clin Biochem. 2007; 40:640-4. [ Links ]
23. Vasala K., Kuvaja P., Turpeenniemi-Hujanen T. Low circulating levels od proMMP-2 are associated with adverse prognosis in bladder cancer. Tumour Biol. 2008; 29:279-86. [ Links ]
24. Fernández C.A., Wszolek M.F., Loughlin K.R., Libertino J.A., Summerhayes I.C., Shuber A.P. A novel approach to using matrix metalloproteinases for bladder cancer. J Urol. 2009; 182:2188-94. [ Links ]
25. Grimm M.O., Modlich O., Brosius U., Struse K., Bojar H., Vogeli T.A. Expression and progression pattern of transitional cell carcinoma of the bladder. J Urol. 2000; 4:557. [ Links ]
26. Szarvas T., Becker M., Dorp F.V., Gethmann C., Tötsch M., Bánkfalvi A., Schmid K.W., et al. Matrix metalloproteinase-7 as a marker of metastasis and predictor of poor survival in bladder cancer. Cancer Sci. 2010; 101:1300-8. [ Links ]
27. Rodríguez Faba O., Fernández Gómez J.M., Palou Redorta J., Escaf Barmadah S., Vizoso F., Villavicencia Mavrich H. Significance of collagenase 3 (matrix metalloproteinase 13) in invasive bladder cancer: correlation with pathological parameters. Urol Int. 2007; 78:140-4. [ Links ]
28. Naruo S., Kanayama H., Takigawa H., Kagawa S., Yamashita K., Hayakawa T. Serum levels of a tissue inhibitor of metalloproteinase-1 (TIMP-1) in bladder cancer patients. Int J Urol. 1994; 1:228-31. [ Links ]
29. Beaudeux J.L., Giral P., Bruckert E., Foglietti M.J., Chapman M.J. Matrix metalloproteinases, inflammation and atherosclerosis: therapeutic perspectives. Clin Chem Lab Med. 2004; 42:121-31. [ Links ]
30. Masson V., de la Ballina L.R., Munaut C., Wielockx B., Jost M., Maillard C., et al. Contribution of host MMP-2 and MMP-9 to promote tumor vascularization and invasion of malignant keratinocytes. FASEB J. 2005; 19:234-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
jangulo@futurnet.es
jangulo.hugf@salud.madrid.org
(J.C. Angulo).
Recibido 26 Septiembre 2010
Aceptado 25 Octubre 2010














