Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.35 no.5 may. 2011
Vesiculectomía con prostatectomía parcial laparoscópica en el tratamiento del adenocarcinoma primario de vesícula seminal con transformación carcinomatosa del conducto eyaculador
Vesiculectomy with laparoscopic partial prostatectomy in the treatment of primary adenocarcinoma of the seminal vesicle with carcinomatous transformation of the ejaculatory duct
J.C. Anguloa, I. Romeroa, P. Cabreraa, J. Gonzáleza, J.M. Rodríguez-Barberob y C. Núñez-Moraa
aServicio de Urología, Fundación para la Investigación Biomédica, Hospital Universitario de Getafe, Universidad Europea de Madrid, Madrid, España
bServicio de Anatomía Patológica, Fundación para la Investigación Biomédica, Hospital Universitario de Getafe, Universidad Europea de Madrid, Madrid, España
Dirección para correspondencia
RESUMEN
Introducción: El adenocarcinoma primario de la vesícula seminal es una condición extremadamente rara. Se han descrito algunos casos en relación con quistes congénitos de la vesícula seminal, que a menudo se asocian también con agenesia o disgenesia renal ipsilateral. La rareza de este tipo de lesiones dificulta la planificación de un planteamiento quirúrgico reglado de las mismas, aunque habitualmente se tratan mediante exéresis simple o exenteración, según el estadio de las mismas al comienzo.
Material y métodos: Presentamos una nueva técnica quirúrgica, consistente en vesiculectomía radical asociada a prostatectomía parcial laparoscópica (segmentaria total) de la zona central para tratar con éxito un adenocarcinoma primario de vesícula seminal en un varón joven, al que se le detectó por un estudio de azoospermia.
Resultados: El estudio de imagen mediante resonancia magnética (RM) con difusión y la biopsia transrectal de la masa permitió una evaluación preoperatoria minuciosa del caso, confirmando malignidad y la precocidad de la lesión. El abordaje laparoscópico permitió llevar a cabo linfadenectomía pélvica y exéresis transperitoneal, incluyendo la zona central prostática y suturando la cara posterior de la uretra a la altura del ápex prostático. La lesión quística seminal confirmó en su pared un adenocarcinoma de células claras infiltrante, y el segmento prostático de la glándula central un adenocarcinoma no invasivo en la luz del conducto eyaculador con crecimiento in situ. Así, el espécimen quirúrgico permitió la exéresis radical con márgenes negativos, garantizando el carácter de cirugía mínimamente invasiva, con preservación de la continencia y de la erección.
Conclusión: Se describe un nuevo abordaje integral para el planteamiento quirúrgico radical del adenocarcinoma primario de vesícula seminal localizado. A pesar de su carácter excepcional, el caso permite llevar a cabo una doble reflexión: a) el estudio de difusión con RM puede sugerir el diagnóstico de malignidad en este tipo de lesiones; y b) el tratamiento quirúrgico radical debe incluir la exéresis de la porción central de la glándula prostática.
Palabras clave: Vesícula seminal; Adenocarcinoma de células claras; Tratamiento quirúrgico; Prostatectomía parcial; Zona central; Quiste de vesícula seminal; CA-125; Azoospermia.
ABSTRACT
Introduction: Primary adenocarcinoma of the seminal vesicle is an extremely rare condition. Some cases have been described in relation to congenital seminal vesicle cysts, which is often also associated with agenesia or ipsilateral renal disgenesia. The rareness of this type of lesions makes it difficult to plan a regulated surgical approach for them, although they are often treated by simple exeresis or exenteration, depending on their stage at the beginning.
Materials and methods: We present a new surgical technique that consists of radical vesiculectomy associated with laparoscopic partial prostatectomy (total segmentary) of the central area to successfully treat primary seminal vesicle adenocarcinoma in a young man who was diagnosed through an azoospermia study.
Results: A study of the scan (MRI) with diffusion and the transrectal biopsy of the mass allowed us to make a thorough preoperative evaluation of the case, confirming the malignity and precociousness of the lesion. The laparoscopic approach allowed us to perform a pelvic lymphadenectomy and transperitoneal exeresis, including the central prostate area and suture of the posterior face of the urethra at the height of the apex of the prostate. The wall of the seminal cyst lesion confirmed infiltrating clear cell adenocarcinoma and non-invasive adenocarcinoma in the prostate segment of the central gland in the light of the ejaculatory conduct with "in situ" growth. Thus, the surgical specimen allowed radical exeresis with negative margins, guaranteeing minimally invasive surgery with preservation of continence and erection.
Conclusion: We describe a new integral approach for the radical surgery of localized primary adenocarcinoma of the seminal vesicle. Despite its exceptional nature, the case allowed for a double reflection: a) The study of diffusion with MRI may suggest the diagnosis of malignity in this type of lesions; and b) Radical surgical treatment must include exeresis of the central portion of the prostate gland.
Key words: Seminal vesicle; Clear cell adenocarcinoma; Surgical treatment; Partial prostatectomy; Central area; Seminal vesicle cyst; CA-125; Azoospermia.
Introducción
Los tumores primarios de la vesícula seminal (adenocarcinoma, sarcoma, linfoma) son lesiones muy infrecuentes, que a menudo se inician por síntomas inespecíficos1. El adenocarcinoma primario de la vesícula seminal suele ocurrir en pacientes por encima de la quinta década de la vida. La detección mediante ecografía transrectal, TAC con contraste o RM de una masa sólida de aspecto papilar en la pared de la vesícula seminal, asociada a masa pélvica palpable y elevación serológica de CA-125, hace pensar en la presencia de este tipo de lesiones, de las que, como mucho, sólo se han descrito varias docenas de casos con buena correlación clínica e histopatológica2,3.
El patrón histopatológico característico del adenocarcinoma de vesícula seminal está formado por unas estructuras finas papilares anastomosantes de compleja ramificación, compuestas mayoritariamente por células cuboidales claras o por células parcialmente granulares con algunas células «en tachuela» de núcleos redondos y figuras mitóticas ocasionales2. Estas células a menudo producen a la luz mucina epitelial azul alcián y mucicarmín positiva. El marcaje inmunohistoquímico con CA-125 es característicamente positivo, mientras que CEA, AFP, PSA y PAP son negativas. Este patrón ayuda a excluir otras lesiones indiferenciadas de origen prostático o rectal con infiltración secundaria de la vesícula seminal3.
El tratamiento de este tipo de lesiones viene definido por el nivel de extensión a los órganos vecinos y por la edad del sujeto. Ya desde 1967 Smith et al recomiendan la inclusión radical de la próstata en el espécimen, porque el conducto eyaculador a menudo se encuentra afectado4. Parece razonable por tanto proponer la prostatovesiculectomía radical en este tipo de pacientes cuando el tumor parezca localizado, y más cuando se sospeche la existencia de infiltración prostática. Ahora bien, algunos de los casos fueron tratados con vesiculectomía aislada5,6 y siguieron una buena evolución clínica. En ocasiones fue necesario plantear también cistectomía7. La radioterapia parece haber sido indicada con carácter paliativo en casos excesivamente avanzados de muy mal pronóstico8. Otros autores han llevado a cabo tratamiento adyuvante con antiandrógenos o incluso orquiectomía3, sin que exista un racional científico para dicha actitud.
Material y método
Presentamos el caso de un varón de 29 años de edad que consulta por azoospermia y microhematuria aislada. En el estudio ecográfico se aprecia un quiste de vesícula seminal de 5cm de diámetro, con contenido de aspecto parcialmente sólido en su interior y ausencia de riñón derecho. Al tacto se aprecia próstata pequeña, de consistencia normal, con masa blanda palpable sobre ella. Los testículos y los conductos deferentes se aprecian dentro de la normalidad. La cistoscopia confirma ausencia de meato ureteral derecho.
Mediante TAC abdominal se aprecia una estructura de aproximadamente 15mm de diámetro, en situación para-aórtica derecha, que pudiera estar en relación con riñón displásico. En la pelvis menor, cranealmente con respecto a la próstata, se aprecia una lesión ovoidea de aproximadamente 6cm de diámetro preferentemente quística, pero con un área sólida de 2cm próxima a la pared. Teniendo en cuenta la displasia renal y la agenesia ureteral asociada, estos hallazgos son compatibles con lesión quística dependiente de vesícula seminal asociada a anomalía congénita renal.
La RM pélvica aprecia formación quística retrovesical, en teórica localización de las vesículas seminales, con unas dimensiones de 5,9 x 7,4cm. El estudio mediante mapa de difusión (ADC) corrobora la existencia de una lesión papilar sólida, con comportamiento sugerente de malignidad en la pared antero-lateral del quiste, que mide 1,8cm (Figura 1). Con la impresión diagnóstica de que se trata de una lesión neoplásica papilar, desarrollada sobre la pared de un quiste de vesícula seminal asociado a agenesia ureteral y displasia renal derecha, se lleva a cabo biopsia transrectal ecodirigida, apreciándose proliferación glandular atípica, sin poder evaluar apropiadamente el carácter infiltrativo de la lesión en la muestra remitida. La neoformación se encuentra formada por túbulos de distintas dimensiones y formas diversas, recubiertos por células muy aplanadas de núcleos grandes con cromatina densa e irregular, que protruyen hacia la luz tubular y tiñen intensamente CK7 y focalmente CA125; CK20, PSA y PAP son negativos. La porción más celular de la muestra expresa un índice proliferativo Ki-67 y sobreexpresa p53 en más del 25% de las células. Ante estos hallazgos se descarta el origen prostático o urotelial y se sospecha un origen de vesícula seminal o de resto mülleriano. La citología de orina es negativa y el PSA sérico es de 0,46 ng/ml.
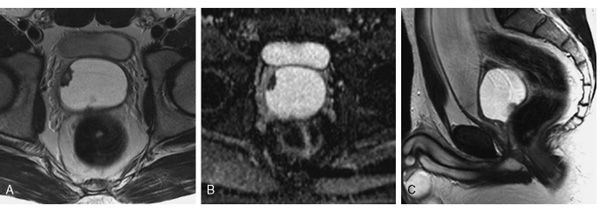
Figura 1. Quiste retrovesical con crecimiento exofítico parietal en RM. A. T2 transversal que muestra
contenido proteínico intraquiste. B. Mapa ADC lesión parietal sugerente de malignidad. C. T2 sagital que
muestra relación entre la masa, el conducto eyaculador y la próstata central, así como uretra
y vejiga rechazadas.
Con la sospecha de que se trate de un adenocarcinoma sobre la pared del quiste de vesícula seminal, sometido a degeneración sobre un terreno embrionario malformativo, se plantea la posibilidad de llevar a cabo una vesiculectomía laparoscópica, decidiéndose además llevar a cabo linfadenectomía pélvica y la exéresis de la porción central de la glándula para practicar la resección completa del margen de los conductos eyaculadores (Figura 2).
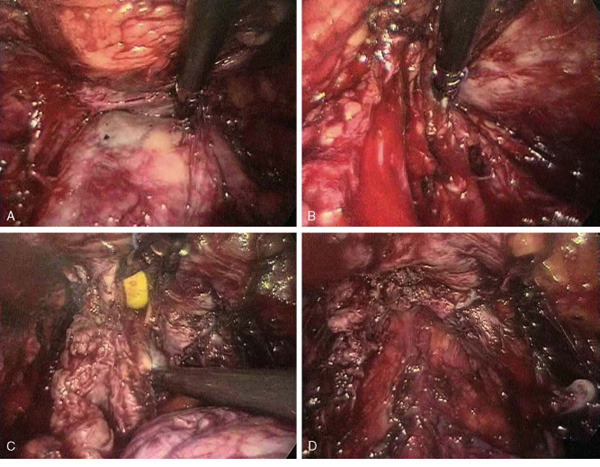
Figura 2. Detalle de la técnica de vesiculectomía y prostatectomía parcial. A. Disección del quiste
retrovesical tras apertura de peritoneo y Denonvillers. B. Ligadura y sección de los pedículos laterales
del quiste. C. Apertura de la próstata hasta la uretra, incluyendo veru montanum y próstata central
en el espécimen de resección. D. Cierre de uretra prostática y campo quirúrgico
tras la retirada del espécimen.
Técnica quirúrgica
Mediante abordaje laparoscópico transperitoneal, a través de 4 trócares se realiza apertura de fondo de saco de Douglas, identificación, disección, ligadura y sección de ambos conductos deferentes, disección del quiste y las vesículas seminales hasta la base prostática, avanzando posteriormente la disección del conducto eyaculador hasta la uretra prostática en donde se secciona. Se incluye en la pieza la zona central de la próstata para análisis histopatológico. Se procede a la extracción de la pieza en bolsa laparoscópica y seguidamente se realiza cierre de cara ventral de la uretra prostática con sutura continua de Monocryl 3/0, hemostasia de lecho quirúrgico, retirada de trócares y cierre por planos (Figura 2).
Diagnóstico histopatológico
La lesión quística resecada mostró una superficie externa irregular, cubierta por tejido adiposo y con ambos deferentes seccionados en la superficie. Un área nodular de 2,5 x 1,5cm de diámetro, constituida por un tejido de consistencia elástica que se corresponde con la zona central prostática, acompaña al espécimen (Figura 3).

Figura 3. A. Relación topográfica entre vejiga y próstata con quiste de vesícula seminal
y conducto eyaculador. B. Espécimen macroscópico de quiste seminal con neoformación
vegetante y tejido que corresponde a la porción central prostática (a la derecha).
Durante el estudio histopatológico se lleva a cabo la apertura del quiste, apreciándose un depósito hemático asociado a crecimiento papilar irregular de células claras con núcleos grandes, hipercromáticos y nucleolo prominente, así como discreta actividad mitótica. En varias zonas el patrón se hace cribiforme y/o tubular, adquiriendo tendencia sólida (Figura 4). Un área tumoral se encuentra calcificada, lo que sugiere el lento crecimiento de la misma. En varias áreas estructuras tubulares de la neoplasia infiltran la pared del quiste, constituida por tejido fibroso y muscular, pero la superficie del mismo se encuentra libre de infiltración y el parénquima prostático remitido que constituye el área nodular acompañante al quiste está también libre de infiltración. Se detecta invasión tumoral peri e intraneural en la pared del quiste. Así mismo, los conductos eyaculadores presentan un revestimiento epitelial de carácter maligno, no infiltrante y con crecimiento de aspecto «intraductal» o in situ.
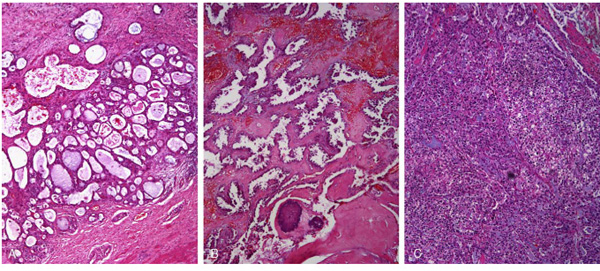
Figura 4. Lesión neoplásica constituida por: A. adenocarcinoma con patrón de crecimiento
mixto tubular, B. papilar y C. sólido con predominio de células claras (hematoxilina-eosina, 100X).
Desde el punto de vista puramente histológico la neoplasia destaca por el predominio de células con citoplasma claro (Figura 4), evidenciándose glucógeno en el interior celular en la tinción de PAS. El tumor presenta positividad para citoqueratina AE1-AE3, citoqueratina 8-18 y citoqueratina 7. También se observa intensa positividad para antígeno de membrana epitelial (EMA) y racemasa, y positividad focal para CA125. El índice proliferativo estimado con Ki-67 es moderado, en torno al 15-20% en los focos más activos. Por otro lado, CK20, CK 8-18, CK 7, calretinina y PSA han sido negativos.
Se trata por tanto de un adenocarcinoma de células claras, de crecimiento papilar, desarrollado sobre la pared de un quiste de vesícula seminal y de carácter infiltrante. Los márgenes son negativos, pero el conducto eyaculador en el interior del espécimen de prostatectomía parcial, que corresponde a la zona central de la próstata, presenta adenocarcinoma in situ difuso, que casi alcanza el veru montanum, pero sin llegar a evidenciarse en la luz uretral. La estructura quística drena a un único conducto eyaculador, que a su vez desemboca a la altura del veru montanum. Toda la zona central de la próstata quedó incluida en el espécimen (Figura 3). Retrospectivamente se aprecia en la imagen de RM la presencia del conducto eyaculador de gran calibre, drenando a la uretra y la verdadera uretra más anterior, en conexión con la vejiga y desplazada por la masa (Figura 1).
Resultados
A pesar de los hallazgos definitivos de extensión intraductal y de invasión perineural en el espécimen, el paciente no recibió tratamiento adyuvante alguno, puesto que los márgenes quirúrgicos fueron negativos. La recuperación postoperatoria ha sido excelente, presentando continencia y función eréctil conservada. Trece meses después de un seguimiento exhaustivo el paciente se encuentra libre de enfermedad y tampoco ha presentado secuela alguna derivada de la cirugía, aunque precisa IPDE para el mantenimiento de la función eréctil. Durante el control clínico se ha realizado flujometría, cistoscopia, citología de orina y RM sin evidenciar hallazgos patológicos.
Discusión
La persistencia de estructuras müllerianas tiene lugar cuando los conductos paramesonéfricos no regresan adecuadamente en el embrión masculino, generando quistes del utrículo prostático y/o de los conductos müllerianos9. Estos remanentes suelen diagnosticarse como masas retrovesicales en varones en la segunda o tercera década de la vida, cuando producen hemospermia y obstrucción de los conductos eyaculadores. Se han descrito algunos casos de degeneración carcinomatosa en el espesor de este tipo de quistes, de forma que tanto las vesículas seminales como los deferentes abocan a esa masa quística. Habitualmente se trata de adenocarcinomas de células claras de crecimiento túbulo-papilar, que recuerdan bastante al adenocarcinoma que tiene lugar en el útero o en el ovario10-13.
También se ha descrito adenocarcinoma de células claras en el utrículo prostático de adolescentes y varones jóvenes, que se presenta como masa sólida y/o quística en la línea media prostática bajo el cuello vesical y conecta mediante un estrecho segmento canalicular con la uretra posterior14. Este tipo de tumores tiene una celularidad común descrita como «en tachuela». No está del todo claro si su origen proviene de remanentes wolfianos, de restos müllerianos o de glándulas parauretrales. La forma en la que este tipo de lesiones infrecuentes y de mal pronóstico suele diagnosticarse es debido a que producen hematuria y síntomas obstructivos al flujo urinario o incluso retención urinaria15. Su perfil inmunohistoquímico habitual es racemasa, CK7 y CK20 positivo, CA125 variable y p63 negativo16. Desde un punto de vista histogenético, el adenocarcinoma de célula clara del tracto urinario tiene un origen urotelial, aunque existe cierta similitud con algunos tumores müllerianos, bien femeninos, bien más raramente masculinos16.
Conceptualmente la neoplasia que hemos tratado en este joven al final de la tercera década de su vida es un adenocarcinoma primario de vesícula seminal, de célula clara con crecimiento túbulo papilar. Existen casos similares que también se asientan sobre quistes congénitos de la vesícula seminal y se asocian además con agenesia renal1 o con ectopia ureteral17. Seguramente que se trata de algún tipo de alteración genética aún no filiada que condiciona la génesis de esta neoplasia tan infrecuente. La condición disgenética manifestada en la formación del quiste seminal, de la displasia o agenesia renal coincidente, y de su desarrollo en una edad tan temprana soporta la existencia de una explicación genética-molecular a día de hoy desconocida.
A pesar del alto índice proliferativo del tumor, su carácter de limitada malignidad viene determinado por el hecho de que esta degeneración sucede en el interior del quiste, donde adquiere un carácter focalmente invasivo, aunque la mayor parte de esta lesión tiene un componente parietal no infiltrante, que se asemeja al carcinoma intraductal de la mama o al carcinoma in situ del ovario. La afectación de todo el epitelio del conducto eyaculador en el espesor de la zona central de la próstata confirma este carácter de enfermedad difusa o multifocal, pero diagnosticada en una fase inicial, si se compara con los escasos casos de adenocarcinoma de vesícula seminal clásicamente descritos3.
Este caso ejemplifica cómo es posible llevar a cabo un abordaje laparoscópico radical en este tipo de lesiones, que debe incluir obligatoriamente linfadenectomía pélvica y la exéresis de la porción de espécimen prostático que alberga el conducto eyaculador; en resumen, una prostatectomía parcial segmentaria total. Esta situación ingeniosa, la vesiculectomía con prostatectomía parcial laparoscópica, es una técnica nueva que aquí describimos por primera vez, y que debe plantearse como la primera opción en todos los infrecuentes casos de adenocarcinoma primario de vesícula seminal precozmente diagnosticados. El comienzo incidental de este paciente, que fue estudiado por azoospermia, y la aplicación de nuevos métodos de diagnóstico por imagen, como la RM con difusión, permitió llevar a cabo un diagnóstico precoz de la lesión y el planteamiento de una cirugía mínimamente invasiva y exitosa de la neoplasia, incluida la exéresis de la transformación carcinomatosa del conducto eyaculador.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Al Dr. Ferrán Algaba (Fundación Puigvert) por corroborar el diagnóstico histopatológico del caso.
Bibliografía
1. Lee BH, Seo JW, Han YH, Kim YH, Cha SJ. Primary mucinous adenocarcinoma of a seminal vesicle cyst associated with ectopic ureter and ipsilateral renal agenesis:a case report. Korean J Radiol. 2007; 8:258-61. [ Links ]
2. Ohmori T, Okada K, Tabel R, Sugiura K, Nabeshima S, Ohoka H, et al. CA125-producing adenocarcinoma of the seminal vesicle. Path Int. 1994; 44:333-7. [ Links ]
3. Thiel R, Effert P. Primary adenocarcinoma of the seminal vesicles. J Urol. 2002; 168:1891-6. [ Links ]
4. Smith BA, Webb EA, Price WE. Carcinoma of the seminal vesicle. J Urol. 1967; 97:743-50. [ Links ]
5. Kawahara M, Matsuhashi M, Tamjma M, Sawamura Y, Matshusima M, Shirai M, et al. Primary carcinoma of seminal vesicle. Diagnosis assisted by sonography. Urology. 1988; 32:269-72. [ Links ]
6. Gohji K, Kamidono S, Okada S. Primary adenocarcinoma of the seminal vesicle. Br J Urol. 1993; 72:514-5. [ Links ]
7. Tanaka T, Takeuchi T, Oguchi K, Niwa K, Mori H. Primary adenocarcinoma of the seminal vesicle. Human Pathol. 1987; 18:200-2. [ Links ]
8. Oxley JD, Brett MT, Gillatt DA, Burton P. Seminal vesicle carcinoma. Histopathol. 1999; 34:562-3. [ Links ]
9. Oh C, Chung I, Won H, Kim JH, Nam K. Morphologic variations of the prostatic utricle. Clin Anat. 2009; 22:358-64. [ Links ]
10. Ferrozi F, Ganzetti A, Mugnoli E. Carcinomatous degeneration in mullerian duct cyst: findings with computerized tomography. Radiol Med. 1998; 96:270-1. [ Links ]
11. Shinmura Y, Yokoi T, Tsutsui Y. A case of clear cell adenocarcinoma of the müllerian duct in persistent müllerian duct syndrome. Am J Surg Pathol. 2002; 26:1231-4. [ Links ]
12. Warmann SW, Vogel M, Wehrmann M, Scheel-Walter HG, Artlich A, Pereira PL, et al. Giant mullerian duct cyst with malignant transformation in a 15-year-old boy. Urology. 2006; 67:424.e3-6. [ Links ]
13. Novak RW, Raines RB, Sollee AN. Clear cell adenocarcinoma in a Müllerian duct cyst. Am J Clin Pathol. 1981; 76:339-41. [ Links ]
14. Gualco G, Ortega V, Ardao G, Cravioto F. Clear cell adenocarcinoma of the prostatic utricle in an adolescent. Annals Diagn Pathol. 2005; 9:153-6. [ Links ]
15. Abascal Junquera JM, Cecchini Rosell L, Mateos Calvo R, Salvador Lacambra C, Celma Doménech A, De Torres I, et al. Presentación de un nuevo caso de adenocarcinoma de células claras uretral y su manejo quirúgico. Actas Urol Esp. 2007; 31:411-6. [ Links ]
16. Sung M, Zhang S, MacLennan GT, López-Beltrán A, Montironi R, Wang M, et al. Histogenesis of clear cell adenocarcinoma in the urinary tract: evidence of urothelial origin. Clin Cancer Res. 2008; 14:1947-55. [ Links ]
17. Narita S, Akao T, Tsuchiya N, Kumazawa T, Kakinuma H, Satoh S, et al. Transitional cell carcinoma in an ectopic ureter. Int J Urol. 2003; 10:276-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: jangulo@futurnet.es,
jangulo.hugf@salud.madrid.org
(J.C. Angulo)
Recibido 26 Enero 2011
Aceptado 27 Enero 2011














