My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actas Urológicas Españolas
Print version ISSN 0210-4806
Actas Urol Esp vol.35 n.8 Sep. 2011
¿Existe un intervalo de tiempo de isquemia fría seguro para el injerto renal?
Is there a Safe Cold Ischemia Time Interval for the Renal Graft?
J. Barba, J.J. Zudaire, J.E. Robles, A. Tienza, D. Rosell, J.M. Berián e I. Pascual
Departamento de Urología, Clínica Universidad de Navarra, Navarra, España
Dirección para correspondencia
RESUMEN
Objetivo: Se pretende caracterizar la verdadera relación del tiempo de isquemia fría (TIF) con la supervivencia del injerto, así como con los principales eventos del postrasplante.
Material y métodos: Analizamos 378 trasplantes renales, estudiando la relación del TIF con la supervivencia del injerto mediante un análisis univariado según el modelo de COX, y buscando el mejor punto de corte mediante el método de Kaplan-Meier y test de log-rank. La relación entre TIF y los principales eventos del postrasplante fue estudiada con la regresión logística binaria.
Resultados: La media de seguimiento de todo el grupo fue de 77,8 meses (± 51 DE) y el TIF medio de 14,8 horas (± 5,1 DE). El análisis univariado revela que el TIF no se relaciona con la supervivencia del injerto como variable continua (OR = 1,04; IC 95% 0,9-1,08; p > 0,05). Al establecer el punto de corte en las 18 horas encontramos diferencias en la supervivencia actuarial. La supervivencia a los 5 años es del 91% con TIF < 18h frente a 84% con TIF > 18h. Cada hora de isquemia fría incrementó un 10% el riesgo de retraso en la función del injerto (OR = 1,1; IC 95%:1,05-1,15; p < 0,001) y también condicionó mayor incidencia de rechazo agudo (41,5% vs. 55,3%; p = 0,02) y menor tiempo hasta el primer episodio de rechazo (72,6 días ± 137 vs. 272,2 días ± 614,8; p = 0,023) a partir de las 18 horas. Con el resto de eventos del postrasplante, tales como complicaciones quirúrgicas o ingresos hospitalarios, el TIF no pareció estar relacionado (p > 0,05).
Conclusiones: En nuestra experiencia una isquemia fría menor de 18 horas no parece afectar negativamente la supervivencia del injerto.
Palabras clave: Tiempo de isquemia fría. Supervivencia del injerto. Trasplante renal.
ABSTRACT
Objective: It is aimed to characterize the true relationship of the cold ischemia time (CIT) with graft survival and with the principal post-transplantation events.
Material and methods: We analyzed 378 kidney transplants, studying the relationship of the CIT with graft survival using a univariate analysis according to the COX model and seeking the optimum cutoff according to the Kaplan-Meier method and log-rank test. The relationship between CIT and the principal events of the post-transplant was studied using the binary logistic regression.
Results: The mean follow-up of all the group was 77.8 months (± 51 SD) and the mean CIT was 14.8hours (± 5.1 SD). The univariate analysis revealed that the CIT was not related with the graft survival as a continuous variable (OR = 1.04; 95% CI: 0.9-1.08; p > 0.05). On establishing the cutoff at 18hours, we found differences in the actuarial survival. Survival at 5 years was 91% with CIT < 18h versus 84% with CIT >18h. Each hour of cold ischemia increased risk of delay in the graft function by 10% (OR = 1.1; 95% CI: 1.05-1.15; p < 0.001) and also conditioned a greater incidence of acute rejection (41.5% vs. 55.3%; p = 0.02) and less time to the first rejection episode (72.6 days ± 137 vs. 272.2 days ± 614.8; p = 0.023) after 18hours. The CIT did not seem to be related (p < 0.05) with the rest of the post-transplantation events, such as surgical complications or hospital admissions.
Conclusions: In our experience, cold ischemia under 18hours does not seem to negatively affect graft survival.
Key words: Cold ischemia time. Graft survival. Kidney transplant.
Introducción
Es un hecho demostrado que el trasplante renal mejora la supervivencia de los pacientes con insuficiencia renal terminal, en comparación con aquellos que permanecen en diálisis1.
Este beneficio proporcionado por el injerto hace que un objetivo primordial en el panorama actual del trasplante sea optimizar los resultados de supervivencia del mismo. Para ello es de vital importancia el estudio detallado de aquellos factores modificables que afectan a la función del riñón trasplantado.
En este sentido cada vez hay mayor evidencia de que la función del órgano trasplantado puede verse afectada desde las primeras horas que rodean a la muerte encefálica, e incluso desde el momento en el que el futuro donante ingresa en la Unidad de Cuidados Intensivos2,3. Entre estos primeros instantes y el momento del trasplante el tiempo de isquemia fría (TIF) supone uno de los principales factores modificables que pueden afectar a la supervivencia del injerto. El TIF prolongado tradicionalmente se ha relacionado con peores resultados funcionales, y por esta razón los esfuerzos del mundo nefrourológico en los últimos tiempos han ido dirigidos hacia un intento por acortarlo al máximo4,5.
Además se ha puesto especial hincapié en el hecho de que en ciertas poblaciones de donantes, como los donantes añosos y con criterios expandidos, el TIF podría tener un efecto pernicioso. Por tanto, los esfuerzos por acortar los tiempos de isquemia se tendrían que intensificar en estos casos6,7.
Con este trabajo pretendemos analizar la verdadera relación del TIF con la supervivencia del injerto, así como estudiar su efecto sobre los principales eventos postquirúrgicos (rechazo agudo, función diferida y complicaciones médico-quirúrgicas) desde la perspectiva de un estudio de centro único. Revisaremos la literatura científica analizando también los resultados de otros estudios de estas características, así como los principales estudios multicéntricos publicados hasta la fecha para obtener conclusiones globales.
En definitiva, trataremos de determinar cuál es el intervalo de tiempo de isquemia fría seguro para los injertos trasplantados, buscando si es posible un hipotético punto de corte que lo defina.
Material y métodos
Analizamos 419 trasplantes realizados entre 1994 y 2009. De ellos excluimos los trasplantes de donante vivo (n = 12) y aquellos con complicaciones médico-quirúrgicas ocurridas durante el primer mes post-intervención y que influyeron de forma decisiva en la evolución del injerto (n = 24). En 5 pacientes no se logró obtener el dato del TIF, por lo que también fueron excluidos. El grupo final fue de 378 trasplantes de donante cadáver.
Analizamos en ellos los factores relacionados con el TIF, su impacto sobre las principales complicaciones médico-quirúrgicas del postoperatorio y valoramos su influencia sobre la supervivencia del injerto. El TIF se definió como el tiempo entre la perfusión inicial del órgano y el comienzo de la sutura vascular durante la intervención quirúrgica.
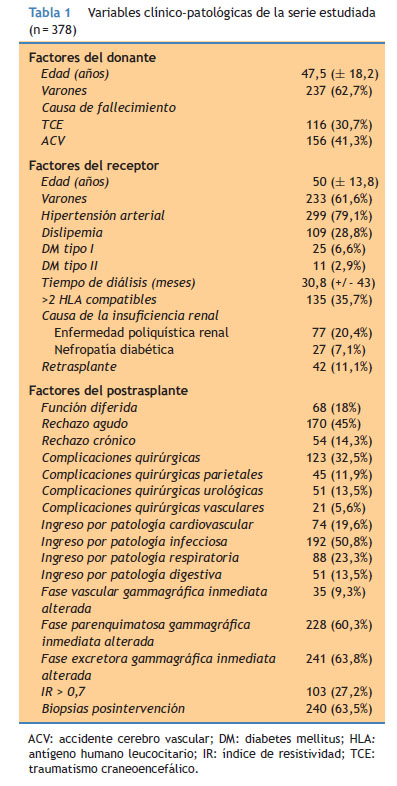
Las variables clínico-patológicas recogidas en la Tabla 1 fueron obtenidas de la historia clínica del paciente. El rechazo agudo se confirmó mediante biopsia, y ante la mejora de la función renal tras la administración de corticoides. Se clasificaron las biopsias en los siguientes grupos: normal, rechazo borderline y rechazos grado 1, 2 y 3. Se recogieron el número de rechazos y el tiempo hasta el primer rechazo. El rechazo crónico se clasificó también en dos grados (según criterios de Banff). La función diferida fue recogida como falta de función renal en la primera semana post-trasplante. En los casos de pacientes en prediálisis, la función diferida se definió como la ausencia de disminución de la creatinina previa durante la primera semana. Las complicaciones quirúrgicas fueron confirmadas mediante ecografía, tomografía computarizada o exploración quirúrgica. La técnica quirúrgica estandarizada queda descrita en trabajos anteriores8.
Para estudiar la relación del TIF como variable continua con la supervivencia del injerto realizamos un análisis univariado según el modelo de la regresión de Cox. Posteriormente, buscamos el mejor punto de corte a partir del cual aparecen diferencias en la supervivencia del injerto mediante tanteo haciendo sugbrupos con el método de Kaplan-Meyer y el test de log-rank.
Para ajustar por variables de distribución heterogénea se realizó un análisis por estratos. El evento para el estudio de la supervivencia del injerto fue la entrada en diálisis del paciente. Los pacientes fallecidos con injerto funcionante han sido tratados como censados en el momento de su fallecimiento. Los estudios de homogeneidad entre grupos se realizaron mediante comparación de proporciones con la prueba de Chi-cuadrado para las variables cualitativas, y comparación de medias con el test «t» de Student para variables cuantitativas.
El incremento de riesgo de aparición de rechazo agudo y de función diferida del injerto, en función del TIF como variable continua, fue estudiado mediante regresión logística binaria, buscando también puntos de corte mediante tanteo. Para conocer cuáles son las variables que se relacionan de un modo independiente con la supervivencia del injerto se realizó un análisis multivariado según los modelos de Cox. La normalidad de la variable «tiempo de isquemia fría» en horas fue determinada mediante los test de Kolmogorov-Smirnov y de Shapiro-Wilk. Un valor de p<0,05 fue exigido para determinar la significación estadística. Todos los análisis estadísticos fueron realizados con el programa SPSS (Statistical Product and Services Solutions, versión 15.0, SPSS Inc, Chicago, Illinois, USA).
Resultados
La media y mediana de seguimiento de todo el grupo (n = 378) fue 77,8 meses (± 51 DE) y 73,8 meses (rango = 85,1) respectivamente. El TIF medio de todo el grupo fue 14,8 horas (± 5,1 DE) y la mediana fue de 14,4 horas (rango = 28,5). La variable tiempo de isquemia fría siguió una distribución normal. Otras variables clínico-patológicas se recogen en la Tabla 1.
Análisis de supervivencia del injerto
La supervivencia del injerto de todo el grupo a los 5 años fue del 89,5%. De los 284 receptores con tiempo de isquemia fría menor o igual a 18 horas, 38 perdieron el injerto al final del estudio (supervivencia a 5 años del 86,6%). En el grupo de receptores con tiempo de isquemia fría mayor a 18 horas (n = 94) hubo 31 eventos (supervivencia a 5 años del 67%). El análisis univariado revela que el tiempo de isquemia fría no se relaciona con la supervivencia del injerto como variable continua (OR=1,04; IC 95%: 0,9 - 1,08; p > 0,05).
En el estudio actuarial encontramos diferencias en la supervivencia del injerto a los 3 y 5 años a partir de las 18 horas, con mejores resultados en el grupo con menos de 18 horas de isquemia. La supervivencia a los 3 y 5 años fue del 96% (IC 95%; 95-97%) y 91% (IC 95%; 90-92%) vs 89% (IC 95%; 86-92%) y 84% (IC 95%; 80-88%), respectivamente (Figura 1).

Figura 1. Supervivencia del injerto en función del tiempo
de isquemia fría (punto de corte: 18 horas).
Se realizó un estudio de homogeneidad entre estos dos grupos (TIF < 18 vs TIF > 18), resultando comparables respecto a los factores de riesgo cardiovasculares recogidos en la Tabla 1. Únicamente encontramos diferencias en cuanto a la edad del donante, que fue superior en el grupo con un TIF > 18 horas (51,5 años ± 16,2 vs. 46,2 años ± 18,6; p = 0,014). De hecho, en el grupo de injertos procedentes de donantes mayores de 60 años, 38 (32,8%) tuvieron un TIF > 18 horas, mientras que en el grupo de donantes menores de 60 fueron 56 (21,4%) los que tuvieron estos tiempos de isquemia (p = 0,018). Al realizar de nuevo el análisis de supervivencia ajustando por la variable edad del donante, el TIF no influye sobre la supervivencia del injerto (p > 0,05).
En definitiva, el TIF se relaciona con la supervivencia del injerto con su punto de corte en las 18 horas, pero no se relaciona con la misma como variable continua ni con carácter independiente. Además, al ajustar por la edad del donante se pierde la significación. En esta serie las variables con influencia independiente sobre la supervivencia del injerto fueron rechazo agudo, función diferida y reintervención quirúrgica inmediata (OR de 1,7, 3,5 y 2,5 respectivamente).
Factores relacionados con el tiempo de isquemia fría
Al estudiar las relaciones del TIF con la función diferida observamos que a partir de las 11 horas ya existe mayor riesgo de que esta se produzca (OR=2,8; IC 95% 1,2-6,5; p = 0,012). Apreciamos un claro aumento de la incidencia de función diferida en el grupo con mas de 11 horas de isquemia (59/ 20,3% vs. 9/ 10,3%; p < 0,034). Además, por cada hora de isquemia se produce un incremento del riesgo de retraso en la función del 10% (OR = 1,1; IC 95%:1,05-1,15; p < 0,001).
En cuanto al rechazo los resultados nos indican que es de nuevo a partir de las 18 horas cuando aparece un incremento del riesgo de aparición del mismo (OR = 1,7; IC 95% 1,08-2,7; p = 0,021). En los receptores de un injerto con más de 18 horas de isquemia fría existe un incremento de la incidencia del episodio agudo (118/41,5% vs 52/ 55,3%; p = 0,02) y de rechazo crónico (21/ 22,6% vs 33/11,6%; p = 0,009), así como menos tiempo hasta el primer episodio de rechazo (72,6 días ± 137 vs 272,2 días ± 614,8; p = 0,023). Por el contrario, la variable TIF en horas no se relacionó como variable continua con el rechazo agudo (OR = 1,03; IC 95% 0,9-1,07; p > 0,05).
El impacto del TIF sobre el rechazo agudo y la función diferida se refleja en los hallazgos de las pruebas de imagen realizadas en las primeras 24 horas postrasplante. Los índices de resistividad inmediatos (43/46,2% vs. 60/ 21,3%; p < 0,001) y la fase vascular gammagráfica inmediata (19/20,2% vs. 16/5,7%; p < 0,001) estuvieron alteradas con más frecuencia en el grupo con más de 18 horas. Para el resto de eventos del postrasplante, como las complicaciones quirúrgicas (vasculares, parietales o urológicas) o los ingresos hospitalarios, el tiempo de isquemia fría no pareció incrementar su incidencia (p > 0,05).
Discusión
En los últimos tiempos se viene postulando el posible papel del TIF como factor esencial en el daño por isquemia-reperfusión, fenómeno influyente en la supervivencia del injerto renal. El grado de esta lesión endotelial se relacionaría con las características previas del injerto en el momento que se restablece el flujo vascular, y se vería favorecido por un TIF prolongado, iniciando un proceso de activación inmunológica que eventualmente podría desencadenar el fracaso renal9. Así mismo, se ha descrito una íntima relación del TIF con la función diferida y con el rechazo agudo, ambos factores claramente influyentes en el futuro del injerto10-13.
Intuitivamente asumimos que tiempos prolongados de isquemia tienen un efecto negativo sobre la función renal, pero el hecho es que su impacto como factor independiente sobre la supervivencia del injerto renal todavía no está aclarado. Paralelamente nos surge la pregunta de dónde se sitúa el punto de corte a partir del cual la supervivencia del injerto comienza a empeorar, y si existirán beneficios al trasplantar injertos acortando drásticamente el TIF.
Con este trabajo hemos tratado de esclarecer la verdadera relación del TIF con la supervivencia del injerto y con los diferentes eventos del postrasplante. Para ello hemos analizado los principales estudios publicados en este campo, comparando sus resultados con los nuestros.
Los estudios de centro único permiten el uso de los datos de donantes y receptores de una forma más detallada, y presentan la ventaja de que la población a estudio es más homogénea en cuanto a tratamiento inmunosupresor y práctica clínica. Los resultados en cuanto a la relación del TIF con la supervivencia del injerto en este tipo de estudios publicados hasta la fecha son contradictorios.
Mientras que algunos trabajos no encuentran diferencias en la supervivencia del injerto a los 5 años11,13,14, otros afirman lo contrario. Entre estos últimos Roodnat et al15 mantienen que el TIF influye de forma independiente sobre la supervivencia del injerto como variable continua sin actuar a través de otras variables. También apreciaron que esta relación era sólo válida para el postrasplante inmediato, durante la primera semana, y que este efecto se iba perdiendo con el paso del tiempo. Otros trabajos establecen puntos de corte entre las 21 y 24 horas a partir de las cuales los resultados de supervivencia del injerto disminuyen sensiblemente16,17.
A pesar de que algunos análisis multivariantes incluyen la isquemia fría como variable significativa16,17, la evidencia parece indicar que el TIF no se relaciona con carácter independiente con la supervivencia del injerto, sino que lo hace a través de la función diferida13, 14. La mayoría de estudios afirman que el TIF está relacionado con FD desde las primeras horas13,14,16-18. En el caso del rechazo agudo los estudios son más heterogéneos, pero también parece que existe un incremento de la incidencia del mismo a partir de tiempos de isquemia más largos, entre 18 y 24 horas17.
De los estudios multicéntricos obtenemos una información más global y de mayor potencia que pretende esclarecer las controversias despertadas por los estudios de centro único. Su et al estudiaron 33.443 trasplantes de donante cadáver procedentes de la base de datos del United Network of Organ Sharing (UNOS) y del United States Renal Data System (USRDS)19. Encontraron una asociación entre TIF y supervivencia actuarial del injerto, estableciendo el punto de corte en las 36 horas. Al formar grupos (9-16h, 17-24h, 25-36h, 37-48h y > 48h) apreciaron un incremento del riesgo de pérdida del injerto a medida que aumentaban las horas de isquemia. Ojo et al analizaron 37.216 primeros trasplantes de donante cadáver realizados entre 1985 y 1992 procedentes del USRDS20. El TIF se relacionó en este estudio con la función diferida como variable continua, con un incrementó del riesgo del 23% por cada incremento de 6 horas de la misma. Cuando comparó la influencia del TIF sobre la supervivencia del injerto a los 5 años no difirió entre los grupos con < 12h y 13-24h (60 vs 61%). Sin embargo, al poner el punto de corte en 12 horas y compararlo con el resto del grupo encontró diferencias significativas (52 vs 61%; p < 0,001). Este hallazgo sugiere que probablemente tiempos muy prolongados de TIF se relacionan directa e independientemente con la supervivencia del injerto.
Otro estudio multicéntrico que estudia de una forma indirecta el impacto del TIF sobre la supervivencia del injerto es el Eurotransplant Senior Program (ESP)21. Este programa de trasplante renal, iniciado en 1999, consiste en la utilización de riñones obtenidos de donantes mayores de 65 años trasplantándolos en receptores con más de 65 años. En este caso se prioriza el TIF en contraposición con el programa Eurotransplant Kidney Allocation System (ETKAS) que prioriza compatibilidad HLA. Como vemos, este estudio no analiza directamente la influencia del TIF sobre la supervivencia del injerto, sino que compara un grupo en el que se hace hincapié en acortar los tiempos de isquemia frente a otro en el que se prioriza la compatibilidad HLA22. En este caso, el grupo ESP se relacionó con un menor TIF y menor incidencia de función diferida pero con una tasa de rechazo agudo un 5-10% superior. En cuanto a la supervivencia del injerto a los 5 años no se encontraron diferencias.
En el Collaborative Transplant Study (CTS), durante el periodo comprendido entre 1986-1996, Opelz et al realizaron un estudio multicéntrico analizando 25.123 trasplantes en el que valoraron el impacto del TIF sobre la supervivencia del injerto23. En este caso, el TIF no resultó ser un factor de influencia independiente sobre la supervivencia del injerto. La compatibilidad de los HLA, el rechazo y la función diferida fueron los mejores elementos predictivos de supervivencia del injerto. Paradójicamente el grupo con TIF 0-6 horas no obtuvo los mejores resultados de supervivencia. De hecho, la supervivencia del injerto en este grupo fue inferior a la de los grupos con tiempos isquemia de entre 25 y 36 horas y entre 37 y 48. Esto se relacionó con que muchos de los pacientes con TIF < 6 horas habían sido trasplantados sin tener en cuenta criterios estrictos de compatibilidad de HLA para favorecer precisamente un TIF corto. En el segundo periodo del CTS, entre 1999 y 2005, se incluyeron 91.674 trasplantes y participaron 195 centros de 26 naciones24. Al valorar el impacto del TIF en la supervivencia del injerto no aparecieron diferencias hasta las 18 horas. Se apreció también que un TIF corto (< 7 horas; n = 2.310) no es suficiente para igualar resultados de donante vivo no relacionado (n = 1.397). En este trabajo tampoco el TIF modificó el efecto de la compatibilidad HLA.
Tradicionalmente se ha mantenido la creencia de que en aquellos donantes mayores de 65 años el TIF prolongado era especialmente nocivo de cara a los resultados funcionales del injerto25. Al estudiar a 5.997 pacientes con más de 65 años en este grupo se apreció una peor supervivencia que con donantes menores de 65 años, y no se observó especial influencia del TIF. La influencia del tiempo de isquemia fue la misma que en el grupo de menos de 45 años, y fue la propia edad del donante la que determinó peores resultados en la supervivencia del injerto. En 44.264 injertos procedentes de donantes subóptimos se apreció peor supervivencia al compararlos con injertos normales, pero tampoco se observó una influencia especial del TIF.
En resumen, la relación entre la supervivencia del injerto el TIF parece patente 19,20,24. Aunque el TIF no se relaciona como variable continua con la supervivencia del injerto, queda claro que existen puntos de corte (entre 12 y 18 horas) a partir de los cuales esta decrece significativamente. Además, los estudios multicéntricos reflejan que el TIF no se relaciona de forma independiente con la supervivencia del injerto renal. Probablemente se relacione a través del aumento de incidencia de la función diferida que lleva asociado20.
El estudio que ahora presentamos ofrece resultados similares y establece un punto de corte en las 18 horas, reflejando que existen además otras variables de mayor importancia en cuanto a impacto sobre la supervivencia del riñón trasplantado. En concreto la propia edad del donante y los factores inmunológicos parecen jugar un papel de mayor importancia24. El TIF no parece tan buen indicador del daño de isquemia-reperfusión como en un principio se había pensado. No obstante, es justo decir que probablemente tiempos muy prolongados de isquemia fría, sí se relacionarían de forma directa e independiente con la supervivencia del injerto. Por ello, en aquellos países o regiones en los que por el tipo de política de asignación de órganos sea más costoso lograr tiempos de isquemia fría cortos, esta variable puede magnificar su impacto sobre la función del injerto y encontrarse dentro del grupo de factores que determinan su supervivencia. En definitiva, el intervalo del TIF por debajo de las 18 horas, con el que la mayoría de grupos nos enfrentamos en nuestro entorno, parece seguro para la supervivencia del injerto.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Wolfe RA, Ashby VB, Milford EL, Ojo AO, Ettenger RE, Agodoa LY, et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 1999; 341:1725-30. [ Links ]
2. Marshall R, Ahsan N, Dhillon S, Holman M, Yang HC. Adverse effect of donor vasopressor support on immediate and one-year kidney allograft function. Surgery. 1996; 120:663-5. [ Links ]
3. Pratschke J, Wilhelm MJ, Laskowski I, Kusaka M, Beato F, Tullius SG, et al. Influence of donor brain death on chronic rejection of renal transplants in rats. J Am Soc Nephrol. 2001; 12:2474-81. [ Links ]
4. Lange H, Kuhlmann U. Organ procurement policy: should we reduce cold ischemia times?. Transplant Proc. 1998; 30:4297-302. [ Links ]
5. Offermann G. What is a reasonably short cold ischemia time in kidney transplantation?. Transplant Proc. 1998; 30:4291-3. [ Links ]
6. Pascual J, Zamora J, Pirsch JD. A Systematic Review of Kidney Transplantation From Expanded Criteria Donors. Am J Kidney Dis. 2008; 52:553-86. [ Links ]
7. Sharma AK, Brown M, Connolly J, Bakran A, Ahmad R, Sells RA. Analysis of factors affecting the outcome of renal transplantation in older people. Transplant Proc. 1997; 29261. [ Links ]
8. Barba Abad J, Rincón Mayans A, Tolosa Eizaguirre E, Romero Vargas L, Rosell Costa D, Robles García JE, et al. Surgical complications in kidney transplantation and their influence on graft survival. Actas Urol Esp. 2010; 34:266-73. [ Links ]
9. Tullius SG, Nieminen-Kelhä M, Buelow R, Reutzel-Selke A, Martins PN, Pratschke J, et al. Inhibition of ischemia/reperfusion injury and chronic graft deterioration by a single-donor treatment with cobalt-protoporphyrin for the induction of heme oxygenase-1. Transplantation. 2002; 74:591-8. [ Links ]
10. Cicciarelli J, Iwaki Y, Mendez R, Asai P, Bogaard T, Khetan U, et al. Effects of cold ischemia time on cadaver renal allografts. Transplant Proc. 1993; 25(1 Pt 2):1543-6. [ Links ]
11. Haberal M, Karakayali H, Moray G, Demirag A, Ozyaylali I, Turan M, et al. Cadaveric kidney transplantation: effect of cold ischemia time and HLA match. Transplant Proc. 1999; 31:3336-7. [ Links ]
12. Shoskes DA, Halloran PF. Delayed graft function in renal transplantation: etiology, management and long-term significance. J Urol. 1996; 155:1831-40. [ Links ]
13. Mikhalski D, Wissing KM, Ghisdal L, Broeders N, Touly M, Hoang AD, et al. Cold ischemia is a major determinant of acute rejection and renal graft survival in the modern era of immunosuppression. Transplantation. 2008; 85 (Suppl):S3-9. [ Links ]
14. Kyllönen LE, Salmela KT, Eklund BH, Halme LE, Höckerstedt KA, Isoniemi HM, et al. Long-term results of 1047 cadaveric kidney transplantations with special emphasis on initial graft function and rejection. Transpl Int. 2000; 13:122-8. [ Links ]
15. Roodnat JI, Mulder PG, van Riemsdijk IC, IJzermars JN, van Gelder T, Weimar W. Ischemia times and donor serum creatinine in relation to renal graft failure. Transplantation. 2003; 75:799-804. [ Links ]
16. Quiroga I, McShane P, Koo DD, Gray D, Friend PJ, Fuggle S, et al. Major effects of delayed graft function and cold ischaemia time on renal allograft survival. Nephrol Dial Transplant. 2006; 21:1689-96. [ Links ]
17. Troppmann C, Gillingham KJ, Benedetti E, Almond PS, Gruessner RW, Najarian JS, et al. Delayed graft function, acute rejection, and outcome after cadaver renal transplantation. The multivariate analysis. Transplantation. 1995; 59:962-8. [ Links ]
18. Boom H, Mallat MJ, de Fijter JW, Zwinderman AH, Paul LC. Delayed graft function influences renal function, but not survival. Kidney Int. 2000; 58:859-66. [ Links ]
19. Su X, Zenios SA, Chakkera H, Milford EL, Chertow GM. Diminishing significance of HLA matching in kidney transplantation. Am J Transplant. 2004; 4:1501-8. [ Links ]
20. Ojo AO, Wolfe RA, Held PJ, Port FK, Schmouder RL. Delayed graft function: risk factors and implications for renal allograft survival. Transplantation. 1997; 63:968-74. [ Links ]
21. Smits JM, Persijn GG, van Houwelingen HC, Claas FH, Frei U. Evaluation of the Eurotransplant Senior Program. The results of the first year. Am J Transplant. 2002; 2:664-70. [ Links ]
22. Frei U, Noeldeke J, Machold-Fabrizii V, Arbogast H, Margreiter R, Fricke L, et al. Prospective age-matching in elderly kidney transplant recipients-a 5-year analysis of the Eurotransplant Senior Program. Am J Transplant. 2008; 8:50-7. [ Links ]
23. Opelz G. Cadaver kidney graft outcome in relation to ischemia time and HLA match. Collaborative Transplant Study. Transplant Proc. 1998; 30:4294-6. [ Links ]
24. Opelz G, Döhler B. Multicenter analysis of kidney preservation. Transplantation. 2007; 83:247-53. [ Links ]
25. Vistoli F, Boggi U, Vanadia Bartolo T, Del Chiaro M, Croce C, Gremmo F, et al. Kidney transplantation from donors aged more than 65 years. Transplant Proc. 2004; 36:481. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: javiferbar@hotmail.com
(J. Barba)
Recibido el 8 de Marzo de 2011
Aceptado el 13 de Marzo de 2011