My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actas Urológicas Españolas
Print version ISSN 0210-4806
Actas Urol Esp vol.35 n.9 Oct. 2011
https://dx.doi.org/10.4321/S0210-48062011000900002
Relación entre los niveles de hormonas sexuales en varones por encima de los 50 años y composición corporal, calidad ósea y calidad de vida
Relationships between Sex Hormone Levels in Men over 50 Years of Age and Body Composition, Bone Quality, and Quality of Life
J.M. Martínez-Jabaloyasa, A. Queipo-Zaragozáb, C. Ferrandis-Cortesa, J.A. Queipo-Zaragozác, M. Gil-Saloma y P. Chuan-Nueza
aServicio de Urología, Hospital Clínico Universitario de Valencia, Valencia, España
bLaboratorio de Bioquímica Clínica, Hospital Clínico Universitario de Valencia, Valencia, España
cServicio Urología, Hospital Clínico de Sagunto, Valencia, España
Dirección para correspondencia
RESUMEN
Objetivo: Determinar la relación existente entre los niveles de hormonas sexuales y la composición corporal, la salud ósea y la calidad de vida en hombres por encima de los 50 años.
Material y métodos: Estudio transversal en el que se incluyen 230 pacientes. Se determina la composición corporal utilizando parámetros antropométricos directos como el peso, la talla, la circunferencia de la cintura, la circunferencia del brazo dominante, el pliegue cutáneo tricipital, el pliegue en brazo dominante y el pliegue subcapsular. Se calculan parámetros antropométricos indirectos. Se realizan medidas cuantitativas de densidad ósea mediante ecografía del calcáneo, así como marcadores de recambio óseo (N-telopéptidos de excreción urinaria y relación calcio/ creatina). La calidad de vida se evalúa mediante el cuestionario abreviado de calidad de vida SF-36. Los análisis sanguíneos incluyen la determinación de testosterona total, globulina transportadora de hormonas sexuales (SHBG), testosterona libre calculada (TLc), sulfato de dehidroepiandrosterona (S-DHEA), androsteriona, 17-β-estradiol y gonadotropinas.
Resultados: La TLc se asocia con un incremento muscular y una disminución del contenido graso, aun ajustándolo por edad (p<0,05). La densidad ósea sólo se relaciona con los niveles de estradiol y su fracción biodisponible (p<0,05). El S-DHEA y la TLc están asociadas a algunas subescalas del SF-36 (p<0,05).
Conclusiones: La TLc es la hormona que mejor se relaciona con los cambios corporales asociados a la edad; sin embargo, los niveles de andrógenos no están asociados a la densidad ósea. Un descenso en la TLc y el S-DHEA podría estar relacionado con un descenso en la calidad de vida.
Palabras clave: Andrógenos. Testosterona. Varón añoso. Antropometría. Calidad de vida. Densidad ósea.
ABSTRACT
Objetive: To determine whether there was a relationship between sex hormone levels and body composition, bone health, and health-related quality of life in men over 50 years of age.
Material and methods: Transversal study carried out in 230 Spanish male outpatients. Body composition was studied using direct anthropometric measures: height, weight, waistline circumference, dominant arm circumference, tricipital skinfold, dominant arm skinfold, subscapular skinfold. Calculated anthropometric parameters were obtained. Quantitative ultrasound measurements of the calcaneus were performed and bone turnover markers were determined (N-telopeptides urinary excretion and calcium/creatinine urinary rate). Quality of life was studied using the short form 36 questionnaire (SF-36). Blood tests included total testosterone, sex hormone binding-globulin, calculated free testosterone (cFT), dehydroepiandrosterone sulphate (DHEA-S), androstenedione, 17-β-estradiol and gonadotrophins.
Results: cFT was associated with increased muscle and to decreased in fat content, even after adjusting for age (p<0.05). Bone density was only related to estradiol and its bioavailable fraction (p<0.05). DHEA-S and cFT were related (p<0.05) to some SF-36 subscales.
Conclusions: cFT level is most associated with body changes that accompany aging. Androgen levels are not related to bone density. Decline in cFT and DHEA-s levels might be related to decreased quality of life.
Key words: Androgens. Testosterone. Aging male. Anthropometry. Quality of life. Bone density.
Introducción
En el varón la edad lleva consigo un descenso en los niveles de andrógenos. Estos cambios en los niveles hormonales están asociados a un conjunto de manifestaciones clínicas englobadas dentro de un síndrome que ha recibido múltiples denominaciones: andropausia, síndrome ADAM, síndrome PADAM, hipogonadismo de aparición tardía (LOH) y más recientemente síndrome de deficiencia de testosterona (SDT).
Las alteraciones en la calidad de vida asociadas con esta entidad clínica han sido descritas en la reciente definición consensuada del SDT1; sin embargo, la sintomatología del SDT está sujeta a una gran variabilidad interindividual y es muy inespecífica. Síntomas similares pueden ser debidos a otras patologías que son altamente prevalentes en este período de la vida, lo que supone una mayor dificultad a la hora de asociar estos síntomas con el descenso de testosterona.
Durante el envejecimiento la masa magra corporal disminuye y la masa grasa aumenta2. Diversos factores pueden llevar a estos cambios, pero se sabe que los andrógenos tienen un efecto anabolizante que puede influir en estas variaciones3. Del mismo modo, en el varón añoso también se va a dar una mayor pérdida ósea4. Los andrógenos desempeñan un papel importante en el metabolismo óseo y es sabido que la terapia de deprivación androgénica para el cáncer de próstata acelera la osteoporosis5. Sin embargo, el SDT en el varón añoso es generalmente una deficiencia parcial, y su relación con las alteraciones del metabolismo óseo son muy difíciles de establecer6. De forma parecida ocurre con la deprivación androgénica a niveles de castración y la calidad de vida7.
En este estudio estudiamos la relación que existe entre los niveles de hormonas sexuales y la calidad de vida, la composición corporal y la salud ósea en el varón por encima de los 50 años.
Material y métodos
Se realiza un estudio transversal que incluye a 230 pacientes mayores de 50 años que consultan por patología urológica menor o patología general. Como único criterio de inclusión se establece que los pacientes tengan más de 50 años. Los criterios de exclusión fueron: a) cualquier enfermedad aguda o crónica como insuficiencia cardíaca congestiva, episodio de cardiopatía isquémica en el último año, enfermedad neoplásica, accidente cerebrovascular u osteoartritis severa; b) el uso de tratamientos concomitantes o condiciones médicas que pudieran modificar los niveles hormonales; o c) que el paciente consultara por problemas de disfunción eréctil.
Se determinan la edad, características sociodemográficas y la historia médica del paciente. Se estudia también la composición corporal determinada por diversas medidas antropométricas, la salud ósea y la calidad de vida. Dentro de las determinaciones analíticas se obtienen el recuento hematológico, glucemia, GOT, GPT, GGT, ácido úrico, albúmina, perfil lipídico y hormonal.
La muestra de sangre se extrajo entre las 8:00 y las 10:00 horas de la mañana y las determinaciones hormonales incluyeron la testosterona total (TT; chemiluminescent Microparticle Inmunoassay, Abbot Laboratories®), globulina transportadora de hormonas sexuales (SHBG, DELFIA® SHBG kit, WALLAC Oy, turku Finland), testosterona libre calculada mediante la fórmula de Vermeulen (TLc), el sulfato de dehidroepiandrosteriona (S-DHEA), androsteriona, 17-β-estradiol y su fracción biodisponible calculada usando el método matemático descrito por Van de Beld8, hormona estimuladora de folículos (FSH), hormona luteinizante (LH) y prolactina.
Las medidas antropométricas directas se determinaron mediante cinta métrica, báscula y un plicómetro. Se obtienen la talla, el peso, el perímetro de la cintura, la circunferencia del brazo predominante, el pliegue tricipital, el pliegue del brazo predominante y el pliegue subcapsular. Usamos estos parámetros para calcular las siguientes variables antropométricas: índice de masa corporal (IMC), perímetro braquial, área braquial, área muscular braquial, porcentaje de grasa corporal y la relación masa magra/ grasa.
Con el fin de evaluar la calidad ósea se utilizaron ultrasonidos cuantitativos (USC) y marcadores de recambio óseo. La densitometría mediante ultrasonidos fue realizada en el calcáneo con CUBA clinical instruments (McCue Ultrasonic Ltd; Winchester, Reino Unido). El ecógrafo utilizado posee dos transductores (emisor y receptor), situados en contacto directo con el talón utilizando un gel conductor. Se mide la atenuación de ultrasonidos de banda ancha (dB/MHz) a través del hueso. El coeficiente de variación previamente determinado fue de 4,5%. Los marcadores de recambio óseo determinados fueron los N-telopéptidos excretados en orina y la ratio calcio/creatinina.
La calidad de vida fue estudiada mediante la versión española abreviada del cuestionario de salud SF-369. Evalúa 8 escalas de aspectos funcionales y de bienestar que son: el estado de salud en general (autopercepción de la salud en el momento actual), funcionamiento físico (actividad o limitaciones físicas), rol físico (limitación que provoca la salud física en el trabajo y otras actividades cotidianas), dolor corporal (intensidad del dolor y repercusión en las actividades de la vida diaria), vitalidad (sensación de vitalidad versus sensación de cansancio y agotamiento), salud mental (salud mental en general incluyendo depresión, ansiedad y autocontrol), rol emocional (limitación que los problemas emocionales pueden crear en el trabajo y otras actividades cotidianas), funcionamiento social (limitación que la salud o los problemas emocionales pueden ocasionar en su vida social).
Tanto la edad, características sociodemográficas, la historia médica y los niveles de hormonas sexuales fueron utilizados como variables predictivas independientes. Las determinaciones antropométricas, los resultados de la salud ósea y las respuestas referentes a la calidad de vida se utilizaron como variables dependientes. La relación entre calidad de vida, parámetros antropométricos y óseos con la edad, características clínicas y sociodemográficas y niveles hormonales fue estudiada mediante análisis uni y multivariante. Para el análisis univariante se utilizaron el test de Student para dos muestras no apareadas y el método de Pearson cuando seguía una distribución normal y el test U de Mann-Withney y correlación de Spearman cuando no lo eran. El análisis multivariante se realizó mediante una regresión lineal múltiple. Para determinar la contribución de las diferentes variables en los parámetros dependientes se utilizó el coeficiente estandarizado de regresión (beta). El nivel de significación fue p<0,05.
Resultados
Se incluyen en el estudio 230 pacientes; sus características demográficas, sociales y clínicas se especifican en la Tabla 1.
Los valores medios de TT y TLc fueron de 5,1±1,7 ng/ ml y 300±98pmol/l respectivamente. La TT estaba por debajo del rango de la normalidad en 18 pacientes (8%), mientras que 56 (24%) presentaban niveles bajos de TLc (< 0,225 nmol/l).
En el análisis univariante para la composición corporal (Tabla 2 y Tabla 3), la TT y la TLc fueron las únicas hormonas que presentaron una relación estadísticamente significativa con los parámetros antropométricos. Los niveles aumentados de estas hormonas estaban asociados con un incremento de la masa magra corporal y una disminución de la masa grasa. El sedentarismo estaba directamente relacionado con un incremento de la relación masa magra/grasa; también el IMC era mayor en varones con diabetes o hiperlipidemia.
En el análisis multivariante (Tabla 4) la TLc se vio asociada a un aumento en la masa muscular y a un descenso de la masa grasa.
No existe una relación aparente entre los marcadores de recambio óseo y la edad, los niveles hormonales o las características clínicas. En el análisis univariante (correlación de Spearman) la atenuación de ultrasonidos de banda ancha fue solamente significativa en relación con los niveles de estradiol (rs: 0,134; p=0,045) y su fracción biodisponible (rs: 0,146; p=0,031).
En el análisis multivariante solo el estradiol biodisponible apareció asociado de forma significativa a la atenuación de ultrasonidos de banda ancha (r: 0,142; p=0,040).
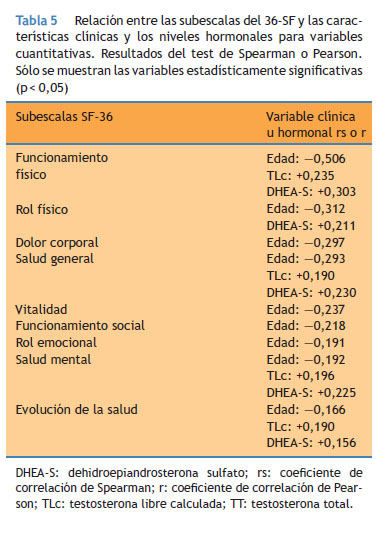
Como se muestra en la Tabla 5 existe una relación inversa significativa entre la edad y cada una de las subescalas del cuestionario de salud 36-SF. El S-DHEA es la hormona que mejor se relaciona con la percepción de salud y calidad de vida según el cuestionario. Sin embargo, la TLc se relaciona con la función física, la salud general, mental y la evolución de la salud. Evaluando las características clínicas el sedentarismo se asocia con puntuaciones más bajas en las diferentes subescalas del cuestionario (Tabla 6). En el análisis multivariante (Tabla 7) la edad es la variable predictora más importante asociada con la percepción de salud y calidad de vida. El S-DHEA fue la hormona que más influía, observando una relación directa entre los niveles plasmáticos de S-DHEA y los scores de calidad de vida. Además, la TLc aparece directamente asociada a la percepción subjetiva de la evolución de la salud del paciente.
Discusión
La teoría actual de que el descenso en los niveles hormonales contribuye al envejecimiento ha sido reforzada en los últimos años. Además, algunas patologías pueden facilitar esta caída en los niveles hormonales. Nuestros datos fueron obtenidos de una población de pacientes del ámbito ambulatorio, por lo que a pesar de que todos ellos presentaban buena salud en términos globales, es posible que nuestros resultados no representen fielmente a la población general.
Los cambios en la composición corporal pueden estar influenciados por modificaciones en el balance hormonal. En nuestro estudio un aumento de la edad aparece asociado a un descenso en la masa muscular y a cambios en la distribución grasa, de tal forma que observamos un descenso en el pliegue tricipital y subescapular y en el área grasa del brazo, y un incremento del perímetro abdominal como consecuencia del cúmulo de grasa visceral (entre otros factores). A pesar de que los cambios en la composición corporal asociados con la edad tienen un origen multifactorial10, existen datos que avalan la influencia del descenso de los andrógenos en estos cambios. En nuestro estudio observamos una asociación entre la TLc y algunos parámetros antropométricos, tanto en el estudio uni como multivariante: mayores niveles de TLc están asociados con mayor masa muscular y menor masa grasa. Existen evidencias epidemiológicas que confirman la relación entre el descenso de la TLc y el descenso en la masa y fuerza muscular11,12, y el papel del tratamiento sustitutivo con testosterona para aumentar la masa muscular13,14. Además, algunos estudios han encontrado que el exceso de grasa abdominal/visceral está asociado con unos menores niveles de testosterona15,16. Algunos autores explican que los niveles bajos de testosterona podrían ser secundarios a los bajos niveles plasmáticos de SHBG encontrados en los varones con obesidad; estos hombres tienen hiperinsulinemia, que a su vez podría explicar en parte los bajos niveles de SHBG17. En nuestro estudio la fracción de la testosterona relacionada con la composición corporal es la TLc, tal y como afirman otros estudios donde se encuentra una asociación de la TLc con la grasa corporal y el IMC8,12.
A pesar de que la osteoporosis es más frecuente en las mujeres añosas, los hombres también pueden presentar una reducción en la masa ósea con la edad4. Nosotros utilizamos la densitometría mediante ultrasonidos para determinar la densidad ósea; muchos estudios, sin embargo, emplean el DEXA (Dual Energy X-Ray Absorptiometry). No obstante, está demostrado que los resultados obtenidos mediante ultrasonografía se correlacionan con los obtenidos mediante DEXA cuando se trata de identificar osteopenia18. Además, la densitometría por ultrasonidos es capaz de distinguir entre un hueso sano y otro osteoporótico, y fue aprobada por la FDA en 1998; la ecografía es fácil de realizar y es más accesible que la DEXA.
Nuestros resultados están en consonancia con la mayoría de las investigaciones realizadas sobre la relación entre la densidad mineral ósea y el estradiol biodisponible. Existe una evidencia cada vez mayor de la relación entre los cambios en las hormonas sexuales como consecuencia de la edad y la osteoporosis en el varón, especialmente en lo que respecta al estradiol biodisponible19-21. Sin embargo, a pesar de que existen estudios que establecen una correlación positiva entre la densidad ósea y las hormonas sexuales19,20, hay otros que no encuentran asociación entre testosterona y la concentración de N-teleopéptidos en orina19,22. La razón de estos resultados contradictorios es desconocida. Las variaciones en la metodología utilizada pueden ser las responsables, así como que la pérdida mineral ósea puede ser secundaria a una variedad de factores, entre los que se incluirían los niveles de hormonas sexuales.
El impacto actual de la deficiencia de testosterona en la calidad de vida no está bien establecido y son pocos los estudios que han investigado esta asociación. Decidimos utilizar el cuestionario SF-36 por ser un método validado para el estudio de la calidad de vida; los ítems son sencillos de responder y además evalúa el funcionamiento físico, psíquico y social del paciente.
Entre las variables sociodemográficas el sedentarismo mostró un impacto negativo en la calidad de vida. En cuanto a las determinaciones hormonales, tanto la TLc como el S-DHEA están asociadas de forma significativa a la calidad de vida. La relación entre calidad de vida y testosterona parece ser más débil que su fracción libre, pues después de ajustar por edad, la TLc es la única asociada con la evolución de la percepción de salud.
En una población de varones añosos con hiperplasia benigna de próstata, utilizando el cuestionario SF-12, los pacientes con bajos niveles de testosterona presentaban peor calidad de vida en términos de bienestar físico y vitalidad. Sin embargo, la salud mental y el bienestar psicológico eran similares a los de los pacientes eugonádicos23.
Los datos referentes a la asociación entre el nivel cognitivo y la testosterona en los varones añosos no son concluyentes, pero sí que se ha observado una relación entre el descenso de la testosterona y cambios cognitivos en pacientes con cáncer de próstata tratados con 12 meses de deprivación androgénica24. También se ha descrito que los suplementos de testosterona asociados al ejercicio mejoraban la esfera física del SF-3625 aunque en un estudio más reciente en varones mayores con niveles bajos de testosterona y 6 meses de tratamiento sustitutivo no se observó mejoría en ninguna de las 9 secciones del cuestionario SF-36 comparado con el grupo placebo14.
A pesar de que en algunos estudios los cuestionarios inespecíficos referentes a la calidad de vida han demostrado relación entre esta y los niveles de testosterona, estos cuestionarios normalmente no son lo bastante sensibles como para detectar cambios físicos o psicológicos causados por un déficit de andrógenos. Por ejemplo, el cuestionario SF-36 no incluye ninguna cuestión referente al funcionamiento sexual, el cual es sensible a un descenso de andrógenos y que verdaderamente afecta a la calidad de vida26. Por tanto, se deberían utilizar cuestionarios más específicos para el estudio del déficit de testosterona, especialmente en el varón añoso. En este aspecto, la escala de síntomas del varón añoso (AMS) se ha desarrollado para la medida específica de la severidad de los síntomas asociados al envejecimiento y el impacto de estos en la percepción de la salud y la calidad de vida27.
Pensamos que es importante destacar la existencia de una fuerte asociación entre el S-DHEA y algunos dominios de la calidad de vida después de ajustarlos por la edad. Conforme el varón envejece, los niveles del S-DHEA descienden más que otras hormonas, aunque el papel fisiológico de esta hormona no se conoce por completo. Niveles bajos de S-DHEA se han relacionado con enfermedades graves, incluyendo enfermedad coronaria, diabetes, cáncer, obesidad y sida28. Hay quien piensa que el S-DHEA es la fuente de la eterna juventud; sin embargo, se ha visto que el tratamiento con DHEA no muestra beneficios para los síntomas que aparecen con la edad respecto al placebo29.
Conclusiones
Un descenso en los niveles de TLc está asociado de forma significativa a cambios corporales que se dan con el envejecimiento. Niveles bajos de andrógenos secundarios a la edad avanzada no están asociados a una merma en la calidad ósea; sin embrago, los niveles de estradiol biodisponible sí están relacionados con la densidad ósea. El descenso en el S-DHEA y la TLc parecen influir en la calidad de vida, tanto en los aspectos físicos y psíquicos como en los sociales, a pesar de que la asociación con la TLc es débil.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Nieschlag E, Swerdloff R, Behre HM, Gooren LJ, Kaufman JM, Legros JJ, et al. Investigation, treatment and monitoring of late-onset hypogonadism in males. ISA, ISSAM, and EAU recommendations. Eur Urol. 2005; 48:1-4. [ Links ]
2. Kyle UG, Genton L, Hans D, Karsegard L, Slosman DO, Pichard C. Age-related differences in fat-free mass, skeletal muscle, body cell mass and fat mass between 18 and 94 years. Eur J Clin Nutr. 2001; 55:663-72. [ Links ]
3. Bhasin S, Tenover JS. Age-associated sarcopenia-issues in the use of testosterone as an anabolic agent in older men. J Clin Endocrinol Metab. 1997; 82:1659-60. [ Links ]
4. Orwoll ES, Klein RF. Osteoporosis in men. Endocr Rev. 1995; 16:87-116. [ Links ]
5. Daniell HW. Osteoporosis after orchiectomy for prostate cancer. J Urol. 1997; 157:439-44. [ Links ]
6. Rapado A, Hawkins F, Sobrinho L, Díaz-Curiel M, Galvao-Telles A, Arver S, et al. Bone mineral density and androgen levels in elderly males. Calcif Tissue Int. 1999; 65:417-21. [ Links ]
7. Dacal K, Sereika SM, Greenspan SL. Quality of life in prostate cancer patients taking androgen deprivation therapy. J Am Geriatr Soc. 2006; 54:85-90. [ Links ]
8. Van den Beld AW, De Jong FH, Grobbee DE, Pols HA, Lamberts SW. Measures of bioavailable serum testosterone and estradiol and their relationships with muscle strength, bone density, and body composition in elderly men. J Clin Endocrinol Metab. 2000; 85:3276-82. [ Links ]
9. Alonso J, Regidor E, Barrio G, Prieto L, Rodríguez C, de la Fuente L. Valores poblacionales de referencia de la versión española del cuestionario de salud MOS SF-36. Med Clin (Barc). 1998; 111:410-6. [ Links ]
10. Morley JE, Baumgartner RN, Roubenoff R, Mayer J, Nair KS. Sarcopenia. J Lab Clin Med. 2001; 137:231-4. [ Links ]
11. Roy TA, Blackman MR, Harman SM, Tobin JD, Schrager M, Metter EJ. Interrelationships of serum testosterone and free testosterone index with FFM and strength in aging men. Am J Physiol Endocrinol Metab. 2002; 283:E284-94. [ Links ]
12. Vermeulen A, Goemaere S, Kaufman JM. Testosterone, body composition and aging. J Endocrinol Invest. 1999; 225 Suppl:110-6. [ Links ]
13. Snyder PJ, Peachey H, Hannoush P, Berlin JA, Loh L, Lenrow DA, et al. Effect of testosterone treatment on body composition and muscle strength in men over 65 years of age. J Clin Endocrinol Metab. 1999; 84:2647-53. [ Links ]
14. Emmelot-Vonk MH, Verhaar HJ, Nakhai Pour HR, Aleman A, Lock TM, Bosch JL, et al. Effect of testosterone supplementation on functional mobility, cognition, and other parameters in older men: a randomized controlled trial. JAMA. 2008; 299:39-52. [ Links ]
15. Couillard C, Gagnon J, Bergeron J, Leon AS, Rao DC, Skinner JS, et al. Contribution of body fatness and adipose tissue distribution to the age variation in plasma steroid hormone concentrations in men: the HERITAGE family study. J Clin Endocrinol Metab. 2000; 85:1026-31. [ Links ]
16. Seidell JC, Björntorp P, Sjöström L, Kvist H, Sannerstedt R. Visceral fat accumulation in men is positively associated with insulin, glucose, and C-peptide levels, but negatively with testosterone levels. Metabolism. 1990; 39:897-901. [ Links ]
17. Kaufman JM, Vermeulen A. Declining gonadal function in elderly men. Baillières Clin Endocrinol. 1997; 11:189-98. [ Links ]
18. Agren M, Karellas A, Leahey D, Marks S, Baran D. Ultrasound attenuation of the calcaneus: A sensitive and specific discriminator of osteopenia in postmenopausal women. Calcif Tissue Int. 1991; 48:240-4. [ Links ]
19. Khosla S, Melton LJ, Atkinson EJ, O'Fallon WM, Klee GG, Riggs BL. Relationship of serum sex steroid levels and bone turnover markers with bone mineral density in men and women: a key role for bioavailable estrogen. J Clin Endocrinol Metab. 1998; 83:2266-74. [ Links ]
20. Kuchuk NO, van Schoor NM, Pluijm SM, Smit JH, de Ronde W, Lips P. The association of sex hormone levels with quantitative ultrasound, bone mineral density, bone turnover and osteoporotic fractures in older men and women. Clin Endocrinol (Oxf). 2007; 67:295-303. [ Links ]
21. Szulc P, Munoz F, Claustrat B, Garnero P, Marchand F, Duboeuf F, Delmas PD. Bioavailable estradiol may be an important determinant of osteoporosis in men: the MINOS study. J Clin Endocrinol Metab. 2001; 86:192-9. [ Links ]
22. Fukui M, Ose H, Nakayama I, Hosoda H, Asano M, Kadono M, et al. Association between serum testosterone concentration and collagen degradation fragments in men with type 2 diabetes mellitus. Metabolism. 2007; 56:1228-32. [ Links ]
23. Finas D, Bals-Pratsch M, Sandmann J, Eichenauer R, Jocham D, Diedrich K, et al. Quality of life in elderly men with androgen deficiency. Andrologia. 2006; 38:48-53. [ Links ]
24. Salminen EK, Portin RI, Koskinen A, Helenius H, Nurmi M. Associations between serum testosterone fall and cognitive function in prostate cancer patients. Clin Cancer Res. 2004; 10:7575-82. [ Links ]
25. Katznelson L, Robinson MW, Coyle CL, Lee H, Farrell CE. Effects of modest testosterone supplementation and exercise for 12 weeks on body composition and quality of life in elderly men. Eur J Endocrinology. 2006; 155:867-75. [ Links ]
26. Sánchez-Cruz JJ, Cabrera-León A, Martín-Morales A, Fernández A, Burgos R, Rejas J. Male erectile dysfunction and health-related quality of life. Eur Urol. 2003; 44:245-53. [ Links ]
27. Heinemann LA, Moore C, Dinger JC, Stoehr D. Sensitivity as outcome measure of androgen replacement: the AMS scale. Health Qual Life Outcomes. 2006; 30:23. [ Links ]
28. Flaherty JH, Morley JE. Anti-aging. Clin Geriatr Med. 2004; 20:xi-v. [ Links ]
29. Arlt W. Dehydroepiandrosterone and ageing. Best Pract Res Clin Endocrinol Metab. 2004; 18:363-80. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: jaba@pulso.com
(J.M. Martínez-Jabaloyas)
Recibido el 18 de Abril de 2011
Aceptado el 27 de Abril de 2011