Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.34 no.3 abr. 2010
El papel del catéter de Swan-Ganz en la actualidad
The current role of the Swan-Ganz catheter
A. Carrillo López, M. Fiol Sala y A. Rodríguez Salgado
Servicio de Medicina Intensiva, Unidad Coronaria, Hospital Universitario Son Dureta, Palma de Mallorca Baleares, España
Dirección para correspondencia
RESUMEN
Han pasado más de 3 décadas desde la introducción del catéter de Swan-Ganz (SG) como técnica de valoración hemodinámica del paciente crítico. Aún se plantean dudas sobre la necesidad de su uso en la práctica clínica por su posible relación con un aumento de la mortalidad y la aparición de otras técnicas alternativas con una probable menor morbimortalidad.
La introducción de la técnica de ecocardiografía Doppler ha sido fundamental en la valoración hemodinámica y etiológica del paciente crítico y ha permitido aclarar muchas situaciones clínicas sin respuesta terapéutica aceptable.
En esta revisión se pretende exponer las bondades y las limitaciones del catéter de SG como técnica gold standard en monitorización hemodinámica del paciente crítico. Creemos que la combinación de distintas técnicas, sin ser excluyentes, deben ayudarnos a responder en el paciente inestable hemodinámicamente la causa etiológica, determinar qué perfil hemodinámico presenta y cuál es el componente principal que genera la inestabilidad hemodinámica para seleccionar adecuadamente el tratamiento inicial y valorar el grado de respuesta a la decisión tomada.
Palabras clave: Función cardiovascular. Monitorización hemodinámica. Catéter de Swan-Ganz. Catéter de la arteria.
ABSTRACT
Nearly forty years ago, Swan and Ganz introduced pulmonary artery catheterization to monitor the hemodynamic status of critical patients. The need for pulmonary artery catheterization in clinical practice has been questioned because it may be related to increased mortality and because alternative techniques that will probably cause less morbidity and mortality have been developed.
The introduction of color Doppler echocardiography has been fundamental in the hemodynamic and etiologic evaluation of critical patients and has made it possible to clarify many clinical situations in which the response to treatment was unacceptable.
This review aims to discuss the advantages and drawbacks of the Swan-Ganz catheter as the gold standard for monitoring hemodynamics in critical patients. We believe that combining the available techniques should help us evaluate the hemodynamics in critical patients and determine the cause of hemodynamic instability so we can select the most appropriate initial treatment and evaluate the subsequent response.
Key words: Cardiovascular function. Hemodynamic monitoring. Swan-Ganz catheterization. Pulmonary artery catheter.
Introducción
La cateterización de la arteria pulmonar se describió en 19451,2 como una técnica útil para la valoración de la insuficiencia mitral. En 19703 se introdujo como una herramienta diagnóstica que podía utilizarse a la cabecera del enfermo, y se extendió su uso en las unidades de cuidados intensivos sin haberse realizado una evaluación rigurosa, como ha ocurrido con muchos otros procedimientos en la práctica clínica4.
El catéter de Swan-Ganz (SG) proporciona datos hemodinámicos con una mayor sensibilidad diagnóstica que los datos clínicos en la valoración de la gravedad del fallo cardíaco1-7. Pone en evidencia datos que no pueden sospecharse desde un punto de vista clínico en la evaluación perioperatoria en pacientes con enfermedad coronaria, enfermedad vascular asociada8 y en caso de cirugía mayor en pacientes añosos9. Presenta, además, una mayor precisión en la estimación de la precarga que la presión venosa central (PVC) en pacientes con disfunción sistólica ventricular10,11. Todos estos datos hacen pensar que su información podría influir positivamente en el pronóstico de los pacientes.
A mediados de los 80 se diseñaron estudios clínicos aleatorizados para evaluar la eficacia del catéter de SG. Ninguno de estos estudios fue lo suficientemente convincente dado el escaso tamaño de la muestra, la confusión en la definición del tratamiento asociado y la presencia de poblaciones muy heterogéneas. Unos concluían que no aportaba beneficio o lo asociaban a un empeoramiento clínico y otros concluían que su utilización mejoraba el pronóstico12.
En 1996, Connors et al13 publicaron el resultado de un estudio multicéntrico no aleatorizado y retrospectivo con la inclusión de 5.735 pacientes ingresados en unidades de cuidados intensivos, y concluyeron que los pacientes monitorizados con catéter de SG presentaron mayor mortalidad y consumo de recursos. Esta publicación se basaba en datos recogidos en parte en el estudio SUPPORT14, que se diseñó para mejorar la decisión tomada en el proceso final de la enfermedad y reducir la futilidad terapéutica, y en el que incluían a pacientes con una mortalidad estimada a los 6 meses del 47%. Los pacientes monitorizados con catéter de SG presentaban un aumento de mortalidad durante la hospitalización, excepto el grupo con fallo cardíaco. También evidenció diferencias en la práctica clínica entre centros y profesionales. La recogida de datos se realizó entre 1989 y 1994 en 5 hospitales americanos y se incluyeron pacientes con una o más de las siguientes categorías diagnósticas: insuficiencia respiratoria aguda, enfermedad obstructiva crónica, fallo cardíaco congestivo, cirrosis, coma no traumático, cáncer de colon con metástasis hepática, cáncer de pulmón no de "células pequeñas" (estadio III o IV) y fallo multiorgánico o sepsis.
En 1997 se publicó el resultado de una conferencia de consenso que concluyó que los estudios realizados presentaban una baja base científica. No se establecieron recomendaciones restrictivas del uso del catéter de SG15.
Posteriormente al estudio observacional de Connors et al, se realizaron 3 metaanálisis con los ensayos disponibles hasta el momento16-18. En este último se observó una tendencia en la reducción de la mortalidad. En ninguno de los estudios incluidos, la indicación del catéter de SG se había hecho de una manera estrictamente aleatorizada. No se encontraron diferencias de mortalidad ni se acortaron las estancias hospitalarias en relación con el uso del catéter de SG. Por el contrario, se observó un aumento en la morbilidad con un mayor empleo de fármacos inotrópicos y vasodilatadores.
Fundamentos de la medición del gasto cardíaco por termodilución
Desde la introducción del catéter de SG, la termodilución se ha convertido en el gold standard para la medición del gasto cardíaco (GC) en la práctica clínica. El termistor situado en la arteria pulmonar mide la temperatura sanguínea y obtiene una curva de dilución a partir de la cual se calcula el GC mediante la ecuación de Stewart-Hamilton (figura 1).

Figura 1. Representación gráfica de la curva de termodilución
para el cálculo del gasto cardíaco.
Una curva de dilución normal muestra una elevación brusca y de gran magnitud, y a continuación una lenta reducción hasta el nivel basal de temperatura. En la parte final de la curva, el nivel de la señal es bajo, hecho que hace que empeore la proporción entre el ruido y la señal. La mayoría de los ordenadores de medición del GC utilizan un algoritmo para calcular esta parte de la curva en lugar de medirla (figura 1). Se obtienen los puntos correspondientes al 70 y al 35% de la caída máxima de la temperatura sanguínea y se definen 3 áreas. La última se caracteriza por la magnitud relativamente baja de señal, con un cociente señal/ruido muy bajo, y aumenta el error de cálculo del GC, por lo que se asume que es igual al área II.
Las fuentes potenciales de ruido pueden estar localizadas en cualquier nivel (termistor, amplificador, procesador, cables de conexión, etc.), así como en la propia variación térmica de la sangre pulmonar en relación con la ventilación mecánica19. Podemos aumentar la señal y minimizar el ruido con la utilización de inyecciones intravenosas de volumen mayor o soluciones frías. Habitualmente se utilizan bolos intravenosos de 5-10 cm3 de soluciones de suero fisiológico o glucosado al 5% fríos (0-5°C) o de 10 cm3 a temperatura ambiente (20-23°C), teniendo la preocupación de introducir en el monitor de GC el coeficiente de corrección adecuado que variará según el modelo de catéter de SG utilizado, el volumen administrado y la temperatura seleccionada20. La administración de bolos a temperatura fría permite administrar menos volumen, pero puede modificar la actividad del nodo sinusal por reducción de la frecuencia cardíaca y modificar en el momento de la lectura el verdadero GC del paciente21. Si el catéter de la arteria pulmonar dispone de una vía adicional venosa por la que se está infundiendo algún suero, éste debería interrumpirse previamente dado que podría provocar infraestimación del GC22,23.
Hay que tener en cuenta que el ruido como fuente de imprecisión puede estar generado por la propia enfermedad del paciente. En caso de insuficiencia tricuspídea grave en que el flujo retrógrado atenúa el pico térmico, aumenta el área bajo la curva por la prolongación de la curva de lavado debida a la recirculación del volumen inyectado, lo que infraestima el valor. La presencia de un cortocircuito, tanto derecha-izquierda como izquierda-derecha, puede producir falsa elevación en la medida del GC. En el primer caso debido al paso de parte del trazador térmico a cámara ventricular izquierda. En el segundo caso por dilución del trazador térmico debido a sobrecarga ventricular y a dilatación ventricular derecha.
En ocasiones, el catéter de SG puede quedar muy introducido en la arteria pulmonar, con lo que el termistor está parcialmente aislado del torrente circulatorio y no puede detectar los cambios de la temperatura de la sangre, y se obtienen curvas de dilución pequeñas que sobrestiman el GC.
Durante la ventilación mecánica las oscilaciones de las presiones intratorácicas y de los volúmenes pulmonares provocan cambios cíclicos en la precarga y la poscarga y, por tanto, en el GC24, que inducen variaciones hasta del ±30% respecto al valor medido25-30.
Técnicas alternativas del catéter de Swan-Ganz de medición del gasto cardíaco
Podemos medir el GC mediante la utilización de otros procedimientos técnicos, que se han implantado en la práctica clínica y han demostrado su fiabilidad al compararse con la determinación del GC por termodilución:
Medición continua del GC por termodilución: Se utiliza un filamento calentado mediante pulsos aleatorizados situado en la porción del catéter en el ventrículo derecho (VD). Un termistor de respuesta rápida analiza los cambios pasajeros de la temperatura y calcula el GC. Dado que la sangre resulta más fácilmente dañada por el calentamiento que por el enfriamiento, la cantidad de energía que se puede administrar con seguridad es menor que la energía administrada mediante la inyección de suero frío. Por consiguiente, el pulso de calor resultante es mucho menor, lo que empeora la precisión y la relación señal/ruido. Para superar este problema, se presentan resultados promediados en lugar de resultados individuales de la medición, que mejoran la precisión a expensas de un aumento en el tiempo de respuesta del sistema31-34.
Análisis del CO2 espirado y técnicas de reinhalación para la determinación del GC: Se halló una correlación estrecha entre la técnica de reinhalación con la presión parcial de dióxido de carbono (pCO2 ) arterial y el método de termodilución en una población variada de pacientes críticos. Por desgracia, el método de reinhalación para la determinación del GC es una técnica dificultosa que requiere mucho tiempo y que sólo se puede aplicar en pacientes intubados, lo que limita su uso sistemático en las unidades de cuidados intensivos. Para reducir las complicaciones técnicas de este sistema se ha desarrollado la técnica de reinhalación parcial para la medición del CO2 . Esta técnica es un método no invasivo que utiliza el principio indirecto de Fick (NICO®, Novametrix) en pacientes que reciben ventilación mecánica35-37, aunque infraestima la determinación del GC con un error porcentual de medida del 37%38,39.
Sistema PiCCO (Pulse-Induced Contour Cardiac Output): Es un sistema de monitorización hemodinámica invasiva capaz de medir el GC por termodilución transpulmonar y estimar la precarga por medio del volumen sanguíneo intratorácico40. Existe evidencia de que el volumen sanguíneo intratorácico es independiente de las variaciones de la presión intratorácica y la distensibilidad ventricular, razón por la que podría ser mejor estimador de la precarga cardíaca que la presión pulmonar enclavada (PPE)41-45, especialmente en pacientes bajo soporte ventilatorio mecánico invasivo46. Este método requiere la inserción de un catéter venoso central con un sensor capaz de medir la temperatura de la solución inyectada y un catéter arterial que posee un sensor de temperatura en su extremo distal. El monitor PiCCO calcula el GC por análisis de la curva de termodilución transpulmonar usando la ecuación de Stewart-Hamilton. A partir de la curva se obtiene el tiempo medio de tránsito y el tiempo de la pendiente de descenso exponencial del indicador térmico. El producto del GC por el tiempo medio de tránsito es igual al volumen térmico intratorácico total, y el producto del GC por la pendiente de descenso exponencial es el equivalente al volumen térmico pulmonar total. La resta de ambos corresponde al volumen de las 4 cámaras cardíacas al final de la diástole.
Uchino et al47 en un estudio epidemiológico prospectivo multicéntrico observaron que el uso de un sistema de monitorización u otro varía según el tipo de paciente: aumenta el uso del catéter de SG en los pacientes con shock cardiogénico y el sistema PiCCO en los pacientes sépticos. Una vez ajustadas las variables de confusión, la elección de una técnica u otra no implicaba diferencias a nivel pronóstico. El balance hídrico positivo fue un predictor independiente de mortalidad, como se demuestra en otros estudios en situaciones clínicas variadas: shock séptico48, edema pulmonar49, síndrome compartimental abdominal50, trauma y shock hemorrágico51, hepatectomía52 y resección colónica53.
Impedanciometría54: La impedancio-cardiografía permite las mediciones de parámetros hemodinámicos, como por ejemplo el GC, el volumen sistólico y la resistencia vascular sistémica (RVS) de forma no invasiva. La técnica mide las variaciones de la resistencia eléctrica por el paso del flujo sanguíneo durante la sístole y la diástole. Su aplicación en el paciente crítico es limitada con resultados discrepantes según el grupo de pacientes incluidos55-57.
Ecocardiografía58,59: La ecocardiografía en modo-M, bidimensional o tridimensional vía transtorácica o transesofágica junto con la aplicación del Doppler proporcionan una importante y una relevante información de la función cardíaca del paciente crítico. Proporcionan información de los datos volumétricos (volumen latido, GC, volumen y fracción de regurgitación, índice flujo pulmonar-sistémico, etc.), de los gradientes de presión (instantáneo máximo, gradiente medio, etc.), de la estimación de las áreas valvulares y de las presiones intracardíacas (presión de la arteria pulmonar, presión de la aurícula izquierda [PAI] y presión telediastólica ventricular [PTDV] izquierda) con una precisión validada con datos derivados de métodos invasivos60.
Actualmente, los avances tecnológicos han permitido el desarrollo de sondas eco-Doppler esofágicas que permiten una monitorización mínimamente invasiva del GC mediante la medición continua de la velocidad del flujo sanguíneo y el diámetro de la aorta torácica descendente, y desprecian el flujo diastólico en la aorta descendente.
Para evitar infraestimar la medición, el software incrementa en un 30% el cálculo que correspondería a la estimación teórica del GC del flujo de la circulación sistémica que se distribuye hacia los vasos supraaórticos. A pesar de la fiabilidad de las medidas en comparación con la técnica de termodilución, su aplicación en las unidades de cuidados intensivos es escasa debido a las interferencias generadas por la movilización y a la necesidad de mantener al paciente adecuadamente sedado61,62.
Limitaciones del gasto cardíaco en la valoración de la función cardíaca
Desde un punto de vista clínico es importante establecer un correcto diagnóstico para poder optimizar adecuadamente todas aquellas variables que influyen en el GC, sin limitarnos exclusivamente en el GC para valorar la función cardíaca. En estado basal el GC en reposo tiene amplias variaciones, por lo que es un parámetro muy poco sensible de la función cardíaca. Cuando está bajo, representa un trastorno grave de la función circulatoria y no necesariamente de la contractilidad. A pesar de esta limitación, permite valorar la principal función del corazón: el suministro de sangre a los tejidos (figura 2).
En los primeros intentos de separar la contractilidad de los efectos de la carga en el estudio de la función ventricular, se utilizó la relación de Frank-Starling: por un lado, relación entre la presión de llenado ventricular o el volumen telediastólico y, por otro lado, la actividad mecánica ventricular determinada mediante la presión desarrollada o el volumen de sangre expulsado o el producto de estas 2 variables (trabajo sistólico) (figura 3).
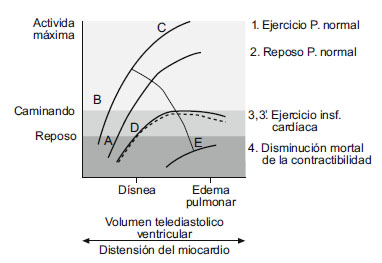
Figura 3. Curvas de Frank-Starling. Relación función ventricular
y distensión miocárdica (volumen telediastólico ventricular)
en distintas situaciones clínicas.
Para obtener una evaluación más exacta de la función cardíaca debemos estimar la presión del llenado ventricular además del GC o del volumen latido. La presión de llenado ventricular equivale a la PTDV. Cuando no hay enfermedad valvular auriculoventricular asociada, esta presión refleja la presión auricular media o la presión auricular justo al inicio de la contracción ventricular. Para el ventrículo izquierdo (VI) la presión capilar pulmonar (PCP) media y para el VD la PVC representan valores aproximados pero bastante precisos de la PTDV, con excepción de los casos en que existe una onda "a" elevada o una onda "v" grande en la curva de presión ventricular. Si existe una onda "a" elevada, la PTDV será superior a la presión auricular media, y en el caso de una onda "v" grande, la presión auricular media será superior a la PTDV. Cuando la resistencia vascular pulmonar (RVP) es normal, la presión diastólica de la arteria pulmonar es parecida a la PCP.
Sin embargo, un aumento en la presión de llenado ventricular no necesariamente indica un aumento en el volumen telediastólico ventricular, dado que la distensibilidad ventricular puede estar disminuida (figura 4). La disminución de la distensibilidad ventricular puede deberse a diversos factores: enfermedad del pericardio, enfermedad restrictiva, disfunción diastólica, hipertrofia cardíaca o isquemia miocárdica.

Figura 4. A) Influencia de la distensibilidad en la presión telediastólica
ventricular. B) Curva de presión intraventricular.
En estas circunstancias la presión de llenado del VI se eleva, mientras que el volumen telediastólico ventricular permanece normal. Los cambios en las relaciones presión-volumen diastólicas del VI complican la interpretación de la presión de llenado ventricular y la evaluación de la función cardíaca.
Debido a los cambios en la distensibilidad ventricular es evidente que la medición del volumen telediastólico ventricular es mejor que la medición de la presión de llenado para valorar la precarga ventricular.
Hellems en 194863 estableció, a nivel experimental, que en condiciones normales existe una continuidad entre la PPE y la PAI, y que ambas se corresponden con la PTDV izquierda. Lozman et al64 en 1974 confirmaron este hallazgo en pacientes quirúrgicos estables, salvo cuando se utilizaba presión positiva espiratoria final (PEEP) elevada. De esta manera, se ha considerado en la práctica diaria la PPE como un indicador de volemia y precarga del VI. Sin embargo, entre la PPE, la PAI y la PTDV izquierda puede haber obstáculos o interacciones que impidan esta equivalencia65,66:
colocación de la punta del catéter de SG en la arteria pulmonar en la zona I o II de West;
aumento de la PTDV izquierda por una hipovolemia marcada;
PEEP elevada (o presencia de auto-PEEP);
obstrucción de arterias o venas pulmonares;
y afectación de la válvula mitral o aórtica.
Estos estudios iniciales han conllevado a la instauración y a la permanencia en la práctica clínica de uno de los errores de concepto más extendidos en la utilización del catéter de SG para discriminar el mecanismo del edema pulmonar: considerar que la PCP hidrostática es equiparable a la PPE. La PPE es la medida de la presión en las venas pulmonares, que con frecuencia puede corresponder a la PAI y en condiciones normales puede corresponder a la PTDV izquierda67. La medición de la PCP a nivel experimental se identifica con un punto de inflexión entre la presión arterial pulmonar (PAP) y la PPE con flujo 0. La PPE es una estimación a la baja de la PCP, datos superponibles cuando la resistencia de las venas pulmonares es prácticamente nula.
Al contrario de lo que ocurre en la circulación sistémica, las resistencias venosas contribuyen en un 40% a las resistencias totales pulmonares y esta proporción aumenta en situaciones de sepsis e hipoxia, que cursan con intensa venoconstricción pulmonar68,69. Garr et al70 en 1966 determinaron la siguiente ecuación que relaciona la PPE con la PCP (figura 5):
![]()

Figura 5. Estimación de la presión capilar pulmonar: punto
de inflexión entre la presión arterial pulmonar y la presión
pulmonar enclavada con flujo 0.
La precarga del VI está determinada por la interacción del estiramiento de las fibras miocárdicas al final de la diástole con la distensibilidad "estructural" del VI y la presión yuxtacardíacas, y puede estimarse a pie de cama a través de la ecocardiografía mediante la determinación del volumen telediastólico ventricular izquierdo (VTDVI).
Como hemos comentado, la PTDV izquierda no puede tomarse como referencia del VTDVI en todos los casos71. Las circunstancias habituales del paciente crítico, como la fiebre, las variaciones en la osmolaridad, la infusión de inotropos, la isquemia, la sepsis y las modificaciones de la presión yuxtacardíaca (PEEP), modifican la relación curvilínea entre presión y volumen (distensibilidad) del VI.
La ecocardiografía facilita no sólo imágenes estructurales del corazón y grandes vasos, sino también información funcional, derivada fundamentalmente de mediciones de las dimensiones (áreas) de las cavidades cardíacas en distintos momentos del ciclo cardíaco72,73, así como la valoración tanto de la función sistólica como diastólica. Tanto en la enfermedad isquémica como en la enfermedad séptica se presentan modificaciones en la función sistólica-diastólica aguda, pudiendo estar influidas por la infusión de catecolaminas, el soporte ventilatorio mecánico y la inducción de isquemia.
La presencia de disfunción miocárdica en el contexto de un proceso séptico es conocida desde hace años74. A pesar de la intensa investigación en estos últimos años, nuestro conocimiento fisiopatológico de este proceso es escaso75-82.
Parker et al83,84 observaron en pacientes sépticos valorados por catéter de SG y gammagrafía un perfil hemodinámico y morfológico diferente entre los pacientes supervivientes y los pacientes fallecidos. En los pacientes supervivientes se comprobó un aumento de los volúmenes sistólicos y diastólicos tanto del VI como del VD, así como una disminución de la fracción de eyección (FE). Por lo contrario, los pacientes fallecidos presentaban volúmenes y FE normales. Estas alteraciones se detectaron entre el 2.o y el 5.o día, pero fueron reversibles en la mayoría de los casos entre el 7.o y el 10.o día.
La explicación de esta paradoja según Walley85 se debe a una adaptación de las cavidades cardíacas, que se dilatan para preservar el volumen latido y provocan disminución de la FE. El hecho de que esta adaptación no se origine indica la existencia de disfunción diastólica grave que impide el aumento de volúmenes cardíacos. Los cambios estructurales, como una infiltración inflamatoria o un edema, el aumento de la rigidez miocárdica por el uso de dosis elevadas de catecolaminas y la interdependencia con el VD causada por la hipertensión pulmonar en el contexto de un síndrome de distrés respiratorio del adulto86, se han propuesto como explicación de esta disfunción diastólica.
En la literatura médica se han publicado excelentes correlaciones entre la ecocardiografía y el catéter de SG en la determinación del GC en pacientes tanto cardiológicos como médicos, independientemente de la presencia o la ausencia de ventilación mecánica con o sin PEEP, soporte inotrópico, etc87-91.
Para poder tener una evaluación más completa de la función cardíaca debemos completar el estudio y valorar la poscarga, que se define como la tensión o el estrés desarrollado por el VI durante la sístole. Este estrés depende tanto de factores intrínsecos (presión, radio y espesor de la pared del VI) como de factores extrínsecos (impedancia aórtica), y es máxima al final de ésta (contracción isovolumétrica), aunque en pacientes cardiópatas el máximo estrés sistólico puede ser variable92.
La valoración de la poscarga en la práctica clínica se realiza obteniendo la RVS mediante el GC, de la diferencia de presiones entre la aorta y la presión media de las cámaras auriculares:
![]()
![]()
En la estimación de la poscarga realizada con catéter de SG, sólo se considera la RVS (factor extrínseco), que informa tan sólo del tono vascular periférico y nos aporta un dato fijo. Niega la naturaleza pulsátil del flujo. Con la ecocardiografía transesofágica (ETE), a través de simples mediciones del VI podría ser posible estimar de forma más integrada la poscarga. Se calcula el estrés de la pared sistólica mediante la aplicación de la ecuación de Laplace93,94 (estrés = P×r/2h); donde P: presión intracavitaria, r: radio de la cavidad en diástole, h espesor de la pared), que considera tanto factores extrínsecos como factores intrínsecos del VI.
Podemos realizar la valoración de la función ventricular de forma independiente de las condiciones de carga a través de la elastancia telesistólica95, que utiliza la curva de la relación presión-volumen que se desplaza hacia la izquierda si aumenta la contractilidad y hacia la derecha si ésta disminuye. La gran limitación que presenta es que necesitamos un catéter a nivel ventricular izquierdo, lo que impide su uso en la práctica clínica, aunque sea un referente a nivel investigacional. Dos modificaciones realizadas sobre esta relación, consistentes en la sustitución de la presión de eyección del VI por la presión arterial con un catéter en la arteria femoral y los volúmenes del VI por las determinaciones del área ventricular mediante ETE de forma automática, se encuentran en evaluación clínica con aparentes buenos resultados96 (figura 6).
¿Qué otra información podríamos evaluar?
La función de bomba del corazón se expresa no sólo en el GC, sino también en la recíproca del gasto, es decir, la diferencia arteriovenosa de O2 (AVO2 ). La ecuación de Fick puede modificarse en: GC = consumo de O2 (VO2)/AVO2 ; así que AVO2 = VO2 /GC. La diferencia AVO2 representa el grado de extracción de O2 por los tejidos periféricos y el grado con que la sangre circulante satisface realmente las necesidades metabólicas del organismo (figura 7).

Figura 7. Representación gráfica de la diferencia arteriovenosa
de O2 (línea punteada) y el índice cardíaco (línea continua) en
individuos normales en reposo, en ejercicio y en pacientes
con insuficiencia cardíaca.
Algunos estudios observacionales han mostrado niveles de saturación venosa de O2 (SvO2 ), GC indexado, PAm y aporte de O2 (DO2 ) más elevados en pacientes con shock séptico que sobreviven que en los pacientes no supervivientes97-99.
En la sepsis hay una marcada alteración del flujo sanguíneo en la microcirculación100-102, atribuido a disfunción endotelial, a incremento de la adherencia leucocitaria, a fenómenos microtrombóticos, a alteraciones reológicas y a la aparición de shunts funcionales. Alteración del flujo sanguíneo que dificulta la extracción de O2 103,104 y se asocia a la aparición del fracaso multiorgánico y al fallecimiento105.
En el intento de optimización de estas variables debemos tener en cuenta no empeorar aún más la ya deteriorada microcirculación por obstinarnos en normalizar un número, y agravar el cuadro clínico por la aparición de efectos secundarios al tratamiento instaurado106, dado que tanto con la optimización del GC, del DO2 , de la SvO2 y de la PAm podemos no mejorar la extracción de O2 a nivel tisular. La alteración en la microcirculación puede ocurrir independientemente de la presión arterial, sin estar demostrado que con mantener una PAm superior o igual a 65mmHg consigamos una adecuada perfusión tisular104,106-109.
¿Qué cuestiones debo plantearme ante un paciente inestable hemodinámicamente?
La combinación de distintas técnicas, sin ser excluyentes, debe ayudarnos a responder a 3 cuestiones fundamentales que debemos plantearnos ante un paciente inestable hemodinámicamente:
causa etiológica;
determinar qué perfil hemodinámico presenta y cuál es el componente principal que genera la inestabilidad hemodinámica,
y seleccionar adecuadamente el tratamiento inicial y valorar el grado de respuesta a la decisión tomada.
La ecocardiografía nos aporta información inmediata, fiable y a veces concluyente de estos 3 puntos, pero presenta limitaciones en cuanto a la valoración de los datos hemodinámicos de forma evolutiva, así como en la monitorización de los cambios inducidos tras instauración del tratamiento específico aplicado.
Una vez planteados estos interrogantes, la siguiente pregunta más frecuente ante un paciente hemodinámicamente inestable es su estado de volemia. En este sentido, el catéter de SG ha sido de gran utilidad y ha permitido establecer perfiles hemodinámicos. De todas las medidas obtenidas por el catéter de SG, la PPE es la más influyente en las decisiones clínicas:
como indicador de la precarga del VI,
y para dilucidar el mecanismo del edema pulmonar: hidrostático (origen cardíaco) o por alteración de la permeabilidad (no cardiogénico).
Pero como hemos comentado, hay que tener en cuenta que un aumento de la presión de llenado ventricular no necesariamente indica aumento en el volumen telediastólico ventricular. De ahí la necesidad de combinar los datos fisiológicos aportados por el catéter de SG de forma directa y continua con datos morfológicos y funcionales aportados por la ecocardiografía.
La optimización en el menor tiempo posible de la relación entre el volumen de llenado (VTDVI) y el volumen sistólico (ley de Frank-Starling) debe ser el objetivo terapéutico en pacientes con hipotensión arterial, por lo que resulta imprescindible el conocimiento de los volúmenes ventriculares. El hallazgo con ecocardiografía de una disminución de las áreas telesistólicas y telediastólicas del VI, junto con una contractilidad subjetivamente normal o aumentada, se puede utilizar con seguridad para el diagnóstico de hipovolemia110-112, aunque un inotropismo elevado puede obliterar el VI por aumento de la FE113. Por el contrario, un incremento de las áreas ventriculares puede corresponder tanto a un exceso de volemia como a la presencia de disfunción cardíaca114.
Indicaciones
Las indicaciones del uso del catéter de SG se han generado sobre la base de la experiencia clínica. En la actualidad, aunque no está indicado el uso habitual, debe ir encaminada a resolver problemas complejos (tabla 1):
Responder aspectos específicos del estado hemodinámico del paciente que no pueden valorarse adecuadamente desde un punto de vista clínico o a través de métodos no invasivos: diferenciación del tipo de shock (cardiogénico, hipovolémico, distributivo, obstructivo, etc.), diferenciación del tipo de mecanismo del edema pulmonar (cardiogénico o no cardiogénico) o evaluación de la hipertensión pulmonar.
Establecer adecuadamente el tratamiento inicial y actuar en el componente principal que genera la inestabilidad hemodinámica.
Evaluar el grado de respuesta al tratamiento instaurado en distintas situaciones clínicas: shock cardiogénico, fallo ventricular derecho, insuficiencia cardíaca crónica descompensada, shock séptico, shock hemorrágico, miocarditis, miocardiopatía periparto, intoxicación farmacológica, hipertensión pulmonar, trasplante, etc.
Conclusiones
El catéter de SG es el gold standard en la incorporación de otras técnicas de monitorización hemodinámica. Hasta la fecha actual hemos aprendido a medir, pero no hemos consensuado qué debemos hacer con los datos obtenidos. La variedad clínica que podemos encontrar tal vez imposibilite este hecho. Probablemente debamos actuar más en la precocidad diagnóstica, terapéutica y en la optimización de los datos hemodinámicos en pacientes bien seleccionados, sin empeñarnos en conseguir metas hemodinámicas, a veces, inalcanzables.
Tal vez la lectura que hacemos de todos estos estudios es inadecuada. Le pedimos más de lo que nos puede aportar el catéter de SG. Se trata de un procedimiento cruento que conlleva un riesgo (tabla 2) en función de la indicación establecida, la capacidad técnica, la calidad de los datos obtenidos y las decisiones que tomemos una vez obtenidos los datos hemodinámicos. El catéter de SG tan sólo nos ayuda a cuantificar el estado hemodinámico en ese momento del paciente y a determinar el grado de respuesta a la decisión terapéutica tomada. Quizás la consecuencia sea una tendencia a utilizar cada vez menos el catéter de SG, que está siendo sustituido, al menos parcialmente, por otras tecnologías. Tecnologías que incorporamos en la práctica clínica sin (de nuevo) una valoración rigurosa en sus implicaciones pronósticas a nivel clínico. Con ello, la experiencia, el conocimiento y el tratamiento están disminuyendo, y esto puede influir en la optimización hemodinámica y en el pronóstico a pesar del avance en nuevas opciones terapéuticas.
Bibliografía
1. Chatterjee K. The Swan-Ganz catheters: Past, present, and future. Circulation. 2009; 119:147-52. [ Links ]
2. Dexter L., Haynes F.W., Burwell C.S., Eppinger E.C., Seibel R.E., Evans J.M. Studies of congenital heart disease. Techniques of venous catheterization as a diagnostic procedur. J Clin Invest. 1947; 26:547-553. [ Links ]
3. Swan H.J., Ganz W., Forester J., Marcus H., Diamond G., Chonette D. Catheterizaton of the heart in man using a flow directed balloon tipped catheter. N Engl J Med. 1970; 283:447-51. [ Links ]
4. Cook D.J., Sibbald W.J., Vincent J.L., Cerra F.B. Evidence based critical care medicine: What is it and what can it do for us?. Crit Care Med. 1996; 24:334-7. [ Links ]
5. Kaplan J.A., Wells P.H. Early diagnosis of myocardial ischemia using the pulmonary artery catheter. Anesth Analg. 1981; 60:789-793. [ Links ]
6. Shell W.E., DeWood M.A., Meter T. Comparison of clinical signs and hemodynamic state in the early hours of transmural myocardial infarction. Am Heart J. 1982; 104:521-8. [ Links ]
7. Stevenson L.W., Perloff J.K. The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. JAMA. 1989; 261:884-8. [ Links ]
8. Babu S.C., Sharma P., Racita A. Monitor-guided responses: Operability with safety is increased in patients with peripheral vascular diseases. Arch Surg. 1980; 115:1384-6. [ Links ]
9. Del Guercio L.R.M., Cohn J.D. Monitoring operative risk in the elderly. JAMA. 1980; 243:1350-5. [ Links ]
10. Mangano D.T. Monitoring pulmonary arterial pressure in coronary artery disease. Anaesthesiology. 1980; 53:364-70. [ Links ]
11. Crexells C., Chatterjee K., Forrester J.S., Dikshit K., Swan H.J. Optimal level of filling pressure in the left side of the heart in acute myocardial infarction. N Engl J Med. 1973; 289:1263-6. [ Links ]
12. Ospina-Tascón G.A., Cordioli R.L., Vicent J.L. What type of monitoring has been shown to improve outcomes in acutely ill patients?. Intensive Care Med. 2008; 34:800-20. [ Links ]
13. Connors A.F., Speroff T., Dawson N.V., Thomas C., Harrell F.E., Wagner D., et al. The effectiveness of right heart catheterisation in the initial care of critically ill patients. JAMA. 1996; 276:889-97. [ Links ]
14. A controlled trial to improve care for seriously ill hospitalized patients. The study to understand prognoses and preferences for outcomes and risks of treatments (SUPPORT). The SUPPORT Principal Investigators. JAMA. 1995;274:1591-8. [ Links ]
15. Sibbald W.J., Keenan S.P. Show me the eviden A critical appraisal of the Pulmonary Artery Catheter Consensus Conference and other musings on how critical care practitioners need to improve the way we conduct business. Crit Care Med. 1997; 25:2060-3. [ Links ]
16. Shah R.M., Hasselblad V., Stevenson L.W., Binanay C., O'Connor C.M., Sopko G., et al. Impact of the pulmonary artery catheter in critically ill patients meta-analysis of randomized clinical trials. JAMA. 2005; 294:1664-70. [ Links ] 17. Harvey S., Young D., Brampton W., Cooper A.B., Doig G., Sibbald W., et al. Pulmonary artery catheters for adult patients in intensive care. Cochrane Database Syst Rev. 2006; CD003408. [ Links ] 18. Ivanov R.I., Allen J., Sandham J.D., Calvin J.E. Pulmonary artery catheterization: A narrative and systematic critique of randomized controlled trials and recommendations for the future. New Horizons. 2007; 5:268-76. [ Links ] 19. Wessel H.U., James G.W., Paul M.H. Effects of respiration and circulation on central blood temperature of the dog. J Appl Physiol. 1966; 211:1403-12. [ Links ] 20. Elkayam U., Berkley R., Azen S., Weber L., Geva B., Henry W.L. Cardiac output by thermodilution technique. Effect of injectate's volumen and temperature on accuracy and reproducibility in the critically ill patient. Chest. 1983; 84:418-22. [ Links ] 21. Harris A.P., Miller C.F., Beattie C., Rosenfeld G.I., Rogers M.C. The slowing of sinus rhythm during thermodilution cardiac output determinations and the effect of altering injectate temperature. Anesthesiology. 1985; 63:540-1. [ Links ] 22. Nishikawa T., Dohi S. Errors in the measurement of cardiac output by thermodilution. Can J Anaesth. 1993; 40:142-53. [ Links ] 23. Griffin K., Benjamin E., DelGiudice R., Schechter C., Iberti T.J. Thermodilution cardiac output measurement during simultaneous volumen infusion through the venous infusion port of the pulmonary artery catheter. J Cardiothorac Vasc Anaesth. 1997; 11:437-9. [ Links ] 24. Groeneveld ABJ, Berendsen RR, Schneider AJ, Pneumatikos IA, Stokkel LA, Thijs LG. Effect of the mechanical ventilatory cycle on thermodilution right ventricular volumes and cardiac output. J Appl Physiol. 2000;89:89-96. [ Links ] 25. Jansen J.R., Versprille A. Improvement of cardiac output estimation by the thermodilution method during mechanical ventilation. Intensive Care Med. 1986; 12:71-9. [ Links ] 26. Vieillard-Baron A., Loubieres Y., Schmitt J.M., Page B., Dubourg O., Jardin F. Cyclic changes in right ventricular outflow impedance during mechanical ventilation. J Appl Physiol. 1999; 87:1644-50. [ Links ] 27. Jardin F., Farcot J.C., Boisante L., Curien N., Margairaz A., Bourdarias J.P. Influence of positive end-expiratory pressure on left ventricular performance. N Engl J Med. 1981; 304:387-92. [ Links ] 28. Sibbald W., Driedger A., Myers M., Short A.I., Wells G.A. Biventricular function in the adult respiratory distress syndrome. Hemodynamic and radionuclide assessment with special emphasis on right ventricular function. Chest. 1983; 84:126-34. [ Links ] 29. Jardin F., Gueret P., Dubourg O., Farcot J.C., Margairaz A., Bourdarias J.P. Two-dimensional echocardiographic evaluation of right ventricular size and contractibility in acute respiratory failure. Crit Care Med. 1985; 13:952-6. [ Links ] 30. Zapol W., Snider M. Pulmonary hypertension in severe acute respiratory failure. N Engl J Med. 1977; 296:476-80. [ Links ] 31. Schmid E.R., Schmidlin D., Tornic M., Seifert B. Continuous thermodilution CO: Clinical validation against a reference technique of known accuracy. Intensive Care Med. 1999; 25:166-72. [ Links ] 32. Poli de Figueiredo L.F., Malbouisson L.M., Varicoda E.Y., Carmona M.J., Auler J.O., Rocha e Silva M. Thermal filament continuous thermodilution cardiac output delayed response limits its value during acute hemodynamic instability. J Trauma. 1999; 47:2888-2893. [ Links ] 33. Lazor M.A., Pierce E.T., Stanley G.D., Cass J.L., Halpern E.F., Bode R.H. Evaluation of the accuracy and response time of STAT-mode continuous cardiac output. J Cardiothorac Vasc Anesth. 1997; 11:432-436. [ Links ] 34. Haller M., Zöllner C., Briegel J., Forst H. Evaluation of a new continuous thermodilution cardiac output monitor in critically ill patients: A prospective criterion standard study. Crit Care Med. 1995; 23:860-6. [ Links ] 35. Jaffe M.B. Partial CO2 rebreathing cardiac output. Operating principles of the NICO system. J Clin Monitoring. 1999; 15:387-401. [ Links ] 36. Capek J.M., Roy R.J. Noninvasive measurement of cardiac output using partial CO2 rebreathing. IEEE Trans Biomed Eng. 1988; 35:653-61. [ Links ] 37. Murias G.E., Villagrá A., Vatua S., Del Mar Fernández M., Solar H., Ochogavía A., et al. Evaluation of a noninvasive method for cardiac output measurement in critical care patients. Intensive Care Med. 2002; 28:1470-4. [ Links ] 38. Jover S.L., Soro M., Belda F.J., Aguilar G., Caro P., Ferrandis R. Measurement of cardiac output after cardiac surgery: Validation of a partial carbon dioxide rebreathing (NICO) system in comparison with continuous thermodilution with a pulmonary artery catheter. Rev Esp Anestesiol Reanim. 2005; 52:256-62. [ Links ] 39. Tachibana K., Imanaka H., Miyano H., Takeuchi M., Kumon K., Nishimura M. Effect of ventilatory settings on accuracy of cardiac output measurement using partial CO(2) rebreathing. Anesthesiology. 2002; 96:96-102. [ Links ] 40. Sakka S.G., Rühl C.C., Pfeiffer U.J., Beale R., McLuckie A., Reinhart K., et al. Assesmen of cardiac preload and extravascular lung water by single transpulmonary thermodilution. Intensive Care Med. 2000; 26:180-7. [ Links ] 41. Buhre W., Weyland A., Schorn B. Changes in central venous and pulmonary capillary wedge pressure do not indicate changes in right and left heart volumen in patients undergoing coronary artery bypass surgery. Eur J Anaesthesiol. 1999; 16:11-7. [ Links ] 42. Hoeft A., Schorn B., Weyland A., Scholz M., Buhre W., Stepanek E., et al. Bedside assessment of intravascular volumen status in patients undergoing coronary bypass surgery. Anesthesiology. 1994; 81:76-86. [ Links ] 43. Gödje O., Peyerl M., Seebauer T., Lamm P., Mair H., Reichart B. Central venous pressure, pulmonary capillary wedge pressure and intrathoracic blood volumes as preload indicators in cardiacsurgery patients. Eur J Cardiothorac Surg. 1998; 13:533-40. [ Links ] 44. Reuter D.A., Felbinger T.W., Moerstedt K., Weis F., Schmidt C., Kilger E., et al. Intrathoracic blood volumen index measure by thermodilution for preload monitoring after cardiac surgery. J Cardiothorac Vasc Anesth. 2002; 16:191-5. [ Links ] 45. Sakka S., Bredle D., Reinhart K., Meier-Hellmann A. Comparation between intrathoracic blood volumen and cardiac filling pressures in the early phase of hemodynamic instability of patients with sepsis or septic shock. J Crit Care. 1999; 14:78-83. [ Links ] 46. Lichtwarck-Aschoff M., Zeravik J., Pfeiffer U.J. Intrathoracic blood volumen accurately reflects circulatory volumen status in critically ill patients with mechanical ventilation. Intensive Care Med. 1992; 18:142-7. [ Links ] 47. Uchino S., Bellono R., Morimatsu H., Sugihara M., French C., Stephens D., et al, the PAC/PiCCO use and likelihood of success evaluation [PULSE] Study Group. Pulmonary artery catheter versus pulse contour analysis: A prospective epidemiological study. Critical Care. 2006; 10:1-10. [ Links ] 48. Alsous F., Khamiees M., DeGirolamo A., Amoateng-Adjepong Y., Manthous C.A. Negative fluid balance predicts survival in patients with septic shock: A retrospective pilot study. Chest. 2000; 117:1749-54. [ Links ] 49. Schuller D., Mitchell J.P., Calandrino F.S., Schuster D.P. Fluid balance during pulmonary edema. Is fluid gain a marker or a cause of poor outcome?. Chest. 1991; 100:1068-75. [ Links ] 50. Kula R., Szturz P., Sklienka P., Neisser J., Jahoda J. A role for negative fluid balance in septic patients with abdominal compartment syndrome?. Intensive Care Med. 2004; 30:2138-9. [ Links ] 51. Bickell W.H., Wall M.J., Pepe P.E., Martin R.R., Ginger V.F., Allen M.K., et al. Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med. 1994; 331:1105-9. [ Links ] 52. Jones R.M., Moulton C.E., Ardí K.J. Central venous pressure and its effect on blood loss during liver resection. Br J Surg. 1998; 85:1058-60. [ Links ] 53. Lobo D.N., Bostock K.A., Neal K.R., Perkins A.C., Rowlands B.J., Allison S.P. Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: A randomised controlled trial. Lancet. 2002; 359:812-18. [ Links ] 54. Silver M.A., Cianci P., Brennan S., Longeran-Thomas H., Ahmad F. Evaluation of impedance cardiography as an alternative to pulmonary artery catheterization in critically ill patients. Congest Heart Fail. 2004; 10:17-21. [ Links ] 55. Kööbi T., Kaukinen S., Ahola T., Turjanmaa V.M. Non-invasive measurement of cardiac output: Whole-body impedance cardiography in simultaneous comparison with thermodilution and direct oxygen Fick methods. Intensive Care Med. 1997; 23:1132-1137. [ Links ] 56. Imhoff M., Lehner J.H., Löhlein D. Noninvasive whole-body electrical bioimpedance cardiac output and invasive thermodilution cardiac output in high-risk surgical patients. Crit Care Med. 2000; 28:2812-18. [ Links ] 57. Woltjer H.H., Bogaard H.J., De Vries P.M.J.M. The technique of bioimpedance cardiography. Eur Heart J. 1997; 18:1396-403. [ Links ] 58. Oh J.K., Seward J.B., Tajik A.J. Evaluación hemodinámica. In: Oh J.K., Seward J.B., Tajik A.J., editors. Eco-manual. 2 ed. Madrid: Marbán; 2004. 59-72. [ Links ] 59. Feigenbaum's H. Hemodynamics. En: Feigenbaum H., Armstrong W.F., Ryan T., editors. Echocardiography. 6 ed. Philadelphia: Lippincott Williams and Wilkins; 2005. 214-45. [ Links ] 60. García-Vicente E., Campos-Nogué A., Gobernado Serrano M.M. Ecocardiografía en la unidad de cuidados intensivos. Med Intensiva. 2008; 32:236-47. [ Links ] 61. Monge M.I., Estella A., Díaz J.C., Gil A. Monitorización hemodinámica mínimamente invasiva con eco-doppler esofágico. Med Intensiva. 2008; 32:33-44. [ Links ] 62. Jain S., Allins A., Salim A., Vafa A., Wilson M.T., Margulies D.R. Noninvasive Doppler ultrasonography for assessing cardiac function: Can it replace the Swan-Ganz catheter?. Am J Surg. 2008; 196:961-8. [ Links ] 63. Hellems H.K., Haynes F.W., Dexter L., Kinney T.D. Pulmonary capillary pressure in animals estimed by venous and arterial catheterization. Am J Physiol. 1948; 155:98-105. [ Links ] 64. Lozman J., Powers S.R., Older T., Dutton R.E., Roy R.J., English M., et al. Correlation of pulmonary wedge and left atrial pressures. A study in the patients receiving positive end expiratory pressure ventilation. Arch Surg. 1974; 109:270-7. [ Links ] 65. Quintana E., Sánchez J.M., Serra C., Net A. Erroneous interpretation of pulmonary capillary wedge pressure in massive pulmonary embolism. Crit Care Med. 1983; 2:933-5. [ Links ] 66. Net A. Aspectos fisiopatológicos de la hemodinámica pulmonar relacionados con el catéter de Swan-Ganz. In: Net A., Betbesé A.J., editors. Avances en Medicina Intensiva. Barcelona: Ars Medica; 2008. 1-18. [ Links ] 67. O'Quin R., Marini J.J. Pulmonary artery occlusion pressure: Clinical physiology, measurement, and interpretation. Am Rev Respir Dis. 1983; 128:319-26. [ Links ] 68. Collee G.G., Lynch K.E., Hill R.D., Zapol W.N. Bedside messurement of pulmonary pressure in patients with acute respiratory failure. Anesthesiology. 1987; 66:614-20. [ Links ] 69. Levy M.M. Pulmonary capillary pressure. Clinical implications. Critical Care Clinics. 1996; 12:819-38. [ Links ] 70. Garr K.A., Taylor A.E., Owens L.J., Guyton A.C. Pulmonary capillary pressure and fitration coefficient in the isolated perfused lung. Am J Physiol. 1967; 213:910-14. [ Links ] 71. Sibbald W.J., Driedgger A.A., Myers M.L., Short A.I., Wells G.A. Biventricular function in the adult respiratory distress syndrome. Chest. 1983; 84:126-34. [ Links ] 72. Cheung A., Savino J., Weiss S., Aukburg S.J., Berlin J.A. Echocardiography and hemodynamic indexes of left ventricular preload in patients with normal and abnormal ventricular function. Anesthesiology. 1994; 81:376-87. [ Links ] 73. Clements F.M., Harpole D.H., Quill T. Estimation of left ventricular volumen and ejection fraction by two-dimensional transoesophageal echocardiography: Comparison of short axis imaging and simultaneus radionuclide angiography. Br J Anaesthesia. 1990; 64:331-6. [ Links ] 74. Parrillo J.E., Burch C., Shelhamer J.H., Parker M.M., Natanson C., Schuette W. A circulating myocardial depressant substance in humans with septic shock. J Clin Invest. 1985; 76:1539-53. [ Links ] 75. Parker M.M., Shelhamer J.H., Bacharach S.L., Green M.V., Natanson C., Frederick T.M., et al. Profound but reversible myocardial depression in patients with septic shock. Ann Intern Med. 1984; 100:483-90. [ Links ] 76. Parker M.M., McCarthy K.E., Ognibene F.P., Parrillo J.E. Right ventricular dysfunction and dilatation, similar to left ventricular changes, characterize the cardiac depression of septic shock in humans. Chest. 1990; 97:126-31. [ Links ] 77. Ellrodt A.G., Riedinger M.S., Kimchi A., Berman D.S., Maddahi J., Swan H.J., et al. Left ventricular performance in septic shock: Reversible segmental and global abnormalities. Am Heart J. 1985; 110:402-9. [ Links ] 78. Cunnion R.E., Schaer G.L., Parker M.M., Natanson C., Parrillo J.E. The coronary circulation in human septic shock. Circulation. 1986; 73:637-44. [ Links ] 79. Dhainaut J.F., Huyghebaert M.F., Monsallier J.F., Lefevre G., Dall'Ava-Santucci J., Brunet F., et al. Coronary hemodynamics and myocardial metabolism of lactate, free fatty acids, glucose, and ketones in patients with septic shock. Circulation. 1987; 75:533-41. [ Links ] 80. Kumar A., Thota V., Dee L., Olson J., Uretz E., Parrillo J.E. Tumor necrosis factor-alpha and interleukin-1 beta are responsible for depression of in vitro myocardial cell contractility induced by serum from humans with septic shock. J Exp Med. 1996; 183:949-58. [ Links ] 81. Kumar A., Brar R., Wang P., Dee L., Skorupa G., Khadour F., et al. Role of nitric oxide and cGMP in human septic serum-induced depression of cardiac myocyte contractility. Am J Physiol. 1999; 276:R265-76. [ Links ] 82. Turner A., Tsamitros M., Bellomo R. Myocardial cell injury in septic shock. Crit Care Med. 1999; 27:1775-80. [ Links ] 83. Parker M.M., Shelhamer J.H., Bacharach S.L., Green M.V., Natanson C., Frederick T.M., et al. Profound but reversible myocardial depression in patients with septic shock. Ann Intern Med. 1984; 100:483-90. [ Links ] 84. Parker M.M., McCarthy K.E., Ognibene F.P., Parrillo J.E. Right ventricular disfuntion and dilatation, similar to left ventricular changes, characterize the cardiac depression of septic shock in humans. Chest. 1990; 97:126-31. [ Links ] 85. Walley K.R. Mechanisms of decreased cardiac function in sepsis. Yearbook of Intensive Care and Emergency Medicine. 1997; 243-55. [ Links ] 86. Poelaert J., Declerk C., Vogelaers D., Colardyn F., Visser C.A. Left ventricular systolic and diastolic function in septic shock. Intensive Care Med. 1997; 23:553-60. [ Links ] 87. Katz W.E., Gasior T.A., Quinlan J.J., Gorcsan J. Transgastric continuous-wave doppler to determine cardiac output. Am J Cardiol. 1993; 71:853-7. [ Links ] 88. Valtier B., Cholley P., Belot J.P., De la Coussaye J.E., Mateo J., Payen D.M. Noninvasive monitoring of cardiac output in critically ill patients using transesophageal doppler. Am J Respir Crit Care Med. 1998; 158:77-83. [ Links ] 89. Darmon P.L., Hillel Z., Mogtader A., Mindich B., Thys D. Cardiac output by transesophageal echocardiography using continuous-wave doppler across the aortic valve. Anesthesiology. 1994; 80:796-805. [ Links ] 90. Perrino A.C., Harris S.N., Luther M.A. Intraoperative determination of cardiac output using multiplane transesophageal echocardiography: A comparison to termodilution. Anesthesiology. 1998; 89:350-7. [ Links ] 91. Ayuela J.M., González Vilchez F. Estimación de las presiones de llenado de ventrículo izquierdo por ecocardiografía Doppler en pacientes críticos. Med Intensiva. 2004; 28:20-5. [ Links ] 92. Katz W.E., Gasior T., Quinlan J., Gorcsan J. Transgastric continuous-wave doppler to determine cardiac output. Am J Cardiol. 1993; 71:853-7. [ Links ] 93. Almeida P., Córdoba M. Revisión del concepto de post-carga ventricular izquierda: ¿impedancia aórtica, presión ventricular o stress parietal?. Anales C Intensivos. 1985; 1:2-9. [ Links ] 94. Reichek N., Wilson J., Sutton M.J., Plappert T.A., Goldberg S., Hirshfeld J.W. Noninvasive determination of left ventricular end-systolic stress: Validation of the method and initial application. Circulation. 1982; 65:99-108. [ Links ] 95. Sagawa K. The ventricular pressure-volumen diagram revisited. Circulation Research. 1978; 43:677-87. [ Links ] 96. Gorcsan III J., Denault A., Gasior T.A., Mandarino W., Kancel M.J., Deneault L.G., et al. Rapid estimation of left ventricular contractility from end-systolic relations by echocardiographic automated border detection and femoral arterial pressure. Anesthesiology. 1994; 81:553-62. [ Links ] 97. Dellinger R.P., Levy M.M., Carlet J.M., Bion J., Parker M.M., Jaeschke R., et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008; 36:296-327. [ Links ] 98. Trzeciak S., Dellinger R.P., Abate N.L., Cowan R.M., Stauss M., Kilgannon J.H., et al. Translating research to clinical practi A 1-year experience with implementing early goaldirected therapy for septic shock in the emergency department. Chest. 2006; 129:225-32. [ Links ] 99. Varpula M., Tallgren M., Saukkonen K., Voipio-Pulkki L.M., Pettilä V. Hemodynamic variables related to outcome in septic shock. Intensive Care Med. 2005; 31:1066-71. [ Links ] 100. De Backer D., Creteur J., Preiser J.C., Dubois M.J., Vincent J.L. Microvascular blood flow is altered in patients with sepsis. Am J Respir Crit Care Med. 2002; 166:98-104. [ Links ] 101. Spronk P.E., Ince C., Gardien M.J., Mathura K.R., Oudemans-van Straaten H.M., Zandstra D.F. Nitroglycerin in septic shock after intravascular volume resuscitation. Lancet. 2002; 360:1395-6. [ Links ] 102. Bateman R.M., Sharpe M.D., Ellis C.G. Bench-to-bedside review: Microvascular dysfunction in sepsis: Hemodynamics, oxygen transport, and nitric oxide. Crit Care. 2003; 7:359-73. [ Links ] 103. Aird W.C. The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood. 2003; 101:3765-3777. [ Links ] 104. Ince C., Sinaasappel M. Microcirculatory oxygenation and shunting in sepsis and shock. Crit Care Med. 1999; 27:1369-77. [ Links ] 105. Sakr Y.L., Dubois M.J., De Backer D., Creteur J., Vincent J.L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock. Crit Care Med. 2004; 32:1825-31. [ Links ] 106. Reisbeck M., Astiz M.E. Arterial pressure, vasopressors and septic shock: Higher is not necessarily better. Crit Care Med. 2005; 33:905-6. [ Links ] 107. De Backer D., Creteur J., Preiser J.C., Dubois M.J., Vincent J.L. Microvascular blood flow is altered in patients with sepsis. Am J Respir Crit Care Med. 2002; 166:98-104. [ Links ] 108. LeDoux D., Astiz M.E., Carpati C.M., Rackow E.C. Effects of perfusion pressure on tissue perfusion in septic shock. Crit Care Med. 2000; 28:2729-32. [ Links ] 109. Bourgoin A., Leone M., Delmas A., Garnier F., Albanèse J., Martin C. Increasing mean arterial pressure in patients with septic shock: Effects on oxygen variables and renal function. Crit Care Med. 2005; 33:780-6. [ Links ] 110. Poelaert J., Schmidt C., Colardyn F. Transoesophageal echocardiography in the critically ill. Anaesthesia. 1998; 53:55-68. [ Links ] 111. Nishimura R.A., Martin D., Hatle L.K., Tajik A.J. Relation of pulmonary vein to mitral flow velocities by transoesophageal doppler echocardiography. Effect of different loading conditions. Circulation. 1990; 81:1488-97. [ Links ] 112. Hoit B.D., Shao Y., Gabel M., Walsh R.A. Influence of loading conditions and contractile state on pulmonary venous flow. Validation of Doppler velocimetry. Circulation. 1992; 86:651-9. [ Links ] 113. Leung J.M., O'Kelly B., Browner W.S., Tubau J., Hollenberg M., Mangano D.T. Prosnoctic importance of postbypass regional wall-motion abnormalities in patients undergoing coronary artery bypass graft surgery. Anesthesiology. 1989; 71:16-25. [ Links ] 114. Troianos C.A., Porembka D.T. Assessment of left ventricular function and hemodynamics with transesofageal echocardiography. Crit Care Clinics. 1996; 2:253-72. [ Links ] Recibido 9 Febrero 2009 ![]() Dirección para correspondencia:
Dirección para correspondencia:
andrescarrillolopez@gmail.com
(A. Carrillo López)
Aceptado 26 Mayo 2009















