Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.34 no.4 may. 2010
Evaluación de la eosinopenia como marcador de infección en pacientes ingresados en una Unidad de Cuidados Intensivos
Evaluation of eosinopenia as an infection marker in critical care patients
I. López de Toro Martín Consuegra, M. Sánchez Casado, S. Rodríguez Villar, A. Raigal Caño, P. López Reina Torrijos, A. Velasco Ramos, P. Sánchez Rodríguez y H. Cabezas Martín
Unidad de Cuidados Intensivos, Hospital Virgen de la Salud, Toledo, España
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la eosinopenia como marcador precoz de infección.
Diseño: Estudio de cohortes retrospectivo.
Pacientes: Enfermos de una UCI medicoquirúrgica con altos índices de gravedad.
Variables de interés: Datos demográficos, diagnóstico, repercusión clínica, necesidad de ventilación mecánica, evolución, estancia y Acute Physiology and Chronic Health Evaluation II (APACHE II) en primeras 24h. Días 1-5: leucocitos y fórmula, plaquetas, SOFA y lactato. Pacientes divididos en 2 grupos: con y sin infección. Mejor punto de discriminación según curvas ROC.
Resultados: Doscientos cuarenta y cuatro pacientes; 55 (22,5%) infectados. El 52,9% eran enfermos médicos, el 22,5% eran enfermos posquirúrgicos y el 24,6% eran enfermos politraumatizados. El APACHE II fue de 14,9±8,9. En regresión logística (variable dependiente de infección) las variables independientes son APACHE II, SOFA, monocitos y eosinófilos. La curva ROC para eosinófilos el primer día muestra área de 0,72; mejor punto de corte: 10 eosinófilos/ml, sensibilidad (S): el 64,8% y especifidad (E): el 70,9%. En pacientes médicos, el área bajo la curva ROC es de 0,80, con punto de corte ideal de 9 eosinófilos/ml; en pacientes quirúrgicos el área bajo la curva es de 0,53, con punto de corte de 54 eosinófilos/ml. Si combinamos eosinófilos y monocitos, el corte de 9 eosinófilos/ml en pacientes médicos con >400 monocitos/ml, tiene una S del 86,7%, una E del 74,7%, un valor predictivo positivo del 40,6% y un valor predictivo negativo del 96,6%; en pacientes posquirúrgicos con <400 monocitos/ml y punto de corte de 54 eosinófilos, una S del 100%, una E del 20%, un valor predictivo positivo del 52,9% y un valor predictivo negativo del 100%.
Conclusiones: En una UCI medicoquirúrgica la eosinopenia no muestra buena capacidad discriminativa de presencia de infección, aunque combinada con la cifra de monocitos podría ser útil para descartarla.
Palabras clave: Sepsis. Eosinopenia. Marcadores de infección. Paciente crítico. Prueba diagnóstica.
ABSTRACT
Introduction: To evaluate eosinopenia as an early marker of infection.
Design: Retrospective cohort study.
Patients: Medical-surgical ICU patients with high severity scores.
Main variables: Data on days 1-5: Demographic data, diagnosis, clinical repercussion, mechanical ventilation, clinical development, length of stay, APACHE II, leukocytes, SOFA and lactate. Patients divided into two groups: with and without infection. ROCs (receiver operator characteristic) curves were plotted and best point for discriminative values determined.
Results: 244 patients were included: 22.5% with infection. 52.9% medical, 22.5% surgical and 24.6% polytrauma patients. APACHE II: 14.9±8.9. In a logistic regression model of infection (dependent variable infection), the independent variables were: APACHE II, SOFA, monocytes and eosinophils. The ROC curve for eosinophils on the first day: area of 0.72; the best cut off value is 10 eosinophils/ml, with sensitivity (S): 64.8% and specificity (Sp): 70.9%. In medical patients, the area under curve is 0.80, with ideal cut off value of 9 eosinophils/ml; in surgical patients is 0.53, with a cut off ideal value of 54. We combined eosinophils and monocytes: a cut-off value of 9 eosinophils/ml in medical patients with >400 monocytes/ml, has: S: 86.7%, Sp: 74.7%, a positive predictive value (PPV) of 40.6% and a negative predictive value (NPV) 96.6%; in postsurgical patients with <400 monocytes/ml and a cut-off value of 54 eosinophils: S: 100%, Sp: 20%, PPV: 52.9% and NPV: 100%.
Conclusions: In a medical-surgical ICU, the capacity to discriminate infection through examining eosinopenia is not high. It could be useful to rule out infection if we combined eosinopenia with monocytes count.
Key words: Sepsis. Eosinopenia. Infection marker. Critically ill patient. Diagnostic assays.
Introducción
La infección, como diagnóstico de admisión en la unidad de cuidados intensivos (UCI), es una importante etiología que conlleva una alta morbimortalidad. La necesidad de tratamiento precoz requiere un adecuado diagnóstico. Por esta razón serían de mucha utilidad herramientas diagnósticas suficientemente sensibles y específicas en la detección precoz de este tipo de pacientes.
La infección, con sus más graves consecuencias (sepsis grave y shock séptico), es la entidad nosológica más prevalente en la UCI1 y la causa más frecuente de muerte en UCI no coronarias2-6. Sin duda, su estudio es uno de los campos médicos que genera más literatura médica7, pues su incidencia continúa incrementándose a pesar del mejor conocimiento de su fisiopatología8.
Los marcadores diagnósticos precoces podrían ser de máxima utilidad, actuar como herramientas diagnósticas que nos informen qué pacientes están realmente infectados y así facilitar una inmediata actuación9-17. La eosinopenia se ha descrito en este contexto como un parámetro asociado con la infección en la literatura médica clásica18-24, aunque su aceptación en la práctica clínica, especialmente en pacientes críticos, ha sido escasa.
De acuerdo con recientes estudios, la eosinopenia ha demostrado ser un buen marcador de infección en pacientes médicos críticos25. Sin embargo, los pacientes críticos presentan una amplia variedad de enfermedades, médicas o no, con diferentes grados de gravedad, por lo que estos «marcadores de infección» pueden presentar diferentes grados de eficacia dependiendo del contexto utilizado.
Nuestro objetivo es evaluar la eosinopenia como marcador precoz de infección en una UCI medicoquirúrgica, con altos índices de gravedad.
Pacientes y métodos
El estudio se realizó en la UCI del Hospital Virgen de la Salud, Toledo. Dispone de 23 camas de hospitalización, y reciben tratamiento todos los enfermos críticos médicos y posquirúrgicos, salvo los coronarios no complicados y los postoperatorios de cirugía cardíaca. En el presente estudio se incluyó a todos los pacientes que ingresaron en la UCI entre los meses de enero y mayo de 2008, ambos inclusive. Se excluyó a todos los pacientes cuya estancia (alta a planta o mortalidad) fuera menor de 12h y a los pacientes que ingresaron por bradiarritmia sintomática (subsidiarios de colocar marcapasos transitorio o definitivo).
Se registraron las siguientes variables: edad, sexo, tipo de paciente (médico, quirúrgico, politraumatizado), diagnóstico principal, repercusión (SIRS, sepsis, sepsis grave o shock séptico)26, necesidad de ventilación mecánica, Acute Physiology and Chronic Health Evaluation II (APACHE II) en las primeras 24h27, estancia en UCI y evolución (muerte o no). Los demás datos que se recogieron comprendían los días 1, 2, 3 y 5 de ingreso: leucocitos y fórmula leucocitaria completa (neutrófilos, monocitos, eosinófilos, basófilos y linfocitos), plaquetas, SOFA28 y lactato en sangre arterial.
Para valorar la etiología infecciosa dividimos a los pacientes en 3 grupos:
1. Infección segura: diagnóstico de infección según los criterios estándares29 y cultivo positivo para germen causante. Se inició tratamiento antibiótico empírico, y se intentó posteriormente desescalar según crecimiento microbiológico.
2. Infección probable: diagnóstico con dudas de infección según los criterios del médico que lo atiende, sin aparición de germen causante. En estos enfermos se inició tratamiento antibiótico de amplio espectro. Estos enfermos se descartaron del análisis.
3. Ausencia de infección: no existen criterios de infección y no se realizó tratamiento antibiótico alguno.
La ausencia o presencia de infección se determinó al alta del paciente por parte del equipo de investigadores (que no debían haber participado plenamente en su cuidado médico) según los criterios anteriores, cuando se disponía de la máxima información en relación con la evolución clínica, los datos de laboratorio y microbiológicos y la respuesta al tratamiento. En el momento de la valoración a los investigadores no se les suministraban los resultados de las cifras de eosinófilos (para asegurar el cegamiento).
Las muestras analizadas fueron las tomadas en la analítica de la mañana. Se utilizó el analizador Coulter LH Beckman®, modelo 750. Siete médicos investigadores recogieron los datos.
Análisis estadístico
Los datos cuantitativos se expresan como media±desviación estándar o mediana (intervalo) si la variable no sigue una distribución normal. Las variables categóricas se expresan como valor absoluto (porcentaje). Para valorar las diferencias entre grupos utilizamos la prueba de chi cuadrado para las variables categóricas y la prueba de análisis de la variancia para las variables cuantitativas. El test de regresión logística se ha realizado para valorar la influencia de los diferentes parámetros analizados en la presencia o no de infección segura.
Utilizamos el coeficiente de correlación de Spearman para calcular el grado de relación cuantitativa entre el recuento de eosinófilos y el resto de parámetros clínicos y analíticos. Para comparaciones entre muestras emparejadas utilizamos el test de rangos de Wilcoxon.
Hemos realizado curvas ROC para el recuento de eosinófilos, y calculado el área que engloba, con su correspondiente intervalo de confianza (IC). Hemos calculado el punto de corte óptimo en el valor que determine un mayor índice de Youden. En este punto calculamos la sensibilidad y la especificidad, los valores predictivos (positivo y negativo) y el cociente de probabilidad.
Se ha considerado significativo todo valor de p<0,05. El análisis estadístico se realizó con el programa SPSS 15.0 (SPSS, Inc., Chicago, IL, EE. UU.).
Resultados
Durante el período de estudio (5 meses) ingresaron en nuestra unidad 313 pacientes. Cuarenta y tres pacientes se excluyeron del estudio por estancia corta (<12h) o diagnóstico de ingreso de bradiarritmia sintomática. De ellos, se evaluó a 270 pacientes (86,3%). Se descartaron 26 pacientes por estar clasificados como infección probable. Doscientos cuarenta y cuatro pacientes entraron definitivamente en el estudio; de ellos, 55 (22,5%) presentaban una infección segura. En la figura 1 se describe el diagrama de flujo del estudio.

Figura 1. Diagrama de flujo del estudio.
La edad de todos los pacientes fue de 54,4±19,8 años, con un APACHE de 14,9±8,9 y un SOFA de 5,5±3,6. La mortalidad global fue del 18,6%. El APACHE II de los enfermos médicos era de 17,1±9,5, el de los enfermos politraumatizados era de 11,2±7,7 y el de los enfermos quirúrgicos era de 13,7±7,5. El SOFA del primer día en los enfermos médicos era de 6,2±3,9; en los enfermos politraumatizados era de 4,2±2,8, y el de los enfermos quirúrgicos era de 5,1±3,2.
Del total de pacientes clasificados con infección segura, el 67,3% eran pacientes médicos y el 32,7% eran pacientes posquirúrgicos. En el total de pacientes médicos destaca la presencia de pacientes con accidentes cerebrovasculares (22,5%) en los que no se considera indicada la cirugía, con shock cardiogénico (7,8%), con intoxicaciones (5,4%) o con parada cardiorrespiratoria (5,4%). El 28,7% de todos los pacientes médicos estaba infectado y el 32,7% de todos los posquirúrgicos.
Las etiologías infecciosas más frecuentes en todos los pacientes son neumonía comunitaria (25,5%), peritonitis (14,5%), neumonía nosocomial (12,7%), foco urológico (12,7%), sin foco (5,5%), y otros (29,1%).
Las características clínicas de los pacientes totales y según el diagnóstico de presencia o ausencia de infección se encuentran en la tabla 1. Si introducimos las variables significativas en un estudio de regresión logística en el que la variable dependiente sea la presencia de infección, las variables que permanecen en el modelo son APACHE II (OR: 0,93; p<0,03), SOFA primer día (OR: 1,36; p<0,001), monocitos (OR: 0,998; p<0,001) y eosinófilos (OR: 0,992; p<0,01).
Si utilizamos la mediana (rango) como parámetro descriptivo del número de eosinófilos en los diferentes grupos, tenemos 0 (0-403) en el grupo de infección segura y 28 (0-516) en el grupo de ausencia de infección. Estas diferencias son estadísticamente significativas (p<0,001) (figura 2).
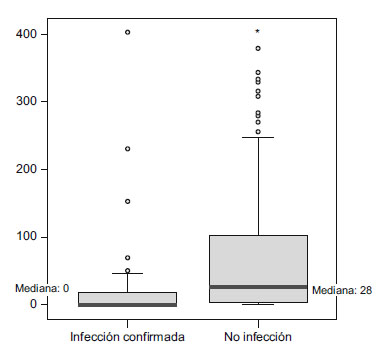
Figura 2. Diferencia entre el grupo con y sin infección en
el número de eosinófilos durante el primer día (p<0,001).
En la figura 3 se muestra la tabla ROC para discriminar la presencia o no de infección según la cifra de eosinófilos durante el primer día en el total de pacientes. El área bajo la curva es de 0,72 (IC del 95%: 0,64-0,79). Si utilizamos el valor con mayor índice de Youden establecemos un punto de corte en 10 eosinófilos/ml, con valores de sensibilidad del 64,8% y valores de especificidad del 70,9%. El cociente de probabilidad positivo es de 2,2 y el cociente de probabilidad negativo es de 0,49.

Figura 3. Curva ROC para la discriminación de pacientes no infectados
de los infectados según el nivel de eosinófilos durante el primer día.
El área bajo la curva es de 0,72 (IC del 95%: 0,64-0,79; p<0,01).
Si realizamos una discriminación con curva ROC solo en los pacientes médicos, el área bajo la curva es de 0,80 (IC del 95%: 0,72-0,88), con un punto de corte ideal en 9 eosinófilos/ml; en enfermos quirúrgicos el área bajo la curva es de 0,53 (IC del 95%: 0,37-0,69), con un punto de corte ideal de 54 eosinófilos/ml.
Del total de pacientes con infección, la mayoría se encontraban en shock séptico (81,8%) y solo el 18,2% se presentó con sepsis grave. Ninguno se presentó con sepsis ni SIRS. La diferencia en eosinófilos en cada grupo es significativa (p<0,01): sepsis grave: 72±146 eosinófilos/ml; shock séptico: 14±27 eosinófilos/ml.
Los monocitos son otras células sanguíneas que presentan significación estadística con la infección y que permanecen en el modelo multivariable. En la curva ROC obtenemos un área de 0,69 (IC del 95%: 0,61-0,78; p<0,01). El punto de corte óptimo son 400 monocitos/ml, con una sensibilidad del 80,9% y una especificidad del 57% y, por tanto, con un menor poder de discriminación. Hemos intentado combinar monocitos y eosinófilos de diferentes formas, tanto en el total de pacientes como en los pacientes médicos y quirúrgicos de forma aislada, para poder mejorar el modelo (tabla 2).
El valor de los eosinófilos tiene una correlación significativa con los neutrófilos (r=-0,148; p<0,05), linfocitos (r=0,135; p<0,05) y plaquetas (r=0,182; p<0,001).
Si analizamos los eosinófilos al día 5 de ingreso en los pacientes, observamos un aumento significativo (173±245 eosinófilos/ml; mediana: 91 eosinófilos/ml), con significación con respecto a la presencia o ausencia de infección (p<0,001) y con respecto a los eosinófilos en el primer día (p<0,001). La curva ROC muestra un área bajo ella de 0,75 (IC del 95%: 0,66-0,84), y un punto de corte de 40 eosinófilos/ml. En este punto existe una sensibilidad del 74% y una especificidad del 73%.
Discusión
Hasta la actualidad, existen 3 estudios clínicos que relacionan eosinopenia e infección: uno en urgencias30, otro en una planta de hospitalización convencional31 y otro en una unidad de cuidados críticos25. Todos se han realizado en pacientes médicos, con variación en el valor del punto de corte en cada uno: 100 eosinófilos/ml en pacientes de urgencias, 40 eosinófilos/ml en pacientes de planta y 50 eosinófilos/ml en pacientes críticos.
En nuestra UCI creemos que existen 3 diferencias importantes con respecto a estos estudios previos, que probablemente condicionen los resultados. Primero, existe un número significativo de enfermos posquirúrgicos y politraumatizados, que condicionan alrededor del 50% de los ingresos. Segundo, el bajo porcentaje de pacientes (22,5%) que se admiten con infección como diagnóstico principal de ingreso, y reciben tratamiento muchos pacientes neurocríticos y con otras enfermedades no infecciosas, como shock cardiogénicos, etc. Tercero, nuestros pacientes presentan unos escores de mayor gravedad (estancia en UCI, necesidad de ventilación mecánica, altos valores en APACHE II y SOFA, etc.).
Hemos encontrado que el mejor valor de punto de corte en la totalidad de nuestros pacientes es de 10 eosinófilos/ml durante el primer día. Este es el punto de corte más bajo de la literatura médica21,22,25. En un reciente estudio llevado a cabo en una UCI marroquí, el punto de corte se estableció en 50 eosinófilos/ml25; la muestra de pacientes analizadas es homogénea (todos los pacientes son médicos), de edad más joven (12 años menos de edad media), y con escores de gravedad inferiores (APACHE II con 2,9 puntos de media más bajos. Esta homogeneidad se apoya en el estrecho margen en el que los eosinófilos se hallan (entre 0 y 36 en el grupo infectado). En contraste, nuestros heterogéneos pacientes exhiben un mucho mayor rango del recuento de eosinófilos durante el primer día (entre 0 y 404 en el grupo infectado). Además, ningún paciente del grupo no infectado en el estudio marroquí presenta un valor de eosinófilos en sangre de menos de 13 eosinófilos/ml, cifra común en nuestra muestra.
Los enfermos médicos son los mejor discriminados con el recuento de eosinófilos. Presentan la mejor curva ROC (área de 0,8), con los mejores parámetros estadísticos de clasificación en infectados y no infectados. Su punto de corte disminuye aún más el establecido para el total de pacientes, y se sitúa en 9 eosinófilos/ml en el primer día. A pesar de todo, esto muestra un valor discriminatorio limitado. Creemos que esto está determinado por los factores comentados previamente. La gravedad de nuestros pacientes podría condicionar una mayor respuesta inflamatoria, que tiende a «homogeneizar todo» en forma de cascada inflamatoria que podría amortiguar las diferencias. Por otra parte, el momento del tratamiento de estos pacientes podría condicionar el número de eosinófilos. Así, en las pocas series halladas, cuando a los pacientes se los ha valorado en urgencias el punto de corte ha sido 100 eosinófilos/ml, en tanto que si se lo ha valorado en planta o UVI médica el punto de corte se estableció en 40-50 eosinófilos/ml. Todos nuestros enfermos probablemente tengan unos tiempos de estancia más prolongados hasta que los atienda la UCI, que demore los tiempos de atención y haga que la respuesta inflamatoria sea más intensa. De hecho, en los enfermos infectados, la gran mayoría se encuentra en situación de shock séptico. Abidi et al25 ya han indicado que la eosinopenia puede estar reflejando la gravedad de la respuesta inflamatoria sistémica; ellos hacen referencia a un «efecto suelo» en las cifras de eosinófilos según el paciente tenga sepsis, sepsis grave o shock séptico.
Hasta el momento actual, todos los pacientes estudiados eran de perfil médico, sin ningún paciente posquirúrgico ni politraumatizado. En nuestra serie, ningún paciente politraumatizado tuvo diagnóstico de infección el primer día, y lo hizo el 32,7% de los posquirúrgicos.
Pocos datos existen en los pacientes politraumatizados. Se han publicado comunicaciones aisladas sobre eosinopenia en el trauma esplénico y en el golpe de calor32,33. En nuestra serie de pacientes, la gran mayoría (73,3%) tiene menos de 50 eosinófilos/ml el primer día, y el 25,4% tiene menos de 10 eosinófilos/ml. Por eso, su presencia en el total de enfermos «contamina» la muestra y empeora la discriminación de presencia o ausencia de infección. No hemos encontrado ninguna asociación entre el tipo de trauma (con o sin TCE, abdominal, etc.) y el recuento de eosinófilos.
Los enfermos posquirúrgicos presentan una mayor dificultad que los enfermos médicos en clasificarse en relación con la infección y la eosinopenia. En ellos no podemos establecer puntos de cortes discriminatorios aceptables, ya que en el mejor de los casos obtenemos áreas de curva ROC próximas a 0,5. Tampoco hemos encontrado mucha bibliografía sobre este hecho, sólo casos aislados34-36.
La búsqueda de una prueba de referencia hizo excluir a los pacientes con «infección probable», dada la incapacidad de definir con certeza la infección en este grupo. Este grupo es frecuente en la práctica habitual, diluyendo la capacidad de detección, lo que hace en la atención clínica habitual menos discriminatorio el empleo de los eosinófilos como parámetro de infección.
Se han buscado otras líneas celulares dentro de la serie blanca que pudieran optimizar solas, o en combinación con los eosinófilos en la distinción de etiología infecciosa. En nuestra serie encontramos que las únicas células que permanecen en el modelo multivariable, junto con la eosinopenia, son el recuento de monocitos el primer día. Como dato aislado, no han demostrado mejor poder discriminatorio que los eosinófilos, aunque vemos que aportan, cuando se combinan con los eosinófilos, una mejor validez de la prueba en los distintos grupos. Otros autores también han encontrado una relación entre monocitos e infección31. Llama mucho la atención la diferente dirección en el recuento de monocitos según el paciente sea médico o quirúrgico.
A los 5 días de ingreso del paciente en UCI, se establece un nuevo punto de corte en 40 eosinófilos/ml, más discriminante entre grupos con respecto al primer día, aunque la distancia temporal desde el ingreso hace que su aplicación clínica diste mucho de ser útil.
En la tabla 2 observamos de forma global los resultados de la validez (sensibilidad y especificidad) y valores predictivos (positivos y negativos) en los distintos contextos comentados. Se encontraron diferentes puntos de corte para diferentes grupos de pacientes, y se observa de forma global una sensibilidad y especificidad no altas. Lo que marca realmente la diferencia con otros estudios es el alto valor predictivo negativo. Así, un paciente con >10 eosinófilos/ml tiene una probabilidad del 87,2% de no estar infectado.
La baja prevalencia de infección en nuestro estudio condiciona la importancia de los valores predictivos negativos. Los valores predictivos son muy útiles a la hora de tomar decisiones clínicas y dependen en gran medida de lo frecuente que sea la enfermedad que se va a diagnosticar. En nuestro estudio, con baja prevalencia de infección, un resultado negativo permitirá descartar la infección con mayor seguridad, y el valor predictivo negativo será mayor. Por el contrario, un resultado positivo no permitirá confirmar el diagnóstico de infección (bajo valor predictivo positivo). Así, los enfermos posquirúrgicos con <400 monocitos/ml y >54 eosinófilos/ml durante el primer día no estarán infectados (sensibilidad del 100%; valor predictivo negativo del 100%). De forma similar, los enfermos médicos con >400 monocitos/ml y >9 eosinófilos/ml durante el primer día tienen una probabilidad del 96,6% de no estar infectados (sensibilidad del 86,7%; valor predictivo negativo del 96%).
Como conclusión, podemos decir que la eosinopenia como marcador precoz de infección presenta limitaciones. En una UCI con enfermos heterogéneos su capacidad de discriminación de la infección no es alta, fundamentalmente en los enfermos posquirúrgicos y politraumatizados. Esto está determinado por 2 factores: el tipo de paciente y su gravedad. En los pacientes médicos presenta un mayor poder discriminador, que disminuye conforme aumenta la gravedad de los pacientes. A esto hay que añadir que en las unidades con baja prevalencia de infección como diagnóstico inicial de ingreso, independientemente del tipo de paciente y su gravedad, la eosinopenia no presenta valores predictivos positivos adecuados, aunque el valor predictivo negativo sí podría ser útil.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Padkin A., Goldfrad C., Brady A.R., Young D., Black N., Rowan K. Epidemiology of severe sepsis ocurring in the first 24 hours in intensive care units in England, Wales and Northern Ireland. Crit Care Med. 2003; 31:2332-8. [ Links ]
2. Brun-Buisson C., Meshaka P., Pinton P., Ballet B., EPISEPSIS Study Group. EPISEPSIS: A reappraisal of the epidemiology and outcome of severe sepsis in French intensive care units. Intensive Care Med. 2004; 30:580-8. [ Links ]
3. Annane D., Aegerter P., Jars-Guincestre M.C., Guidet B. for the CUB-Criminal Network. Current epidemiology of septic shock. Am J Respir Crit Care Med. 2003; 168:165-72. [ Links ]
4. Bone R.C., Balk R.A., Cerra F.B. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conferen Definitions for sepsis and organ faliure and guidelines for the uses of innovative therapies in sepsis. Chest. 1992; 101:1644-55. [ Links ]
5. Abraham A., Mathay M.A., Dinarello C.A., Vincet J.L. Consensus for Conference definitions sepsis, septic shock, acute lung injury and acute respiratory distress syndrome: Time for revaluation. Crit Care Med. 2000; 28:232-5. [ Links ]
6. Bernard G.R., Vincent J.L., Laterre P.F., LaRosa S.P., Dhainaut J.F., López Rodríguez A., et al, The Recombinant Human Activated Protein C Worldwide Evaluation in Severe Sepsis (PROWESS) Study Group. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001; 344:699-709. [ Links ]
7. Cohen J., Guyatt G., Bernard G.R., Calender T., Cook D., Elbourne D., et al, UK Medical Research Council International Working Party. Clinical: New strategies for trials in patients with sepsis and septic shock. Crit Care Med. 2001; 29:880-6. [ Links ]
8. Martín G.S., Mannino D.M., Eaton S., Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med. 2003; 348:1546-54. [ Links ]
9. Rey C., Los Arcos M., Concha A., Medina A., Prieto S., Martínez P., et al. Procalcitonin and C-reactive protein as markers of systemic inflammatory response syndrome severity in critically ill children. Intensive Care Med. 2007; 33:477-84. [ Links ]
10. Luzzani A., Polati E., Dorizzi R., Rungatscher A., Pavan R., Merlini A. Comparison of procalcitonin and C-reactive protein as markers of sepsis. Crit Care Med. 2003; 31:1737-41. [ Links ]
11. Ho K.M., Lee K.Y., Dobb G.J., Webb S.A. C-reactive protein concentration as a predictor of in-hospital mortality after ICU discharge: A prospective cohort study. Intensive Care Med. 2008; 34:481-7. [ Links ]
12. Castelli G.P., Pognani C., Appointment M., Stuani A., Sgarbi L., Paladini R. Procalcitonin, C-reactivates protein, white blood cells and SOFA score in ICU: Diagnosis and monitoring of sepsis. Minerva Anestesiol. 2006; 72:69-80. [ Links ]
13. Meisner M., Adina H., Schmidt J. Correlation of procalcitonin and C-reactive protein to inflammation, complications, and outcome during the intensive care unit course of multiple-trauma patients. Crit Care. 2006; 10:R1. [ Links ]
14. Póvoa P., Coelho L., Almeida , Fernandes A., Mealha R., Moreira P., et al. C-reactivate protein as a marker of infection in critically ill patients. Clin Microbiol Infect. 2005; 11:101-8. [ Links ]
15. Lobo S.M., Lobo F.R., Dull D.P., Lopes-Ferreira F., Soliman H.M., Mélot C., et al. C-reactive protein levels correlate with mortality and organ failure in critically ill patients. Chest. 2003; 123:2043-9. [ Links ]
16. Du B., Bread J., Chen D., Li. Serum procalcitonin and interleukin-6 levels may help to differentiate systemic inflammatory response of infectious and non-infectious origin. Chin Med J (Engl). 2003; 116:538-42. [ Links ]
17. Brunkhorst F.M., Eberhard O.K., Brunkhorst R. Discrimination of infectious and non infectious causes of early acute respiratory distress syndrome by procalcitonin. Crit Care Med. 1999; 27:2172-6. [ Links ]
18. Morgan J.E., Beeson P.B. Experimental observations on the eosinopenia induced by acute infection. Br J Exp Pathol. 1971; 52:214-20. [ Links ]
19. Bass G. Behavior of eosinophil leukocytes in acute inflammation: I. Lack of dependence on adrenal function. J Clin Invest. 1975; 55:1229-36. [ Links ]
20. Bass G. Behavior of eosinophil leukocytes in acute inflammation: II. Eosinophil dynamics during acute inflammation. J Clin Invest. 1975; 56:870-9. [ Links ]
21. Bass G. Reproduction of the eosinopenia of acute infection by passive transfer of a material obtained from inflammatory exudate. Infect Immun. 1977; 15(2):410-6. [ Links ]
22. Bass G., Gonwa T.A., Szejda P., Cousart M.S., DeChatelet L.R., McCall E.C. Eosinopenia of acute infection: Production of eosinopenia by chemotactic factors of acute inflammation. J Clin Invest. 1980; 65:1265-71. [ Links ]
23. Montesanti M., Testa G., Biagi C., Bartolini F. Trend of circulating eosinophils in healthy children and children suffering from infectious diseases. A retrospective study. Minerva Pediatr. 1997; 49:179-86. [ Links ]
24. Raz R., Ben-Israel Y., Gronich D., Granot E., Colodner R., Visotzky I. Usefulness of blood cultures in the management of febrile patients in long-term care facilities. Eur J Clin Microbiol Infect Dis. 2005; 24:745-8. [ Links ]
25. Abidi K., Khoudri I., Belayachi J., Madani N., Zekraoui A., Zeggwagh A.A., et al. Eosinopenia is a reliable marker of sepsis on admission to medical intensive care units. Critical Care. 2008; 12:R59, doi:10.1186/cc6883. [ Links ]
26. Bone R.C., Balk R.A., Cerra F.B. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conferen Definitions for sepsis and organ faliure and guidelines: Uses of innovative therapies in sepsis. Chest. 1992; 101:1644-55. [ Links ]
27. Knaus W.A., Draper E.A., Wagner D.P., Zimmerman J.E. APACHE II: A severity of disease classification system. Crit Care Med. 1985; 13:818-29. [ Links ]
28. Vincent J.L., Moreno R., Takala J., Willatts S., De Mendonça A., Bruining H., et al. The SOFA (Sepsis-related Organ Failure Assesment) score to describe organ disfunction/failure. On behalf of the Working Group of Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996; 22:707-10. [ Links ]
29. En: http://www.cdc.gov/ncidod/dhqp/a_z.html#. Infection Control A-Z Index of Centers for Disease Control and Prevention. [ Links ]
30. Kaminsky P., Deibener J., Lesesve J.F., Humbert J.C. Variations des paramètres de l´ hémogramme au cours des infection. Rev Med Intern. 2002; 23:132-6. [ Links ]
31. Gil H., Magy N., Mauny F., Dupond J.L. Value of eosinopenia in inflammatory disorders: An "old" to marker revisited. Rev Med Intern. 2003; 24:431-5. [ Links ]
32. Sevitt S. The spleen and blood eosinopenia. J Clin Pathol. 1955; 8:42-6. [ Links ]
33. Donoghue A.M., Sinclair M.J., Bats G.P. Heat exhaustion in a deep underground metalliferous mines. Occup Environ Med. 2000; 57:165-74. [ Links ]
34. Chen HX, Yin L, Peng CH, Zhou GW, Shen BY, Chen GM, et al. Clinical abdominal analysis of infectious complications following cluster transplantation. Zhonghua Wai Ke Za Zhi. 2007;45:319-2. [ Links ]
35. Leibovitz I., Zamir D., Polychuck I., Reitblat T., Gheorghiu D. Recurrent pneumonia post-thymectomy ace to manifestation of Good syndrome. Eur J Intern Med. 2003; 14:60-2. [ Links ]
36. Jorns G. Blood eosinophilia & eosinopenia from surgical point of view. Medizinische. 1958; 9:1196-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
marcel55@terra.es
(M. Sánchez Casado)
Recibido 11 Junio 2009
Aceptado 26 Noviembre 2009














