My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicina Intensiva
Print version ISSN 0210-5691
Med. Intensiva vol.35 n.6 Aug./Sep. 2011
PUESTA AL DÍA EN MEDICINA INTENSIVA: NOVEDADES EN RESUCITACIÓN
Novedades en soporte vital avanzado
Novelties in advanced life support
J.L. Pérez-Velaa,e, J.B. López-Messab,e, H. Martín-Hernándezc,e y P. Herrero-Ansolad,e
aHospital 12 de Octubre, Madrid, España
bComplejo Asistencial de Palencia, Palencia, España
cHospital Galdakao-Usansolo, Bizkaia, España
dServicio de Urgencias Médicas, SUMMA 112, Madrid, España
eComité Directivo PNRCP (SEMICYUC), Espana
Dirección para correspondencia
RESUMEN
Se presentan a continuación algunas de las novedades más importantes en soporte vital avanzado que incorporan las nuevas recomendaciones internacionales en resucitación de 2010. Se destacan los aspectos relacionados con la prevención y detección precoz de la parada cardiaca intrahospitalaria, la resucitación en el hospital, el nuevo algoritmo de soporte vital avanzado, las técnicas y dispositivos de resucitación cardiopulmonar, los cuidados posresucitación, la valoración del pronóstico de los pacientes que sobreviven inicialmente a la parada y aspectos específicos relativos a la donación de órganos a corazón parado y la creación de centros de referencia de parada cardiaca.
Palabras clave: Parada cardiaca. Resucitación. Soporte vital avanzado. Posresucitación. Pronóstico. Donación de órganos.
ABSTRACT
We present some of the most important developments in advanced life support incorporating the new international recommendations for resuscitation 2010. The study highlights aspects related to prevention and early detection of in-hospital cardiac arrest, resuscitation in the hospital, the new advanced life support algorithm, the techniques and devices for cardiopulmonary resuscitation, post-resuscitation care, assessment of the prognosis of patients who survive initially, and specific aspects of non-beating heart organ donation and the creation of cardiac arrest referral centers.
Key words: Cardiac arrest. Resuscitation. Advanced life support. Post-resuscitation. Prognosis. Organ donation.
Introducción
En octubre del pasado año 2010 se han publicado, de manera simultánea en las revistas Resuscitation1 y Circulation2, las Guías del ERC (European Resuscitation Council) y de la American Heart Association para la resucitación cardiopulmonar (RCP). Estas guías actualizan las previas, que se publicaron en el año 2005,y se basan en el más reciente Consenso Internacional sobre la Ciencia de la RCP con Recomendaciones de Tratamiento (CoSTR). De esta manera, en las guías actuales, se incorporan los resultados de revisiones sistemáticas, realizadas con una estricta metodología, de más de 270 temas relativos a la RCP y realizadas por más de 300 expertos internacionales.
Estas revisiones de la literatura, realizadas para responder las cuestiones que se habían planteado cada uno de los grupos de trabajo del International Liaison Commitee on Resuscitation, se realizaron mediante un worksheet estandarizado que incluía un sistema de graduación diseñado para definir el nivel de evidencia de cada estudio. La Conferencia Internacional de Consenso, celebrada en Dallas en febrero de 2010 y las conclusiones y recomendaciones publicadas de este proceso constituyen la base de las Guías del ERC 2010. Aunque las guías se derivan del documento CoSTR de 2010, representan el consenso entre los miembros del Comité Ejecutivo del ERC. Este comité considera que estas nuevas recomendaciones son las intervenciones más eficaces y fáciles de aprender que pueden ser apoyadas por los conocimientos, investigaciones y experiencia actuales.
Las guías actuales en soporte vital avanzado recomiendan algunos cambios con respecto a las anteriores3. Estos cambios son los que vamos a reflejar en la siguiente publicación, así como los motivos que han generado el cambio. Sin embargo, muchas de las recomendaciones formuladas en las guías del ERC 2005 no han cambiado en el año 2010, bien porque no se han publicado nuevos estudios o porque las nuevas evidencias desde 2005 simplemente han reforzado la evidencia ya disponible. Además, se presenta el algoritmo universal de soporte vital avanzado (SVA) actual.
De una manera didáctica, se presentan los cambios en las recomendaciones, diferenciados en los siguientes apartados:
1. Prevención de la parada cardiaca (PC) intrahospitalaria.
2. Resucitación en el hospital.
3. Algoritmo de SVA, simplificado.
4. Técnicas y dispositivos de RCP.
5. Cuidados posresucitación.
6. Pronóstico.
7. Donantes a «corazón parado» y centros de referencia de PC.
Prevención de la parada cardiaca intrahospitalaria
En las actuales recomendaciones se enfatiza la importancia del reconocimiento precoz del paciente hospitalizado que está deteriorándose y la posibilidad de evitar la evolución a la PC, resaltando así la prevención de ésta como primer eslabón de la cadena de supervivencia.
Para prevenir la PC intrahospitalaria, los hospitales deberían proporcionar un sistema de cuidados que incluya: a) la formación del personal sanitario para que sea capaz de reconocer los signos de deterioro del paciente y las razones para ofrecer una respuesta rápida a la enfermedad; b) una monitorización apropiada y regular de los signos vitales en los pacientes hospitalizados; c) unas guías claras (p. ej., por medio de criterios de llamada o de puntuaciones de signos de aviso o alarma) para ayudar al personal en la detección precoz del deterioro del paciente; d) un sistema uniforme y claro para pedir ayuda, y e) una respuesta clínica apropiada y a tiempo a las llamadas de petición de ayuda4.
Se proponen las siguientes estrategias para prevenir PC intrahospitalarias evitables:
1. Proporcionar cuidados a los pacientes que están en situación crítica o en riesgo de deterioro clínico en las áreas apropiadas5. Esto es, se deben proporcionar unos cuidados ajustados al nivel de gravedad de cada paciente.
2. Cada paciente debería tener un plan documentado para la monitorización de los signos vitales que se consideren oportunos, identificando las variables que necesitan medirse y la frecuencia de la medición, de acuerdo con la severidad de la enfermedad o la probabilidad de deterioro clínico. Las guías sugieren la monitorización de variables fisiológicas sencillas (frecuencia cardiaca, presión arterial, frecuencia respiratoria, nivel de conciencia, temperatura y SpO2)6-8. Utilizar una hoja de recogida de datos que permita la medición y registro regular de los signos vitales y, cuando se utilicen, las puntuaciones de aviso precoz.
3. Utilizar un sistema de rastreo y alarma («criterios de llamada» o sistema de aviso precoz) para identificar a los pacientes que están en situación crítica y/o en riesgo de deterioro clínico y PC9. En la Tabla 1 se muestra un ejemplo de store de aviso precoz para identificación de pacientes críticos, basado en la valoración de múltiples signos vitales10.
4. Proporcionar una respuesta clínica adecuada a la alteración de los parámetros fisiológicos, basada en el sistema de rastreo y alarma utilizado.
5. El hospital debería tener una respuesta claramente identificada a la enfermedad crítica. Esta puede incluir la designación de un equipo de resucitación capaz de responder en un tiempo adecuado a las situaciones clínicas agudas identificadas por el sistema de rastreo y alarma u otros indicadores. Este servicio debe estar disponible 24h al día. El equipo debe incluir personal capaz de resolver situaciones que requieran cuidados agudos o críticos.
6. Entrenar a todo el personal clínico en el reconocimiento, monitorización y manejo del paciente crítico. Hay que asegurar que el personal conoce su papel en el sistema de respuesta rápida.
7. Identificar a los pacientes para los cuales la PC es un evento terminal previsible y en los cuales la RCP es inapropiada, y los pacientes que no desean ser tratados con RCP11. Así, los hospitales deberían tener una política de «órdenes de no iniciar RCP», basada en guías nacionales, que sea comprendida por todo el personal clínico.
8. Asegurar una auditoría de PC, «falsa parada», muertes inesperadas e ingresos en UCI no previstos utilizando bases de datos comunes. Hay que auditar también los antecedentes y la respuesta clínica a estos eventos.
Resucitación en el hospital
Cuando sucede una PC en el hospital, la división entre el soporte vital básico (SVB) y el soporte vital avanzado es arbitraria; en la práctica, el proceso de resucitación es un continuum y se basa en el sentido común aplicado a cada situación concreta.
Las PC deben ser reconocidas inmediatamente y se ha de pedir ayuda utilizando un número de teléfono estándar preestablecido. Se debe comenzar la RCP de manera inmediata, utilizando accesorios de vía aérea (p. ej., mascarilla de bolsillo) y, si está indicado, se debe llevar a cabo la desfibrilación tan rápidamente como sea posible (y, en cualquier caso, antes de 3min de producirse la parada).
La secuencia exacta de acciones tras una PC intrahospitalaria dependerá de muchos factores, incluyendo:
- La localización donde se produce la parada (área clínica/no clínica; área monitorizada/no monitorizada). Los pacientes que tienen paradas monitorizadas, en general, son diagnosticados rápidamente. De modo diferente, los pacientes de planta pueden haber tenido un periodo de deterioro y una parada no presenciada. Idealmente, todos los pacientes que tienen un alto riesgo de PC deberían ser atendidos en un área monitorizada donde se disponga de medios para una resucitación inmediata.
- Entrenamiento de los primeros respondedores y número de respondedores. En principio, se recomienda que todos los profesionales sanitarios deben ser capaces de reconocer una PC, pedir ayuda y empezar las maniobras de RCP. Cada profesional sanitario hospitalario debería hacer lo que ha sido entrenado para hacer, ya que pueden tener diferentes niveles de entrenamiento y pericia para manejar la vía aérea, respiración y circulación. Así, los reanimadores deben llevar a cabo solamente las habilidades en las cuales están entrenados y son competentes. Cuando hay solo un respondedor, este debe asegurarse de que se ha pedido ayuda y de que esta está en camino. Si son varios los profesionales disponibles, se pueden llevar a cabo varias acciones simultáneamente.
- Equipo disponible y sistema de respuesta hospitalaria a la PC y emergencias médicas. Todas las áreas clínicas deberían tener acceso inmediato al equipo de resucitación y a fármacos para facilitar la rápida resucitación del paciente en PC. El equipo para utilizar en la RCP (incluidos los desfibriladores), su distribución y la medicación deberían estar estandarizados por todo el hospital12. El equipo de resucitación puede tomar la forma de un equipo de PC tradicional, que es avisado solamente cuando se reconoce una PC. Pero, de modo alternativo, los hospitales pueden tener estrategias para reconocer a los pacientes en riesgo de PC y llamar a un equipo, por ejemplo, equipo de emergencias médicas, antes de que ocurra la PC. Las PC intrahospitalarias raramente son súbitas o inesperadas; una estrategia que incluya el reconocimiento de los pacientes en riesgo de PC puede ser capaz de prevenir algunas de estas paradas, o puede evitar intentos fútiles de resucitación en aquellos que es improbable que se beneficien de la RCP.
Acciones inmediatas en un paciente colapsado en un hospital
En la Figura 1 se muestra el algoritmo general para el manejo inicial de la PC intrahospitalaria:
- Asegurar la seguridad del personal que atiende la parada.
- Comprobar si la víctima responde.
- Cuando los profesionales sanitarios ven que un paciente sufre un colapso o encuentran a un paciente aparentemente inconsciente en un área clínica, lo primero deberían gritar pidiendo ayuda y luego valorar si el paciente responde. Hay que zarandear por los hombros y preguntarle en voz alta: «¿Se encuentra bien?».
- Si hay cerca otros miembros del personal, será posible llevar a cabo acciones de forma simultánea.
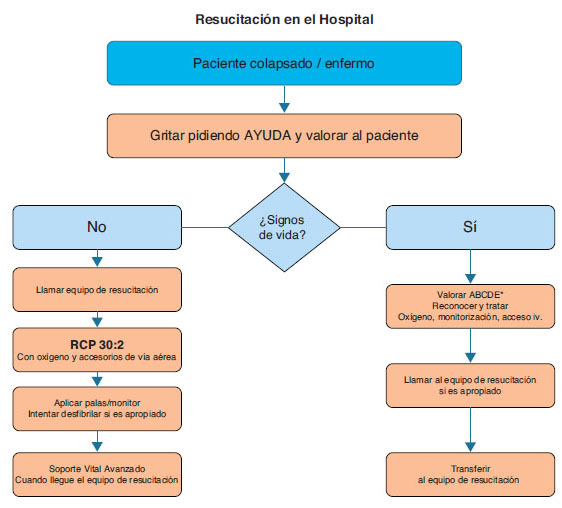
Figura 1. Algoritmo para el tratamiento de la parada cardiaca en el hospital.
*vía Aérea, Respiración, Circulación, Discapacidad, Exposición
En el caso de que el paciente responde: se requiere valoración médica urgente. Esta dependerá de los protocolos de atención al paciente crítico agudo de cada hospital. Mientras se espera la asistencia, se debe administrar oxígeno al paciente, monitorizar e insertar una cánula intravenosa.
En el caso en que el paciente no responde: la secuencia de acciones exacta dependerá del entrenamiento del personal que atiende al paciente y de la experiencia en valorar la respiración y circulación. Se debe tener en cuenta que, el personal sanitario, aun entrenado puede no valorar la respiración y el pulso de modo suficientemente fiable para confirmar la PC. La respiración agónica (boqueadas ocasionales, respiración lenta, laboriosa o ruidosa) es un signo de PC, que no debería confundirse como un signo de vida/circulación. Se debe actuar siguiendo la secuencia siguiente:
1. Gritar pidiendo ayuda (si no se ha pedido ya).
2. Girar a la víctima sobre su espalda y abrir la vía aérea.
3. Abrir la vía aérea y comprobar si respira:
- Abrir la vía aérea utilizando la maniobra «frente mentón».
- Mirar en la boca. Si hay un cuerpo extraño o resto visible, intentar extraerlo.
- Si se sospecha que puede haber habido una lesión de cuello, intentar abrir la vía aérea utilizando tracción mandibular. Si se dispone de suficientes reanimadores, hay que utilizar una estabilización manual alineada para minimizar el movimiento de la cabeza. Los esfuerzos por proteger la columna cervical no deben poner en riesgo la oxigenación y la ventilación.
- Manteniendo abierta la vía aérea, mirar si se mueve el tórax, escuchar en la boca del paciente si hay ruidos respiratorios y sentir el aire en la mejilla, para valorar una respiración normal. No debe tardarse más de 10s para determinar si la víctima está respirando normalmente.
4. Comprobar los signos de circulación:
- Si el paciente no tiene signos de vida (consciencia, movimientos con propósito, respiración normal, o tos), comenzar las maniobras de RCP hasta que llegue ayuda más experimentada o el paciente presente signos de vida.
- Aquellos que tengan experiencia en la valoración clínica, deberían valorar el pulso carotídeo, mientras simultáneamente buscan signos de vida, durante no más de 10s.
- Si el paciente parece no tener signos de vida, o si hay dudas, comenzar la RCP inmediatamente. La administración de compresiones torácicas a un paciente con un corazón que late es poco probable que produzca daño. Sin embargo, los retrasos en diagnosticar la PC y en comenzar la RCP afectarán de modo adverso a la supervivencia, por lo que deben ser evitados.
Si hay pulso o signos de vida, se requiere una valoración médica urgente.
Si no hay respiración, pero hay pulso (parada respiratoria), hay que ventilar al paciente y comprobar la circulación cada 10 respiraciones.
Comienzo de la RCP en el hospital
- Una persona comienza la RCP mientras otros llaman al equipo de resucitación y recogen el equipamiento de resucitación y el desfibrilador. Si sólo está presente un miembro del personal, esto significará dejar momentáneamente al paciente.
- Dar 30 compresiones torácicas seguidas de 2 ventilaciones.
- Minimizar las interrupciones y asegurar compresiones de alta calidad.
- Mantener la vía aérea y ventilar los pulmones con el equipamiento más apropiado que se tenga inmediatamente disponible: mascarillas de bolsillo, dispositivos supraglóticos y un balón autoinflable o un balón-mascarilla, según la política local. La intubación traqueal sólo debería intentarse por aquellos que estén entrenados, sean competentes y experimentados en esta técnica.
- Administrar suficiente volumen como para producir una elevación normal del tórax. Añadir oxígeno suplementario tan pronto como sea posible.
- Una vez se ha intubado la tráquea del paciente o se ha insertado un dispositivo supraglótico, continuar con las compresiones torácicas de manera ininterrumpida (excepto para desfibrilación o comprobación del pulso cuando esté indicado), a una frecuencia de al menos 100min-1, y ventilar los pulmones a 10 respiraciones min-1,aproximadamente.
- Cuando llegue el desfibrilador, hay que aplicar las palas al paciente y analizar el ritmo en la parada. Si se dispone de parches de desfibrilación autoadhesivos, colóquelos sin interrumpir las compresiones torácicas. La utilización de parches autoadhesivos o la técnica de un «vistazo rápido» con las palas permitirá una rápida valoración del ritmo cardiaco. Con un desfibrilador manual, si el ritmo es fibrilación ventricular/taquicardia ventricular sin pulso (FV/TV) cargue el desfibrilador mientras otro reanimador continúa las compresiones torácicas. Una vez cargado el desfibrilador, dar una descarga. Si se utiliza un desfibrilador externo automático (DEA) seguir las indicaciones audio-visuales del DEA.
- Reiniciar las compresiones torácicas inmediatamente tras el intento de desfibrilación. Minimizar las interrupciones de las compresiones torácicas.
- Continuar la resucitación hasta que llegue el equipo de resucitación o el paciente muestre signos de vida. Seguir las indicaciones de voz si se utiliza un DEA. Si estamos usando un desfibrilador manual, seguir el algoritmo universal de soporte vital avanzado (Figura 2).
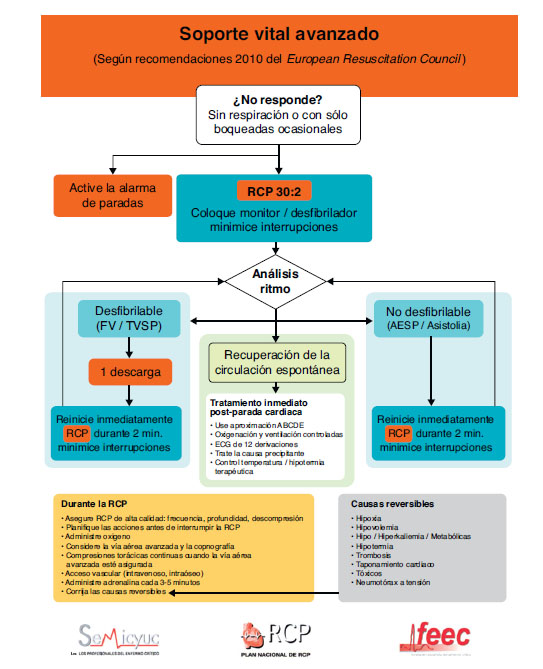
Figura 2. Algoritmo de soporte vital avanzado en la parada cardiaca.
- Una vez que la resucitación está en marcha, y si hay suficiente personal presente, hay que preparar una cánula intravenosa y los fármacos que probablemente van a ser utilizados (p. ej., adrenalina).
- Incluso breves interrupciones de las compresiones torácicas empeoran el pronóstico, por lo que se deben hacer todos los esfuerzos para asegurar que se mantiene una compresión torácica efectiva continua a todo lo largo del intento de resucitación. El líder del equipo debería monitorizar la calidad de la RCP y alternar a los participantes en la RCP si la calidad de la misma es pobre.
Algoritmo de soporte vital avanzado universal «simplificado»
El algoritmo universal de SVA de las recomendaciones ERC 2010 (Figura 2) es similar al previo del año 2005, pero en el desarrollo de las recomendaciones podemos encontrar algunos cambios relevantes y, sobre todo, un diferente énfasis en alguna de ellas. En general, se prioriza la simplificación y la racionalización para facilitar la aplicación del algoritmo. Cabe destacar:
1. Las intervenciones que, sin duda, contribuyen a mejorar la supervivencia en una PC son el SVB efectivo, con compresiones ininterrumpidas de alta calidad, y la desfibrilación precoz en la FV/TV. Así, se hace especial hincapié en la realización de una RCP de calidad13. Esto incluiría:
- Realización de compresiones torácicas de alta calidad, con una profundidad adecuada (aproximadamente 5cm) y permitiendo una completa expansión de la caja torácica. Si la vía aérea no está aislada, mantener una relación compresión:ventilación 30:2; en caso de tener aislada la vía aérea la frecuencia será de 100 lat/min.
- Las compresiones deben ser interrumpidas lo mínimo posible durante toda la reanimación14,15. Deben ser sólo brevemente interrumpidas para permitir intervenciones específicas, como la desfibrilación o la intubación traqueal. Un retraso de tan solo 5-10s es suficiente para reducir las posibilidades de éxito de la PC. Para disminuir la pausa predescarga, se deben mantener las compresiones torácicas mientras se carga el desfibrilador16,17. Sin valorar el ritmo cardiaco, ni palpar el pulso, se deben reanudar las compresiones torácicas inmediatamente tras la descarga. Incluso en los casos en los que la descarga es exitosa y restaura un ritmo con perfusión, se tarda un tiempo hasta que se establece la circulación posdescarga.
- Evitar una excesiva ventilación.
2. Se sigue haciendo especial énfasis en la desfibrilación precoz en los pacientes con PC con ritmos desfibrilables18-20. Se mantiene igual que en las recomendaciones previas el protocolo de 1 descarga frente a la secuencia de 3 descargas para los ritmos desfibrilables, los mismos niveles de energía, tanto en ondas mono como bifásicas, y el aumento del voltaje para la segunda descarga y las siguientes, en lugar de mantener un voltaje fijo (en desfibriladores con onda bifásica).
3. A diferencia de otras situaciones clínicas, se recomienda la administración de hasta tres descargas rápidas consecutivas (agrupadas) en la fibrilación ventricular/taquicardia ventricular sin pulso (FV/TV) que ocurre en la sala de cateterismo cardíaco o en el período inmediato post-operatorio tras la cirugía cardiaca21. Esta estrategia también puede ser considerada en el caso de PC presenciada con FV/TV, cuando el paciente ya está conectado a un desfibrilador manual.
4. En el caso de PCR extrahospitalaria, se elimina la recomendación de realizar un período predeterminado de RCP antes de la desfibrilación tras una PC no presenciada por los servicios de emergencias médicas (SEM)16,22-24.
5. Para la administración de fármacos, se sigue recomendando el establecimiento de un acceso venoso periférico por la rapidez, eficacia y seguridad de la técnica. En el caso que no se pueda conseguir un acceso intravenoso en los primeros 2min de reanimación, se debe intentar conseguir una vía intraósea (IO) para la administración de los fármacos. La disponibilidad cada vez mayor de estos dispositivos ha aumentado la facilidad de realizar esta técnica25,26. Las dosis por vía IO son las mismas que por vía intravenosa. Esta ruta de administración se ha mostrado segura y eficaz27,28.
6. Tratamiento farmacológico. A pesar de la falta de datos, en estudios clínicos en humanos, que demuestren una mejoría en la supervivencia, en las guías actuales de 2010 se sigue manteniendo la adrenalina como único fármaco vasopresor en el tratamiento de la PC.
- Los fármacos solo deben ser considerados después de la administración de las descargas iniciales (si están indicadas) y de haber comenzado las compresiones torácicas y la ventilación. Por tanto, durante el tratamiento de la PC por FV/TV, se debe administrar 1mg de adrenalina después de la tercera descarga, una vez se han reiniciado las compresiones torácicas, y después cada 3-5min (durante ciclos alternos de RCP). No se debe interrumpir la RCP para realizar la administración de fármacos. No hay vasopresores alternativos que mejoren la supervivencia cuando se comparan con la adrenalina.
- Aunque no hay evidencia de que la administración de ningún fármaco antiarrítmico, de forma rutinaria, aumente la supervivencia al alta hospitalaria, en estas guías se mantiene igual la recomendación de administrar amiodarona en la FV refractaria29,30, después de la tercera descarga. También igual dosis: 300mg la primera dosis y perfusión de 900mg en 24h. Se puede administrar una posterior dosis en bolo de 150mg.
- Se reconoce que la asistolia es debida fundamentalmente a patología miocárdica primaria más que a un excesivo tono vagal y que no hay evidencia clara que el uso de atropina mejore los resultados en la PC31,32. Por ello, a diferencia de las anteriores guías de 2005, ya no se recomienda la utilización rutinaria de atropina en la asistolia o actividad eléctrica sin pulso (AESP) y se ha eliminado del algoritmo de SVA. Solo se usaría en el contexto de bradiarritmias.
- En los últimos años se han realizado múltiples estudios analizando el papel del tratamiento fibrinolítico en el contexto de la PC, para deshacer el trombo arterial coronario y/o pulmonar. Las conclusiones son que este tratamiento no se debe utilizar de manera rutinaria en la PC, pero se debe considerar cuando la PC está causada por una embolia pulmonar aguda, bien diagnosticada o bien sospechada33-36. Una RCP en curso no es una contraindicación para la fibrinólisis.
7. Se reduce el énfasis en la intubación traqueal precoz. Debería realizarse solo por reanimadores con alta pericia en la técnica, ejecutándola con mínima interrupción de las compresiones torácicas. Sólo se debería hacer una pequeña pausa en las compresiones para pasar el tubo a través de las cuerdas vocales (una pausa que no debería sobrepasar los 10s). Como alternativa, para evitar las interrupciones se puede diferir el intento de intubación traqueal hasta que se produzca la recuperación de la circulación espontanea37. No hay datos clínicos concluyentes de que la intubación temprana mejore la supervivencia sin secuelas al alta hospitalaria. Cuando el personal que atiende la PC no esté entrenado en la intubación traqueal, se consideran alternativas aceptables para el aislamiento de la vía aérea los dispositivos supraglóticos (p. ej., mascarilla laríngea).
8. Dado que cuando se administran fármacos por vía traqueal la concentración plasmática es impredecible, la dosis óptima de los fármacos se desconoce y, por otro lado, hay una mayor disponibilidad actual de dispositivos intraóseos, ya no se recomienda la administración de fármacos a través del tubo traqueal. La administración de fármacos a través de un dispositivo supraglótico es aún menos fiable.
9. Similar a las recomendaciones previas, en la actualidad no se recomienda el uso rutinario de ningún dispositivo circulatorio que sustituya a las compresiones manuales. Sin embargo, en determinados pacientes que precisan maniobras de RCP prolongadas, como es el caso de los traslados, la hipotermia, el embolismo pulmonar que se ha fibrinolisado, los pacientes que son sometidos a tomografía computarizada o intervención coronaria percutánea (ICP), se están usando dispositivos mecánicos.
10. Se mantiene igual la importancia sobre la corrección de las potenciales causas reversibles, manteniendo la regla nemotécnica de las 4 «Hs» y las 4 «Ts».
Las figuras 3 y 4 resumen, de manera esquemática, las secuencias de actuación en la PC, tanto en los ritmos desfibrilables como en los no desfibrilables, respectivamente.

Figura 3. Secuencia de actuación en la parada cardiaca. Ritmo desfibrilable.
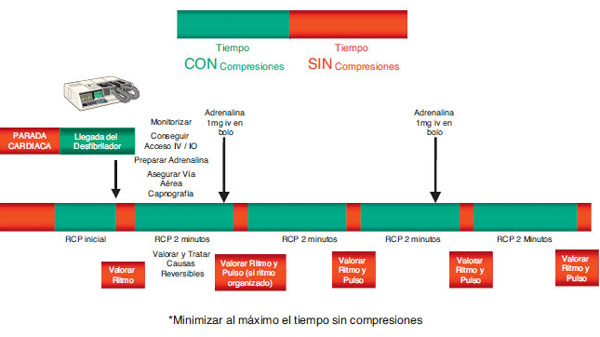
Figura 4. Secuencia de actuación en la parada cardiaca. Ritmo no desfibrilable.
Técnicas y dispositivos de resucitación cardiopulmonar
En cuanto a las diferentes técnicas y dispositivos que se utilizan durante las maniobras de RCP, debemos destacar:
1. Se disminuye el énfasis sobre el papel del golpe precordial38,39. El golpe precordial no debe utilizarse en PC extrahospitalarias no presenciadas. Su uso debe plantearse en los pacientes con TV presenciada, monitorizada e inestable (incluida la TV sin pulso), si no se puede usar inmediatamente un desfibrilador; pero no debe retrasar ni las maniobras de RCP ni la administración de descargas de un desfibrilador.
2. En las anteriores guías de 2005 se recomendaba utilizar un detector de CO2 exhalado para confirmar la colocación del tubo traqueal; además, se señalaba que la monitorización de end-tidal CO2 (PetCO2) podía ser útil como indicador no invasivo del gasto cardiaco que se generaba durante las maniobras de RCP. En las actuales guías de 2010, se hace un mayor énfasis en el uso de capnografía, recomendando el registro cuantitativo de la onda de capnografía para confirmar y vigilar de forma continua la posición del tubo traqueal, monitorizar la calidad de la RCP y para proporcionar una indicación temprana de la recuperación de la circulación espontánea (RCE). Aunque hay otros métodos disponibles para confirmar la colocación del tubo traqueal, el registro continuo de la onda de capnografía es el más fiable40,41. La monitorización de esta onda es especialmente importante en momentos en los que el tubo traqueal se puede desplazar y descolocar, como es el caso de los traslados o transferencia de los pacientes. Para que el capnógrafo pueda medir el CO2 exhalado, se precisa que el flujo sanguíneo circule a través del pulmón. De esta manera, unas compresiones ineficaces, una disminución del gasto cardiaco o una nueva situación de PC (en un paciente que ya había recuperado la circulación espontánea) se asocian con una disminución de la PetCO2. A diferencia, el restablecimiento de la circulación espontánea genera un aumento en la PetCO2.
3. Se reconoce el potencial papel de la ecografía en el SVA. Aunque ningún estudio ha demostrado que la utilización de los ultrasonidos mejore el pronóstico en la PC, está claro que la ecocardiografía tiene el potencial para detectar varias de las causas potencialmente reversibles de PC (p. ej., taponamiento pericárdico, embolismo pulmonar, hipovolemia, neumotórax)42,43,44. No obstante, la integración de los ultrasonidos en el SVA requiere un importante entrenamiento para poder realizarlo solo en determinadas situaciones y con un mínimo de interrupciones de las compresiones torácicas (intentando conseguir las imágenes «útiles» en menos 10s). Se recomienda la ventana subxifoidea de la sonda45.
Cuidados posresucitación
A diferencia de las guías previas de 2005, en las actuales del año 2010 se presta una especial atención e importancia al síndrome post-PC y una gran relevancia a los cuidados posresucitación. El síndrome post-PC comprende la lesión cerebral post-PC, la disfunción miocárdica posparada, la respuesta sistémica a la isquemia/reperfusión y la persistencia de la patología precipitante46. La severidad de este síndrome variará dependiendo de la duración y de la causa de la PC. La lesión cerebral post-PC puede exacerbarse por el fallo en la microcirculación, por deterioro de la autorregulación, hipercapnia, hiperoxia, fiebre, hiperglucemia y convulsiones.
Se reconoce de una manera clara que el éxito en la RCE es sólo el primer paso hacia el objetivo de la recuperación completa de la PC. Es importante reconocer que el tratamiento que reciben durante este periodo posresucitación influye significativamente en el pronóstico neurológico final47-49. La fase posresucitación comienza en el lugar donde se consigue la RCE pero, una vez estabilizado, el paciente debe ser transferido a un área de cuidados intensivos, para monitorización continua y tratamiento. En la Figura 5 y en la Tabla 2 se resumen las acciones y abordaje multisistémico que se debe seguir en los cuidados posresucitación en el paciente adulto.

Figura 5. Cuidados inmediatos posparada cardiaca en el adulto.
Los cambios más importantes que podemos observar en las guías actuales los podemos resumir en:
1. Destacar el reconocimiento de que la implementación de un protocolo de tratamiento posresucitación detallado y estructurado puede mejorar la supervivencia de las víctimas de PC tras la RCE50.
2. Vía aérea y ventilación. Como en las guías previas, se debe considerar la intubación traqueal, sedación y ventilación mecánica en cualquier paciente con alteración de la función cerebral. Se destaca y enfatiza que tanto la hipoxemia como la hipercapnia aumentan la probabilidad de una ulterior PC y pueden contribuir a la lesión cerebral secundaria. Varios estudios en animales indican que la hipoxemia causa estrés oxidativo y lesiona las neuronas post-isquémicas51. En un estudio experimental y en un registro clínico se ha documentado que la hiperoxemia posresucitación se asociaba con peor pronóstico comparado con normo o hipoxemia52. En la práctica clínica, se recomienda ajustar la fracción inspirada de oxígeno para mantener la saturación arterial de oxígeno (por gasometría y/o pulsioximetría) en el rango de 94-98%, lo que podríamos denominar «reoxigenación controlada».
Tras la PC, la hipocapnia inducida por la hiperventilación produce isquemia cerebral (por vasoconstricción cerebral y descenso en el flujo sanguíneo cerebral). No hay datos que apoyen el objetivo de una PCO2 arterial específica tras la resucitación, pero parece razonable ajustar la ventilación para conseguir normocapnia y monitorizarla utilizando la capnografía y los valores de gasometría arterial.
3. Circulación: se da un mayor énfasis al uso de la ICP primaria en los pacientes apropiados, incluyendo los comatosos, con RCE mantenida tras PC. Dado el alto porcentaje de enfermos que sufren una PC y presentan una enfermedad arterial coronaria y está bien establecido que a los pacientes post-PC con infarto agudo de miocardio (IAM) con elevación de ST se les debería realizar una coronariografía e ICP de forma precoz, se recomienda considerar esta intervención en todos los pacientes post-PC en los que se tenga sospecha de tener enfermedad coronaria50,53-56. Además, varios estudios indican que la combinación de hipotermia terapéutica e ICP es factible y segura tras la PC causada por IAM50,57,58.
El tratamiento de la inestabilidad hemodinámica posparada con fluidos, inotropos y vasopresores puede ser guiado por parámetros fisiológicos y de laboratorio, como la presión arterial, la frecuencia cardiaca, la diuresis, el lactato plasmático y las saturaciones venosas centrales de oxígeno. Aunque la terapia precoz dirigida por objetivos está bien establecida en el tratamiento de la sepsis y se ha propuesto como estrategia terapéutica tras la PC, no hay datos de estudios controlados y aleatorizados que avalen su uso rutinario. Hay que tomar como objetivo la presión arterial media para conseguir una diuresis adecuada (1mlkg-1h-1) y valores de lactato plasmático normales o en descenso, tomando en consideración la presión arterial normal del paciente, la causa de la parada y la severidad de cualquier disfunción miocárdica.
4. Control de convulsiones: las convulsiones aumentan el metabolismo cerebral y pueden causar lesión cerebral. De manera similar a las guías anteriores, hay que tratar de manera inmediata y eficaz las crisis convulsivas con benzodiacepinas, fenitoína, valproato sódico, propofol o un barbitúrico. Las mioclonías pueden ser muy difíciles de tratar; el clonacepam es el fármaco más efectivo, pero el valproato sódico, el levetiracetam y el propofol pueden ser alternativas efectivas. No hay estudios que avalen de una manera definitiva el uso de fármacos anticomiciales profilácticos tras la PC en los adultos.
5. Control de la glucemia: hay una fuerte asociación entre los niveles de glucemia elevados tras la resucitación de una PC y el mal pronóstico neurológico del paciente, por lo que se recomienda su control. En las guías de resucitación 2010, se ha revisado la recomendación sobre el control de la glucosa. Basándose en los datos disponibles en el momento de redactar las guías, se recomienda que los niveles de glucemia tras la RCE deberían mantenerse < 10mmoll-1 (180mg/dl)59. La hipoglucemia severa está asociada a un aumento en la mortalidad en los pacientes críticos60, y los pacientes comatosos tienen un riesgo particular de hipoglucemia desapercibida. Por tanto, se recuerda la necesidad de evitar la hipoglucemia. El control estricto de la glucemia (72-108mg/dl-1, 4-6mmol/l-1) no debe implementarse en los pacientes adultos con RCE tras la PC por el riesgo aumentado de hipoglucemia.
6. Hipotermia terapéutica: de una manera más clara y en el contexto de unos cuidados posresucitación más globales, en estas recomendaciones en resucitación del año 2010, se destaca el papel clave de la hipotermia terapéutica. El uso de esta técnica incluiría a los supervivientes comatosos de PC asociada inicialmente tanto a ritmos no desfibrilables como a ritmos desfibrilables. Se reconoce el menor nivel de evidencia para su empleo tras PC por ritmos no desfibrilables.
En las recomendaciones, se revisan detenidamente:
- Las bases fisiológicas que explican por qué la hipotermia moderada ha mostrado ser neuroprotectora y mejorar el pronóstico tras un periodo de hipoxia-isquemia cerebral global61.
- ¿Qué pacientes post-PC deben ser enfriados? Hay buena evidencia apoyando el uso de hipotermia inducida en supervivientes comatosos de PC extrahospitalaria causada por ritmos desfibrilables. Parece razonable extrapolar estos datos a otros tipos de PC, con otros ritmos iniciales o paradas intrahospitalarias, aunque esto se apoya en datos de estudios de menor nivel.
- ¿Cómo enfriar? En las guías se revisan las diferentes técnicas posibles para realizar la inducción y el mantenimiento de la hipotermia, así como la manera de realizar posteriormente el recalentamiento. Para iniciar el enfriamiento pueden usarse técnicas externas y/o internas. La infusión de 30ml/kg-1 de salino a 4oC disminuye la temperatura central aproximadamente 1,5oC62-65 y ha mostrado ser segura y eficaz, pudiendo utilizarse para iniciar el enfriamiento desde el medio prehospitalario66,67. En la fase de mantenimiento es preferible un método de enfriamiento con monitorización efectiva de la temperatura, para evitar las fluctuaciones de la misma. La temperatura habitualmente se monitoriza en vejiga y/o esófago. No hay datos que indiquen que una técnica específica de enfriamiento aumente la supervivencia cuando se compara con cualquier otra técnica de enfriamiento; sin embargo, los dispositivos internos permiten un control más preciso de la temperatura comparados con las técnicas externas. El recalentamiento se debe realizar lentamente: aunque la velocidad óptima no se conoce, el consenso actual está en recalentar a una velocidad de 0,25-0,5oC por hora68.
- ¿Cuándo enfriar? Datos en estudios experimentales indican que el enfriamiento más precoz tras la RCE produce mejores pronósticos69. Aunque hay varios estudios clínicos que han mostrado que la hipotermia puede ser iniciada de una manera precoz, en el ámbito prehospitalario, hasta ahora, no hay datos en humanos que prueben que un objetivo de temperatura por tiempo produzca mejores pronósticos.
- También se revisan los efectos fisiológicos, complicaciones y contraindicaciones de la hipotermia, lo que facilita la comprensión de la técnica y su aplicación en la práctica clínica.
7. Otros tratamientos. En las actuales guías se revisa la literatura publicada acerca de los fármacos neuroprotectores (coenzima Q10, tiopental, glucocorticoides, nimodipino, lidoflazina o diacepam) utilizados solos, o añadidos a la hipotermia terapéutica. Se destaca que no se ha demostrado que aumenten la supervivencia con situación neurológica intacta cuando se incluían en el tratamiento post-PC. También hay evidencia insuficiente para apoyar el uso rutinario de la hemofiltración de alto volumen para mejorar el pronóstico neurológico en los pacientes con RCE tras la PC.
Pronóstico
En las guías de resucitación del año 2010, se destaca el reconocimiento de que muchos de los predictores de mal pronóstico aceptados en los supervivientes comatosos de una PC no son fiables, especialmente si el paciente ha sido tratado con hipotermia terapéutica. En general, se revisan potenciales predictores:
- Exploración clínica. No hay ningún signo clínico neurológico que prediga de manera fiable mal pronóstico (categoría de función cerebral [Cerebral Performance Category], CPC, 3 o 4, o muerte] en menos de 24h tras la PC. La ausencia de reflejos pupilares a la luz y corneal más de 72h, puede predecir fiablemente mal pronóstico70 en los pacientes adultos que están comatosos, que no han sido tratados con hipotermia, y que no presentan factores de confusión (tales como hipotensión, sedantes, o relajantes musculares).
- Marcadores bioquímicos. Aunque se han estudiado muchos marcadores, la evidencia actual no apoya el uso de los biomarcadores séricos o en líquido cefalorraquídeo, de manera aislada, como predictores de mal pronóstico en pacientes comatosos tras PC, reciban o no tratamiento con hipotermia terapéutica. Esto es debido a las limitaciones que presentan los estudios realizados, que incluyen un número pequeño de pacientes y/o a la inconsistencia en los valores de corte para predecir mal pronóstico.
- Estudios electrofisiológicos: ningún estudio electrofisiológico predice, de manera completamente fiable, el pronóstico de un paciente comatoso en las primeras 24h tras la PC. En ausencia de circunstancias que produzcan confusión (sedación, hipotensión, hipotermia o hipoxemia), puede ser razonable utilizar el EEG (identificando supresión generalizada a menos de 20μV, patrón de salva supresión con actividad epiléptica generalizada, o complejos periódicos difusos sobre una actividad basal aplanada) realizándolo entre las 24 y 72h tras la RCE para ayudar a predecir un mal pronóstico en supervivientes comatosos de PC no tratada con hipotermia71. Si se miden los potenciales evocados somatosensoriales (PESS) tras 24h en supervivientes comatosos de PC, no tratados con hipotermia terapéutica, la ausencia bilateral de la respuesta cortical N20 a la estimulación del nervio mediano predice mal pronóstico (muerte o CPC 3 o 4)69.
- Estudios de imagen. Tampoco se han encontrado estudios de nivel uno o nivel dos que apoyen el uso de ninguna modalidad de imagen para predecir, de manera fiable, el pronóstico en supervivientes comatosos tras PC. En conjunto, los estudios de imagen que se han llevado a cabo están limitados por los pequeños tamaños muestrales, la variabilidad en el momento de realizar la imagen, la ausencia de comparación con un método de pronóstico estandarizado, y por la retirada precoz de cuidados. A pesar de su enorme potencial, no se recomienda la neuroimagen, para tomar decisiones, de manera rutinaria, para este propósito.
Como se ha comentado previamente, resulta más complicado todavía, en los pacientes en los que se realiza hipotermia terapéutica posparada. No podemos encontrar una adecuada evidencia para recomendar una aproximación específica a la hora de predecir el mal pronóstico. No se han encontrado signos clínicos neurológicos, estudios electrofisiológicos, biomarcadores ni técnicas de imagen que puedan predecir, de manera fiable, el pronóstico neurológico en las primeras 24h tras la PC. Basados en la limitada evidencia disponible, los predictores de mal pronóstico potencialmente más fiables en pacientes tratados con hipotermia terapéutica son la ausencia bilateral del pico N20 en los PESS > 24 horas tras PC (TFP 0%, IC del 95%, 0-69%) y la ausencia de reflejos corneales y pupilares a los 3 o más días tras la PC (TFP 0%, ICP del 95%, IC 0-48%)72,73. En un estudio realizado en pacientes tratados con hipotermia terapéutica posparada, se desarrolló una regla de decisión usando un conjunto de datos (clínicos y electrofisiológicos) y demostró que la presencia de dos predictores independientes de mal pronóstico neurológico (recuperación incompleta de los reflejos de tronco, mioclonías precoces, electroencefalograma arreactivo y ausencia bilateral cortical de PESS) presentaban un mal pronóstico neurológico con una tasa de falsos positivos de 0% (IC del 95%, 0-14%). En general, y dada la limitada evidencia disponible, las decisiones de limitar los cuidados no deberían tomarse en base a los resultados de una única herramienta pronóstica.
Donación de órganos y centros de parada cardiaca
Por último, en estas recientes guías de resucitación de 2010, se plantean dos conceptos a tener presente en el contexto de la resucitación. En primer lugar, dado que se han trasplantado con éxito órganos sólidos después de la muerte cardiaca, se plantea cómo alguno de los pacientes tras una PC, ofrecen la oportunidad de incrementar el pool de donantes de órganos (donantes a «corazón parado»), que tanto escasean en relación a la demanda de los potenciales receptores. La función del injerto tras el trasplante está influenciada por la duración del tiempo de isquemia caliente desde el cese del gasto cardiaco hasta que se realiza la preservación del órgano. Cuando se prevé un retraso en el inicio de la preservación del órgano, los dispositivos mecánicos de compresión torácica pueden ser útiles para mantener una adecuada perfusión orgánica, mientras que se llevan a cabo los pasos necesarios para permitir la donación de órganos74.
Existe una enorme variabilidad en la supervivencia entre los distintos hospitales que atienden pacientes resucitados de PC. Existe alguna evidencia de bajo nivel de que las UCI que ingresan más pacientes post-PC al año presentan una mejor tasa de supervivencia que aquellas que ingresan menos. Varios estudios han mostrado una mejoría en la supervivencia tras la implementación de un paquete de medidas de cuidados posresucitación que incluyen la hipotermia terapéutica y la ICP. Por otro lado, varios estudios de PC extrahospitalaria en adultos no demostraron ningún efecto del intervalo del traslado, desde la escena hasta el hospital receptor, sobre la supervivencia al alta hospitalaria si se conseguía la RCE en la escena y los intervalos de traslado eran cortos (3 a 11min)75,76. Esto implica que puede ser seguro no llevar al paciente posparada a hospitales locales y trasladarle a un centro de PC regional. Hay evidencia indirecta de que los sistemas sanitarios de resucitación cardiaca regionales mejoran el pronóstico del infarto de miocardio con elevación del segmento ST. La consecuencia de todos estos datos es que los centros y los sistemas sanitarios especializados de PC pueden ser efectivos, pero todavía no hay evidencia directa que apoye esta hipótesis77,78.
Sumario de los cambios desde las Guías de 2005
Finalmente, debemos señalar que muchas de las recomendaciones de las Guías ERC de 2005 permanecen sin cambios, bien porque no se han publicado nuevos estudios o porque la nueva evidencia desde el 2005 simplemente ha reforzado la evidencia que ya estaba disponible. Sin embargo, la evidencia publicada desde 2005 orienta a la necesidad de cambios en algunas partes de las Guías 2010. Los cambios de 2010 en relación con las Guías de 2005, en lo referente a soporte vital avanzado, son de forma resumida3:
- Mayor énfasis en la importancia de las compresiones torácicas de alta calidad mínimamente interrumpidas a todo lo largo de cualquier intervención de SVA: las compresiones torácicas son sólo brevemente detenidas para permitir intervenciones específicas.
- Mayor énfasis en el uso de «sistemas de rastreo y alarma» para detectar el deterioro del paciente y permitir el tratamiento para prevenir la PC intrahospitalaria.
- Aumento de la atención a los signos de alarma asociados con el riesgo potencial de muerte súbita cardiaca fuera del hospital.
- Eliminación de la recomendación de un período predeterminado de RCP antes de la desfibrilación extrahospitalaria tras PC no presenciada por los SEM.
- Mantenimiento de las compresiones torácicas mientras se carga el desfibrilador (esto minimizará la pausa predescarga).
- Se disminuye el énfasis sobre el papel del golpe precordial.
- La administración de hasta tres descargas rápidas consecutivas (agrupadas) en la FV/TV que ocurre en la sala de cateterismo cardiaco o en el periodo inmediato post-operatorio tras la cirugía cardiaca.
- Ya no se recomienda la administración de medicamentos a través de un tubo traqueal (si no se puede conseguir un acceso intravenoso, los fármacos deben ser administrados por vía IO).
- Durante el tratamiento de la PC por FV/TV, se administra 1mg de adrenalina después de la tercera descarga, una vez se han reiniciado las compresiones torácicas, y después cada 3-5min (durante ciclos alternos de RCP). Después de la tercera descarga también se administran 300mg de amiodarona.
- Ya no se recomienda la utilización rutinaria de atropina en la asistolia ni en la AESP.
- Se reduce el énfasis en la intubación traqueal precoz, salvo que se lleve a cabo por reanimadores con alta pericia, con mínima interrupción de las compresiones torácicas.
- Mayor énfasis en el uso de capnografía para confirmar y vigilar de forma continua la posición del tubo traqueal, la calidad de la RCP y para proporcionar una indicación precoz de la RCE.
- Se reconoce el papel potencial de la ecografía en el SVA.
- Reconocimiento del potencial daño causado por la hiperoxemia después de conseguir la RCE: una vez que se ha establecido la RCE y la saturación de oxígeno en sangre arterial (SaO2) se puede monitorizar de forma fiable (por pulsioximetría y/o gasometría arterial), la concentración de oxígeno inspirado se ajusta para lograr una SaO2 del 94-98%.
- Mucha mayor atención y énfasis en el tratamiento del síndrome post-PC.
- Reconocimiento de que la implementación de un protocolo de tratamiento posresucitación detallado y estructurado puede mejorar la supervivencia de las víctimas de PC tras la RCE.
- Mayor énfasis en el uso de la ICP primaria en los pacientes apropiados (incluidos los comatosos) con RCE mantenida tras PC.
- Revisión de la recomendación sobre el control de la glucosa: en adultos con RCE mantenida tras PC, deberían ser tratados valores de glucosa en sangre >10 mmol/l (> 180mg/dl), pero debe evitarse la hipoglucemia.
- Utilización de la hipotermia terapéutica, incluidos los supervivientes comatosos de PC asociada inicialmente tanto a ritmos no desfibrilables como a ritmos desfibrilables. Se reconoce el menor nivel de evidencia para su empleo tras PC por ritmo no desfibrilable.
- Reconocimiento de que muchos de los predictores de mal pronóstico aceptados en los supervivientes comatosos de una PC no son fiables, especialmente si el paciente ha sido tratado con hipotermia terapéutica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Nolan JP, Soar J, Zideman DA, Biarent D, Bossaert LL, Deakin C, et al. European Resuscitation Council for Resuscitation 2010. Section1. Executive summary. Resuscitation. 2010; 81:1219-76. [ Links ]
2. Hazinski MF, Nolan JP, Billi JE, Bottiger BW, Bossaert L, De Caen AR, et al. Part 1: Executive Summary: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Circulation. 2010; 122(Suppl 2):S250-275. [ Links ]
3. Deakin CD, Nolan JP, Soar J, Sunde K, Koster RW, Smith GB, et al. European Resuscitation Council Guidelines for Resuscitation 2010. Section 4. Adult advanced life support. Resuscitation. 2010; 81:1305-52. [ Links ]
4. Smith GB. In-hospital cardiac arrest: It is time for an in-hospital «chain» of prevention?. Resuscitation. 2010; 81:1209-11. [ Links ]
5. Haupt MT, Bekes CE, Brilli RJ, Carl LC, Gray AW, Jastremski MS, et al. Guidelines on critical care services and personnel: Recommendations based on a system of categorization of three levels of care. Crit Care Med. 2003; 31:2677-83. [ Links ]
6. DeVita MA, Smith GB, Adam SK, Adams-Pizarro I, Buist M, Bellomo R, et al. «Identifying the hospitalised patient in crisis» -a consensus conference on the afferent limb of rapid response systems. Resuscitation. 2010; 81:375-82. [ Links ]
7. Excellence NIfHaC. NICE clinical guideline 50 Acutely ill patients in hospital: recognition of and response to acute illness in adults in hospital. London: National Institute for Health and Clinical Excellence; 2007. [ Links ]
8. Armitage M, Eddleston J, Stokes T. Recognising and responding to acute illness in adults in hospital: summary of NICE guidance. BMJ. 2007; 335:258-9. [ Links ]
9. Critical care outreach 2003: progress in developing services. The National Outreach Report. London, UK. Department of Health and National Health Service Modernisation Agency. London: Department of Health and National Health Service Modernisation Agency; 2003. [ Links ]
10. Mitchell IA, McKay H, Leuvan CV, Berry R, McCutcheon C, Avard B, et al. A prospective controlled trial of the effect of a multi-faceted intervention on early recognition in deteriorating hospital patients. Resuscitation. 2010; 81:658-66. [ Links ]
11. Lippert FK, Raffay V, Georgiou M, Steen PA, Bossaert L. European Resuscitation Council Guidelines for Resuscitation 2010. Section 10. The ethics of resuscitation and end-of-life decisions. Resuscitation. 2010; 81:1445-51. [ Links ]
12. Gabbott D, Smith G, Mitchell S, Colquhoun M, Nolan J, Soar J, et al. Cardiopulmonary resuscitation standards for clinicalpractice and training in the UK. Resuscitation. 2005; 64:13-9. [ Links ]
13. Koster RW, Baubin MA, Bossaert LL, Caballero A, Cassan P, Castrén M, et al. European Resuscitation Council Guidelines for resuscitation 2010. Section 2. Adult basic life support and use of automated external defibrillators. Resuscitation. 2010; 81:1277-92. [ Links ]
14. Edelson DP, Abella BS, Kramer-Johansen J, Wik L, Myklebust H, Barry AM, et al. Effects of compression depth and preshock pauses predict defibrillation failure during cardiac arrest. Resuscitation. 2006; 71:137-45. [ Links ]
15. Eftestol T, Sunde K, Steen PA. Effects of interrupting precordial compressions on the calculated probability of defibrillation success during out-of-hospital cardiac arrest. Circulation. 2002; 105:2270-3. [ Links ]
16. Edelson DP, Robertson-Dick BJ, Yuen TC, Eilevstjonn J, Walsh D, Bareis CJ, et al. Safety and efficacy of defibrillator charging during ongoing chest compressions: A multi-center study. Resuscitation. 2010; 81:1521-6. [ Links ]
17. Christenson J, Andrusiek D, Everson-Stewart S, Kudenchuk P, Hostler D, Powell J, et al. Chest compression fraction determines survival in patients with out-of-hospital ventricular fibrillation. Circulation. 2009; 120:1241-7. [ Links ]
18. Deakin CD, Nolan JP, Sunde K, Koster RW. European Resuscitation Council Guidelines for resuscitation 2010. Section 3. Electrical therapies: automated external defibrillators, defibrillation, cardioversion and pacing. Resuscitation. 2010; 81:1293-304. [ Links ]
19. Larsen MP, Eisenberg MS, Cummins RO, Hallstrom AP. Predicting survival from out-ofhospitalcardiac arrest: a graphic model. Ann Emerg Med. 1993; 22:1652-8. [ Links ]
20. Valenzuela TD, Roe DJ, Cretin S, Spaite DW, Larsen MP. Estimating effectiveness of cardiacarrest interventions: a logistic regression survival model. Circulation. 1997; 96:3308-13. [ Links ]
21. Soar J, Perkins GD, Abbas G, Alfonzo A, Barelli A, Bierens JJLM, et al. European Resuscitation Council Guidelines for Resuscitation 2010. Section 8. Cardiac arrest in special circumstances: electrolyte abnormalities, poisoning, drowning, accidental hypothermia, hyperthermia, asthma, anaphylaxis, cardiac surgery, trauma, pregnancy, electrocution. Resuscitation. 2010; 81:1400-33. [ Links ]
22. Baker PW, Conway J, Cotton C, Ashby DT, Smyth J, Woodman RJ, et al. Defibrillation or cardiopulmonary resuscitation first forpatients with out-of-hospital cardiac arrests found by paramedics to be in ventricular fibrillation? Arandomised control trial. Resuscitation. 2008; 79:424-31. [ Links ]
23. Jacobs IG, Finn JC, Oxer HF, Jelinek GA. CPR before defibrillation in out-of-hospital cardiacarrest: a randomized trial. Emerg Med Australas. 2005; 17:39-45. [ Links ]
24. Bradley SM, Gabriel EE, Aufderheide TP, Barnes R, Christenson J, Davis DP, et al. Survival Increases with CPR by Emergency Medical Services before defibrillation of out-of-hospital ventricular fibrillation or ventricular tachycardia: observations from the Resuscitation Outcomes Consortium. Resuscitation. 2010; 81:155-62. [ Links ]
25. Shavit I, Hoffmann Y, Galbraith R, Waisman Y. Comparison of two mechanical intraosseous infusion devices: a pilot, randomized crossover trial. Resuscitation. 2009; 80:1029-33. [ Links ]
26. Macnab A, Christenson J, Findlay J, Horwood B, Johnson D, Jones L, et al. A new system for sternal intraosseous infusion in adults. Prehosp Emerg Care. 2000; 4:173-7. [ Links ]
27. Glaeser PW, Hellmich TR, Szewczuga D, Losek JD, Smith DS. Five-year experience in prehospitalintraosseous infusions in children and adults. Ann Emerg Med. 1993; 22:1119-24. [ Links ]
28. Brenner T, Bernhard M, Helm M, Doll S, Völkl A, Ganion N, et al. Comparison of two intraosseous infusion systems for adult emergency medical use. Resuscitation. 2008; 78:314-9. [ Links ]
29. Kudenchuk PJ, Cobb LA, Copass MK, Cummins RO, Doherty AM, Fahrenbruch CE, et al. Amiodarone for resuscitation after out-of-hospital cardiac arrest due to ventricular fibrillation. N Engl J Med. 1999; 341:871-8. [ Links ]
30. Dorian P, Cass D, Schwartz B, Cooper R, Gelaznikas R, Barr A. Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. N Engl J Med. 2002; 346:884-90. [ Links ]
31. Stiell IG, Wells GA, Field B, Spaite DW, Nesbitt LP, De Maio VJ, et al. Advanced cardiac life support in out-of-hospital cardiac arrest. N Engl J Med. 2004; 351:647-56. [ Links ]
32. Engdahl J, Bang A, Lindqvist J, Herlitz J. Factors affecting short- and long-term prognosis among 1069 patients with out-of-hospital cardiac arrest and pulseless electrical activity. Resuscitation. 2001; 51:17-25. [ Links ]
33. Abu-Laban RB, Christenson JM, Innes GD, Van Beek CA, Wanger KP, McKnight RD, et al. Tissue plasminogen activator in cardiac arrest with pulseless electrical activity. N Engl J Med. 2002; 346:1522-8. [ Links ]
34. Böttiger BW, Arntz HR, Chamberlain DA, Bluhmki E, Belmans A, Danays T, et al. Thrombolysis during resuscitation for out-of hospital cardiac arrest. N Engl J Med. 2008; 359:2651-62. [ Links ]
35. Li X, Fu QL, Jing XL, Li YJ, Zhan H, Ma ZF, et al. A meta-analysis of cardiopulmonary resuscitation with and without the administration of thrombolytic agents. Resuscitation. 2006; 70:31-6. [ Links ]
36. Lederer W, Lichtenberger C, Pechlaner C, Kinzl J, Kroesen G, Baubin M. Long-term survival and neurological outcome of patients who received recombinant tissue plasminogen activator during out-of-hospital cardiac arrest. Resuscitation. 2004; 61:123-9. [ Links ]
37. Bobrow BJ, Clark LL, Ewy GA, Chikani V, Sanders AB, Berg RA, et al. Minimally interrupted cardiac resuscitation by emergency medical services for out-of-hospital cardiac arrest. JAMA. 2008; 299:1158-65. [ Links ]
38. Amir O, Schliamser JE, Nemer S, Arie M. Ineffectiveness of precordial thump for cardioversion of malignant ventricular tachyarrhythmias. Pacing Clin Electrophysiol. 2007; 30:153-6. [ Links ]
39. Pellis T, Kette F, Lovisa D, Franceschino E, Magagnin L, Mercante WP, et al. Utility of pre-cordial thump for treatment of out of hospital cardiac arrest: a prospective study. Resuscitation. 2009; 80:17-23. [ Links ]
40. Grmec S. Comparison of three different methods to confirm tracheal tube placement in emergency intubation. Intensive Care Med. 2002; 28:701-4. [ Links ]
41. Silvestri S, Ralls GA, Krauss B, Thundiyil J, Rothrock SG, Senn A, et al. The effectiveness of out-of-hospital use of continuous end-tidal carbon dioxide monitoring on the rate of unrecognized misplaced intubation within a regional emergency medical services system. Ann Emerg Med. 2005; 45:497-503. [ Links ]
42. Price S, Uddin S, Quinn T. Echocardiography in cardiac arrest. Curr Opin Crit Care. 2010; 16:211-5. [ Links ]
43. Niendorff DF, Rassias AJ, Palac R, Beach ML, Costa S, Greenberg M. Rapid cardiac ultrasound of inpatients suffering PEA arrest performed by nonexpert sonographers. Resuscitation. 2005; 67:81-7. [ Links ]
44. Hernandez C, Shuler K, Hannan H, Sonyika C, Likourezos A, Marshall J. C.A.U.S.E.: Cardiac arrest ultra-sound exam -a better approach to managing patients in primary non-arrhythmogenic cardiac arrest. Resuscitation. 2008; 76:198-206. [ Links ]
45. Breitkreutz R, Walcher F, Seeger FH. Focused echocardiographic evaluation in resuscitation management: concept of an advanced life support-conformed algorithm. Crit Care Med. 2007; 35:S150-161. [ Links ]
46. Nolan JP, Neumar RW, Adrie C, Aibiki M, Berg RA, Böttiger BW, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A Scientific Statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke. Resuscitation. 2008; 79:350-79. [ Links ]
47. Martín-Hernández H, López-Messa JB, Pérez-Vela JL, Molina-Latorre R, Cárdenas-Cruz A, Lesmes-Serrano A, et al. Manejo del síndrome post-PC. Med Intensiva. 2010; 34:107-26. [ Links ]
48. Gaieski DF, Band RA, Abella BS, Neumar RW, Fuchs BD, Kolansky DM, et al. Early goal-directed hemodynamic optimization combined with therapeutic hypothermia in comatose survivors of out-of-hospital cardiac arrest. Resuscitation. 2009; 80:418-24. [ Links ]
49. Knafelj R, Radsel P, Ploj T, Noc M. Primary percutaneous coronary intervention and mild induced hypothermia in comatose survivors of ventricular fibrillation with ST-elevation acute myocardial infarction. Resuscitation. 2007; 74:227-34. [ Links ]
50. Sunde K, Pytte M, Jacobsen D, Mangschau A, Jensen LP, Smedsrud C, et al. Implementation of a standardised treatment protocol for post resuscitation care after out-of-hospital cardiac arrest. Resuscitation. 2007; 73:29-39. [ Links ]
51. Vereczki V, Martin E, Rosenthal RE, Hof PR, Hoffman GE, Fiskum G. Normoxic resuscitation after cardiac arrest protects against hippocampal oxidative stress, metabolic dysfunction, and neuronal death. J Cereb Blood Flow Metab. 2006; 26:821-35. [ Links ]
52. Kilgannon JH, Jones AE, Shapiro NI, Angelos MG, Milcarek B, Hunter K, et al. Association between arterial hyperoxia following resuscitation from cardiac arrest and in-hospital mortality. JAMA. 2010; 303:2165-71. [ Links ]
53. Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut JF, et al. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med. 1997; 336:1629-33. [ Links ]
54. Bendz B, Eritsland J, Nakstad AR, Brekke M, Klow NE, Steen PA, et al. Long-term prognosis after out-of-hospital cardiac arrest and primary percutaneous coronary intervention. Resuscitation. 2004; 63:49-53. [ Links ]
55. Quintero-Moran B, Moreno R, Villarreal S, Perez-Vizcayno MJ, Hernandez R, Conde C, et al. Percutaneous coronary intervention for cardiac arrest secondary to ST-elevation acute myocardial infarction. Influence of immediate paramedical/medical assistance on clinical outcome. J Invasive Cardiol. 2006; 18:269-72. [ Links ]
56. Nagao K, Hayashi N, Kanmatsuse K, Arima K, Ohtsuki J, Kikushima K, et al. Cardiopulmonary cerebral resuscitation using emergency cardiopulmonary bypass, coronary reperfusion therapy and mild hypothermia in patients with cardiac arrest outside the hospital. J Am Coll Cardiol. 2000; 36:776-83. [ Links ]
57. Hovdenes J, Laake JH, Aaberge L, Haugaa H, Bugge JF. Therapeutic hypothermia after outof-hospital cardiac arrest: experiences with patients treated with percutaneous coronary intervention and cardiogenic shock. Acta Anaesthesiol Scand. 2007; 51:137-42. [ Links ]
58. Wolfrum S, Pierau C, Radke PW, Schunkert H, Kurowski V. Mild therapeutic hypothermia in patients after out-of-hospital cardiac arrest due to acute ST-segment elevation myocardial infarction undergoing immediate percutaneous coronary intervention. Crit Care Med. 2008; 36:1780-6. [ Links ]
59. Padkin A. Glucose control after cardiac arrest. Resuscitation. 2009; 80:611-2. [ Links ]
60. Krinsley JS, Grover A. Severe hypoglycemia in critically ill patients: risk factors and outcomes. Crit Care Med. 2007; 35:2262-7. [ Links ]
61. Froehler MT, Geocadin RG. Hypothermia for neuroprotection after cardiac arrest: mechanisms, clinical trials and patient care. J Neurol Sci. 2007; 261:118-26. [ Links ]
62. Castrejon S, Cortes M, Salto ML, Benittez LC, Rubio R, Juarez M, et al. Improved prognosis after using mild hypothermia to treat cardiorespiratory arrest due to a cardiac cause: comparison with a control group. Rev Esp Cardiol. 2009; 62:733-41. [ Links ]
63. Bro-Jeppesen J, Kjaergaard J, Horsted TI, Wancher MC, Nielsen SL, Rasmussen LS, et al. The impact of therapeutic hypothermia on neurological function and quality of life after cardiac arrest. Resuscitation. 2009; 80:171-6. [ Links ]
64. Larsson IM, Wallin E, Rubertsson S. Cold saline infusion and ice packs alone are effective in inducing and maintaining therapeutic hypothermia after cardiac arrest. Resuscitation. 2010; 81:15-9. [ Links ]
65. Hoedemaekers CW, Ezzahti M, Gerritsen A, Van der Hoeven JG. Comparison of cooling methods to induce and maintain normo- and hypothermia in intensive care unit patients: a prospective intervention study. Crit Care. 2007; 11:R91. [ Links ]
66. Kamarainen A, Virkkunen I, Tenhunen J, Yli-Hankala A, Silfvast T. Prehospital therapeutic hypothermia for comatose survivors of cardiac arrest: a randomized controlled trial. Acta Anaesthesiol Scand. 2009; 53:900-7. [ Links ]
67. Kamarainen A, Virkkunen I, Tenhunen J, Yli-Hankala A, Silfvast T. Induction of therapeutic hypothermia during prehospital CPR using ice-cold intravenous fluid. Resuscitation. 2008; 79:205-11. [ Links ]
68. Arrich J. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit Care Med. 2007; 35:1041-7. [ Links ]
69. Kuboyama K, Safar P, Radovsky A, Tisherman SA, Stezoski SW, Alexander H, et al. Delay in cooling negates the beneficial effect of mild resuscitative cerebral hypothermia after cardia arrest in dogs: a prospective, randomized study. Crit Care Med. 1993; 21:1348-58. [ Links ]
70. Zandbergen EG, Hijdra A, Koelman JH, Hart AA, Vos PE, Verbeek MM, et al. Prediction of poor outcome within the first 3 days of postanoxic coma. Neurology. 2006; 66:62-8. [ Links ]
71. Wijdicks EF, Hijdra A, Young GB, Bassetti CL, Wiebe S. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006; 67:203-10. [ Links ]
72. Al Thenayan E, Savard M, Sharpe M, Norton L, Young B. Predictors of poor neurologic outcome after induced mild hypothermia following cardiac arrest. Neurology. 2008; 71:1535-7. [ Links ]
73. Tiainen M, Kovala TT, Takkunen OS, Roine RO. Somatosensory and brainstem auditory evoked potentials in cardiac arrest patients treated with hypothermia. Crit Care Med. 2005; 33:1736-40. [ Links ]
74. Perkins GD, Brace S, Gates S. Mechanical chest-compression devices: current and future roles. Curr Opin Crit Care. 2010; 16:203-10. [ Links ]
75. Spaite DW, Bobrow BJ, Vadeboncoeur TF, Chicani V, Clark L, Mullins T, et al. The impact of prehospital transport interval on survival in out-of-hospital cardiac arrest: implications for regionalization of post-resuscitation care. Resuscitation. 2008; 79:61-6. [ Links ]
76. Spaite DW, Stiell IG, Bobrow BJ, de Boer M, Maloney J, Denninghoff K, et al. Effect of transport interval on out-of-hospital cardiac arrest survival in the OPALS Study: Implications for triaging patients to specialized cardiac arrest centers. Ann Emerg Med. 2009; 54:248-55. [ Links ]
77. Nichol G, Aufderheide TP, Eigel B, Neumar RW, Lurie KG, Bufalino VJ, et al. Regional systems of care for out-of-hospital cardiac arrest: A policy statement from the American Heart Association. Circulation. 2010; 121:709-29. [ Links ]
78. Nichol G, Soar J. Regional cardiac resuscitation systems of care. Curr Opin Crit Care. 2010; 16:223-30. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
jlopezme@saludcastillayleon.es
(J.B. López-Messa)
Recibido 6 Marzo 2011
Aceptado 11 Marzo 2011














