Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.29 no.6 Cantabria 2009
Aspectos clínicos y microbiológicos de la peritonitis fúngica en diálisis peritoneal
Clinical and microbiological aspects of fungal peritonitis in peritoneal dialysis
R. García Agudo1, P. García-Martos2
1Sección de Nefrología. Complejo Hospitalario La Mancha-Centro. Alcázar de San Juan. Ciudad Real.
2Servicio de Microbiología y Parasitología. Hospital Universitario Puerta del Mar. Cádiz.
Dirección para correspondencia
RESUMEN
La peritonitis es una de las complicaciones más graves de la diálisis peritoneal. Las bacterias son las responsables de la mayoría de los casos. La infección fúngica es infrecuente, pero se asocia con una alta morbilidad, con la imposibilidad de continuar en el programa de diálisis y con un importante índice de mortalidad. Su incidencia varía del 1% al 10% de los episodios de peritonitis en niños y del 1% al 23% en adultos. Su presentación clínica es similar a la de la peritonitis bacteriana. Los factores predisponentes de peritonitis fúngica no han sido establecidos con claridad; los episodios previos de peritonitis bacteriana y el tratamiento con antibióticos de amplio espectro han sido descritos a menudo en la literatura. Las especies de Candida son los patógenos más habituales y Candida albicans la más frecuente, pero en la última década se ha observado una alta prevalencia de Candida parapsilosis. El diagnóstico microbiológico es fundamental para determinar la etiología y prescribir el tratamiento, que suele requerir, además de la terapia antifúngica, la retirada del catéter peritoneal y la consecuente transferencia a hemodiálisis. Fluconazol y anfotericina B son los antifúngicos recomendados; los nuevos fármacos como voriconazol y caspofungina han demostrado tener también una gran utilidad. El propósito de esta revisión sistemática ha sido analizar los aspectos clínicos y microbiológicos de la peritonitis fúngica, los cuales son poco conocidos y han cambiado en los últimos años.
Palabras clave: Peritonitis, Peritonitis fúngica, Diálisis peritoneal, Candida, Catéter peritoneal, Antifúngicos, Fluconazol, Voriconazol,
ABSTRACT
Peritonitis is one of the most serious complications of peritoneal dialysis. Pathogenic bacteria cause the majority of cases of peritonitis. Fungal infection is rare but it is associated with high morbidity, the inability to continue on the dialysis program and a high mortality rate. Its incidence ranges from 4% to 10% of all peritonitis episodes in children and from 1% to 23% in adults. Its clinical presentation is similar to bacterial peritonitis. Until now, predisposing factors of fungal peritonitis have not been clearly established; the history of bacterial peritonitis episodes and treatment with broad-spectrum antibiotics have been often reported in literature. Candida species were the most common pathogens and Candida albicans was the most frequent, but high prevalence of Candida parapsilosis has been observed in the last decade. Microbiological findings are essential to determine the etiology of peritonitis. Successful management of fungal peritonitis requires antifungal therapy, the removal of the peritoneal catheter and the subsequent transfer to hemodialysis. Fluconazole and amphotericin B are recommended as antifungal agents. New drugs such as voriconazole and caspofungin are very effective. The aim of this systematic review has been to analyse the clinical and microbiological aspects of fungal peritonitis, as they are not well known and have changed in the last few years.
Key Words: Peritonitis, Fungal peritonitis, Peritoneal dialysis, Candida, Peritoneal catheter, Antifungal therapy, Fluconazole, Voriconazole.
Introducción
La peritonitis constituye una de las complicaciones más graves y frecuentes en los pacientes en tratamiento sustitutivo renal mediante diálisis peritoneal, especialmente en diálisis peritoneal continua ambulatoria. Los pacientes tratados con diálisis peritoneal están expuestos a la infección debido a la comunicación no natural que se establece con el exterior a través del catéter peritoneal y a la introducción reiterada de soluciones más o menos biocompatibles en la cavidad peritoneal. Los episodios repetidos de peritonitis pueden conducir a un daño irreversible de la membrana peritoneal que a veces requiere la suspensión de la técnica y la transferencia del paciente a hemodiálisis.
La etiología bacteriana es responsable de aproximadamente el 80% de los episodios de peritonitis asociada con diálisis peritoneal. La infección fúngica es una complicación infrecuente, ocurre en mayor parte en pacientes que llevan un período prolongado en programa de diálisis peritoneal y no suele iniciarse como primer episodio. La excepcionalidad de la peritonitis fúngica ha dificultado el establecimiento de unos criterios de actuación generalizados, ya que los autores describen usualmente en sus series un número limitado de episodios que no permiten extrapolar los resultados.
En este trabajo analizamos, mediante una revisión sistemática, los artículos sobre peritonitis fúngica publicados en la literatura, con el fin de extraer conclusiones que permitan conocer mejor las peculiares características de esta entidad clínica.
Material y método
Los artículos de investigación clínica revisados fueron seleccionados entre los publicados en las últimas tres décadas, incluyendo trabajos originales, revisiones, casos clínicos y cartas al director sobre peritonitis fúngica en pacientes tratados con diálisis peritoneal. Utilizamos dos fuentes de búsqueda bibliográfica: por un lado, la plataforma Ovid Technologies, que contiene prácticamente todas las bases de datos existentes (Medline, Embase, Current Contents, Cinahl, Inspec, Psycinfo, etc.) y que permite consultar un importante número de artículos a texto completo y, por otro, el sistema de búsqueda PubMed desarrollado por el National Center for Biotechnology Information, que faculta el acceso a las bases de datos bibliográficas compiladas en la National Library of Medicine. Adicionalmente se consultaron otras fuentes habituales: EBSCO Open Journals, Proquest Medical Library, Science Direct, Springer Links y Wiley Interscience.
Los términos de búsqueda empleados fueron los siguientes: fungal peritonitis, peritoneal dialysis, continuous ambulatory peritoneal dialysis, Candida, Cryptococcus, Geotrichum, Saccharomyces, Malassezia, Pichia, Rhodotorula, Trichosporon, Blastomyces, Coccidioides, Paracoccidioides, Histoplasma, Acremonium, Alternaria, Aspergillus, Aureobasidium, Beauveria, Bipolaris, Chaetomium, Chrysonilia, Chrysosporum, Cladophialophora, Cladosporium, Curvularia, Drechslera, Emmonsia, Exophiala, Fonsecaea, Fusarium, Natrassia, Onychocola, Paecilomyces, Penicillium, Phialemonium, Phialophora, Rhamichloridium, Rhinocladiella, Scedosporium, Scopulariopsis, Scytalidium, Sporothrix, Trichoderma, Absidia, Cunninghamella, Mucor, Rhizomucor, Rhizopus, Syncephalastrum.
A partir de la bibliografía consultada se recabó información referente a la epidemiología y la patogenia de la peritonitis fúngica, los factores de riesgo para su desarrollo, la distribución de los agentes etiológicos (tanto levaduras como hongos filamentosos) responsables de los episodios de peritonitis, las manifestaciones clínicas, las técnicas de diagnóstico microbiológico y las opciones terapéuticas.
Epidemiología y factores de riesgo
La peritonitis fúngica en diálisis peritoneal es una complicación infrecuente. Su incidencia es similar en la diálisis peritoneal automatizada y la diálisis peritoneal continua ambulatoria, aunque el menor número de conexiones puede reducir los episodios en la técnica automatizada. Los hongos penetran en la cavidad peritoneal por vía intraluminal o periluminal, atravesando la mucosa intestinal, y por vía hematógena, a partir de una infección fúngica a distancia.
Aunque la infección fúngica supone alrededor del 4-10% de las peritonitis en niños y del 1-23% en adultos, según las series1-18, lo que supone un promedio del 4-6% de los episodios de peritonitis, presenta peor pronóstico que la de etiología bacteriana, pues la infección fúngica favorece la obstrucción del catéter, la formación de abscesos y el desarrollo de peritonitis esclerosante3,4,7,8,10,19-23. Se ha comunicado una mortalidad del 5-53% en los pacientes que la presentan y un 40-55% de fallos de la técnica, que obligan a suspender el programa de diálisis peritoneal y transferir a los pacientes a hemodiálisis1,4,9,10,12,13,19,23-27.
Los factores de riesgo para el desarrollo de peritonitis fúngica no se han determinado con exactitud. Se han enumerado diversas situaciones que desempeñan un papel importante en la aparición de la infección micótica, entre las que destacan los episodios previos de peritonitis bacteriana y la antibioterapia de amplio espectro. A menudo se identifica más de un factor de riesgo en los pacientes. En la tabla 1 se reflejan los factores de riesgo descritos con mayor frecuencia.
Los pacientes con peritonitis fúngica presentan una mayor tasa de episodios de peritonitis bacteriana que los pacientes sin peritonitis fúngica2,5,10,11,13,14,20,23,28-31, a veces más del doble8,14,23, debido sobre todo a que la inflamación del peritoneo puede aumentar la susceptibilidad a la invasión por hongos. Se ha sugerido que la infección fúngica aparece sobre todo después de episodios de peritonitis bacteriana por bacilos gramnegativos16,27. La administración de antibióticos de amplio espectro en los meses previos, en general como tratamiento de episodios de peritonitis bacteriana, está estrechamente relacionada con la aparición de peritonitis fúngica y se indica en un 30-95% de los episodios descritos en la literatura1-4,7-11,13-16,18,23,25,26,29,30, aunque la ausencia de terapia antimicrobiana previa no excluye la posibilidad de infección15. En los casos de peritonitis por hongos filamentosos ambientales parece que el uso de antibióticos no desempeña un papel tan importante13.
Otros factores de riesgo mencionados son el tiempo prolongado de permanencia en programa de diálisis peritoneal y el tiempo desde la inserción del catéter peritoneal3-5,8,12,30. El mantenimiento del catéter una vez detectada la infección fúngica se ha relacionado con un peor pronóstico y constituye en ocasiones el principal factor desencadenante del fallo de la técnica y de la mortalidad8,12,13,15,18,25,26.
La edad avanzada se ha referido en varias ocasiones como un rasgo destacado en los pacientes con peritonitis fúngica6,8,14,26,30,31. Del mismo modo, también se señala la administración de fármacos inmunosupresores, como los corticoides1,15, y la presencia de enfermedades inmunodepresoras o debilitantes, como el lupus eritematoso sistémico27,32, la infección por el VIH33 y, especialmente, la diabetes mellitus, que se identifica como factor de riesgo en el 30-65% de los episodios7,13-15,19,23,25,26,31, aunque también es frecuente en la peritonitis bacteriana. La hospitalización se ha considerado un factor de riesgo cuando acontece una infección de origen nosocomial, así como la coexistencia de una infección fúngica extraperitoneal que causa infección peritoneal por vía hematógena14,29.
Por otra parte, no se observan diferencias significativas con respecto al sexo, pues hay autores que señalan una mayor incidencia en el sexo femenino31,34 y otros en el masculino26. Tampoco se han relacionado la etiología de la insuficiencia renal (por causa vascular, glomerulonefritis, nefropatía diabética, nefropatía tubulointersticial, poliquistosis renal, otras), la comorbilidad cardiovascular (arritmias, cardiopatía isquémica, vasculopatía cerebral, vasculopatía periférica) o el período estacional8,35.
Agentes etiológicos
La peritonitis infecciosa en pacientes en tratamiento con diálisis peritoneal está originada comúnmente por bacterias. Los agentes más habituales son Staphylococcus coagulasa negativa y Staphylococcus aureus, seguidos de Streptococcus, Enterococcus, Pseudomonas aeruginosa, Escherichia coli y Klebsiella pneumoniae; otras bacterias son ocasionales. En algunos casos la etiología es mixta (bacteriana y fúngica) o polimicrobiana13,36-38. La etiología de la peritonitis fúngica, sin embargo, es muy diversa e incluye a la mayoría de las especies de levaduras y de hongos filamentosos patógenos humanos, así como a otras levaduras y hongos ambientales inusuales en la práctica clínica.
Levaduras
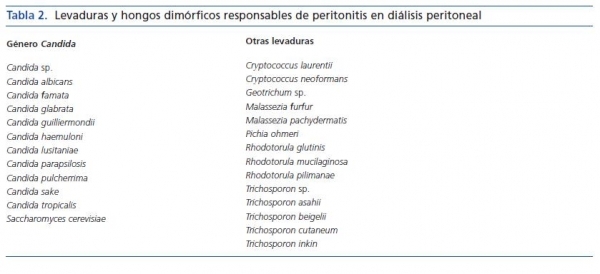
Las levaduras están ampliamente distribuidas en la naturaleza, pues son organismos capaces de sobrevivir en condiciones ambientales extraordinarias. De las aproximadamente 500 especies conocidas, sólo unas 25 o 30 eran consideradas patógenas hasta hace unos años, pero en la actualidad este número se ha incrementado de forma notable. En la tabla 2 se relacionan las levaduras implicadas en episodios de peritonitis en pacientes tratados con diálisis peritoneal.
Las especies del género Candida son las de mayor incidencia en peritonitis fúngica en diálisis peritoneal, responsables aproximadamente del 60-90% de los casos1,4,15,19,20,23,30,31,34. Candida albicans se ha considerado clásicamente la especie predominante. En los últimos años, C. parapsilosis, un colonizador habitual de la piel con manifiesta capacidad de adherencia a materiales sintéticos, se ha implicado en ocasiones en igual o mayor proporción que C. albicans1,4,15,19,20,23, 30,31,34 y su presencia se ha considerado un factor de peor pronóstico que conlleva la necesidad de realizar un tratamiento más agresivo4,20,39. Actualmente se puede afirmar que C. parapsilosis es el patógeno más habitual en peritonitis fúngica en pacientes en diálisis peritoneal.
La incidencia de otras especies de Candida no está bien establecida porque en muchos casos no se identifica la especie y se menciona como Candida sp. En la última década el número de especies no-albicans ha ido en aumento y su participación se ha asociado con una mayor mortalidad, ya que algunas de ellas presentan resistencia a los antifúngicos empleados usualmente en el tratamiento1,2,4-6,8,9,13,15,19,21,23,28,30,31,34,40-49. No hemos encontrado en la literatura ningún caso de infección por C. krusei, que presenta resistencia natural a fluconazol.
Otras levaduras productoras de peritonitis son excepcionales y sólo se han referido en contados episodios. Del género Cryptococcus se han publicado algunos casos de infección peritoneal como manifestación de una infección sistémica por C. neoformans43,50,51 y un caso debido a C. laurentii52. El género Trichosporon es un patógeno peritoneal más constante, bien la especie T. beigelii31,53-55, la única reconocida hasta hace unos años, o bien algunas de las nuevas especies (T. inkin56-58, T. cutaneum30,59, T. asahii30,60). Del género Rhodotorula, una levadura que raramente causa infecciones humanas, se han comunicado casos de peritonitis por R. mucilaginosa antes denominada rubra)15,16,30,61-63, R. glutinis64 y R. pilimanae6. Hemos encontrado también casos aislados de infección peritoneal por Pichia ohmeri65 y Geotrichum sp.66, así como por Malassezia furfur67, levadura lipófila productora de la pitiriasis versicolor, y Malassezia pachydermatis68, comensal del conducto auditivo externo de cánidos.
Algunos hongos dimórficos, con morfología levaduriforme y filamentosa, se han descrito ocasionalmente en peritonitis en diálisis peritoneal: Histoplasma capsulatum69,70 y Coccidioides immitis71, ambos patógenos, y Blastobrotys proliferans72, nunca mencionado en infecciones humanas.
Hongos filamentosos
Los hongos filamentosos o mohos, como las levaduras, se encuentran ampliamente distribuidos en la naturaleza. Se describen en un porcentaje muy bajo de peritonitis en comparación con las levaduras, pero su participación está creciendo y en algunas series suponen hasta un 40% de los casos26. El hecho de que estos hongos presenten mayor resistencia a los antifúngicos ha suscitado un especial interés clínico. Los géneros y especies descritos son muy variados e incluyen hongos hialinos, dematiáceos y zigomicetos, algunos de ellos relacionados con infecciones humanas y otros saprofitos que sólo excepcionalmente se han descrito en clínica. En la tabla 3 se relacionan los hongos filamentosos que se han implicado en peritonitis fúngica en diálisis peritoneal.
A pesar de que el género Aspergillus es uno de los más frecuentes en clínica, los casos de infección peritoneal no son muy numerosos6,13,22,,26,34,35,64,73-83. Penicillium se refiere en varias ocasiones, pero sin concretar la especie26,38,84-87. También con cierta periodicidad se detectan episodios de peritonitis por Paecilomyces6,88-94. Especial interés presentan los géneros Acremonium y Fusarium, por su resistencia a los antifúngicos6,23,26,34,90,95-102. Las llamadas levaduras negras del género Exophiala también se han implicado en casos de infección peritoneal94,103-107, así como el género Curvularia, raramente patógeno humano53,108-111.
Otros hongos filamentosos son menos habituales en casos de peritonitis en pacientes sometidos a diálisis peritoneal. Algunos son conocidos como patógenos oportunistas: Alternaria112,113, Bipolaris114,115, Aureobasidium pullulans116,117, Scedosporium apiospermum118, Scopulariopsis sp.119, Cladosporium sp.26 y Madurella mycetomatis30; otros se han documentado raramente como patógenos: Trichoderma90,120-122, Chaetomium globosum123, Chrysonilia sitophila123, Lecythophora mutabilis124, Hormonema dematioides125 y Verticillium sp.126.
Los zigomicetos son hongos inusuales como agentes de peritonitis en diálisis peritoneal, pero se asocian con un alto índice de mortalidad, debido a la falta de respuesta a los antifúngicos78. Se han comunicado casos de peritonitis por Rhizopus sp.16,127,128, Mucor sp.78,129,130 y Cuninghamella26,131.
Manifestaciones clínicas
Desde el punto de vista clínico, las peritonitis fúngicas son indistinguibles de las bacterianas, compartiendo la sintomatología de dolor abdominal y, menos frecuentemente, fiebre, náuseas, vómitos, diarrea, deterioro del estado general y efluente peritoneal turbio. El diagnóstico se realiza por análisis bioquímico del líquido peritoneal cuando se detecta un recuento de 100 o más leucocitos por microlitro y, al menos, el 50% de polimorfonucleares, pero el análisis microbiológico es imprescindible para establecer la etiología fúngica15. Hay que tener en cuenta que a veces el líquido puede ofrecer un recuento bajo si ha permanecido menos de 2 horas en la cavidad peritoneal; el predominio de polimorfonucleares puede ser indicativo de infección en estos casos. Como es rara la existencia de fungemia, no suele haber leucocitosis sistémica.
Se puede sospechar un episodio de peritonitis fúngica cuando acontecen episodios recurrentes de peritonitis bacteriana y se observa falta de respuesta a la antibioterapia. Entre los datos analíticos asociados con infección por hongos únicamente se han descrito como significativos la presencia de anemia y el descenso de la albúmina plasmática por debajo de 3 g/dl; ocasionalmente se ha observado eosinofilia en el líquido de diálisis8,14,52,71,75,77. La hipoalbuminemia podría explicarse por el déficit de ultrafiltración que acontece durante el episodio de peritonitis o por el incremento de la pérdida peritoneal de proteínas. Este factor se ha relacionado con un peor pronóstico18, aunque los factores pronósticos de la peritonitis fúngica tampoco están bien definidos. El mantenimiento del catéter peritoneal y la presencia de íleo y dolor abdominal parecen implicar una mayor mortalidad4,7.
Diagnóstico microbiológico
El diagnóstico microbiológico se fundamenta en la visualización microscópica o en el aislamiento en cultivo de hongos a partir del dializado peritoneal. En general, y especialmente en el caso de hongos ambientales, es necesario demostrar su presencia en más de una muestra para poder confirmar su participación como agente causal de peritonitis, ya que es frecuente el aislamiento de estos hongos en los cultivos como contaminantes131.
Se deben enviar al laboratorio 50-100 ml de líquido peritoneal, de los que 10 ml se inoculan en frascos de hemocultivo aerobio y anaerobio, con incubación durante 7 días a 35-37 oC; el resto se centrifuga a 3.000 rpm durante 15 minutos. A partir del sedimento se realiza la observación microscópica directa en fresco y mediante tinción. Paralelamente se inocula la muestra en medios de cultivo generales y específicos para investigar bacterias y hongos. En el caso de clara sospecha de peritonitis fúngica, se puede añadir el medio de cultivo CHROMagar Candida, de gran utilidad para la diferenciación de levaduras34.
La observación microscópica directa y la tinción de Gram tienen una sensibilidad muy variable, del 10-70% según diferentes autores, pero superior a la de las peritonitis bacterianas6,13,26. A pesar de su dudoso rendimiento, resulta eficaz para la detección precoz de elementos fúngicos, lo que posibilita considerar la retirada del catéter peritoneal y el establecimiento de una terapia específica13,25. El cultivo microbiológico tiene una sensibilidad próxima al 100% y permite identificar la especie del agente responsable del cuadro infeccioso. Las levaduras se identifican por sus características morfológicas, bioquímicas y nutricionales, esencialmente por el patrón de asimilación de compuestos de carbono, utilizando sistemas comerciales como el denominado ID 32C (bioMérieux, Francia) u otros13. Los hongos filamentosos, sin embargo, se identifican de forma exclusiva por el tiempo de crecimiento, las características morfológicas de la colonia (tamaño, color, textura, bordes, pigmento difusible) y las características microscópicas (hifas, fiálides, conidióforo, conidias). Actualmente se dispone de técnicas de diagnóstico serológico, como la detección del antígeno galactomanano de Aspergillus, y de técnicas moleculares de secuenciación de ADN para la identificación de levaduras y hongos filamentosos132,133.
La determinación de sensibilidad a antifúngicos en los hongos productores de peritonitis no se realiza de manera sistemática, sino sólo en aquellas especies de reconocida resistencia y en caso de fallo terapéutico. En la actualidad se reconoce la importancia de determinar la sensibilidad de algunas especies de levaduras frente a compuestos azólicos frente a los que se ha constatado la aparición de cepas resistentes6.
Tratamiento
El tratamiento de la peritonitis fúngica no está claramente establecido debido al escaso número de pacientes tratados en las series revisadas y al empleo de diferentes antifúngicos, vías de administración, dosis y duración del tratamiento.
Las recomendaciones de la Sociedad Internacional de Diálisis Peritoneal de 2005 y las de la Sociedad Española de Nefrología de 2006 argumentan que, además de la terapia antifúngica, la retirada precoz del catéter es fundamental para resolver el cuadro clínico25,134. Se ha comprobado que en un gran número de episodios persisten los síntomas hasta 72 horas después de administrar antifúngicos, debido en parte a la capacidad de los hongos para formar biopelículas en la superficie de los catéteres, lo que disminuye la penetración de los fármacos. Se acepta, pues, que la retirada del catéter es necesaria para erradicar la infección, porque constituye un lugar primordial de colonización microbiana, pero el momento más adecuado no se concreta. Algunos autores indican la retirada del catéter en las primeras 24 horas, tras la administración de tratamiento antifúngico, y otros incluso sin haber administrado tratamiento, porque se ha constatado que el índice de mortalidad aumenta si la retirada del catéter se dilata más de 24 horas5,8,9,13,15,18,25,26. La reinserción de un nuevo catéter peritoneal, si procede, debe efectuarse al menos 4-6 semanas después de la resolución del cuadro clínico1,9,26.
Cualquier protocolo debe incluir, además de la retirada del catéter, la administración de antifúngicos por vía peritoneal, oral o intravenosa. Las opciones de tratamiento de la peritonitis fúngica han sido limitadas hasta la aparición de las nuevas formulaciones de anfotericina B, los triazoles de amplio espectro y las equinocandinas, que ofrecen mayor seguridad y presentan un mejor perfil farmacocinético. En la actualidad, entre los antifúngicos disponibles en el mercado existen polienos (anfotericina B), derivados azólicos (miconazol, ketoconazol, fluconazol, itraconazol, voriconazol, posaconazol, ravuconazol, isavuconazol), pirimidinas fluoradas (fluorocitosina) y equinocandinas (caspofungina, micafungina, anidulafungina). En casos aislados se ha usado terbinafina (del grupo de las alilaminas), un antifúngico activo frente a hongos dermatofitos, C. albicans y Malassezia92.
Fluconazol ha sido considerado desde hace años como el tratamiento de elección por su excelente penetración en el peritoneo, su buena biodisponibilidad, las escasas reacciones adversas que origina y la posibilidad de utilización en pacientes de forma ambulatoria135. Incluso se ha indicado que el tratamiento con fluconazol oral y la retirada del catéter peritoneal serían comparables en cuanto a eficacia a la asociación de fluconazol intraperitoneal y 5-fluorocitosina oral24. Se sabe que este antifúngico no es efectivo frente a muchos de los hongos filamentosos causantes de peritonitis, especialmente Aspergillus y Fusarium. Por otra parte, en años recientes se ha confirmado la aparición de especies de Candida resistentes a fluconazol (C. krusei, C. ciferrii, C. norvegensis, C. glabrata, C. famata, C. lusitaniae, C. guilliermondii y C. tropicalis) y otras levaduras (Trichosporon), lo que indica la conveniencia de no emplear fluconazol en monoterapia en ciertos episodios de peritonitis y la necesidad de evaluar su eficacia en algunas especies de levaduras25. Los nuevos triazoles, especialmente voriconazol, son de gran utilidad por vía oral e intravenosa en la peritonitis fúngica e incluso permiten mantener el catéter peritoneal73,136,137.
Anfotericina B es un antifúngico con un espectro de acción amplio; sólo se ha detectado resistencia in vitro frente a un escaso número de especies de levaduras y hongos filamentosos, por lo que ofrece cierta seguridad46. Uno de los problemas que presenta es que la administración intraperitoneal provoca irritación local y no permite alcanzar buenas concentraciones inhibitorias, por lo que se usa la vía intravenosa135,136. La formulación liposomal disminuye la toxicidad sin pérdida de la eficacia. La resistencia primaria a anfotericina B ha emergido en paralelo con el incremento de infecciones causadas por ciertas levaduras (Trichosporon beigelii, C. lusitaniae, C. guilliermondii), hongos filamentosos hialinos (Fusarium, Scopulariosis, Scedosporium) y algunos hongos dematiáceos.
Las equinocandinas tienen capacidad de actuar sobre las biopelículas, lo que puede reforzar su indicación terapéutica en el tratamiento de infecciones asociadas con catéteres. Se administran mediante perfusión intravenosa. Caspofungina es la más utilizada, pero su análoga anidulafungina es de dos a cuatro veces más activa in vitro. El mayor inconveniente de las equinocandinas es que no se dispone de un método de referencia para valorar su actividad in vitro frente a levaduras y hongos filamentosos, por lo que hay que ser prudentes al extrapolar los datos in vivo.
Entre los antifúngicos empleados en la práctica clínica actual se incluyen: fluconazol (asociado o no a 5-fluorocitosina), anfotericina B, voriconazol y caspofungina, bien en monoterapia o en cualquiera de las posibles asociaciones entre ellos4,9,28-30,90. Aunque la monoterapia con fluconazol (200 mg/día) suele ser efectiva, la terapia combinada o el uso de fármacos más potentes puede mejorar el pronóstico y disminuir la mortalidad100, por lo que se recomienda en situaciones de fracaso terapéutico, resistencia o intolerancia a otros antifúngicos y episodios cuya etiología corresponda a hongos filamentosos13,25,29,56,138. La terapia combinada con fluconazol permite reducir su dosis a 100 mg/día y acortar el tiempo de tratamiento, que por lo general debe ser de un mínimo de 2 semanas hasta 4-6 semanas, según los distintos autores.
Se ha notificado la utilidad de la administración de tratamiento profiláctico oral con fluconazol (100 mg/día), ketoconazol (200 mg/día) y nistatina (enjuagues diarios), para evitar la proliferación de hongos en aquellos pacientes con elevado riesgo de infección por antibioterapia prolongada, peritonitis de repetición o inmunodepresión9,35,139-142. Sin embargo, algunos estudios no confirman la reducción de los episodios de peritonitis fúngica empleando nistatina como profilaxis143-145.
Algunos estudios han demostrado una disminución de la incidencia de peritonitis bacteriana con los nuevos avances en los sistemas de diálisis peritoneal, el uso de soluciones más biocompatibles (carentes de productos de degradación de la glucosa, con bicarbonato o con bajas concentraciones de lactato)138, el mejor conocimiento de los factores de riesgo y el empleo de medidas de prevención, pero no hay datos en relación con la infección fúngica. Es posible que este hecho, junto a la retirada precoz del catéter peritoneal y el empleo de potentes antifúngicos, contribuya decisivamente al descenso de episodios de peritonitis fúngica en diálisis peritoneal.

Bibliografía
1. Goldie SJ, Kiernan-Troidle L, Torres C, Sorban-Brennan N, Dunne D, Kliger AS, et al. Fungal peritonitis in a large chronic peritoneal dialysis population: a report of 55 episodes. Am J Kidney Dis 1996;1:86-91. [ Links ]
2. Bren A. Fungal peritonitis in patients on continuous ambulatory peritoneal dialysis. Eur J Clin Microbiol Infect Dis 1998;17:839-43. [ Links ]
3. The Turkish Multicenter Peritoneal Dialysis Study Group (TULIP). The rate, risk factors, and outcome of fungal peritonitis in CAPD patients: experience in Turkey. Perit Dial Int 2000;20:338-40. [ Links ]
4. Wang AY, Yu AW, Li PK, Lam PK, Leung CB, Lai KN, et al. Factors predicting outcome of fungal peritonitis in peritoneal dialysis: analysis of a 9-year experience of fungal peritonitis in a single center. Am J Kidney Dis 2000;36:1183-92. [ Links ]
5. Troidle L, Gorban-Brennan N, Kliger A, Finkelstein FO. Continous peritoneal dialysis-associated peritonitis: a review and current concepts. Semin Dial 2003;6:428-37. [ Links ]
6. Bibashi E, Memmos D, Kokolina E, Tsakiris D, Sofianou D, Papadimitriou M. Fungal peritonitis complicating peritoneal dialysis during an 11-year period: report of 46 cases. Clin Infect Dis 2003;36:927-30. [ Links ]
7. Prasad KN, Prasad N, Gupta A, Sharma RK, Verma AK, Ayyagari A. Fungal peritonitis in patients on continuous ambulatory peritoneal dialysis: a single centre Indian experience. J Infect 2004;48:96-101. [ Links ]
8. Molina P, Puchades MJ, Aparicio M, García Ramón R, Miguel A. Experiencia en peritonitis fúngica en una unidad de diálisis durante diez años. Nefrología 2005;25:393-8. [ Links ]
9. Prasad, N, Gupta, A. Fungal peritonitis in peritoneal dialysis patients. Perit Dial Int 2005;25:207-22. [ Links ]
10. Ekim M, Fitöz S, Yagmurlu A, Ensari A, Yüksel S, Acar B, et al. Encapsulating peritoneal sclerosis in paediatric peritoneal dialysis patients. Nephrology (Carlton) 2005;10:341-3. [ Links ]
11. Das R, Vaux E, Barker L, Naik R. Fungal peritonitis complicating peritoneal dialysis: report of 18 cases and analysis of outcomes. Adv Perit Dial 2006;22:55-9. [ Links ]
12. Felgueiras J, Del Peso G, Bajo A, Hevia C, Romero S, Celadilla O, et al. Risk of technique failure and death in fungal peritonitis is determined mainly by duration on peritoneal dialysis: single-center experience of 24 years. Adv Perit Dial 2006;22:77-81. [ Links ]
13. Predari SC, De Paulis AN, Verón D, Zucchini A, Santoianni JE. Fungal peritonitis in patients on peritoneal dialysis: twenty five years of experience in a teaching hospital in Argentina. Rev Argent Microbiol 2007;39:213-7. [ Links ]
14. Kocak Z, Bulut C, Kinikli S, Yilmaz GR, Irmak H, Demdroz AP. Fungal peritonitis in patients undergoing continuous ambulatory peritoneal dialysis: A report of three cases. Turk Med J 2007;1:30-3. [ Links ]
15. Rosa NG, Silva S, Lopes JA, Branco P, De Almeida E, Ribeiro C, et al. Fungal peritonitis in peritoneal dialysis patients: Is previous antibiotic therapy an essential condition? Mycoses 2007;50:79-81. [ Links ]
16. Raaijmakers R, Schröder C, Monnens L, Cornelissen E, Warris A. Fungal peritonitis in children on peritoneal dialysis. Pediatr Nephrol 2007;22:288-93. [ Links ]
17. Hooman N, Madani A, Sharifian Dorcheh M, Mahdavi A, Derakhshan A, Gheissari A, et al. Fungal peritonitis in Iranian children on continuous ambulatory peritoneal dialysis: a national experience. Iran J Kidney Dis 2007;1:29-33. [ Links ]
18. Ram R, Swarnalatha G, Neela P, Murty KV. Fungal peritonitis in patients on continuous ambulatory peritoneal dialysis: a single-centre experience in India. Nephron Clin Pract 2008;110: 207-12. [ Links ]
19. Wong PN, Mak SK, Lo KY, Tong GM, Wong AK. A retrospective study of seven cases of Candida parapsilosis peritonitis in CAPD patients: the therapeutic implications. Perit Dial Int 2000;20:76-9. [ Links ]
20. Chen KH, Chang CT, Yu CC, Huang JY, Yang CW, Hung CC. Candida parapsilosis peritonitis has more complications than other Candida peritonitis in peritoneal dialysis patients. Ren Fail 2006;28:241-6. [ Links ]
21. Gupta A, Mi H, Wroe C, Jaques B, Talbot D. Fatal Candida famata peritonitis complicating sclerosing peritonitis in a peritoneal dialysis patient. Nephrol Dial Transplant 2006;21:2036-7. [ Links ]
22. Liu SW, Chern CH, Yen DH, Huang CI, How CK. Abdominal wall and intraperitoneal abscesses complicating Aspergillus peritonitis in peritoneal dialysis. Am J Med Sci 2009;337:56. [ Links ]
23. García-Martos P, Gil de Sola F, Marín P, García-Agudo L, García-Agudo R, Tejuca F, et al. Peritonitis fúngica en diálisis peritoneal continua ambulatoria: descripción de 10 casos. Nefrología 2009;29(6):534-9. [ Links ]
24. Chan TM, Chan CY, Cheng SW, Lo WK, Lo CY, Cheng IK. Treatment of fungal peritonitis complicating continuous ambulatory peritoneal dialysis with oral fluconazole: a series of 21 patients. Nephrol Dial Transplant 1994; 9: 539-42. [ Links ]
25. Piraino B, Bailie GR, Bernardini J, Boeschoten E, Gupta A, Holmes C, et al. ISPD guidelines/recommendations. Peritoneal dialysisrelated infections: 2005 update. Perit Dial Int 2005;25:107-31. [ Links ]
26. Indhumathi E, Chandrasekaran V, Jagadeswaran D, Varadarajan M, Abraham G, Soundararajan P. The risk factors and outcome of fungal peritonitis in continuous ambulatory peritoneal dialysis patients. Indian J Med Microbiol 2009;27:59-61. [ Links ]
27. Huang JW, Hung KY, Wu KD, Peng YS, Tsai TJ, Hsieh BS. Clinical features of and risk factors for fungal peritonitis in peritoneal dialysis patients. J Formos Med Assoc 2000;99:544-8. [ Links ]
28. Kaitwatcharachai C. Candida parapsilosis peritonitis in patients on CAPD. Mycopathologia 2002;154:181-4. [ Links ]
29. Fourtounas C, Marangos M, Kalliakmani P, Savidaki E, Goumenos DS, Vlachojannis JG. Treatment of peritoneal dialysis related fungal peritonitis with caspofungin plus amphotericin B combination therapy. Nephrol Dial Transplant 2006;21:236-7. [ Links ]
30. Chen CM, Ho MW, Yu WL, Wang JH. Fungal peritonitis in peritoneal dialysis patients: effect of fluconazole treatment and use of the twin-bag disconnect system. J Microbiol Immunol Infect 2004;37:115-20. [ Links ]
31. Wong PN, Lo KY, Tong GM, Chan SF, Lo MW, Mak SK, et al. Treatment of fungal peritonitis with a combination of intravenous amphotericin B and oral flucytosine, and delayed catheter replacement in continuous ambulatory peritoneal dialysis. Perit Dial Int 2008;28:155-62. [ Links ]
32. Schattner A, Kagan A, Zimhony O. Aspergillus peritonitis in a lupus patient on chronic peritoneal dialysis. Rheumatol Int 2006;26:762-4. [ Links ]
33. Anuradha S, Chatterjee A, Bajaj J, Singh NP, Agarwal SK, Kaur R. Trichosporon beigelii peritonitis in a HIV-positive patient on continuous ambulatory peritoneal dialysis. J Assoc Physicians India 2000;48:1022-4. [ Links ]
34. Manzano-Gayosso P, Hernández-Hernández F, Méndez-Tovar LJ, González-Monroy J, López-Martínez R. Fungal peritonitis in 15 patients on continuous ambulatory peritoneal dialysis (CAPD). Mycoses 2003;46:425-9. [ Links ]
35. Morey A, Lima C, Matas B, Munar MA. Profilaxis con fluconazole de las peritonitis fúngicas en diálisis peritoneal. Nefrología 2001;21:608. [ Links ]
36. Olea T, Hevia C, Bajo MA, Del Peso G, Selgas R. Peritonitis por Pasteurella multocida y Candida albicans. Nefrología 2006;26:136-8. [ Links ]
37. Janakiraman H, Abraham G, Mathew M, Lalitha MK, Bhaskar S. Relapsing peritonitis due to co-infection with Mycobacterium triviale and Candida albicans in a CAPD patient. Perit Dial Int 2007;27:311-3. [ Links ]
38. Böhlke M, Souza PA, Menezes AM, Roth JM, Kramer LR. Peritonitis due to Penicillium and Enterobacter in a patient receiving continuous ambulatory peritoneal dialysis. Braz J Infect Dis 2007;11:166-8. [ Links ]
39. Liang CC, Fang JT, Chen KH, Hung CC, Hwang TL, Huang JY. Candida parapsilosis peritonitis complicated with infected pancreatic pseudocysts in a peritoneal dialysis patient: a challenge for nephrologists. Clin Nephrol 2008;69:461-3. [ Links ]
40. Montenegro J, Aguirre R, González O, Martínez I, Saracho R. Fluconazole treatment of Candida peritonitis with delayed removal of the peritoneal dialysis catheter. Clin Nephrol 1995;44:60-3. [ Links ]
41. Yuen KY, Seto WH, Ching TY, Cheung WC, Kwok Y, Chu YB. An outbreak of Candida tropicalis peritonitis in patients on intermittent peritoneal dialysis. J Hosp Infect 1992;22:65-72. [ Links ]
42. Cheng VC, Lo WK, Woo PC, Chan SB, Cheng SW, Ho M, Yuen KY. Polymicrobial outbreak of intermittent peritoneal dialysis peritonitis during external wall renovation at a dialysis center. Perit Dial Int 2001;21:296-301. [ Links ]
43. Mocan H, Murphy AV, Beattie TJ, McAllister TA. Fungal peritonitis in children on continuous ambulatory peritoneal dialysis. Scott Med J 1989;34:494-6. [ Links ]
44. Cinar S, Nedret Koc A, Taskapan H, Dogukan A, Tokgöz B, Utas C. Case report. Candida lusitaniae peritonitis in a patient on continuous ambulatory peritoneal dialysis. Mycoses 2002;45:120-2. [ Links ]
45. García-Martos P, Díaz J, Castaño M, Pérez M, Marín P. Peritonitis caused by Candida lusitaniae in patient on continuous ambulatory peritoneal dialysis (CAPD). Clin Nephrol 1991;36:50. [ Links ]
46. Tarif N. Candida lusitaniae peritonitis in a chronic ambulatory peritoneal dialysis patient. Saudi J Kidney Dis Transpl 2004;15:170-3. [ Links ]
47. Mydlik M, Tkacova E, Szovenyiova K, Mizla P, Derzsiova K. Saccharomyces cerevisiae peritonitis complicating CAPD. Perit Dial Int 1996;16:188. [ Links ]
48. Snyder S. Peritonitis due to Saccharomyces cerevisiae in a patient on CAPD. Perit Dial Int 1992;12:77-8. [ Links ]
49. Guclu E, Soypacaci Z, Yildirim M, Kucukbayrak A, Ozdemir D. First case of continuous ambulatory peritoneal dialysis peritonitis due to Candida sake. Mycoses 2008;52:280-1. [ Links ]
50. Yinnon AM, Solages A, Treanor JJ. Cryptococcal peritonitis: report of a case developing during continuous ambulatory peritoneal dialysis and review of the literature. Clin Infect Dis 1993;17:736-41. [ Links ]
51. Mansoor GA, Ornt DB. Cryptococcal peritonitis in peritoneal dialysis patients: a case report. Clin Nephrol 1994;41:230-2. [ Links ]
52. Sinott JT, Rodnite J, Emmanuel PJ, Campos A. Cryptococcus laurentii infection complicating peritoneal dialysis. Pediatr Infect Dis J 1989;8:803-5. [ Links ]
53. Ujhelyi MR, Raasch RH, Van der Horst CM, Mattern WD. Treatment of peritonitis due to Curvularia and Trichosporon with amphotericin B. Rev Infect Dis 1990;12:621-7. [ Links ]
54. Kouppari G, Stephanidis K, Zaphiropoulou A, Siapera D, Deliyianni V. Trichosporon beigelii peritonitis in a child on continuous ambulatory peritoneal dialysis. Clin Microbiol Infect 1997;3:509-10. [ Links ]
55. Yuen KY, Seto WH, Li KS, Leung R. Trichosporon beigelii peritonitis in continuous ambulatory peritoneal dialysis. J Infect 1990;20:178-9. [ Links ]
56. Madariaga MG, Tenorio A, Proia L. Trichosporon inkin peritonitis treated with caspofungin. J Clin Microbiol 2001;41:5827-9. [ Links ]
57. Crowther KS, Webb AT, McWhinney PH. Trichosporon inkin peritonitis in a patient on continuous ambulatory peritoneal dialysis returning from the Caribbean. Clin Nephrol 2003; 59:69-70. [ Links ]
58. Lopes JO, Alves SH, Klock C, Oliveira LT, Dal Forno NR. Trichosporon inkin peritonitis during continuous ambulatory peritoneal dialysis with bibliography review. Mycopathologia 1997;139:15-8. [ Links ]
59. De Saedeleer B, Sennesael J, Van der Niepen P, Verbeelen D. Intraperitoneal fluconazole therapy for Trichosporon cutaneum peritonitis in continuous ambulatory peritoneal dialysis. Nephrol Dial Transplant 1994;9:1658-9. [ Links ]
60. Jian DY, Yang WC, Chen TW, Lin CC. Trichosporon asahii following polymicrobial infection in peritoneal dialysis-associated peritonitis. Perit Dial Int 2008;28:100-1. [ Links ]
61. Soylu A, Demirciolu F, Türkmen M, Yücesoy M, Kavukçu S. Unusual cause of peritonitis during peritoneal dialysis. Rhodotorula rubra and amphotericin B. Pediatr Nephrol 2004;19:1426-8. [ Links ]
62. Pennington JC 3rd, Hauer K, Miller W. Rhodotorula rubra peritonitis in an HIV patient on CAPD. Del Med J 1995;67:184. [ Links ]
63. De Zoysa JR, Searle M, Lynn KL, Robson RA. Successful treatment of CAPD peritonitis caused by Rhodotorula mucilaginosa. Perit Dial Int 2001;21:627-8. [ Links ]
64. Wood M, Roxby CM, Gould K, Martin AM. Peritonitis due to Rhodotorula glutinis in a patient on CAPD. Perit Dial Bull 1985;5:205. [ Links ]
65. Choy BY, Wong SS, Chan TM, Lai KN. Pichia ohmeri peritonitis in a patient on CAPD: response to treatment with amphotericin. Perit Dial Int 2000;20:91. [ Links ]
66. Hernández Jaras J, Martínez-Martínez L, Gallego JL, Fernández Fernández J, Botella J. Geotrichum sp. as an agent of peritonitis in continuous ambulatory peritoneal dialysis (CAPD). Clin Nephrol 1987;28:210. [ Links ]
67. Johnson AS, Bailey E, Wright PA, Solomon L. Malassezia furfur: a possible cause of culture-negative CAPD peritonitis. Perit Dial Int 1996;16:187-8. [ Links ]
68. Fine A, Churchill D, Gault H, Furdy P. Pityrosporum pachydermatis peritonitis in a CAPD patient on long-term intraperitoneal antibiotics. Perit Dial Bull 1983;3:108-9. [ Links ]
69. Lopes JO, Alves SH, Benevenga JP, Regio OR, Calil A. Histoplasma capsulatum peritonitis associated with continuous ambulatory peritoneal dialysis. Mycopathologia 1993;122:101-2. [ Links ]
70. Lopes JO, Alves SH, Benevenga JP, Rosa AC. The second case of peritonitis due to Histoplasma capsulatum during continuous ambulatory peritoneal dialysis in Brazil. Mycoses 1994;37:161-3. [ Links ]
71. Ampel NM, White JD, Varanasi UR, Larwood TR, Van Wyck DB, Galgiani JN. Coccidioidal peritonitis associated with continuous ambulatory peritoneal dialysis. Am J Kidney Dis 1988;11:512-4. [ Links ]
72. Quirin N, Desnos-Ollivier M, Cantin JF, Valery JC, Doussy Y, Goursaud R, et al. Peritonitis due to Blastobotrys proliferans in a patient undergoing continuous ambulatory peritoneal dialysis. J Clin Microbiol 2007;45:3453-5. [ Links ]
73. Ide L, De Laere E, Verlinde A, Surmont I. A case of Aspergillus fumigatus peritonitis in a patient undergoing continuous ambulatory peritoneal dialysis (CAPD): diagnostic and therapeutic challenges. J Clin Pathol 2005;58:559. [ Links ]
74. Bonfante L, Nalesso F, Cara M, Antonello A, Malagoli A, Pastori G, et al. Aspergillus fumigatus peritonitis in ambulatory peritoneal dialysis: a case report and notes on the therapeutic approach. Nephrology 2005;10:270-3. [ Links ]
75. Bibashi E, Papagianni A, Kelesidis A, Antoniadou R, Papadimitriou M. Peritonitis due to Aspergillus niger in a patient on continuous ambulatory peritoneal dialysis after kidney graft rejection. Nephrol Dial Transplant 1993;8:185-7. [ Links ]
76. Miles AM, Barth RH. Aspergillus peritonitis: therapy, survival, and return to peritoneal dialysis. Am J Kidney Dis 1995;26:80-3. [ Links ]
77. Sridhar R, Thornley-Brown D, Shashi Kant K. Peritonitis due to Aspergillus niger: diagnostic importance of peritoneal eosinophilia. Perit Dial Int 1990;10:100-1. [ Links ]
78. Nannini EC, Paphitou NI, Ostrosky-Zeichner L. Peritonitis due to Aspergillus and Zygomycetes in patients undergoing peritoneal dialysis: report of 2 cases and review of the literature. Diagn Microbiol Infect Dis 2003;46:49-54. [ Links ]
79. Verghese S, Palani R, Thirunavakarasu N, Chellamma T, Pathipata P. Peritonitis due to Aspergillus terreus in a patient undergoing continuous ambulatory peritoneal dialysis. Mycoses 2008;51:174-6. [ Links ]
80. Kalishian Y, Miller EB, Kagan A, Landau Z. Aspergillus terreus peritonitis in a CAPD patient: report of a case. Perit Dial Int 2004;24:93. [ Links ]
81. Schwetz I, Horina J, Buzina W, Roob J, Olschewski H, Krause R. Aspergillus oryzae peritonitis in CAPD: case report and review of the literature. Am J Kidney Dis 2007;49:701-4. [ Links ]
82. Chiu YL, Liaw SJ, Wu VC, Hsueh PR. Peritonitis caused by Aspergillus sydowii in a patient undergoing continuous ambulatory peritoneal dialysis. J Infect 2005;51:159-61. [ Links ]
83. Ghebremedhin B, Bluemel A, Neumann KH, Koenig B, Koenig W. Peritonitis due to Neosartorya pseudofischeri in an elderly patient undergoing peritoneal dialysis successfully treated with voriconazole. J Med Microbiol 2009;58:678-82. [ Links ]
84. Matsumoto N, Shiraga H, Takahashi K, Kikuchi K, Ito K. Successful treatment of Aspergillus peritonitis in a peritoneal dialysis patient. Pediatr Nephrol 2002;17:243-5. [ Links ]
85. Chang HR, Shu KH, Cheng CH, Wu MJ, Chen CH, Lian JD. Peritoneal-dialysis-associated Penicillium peritonitis. Am J Nephrol 2000;20:250-2. [ Links ]
86. Huang JW, Chu TS, Wu MS, Peng YS, Hsieh BS. Visible Penicillium spp. colonization plaques on a Tenckhoff catheter without resultant peritonitis in a peritoneal dialysis patient. Nephrol Dial Transplant 2000;15:1872-3. [ Links ]
87. Keceli S, Yegenaga I, Dagdelen N, Mutlu B, Uckardes H, Willke A. Case report: peritonitis by Penicillium spp. in a patient undergoing continuous ambulatory peritoneal dialysis. Int Urol Nephrol 2005;37:129-31. [ Links ]
88. Kovac D, Lindic J, Lejko-Zupanc T, Bren AF, Knap B, Lesnik M, et al. Treatment of severe Paecilomyces varioti peritonitis in a patient on continuous ambulatory peritoneal dialysis. Nephrol Dial Transplant 1998;13:2943-6. [ Links ]
89. Rinaldi S, Fiscarelli E, Rizzoni G. Paecilomyces variotii peritonitis in an infant on automated peritoneal dialysis. Pediatr Nephrol 2000;14:365-6. [ Links ]
90. Bibashi E, Kokolina E, Sigler L, Sofianou D, Tsakiris D, Visvardis G, et al. Three cases of uncommon fungal peritonitis in patients undergoing peritoneal dialysis. Perit Dial Int 2002;22:523-5. [ Links ]
91. Wright K, Popli S, Gandhi VC, Lentino JR, Reyes CV, Leehey DJ. Paecilomyces peritonitis: case report and review of the literature. Clin Nephrol 2003;59:305-10. [ Links ]
92. Chang BP, Sun PL, Huang FY, Tsai TC, Lin CC, Lee MD, et al. Paecilomyces lilacinus peritonitis complicating peritoneal dialysis cured by oral voriconazole and terbinafine combination therapy. J Med Microbiol 2008;57:1581-4. [ Links ]
93. Korzets A, Weinberger M, Chagnac A, Goldschmied-Reouven A, Rinaldi MG, Sutton DA. Peritonitis due to Thermoascus taitungiacus Anamorph Paecilomyces taitungiacus. J Clin Microbiol 2001;39:720-4. [ Links ]
94. Alscher DM, Pfinder-Nohe E, Rumpf D, Pauli-Magnus C, Knabbe C, Kuhlmann U, et al. Moulds in containers with biological wastes as a possible source of peritonitis in two patients on peritoneal dialysis. Perit Dial Int 1998;18:643-6. [ Links ]
95. Koc N, Utas C, Oymak O, Sehmen E. Peritonitis due to Acremonium strictum in a patient on continuous ambulatory peritoneal dialysis. Nephron 1998;79:357-8. [ Links ]
96. Sener AG, Yucesoy M, Senturkun S, Afsar I, Yurtsever SG, Turk M. A case of Acremonium strictum peritonitis. Med Mycol 2008;46:495-7. [ Links ]
97. Lopes JO, Alves SH, Rosa AC, Silva CB, Sarturi JC, Souza CAR. Acremonium kiliense peritonitis complicating continuous ambulatory peritoneal dialysis: report of two cases. Mycopathologia 1995;131:83-5. [ Links ]
98. Kendirli T, Ciftçi E, Ekim M, Galip N, Düzenli F, Ozçakar ZB, et al. Acremonium spp. peritonitis in an infant. Mycoses 2008;51:455-7. [ Links ]
99. Nuño E, Cisneros JM, Regordan C, Montes R, Guerrero MA, Martín C. Peritonitis por Fusarium solani: una complicación infrecuente de la diálisis peritoneal. Enferm Infecc Microbiol Clin 1995;13:196-7. [ Links ]
100. García-Tapia A, Aznar E, García-Martos P, Marín P, Márquez A, Lozano C, et al. Fusarium peritonitis in a patient on peritoneal dialysis. Rev Iberoam Micol 1999;16:166-7. [ Links ]
101. Flynn JT, Meislich D, Kaiser BA, Polinsky MS, Baluarte HJ. Fusarium peritonitis in a child on peritoneal dialysis: case report and review of the literature. Perit Dial Int 1996;16:52-7. [ Links ]
102. Giacchino F, Belardi P, Merlino C, Aimino M, Garneri G, Cuffini AM, et al. Treatment of Fusarium peritonitis in a peritoneal dialysis patient. Perit Dial Int 1997;17:403-4. [ Links ]
103. Agarwal S, Goodman NL, Malluche HH. Peritonitis due to Exophiala jeanselmei in a patient undergoing continuous ambulatory peritoneal dialysis. Am J Kidney Dis 1993;21:673-5. [ Links ]
104. Remon C, De la Calle IJ, Vallejo Carrión F, Pérez-Ramos S, Fernández Ruiz E. Exophiala jeanselmei peritonities in a patient on CAPD. Perit Dial Int 1996;16:536-8. [ Links ]
105. Lye WC. Peritonitis due to Wangiella dermatitidis in a patient on CAPD. Perit Dial Int 1993;13:319-20. [ Links ]
106. Vlassopoulos D, Kouppari G, Arvanitis D, Papaefstathiou K, Dounavis A, Velegraki A, et al. Wangiella dermatitidis peritonitis in a CAPD patient. Perit Dial Int 2001;21:96-7. [ Links ]
107. Greig J, Harkness M, Taylor P, Hashmi C, Liang S, Kwan J. Peritonitis due to the dermatiaceous mold Exophiala dermatitidis complicating continuous ambulatory peritoneal dialysis. Clin Microbiol Infect 2003;9:713-5. [ Links ]
108. Lopes JO, Alves SH, Benevenga JP, Brauner FB, Castro MS, Melchiors E. Curvularia lunata peritonitis complicating peritoneal dialysis. Mycopathologia 1994;127:65-7. [ Links ]
109. Pimentel JD, Mahadevan K, Woodgyer A, Sigler L, Gibas C, Harris OC, et al. Peritonitis due to Curvularia inaequalis in an elderly patient undergoing peritoneal dialysis and a review of six cases of peritonitis associated with other Curvularia spp. J Clin Microbiol 2005;43:4288-92. [ Links ]
110. Vachharajani TJ, Zaman F, Latif S, Penn R, Abreo KD. Curvularia geniculata fungal peritonitis: a case report with review of literature. Int Urol Nephrol 2005;37:781-4. [ Links ]
111. Canon HL, Buckingham SC, Wyatt RJ, Jones DP. Fungal peritonitis caused by Curvularia species in a child undergoing peritoneal dialysis. Pediatr Nephrol 2001;16:35-7. [ Links ]
112. Vogelgesang SA, Lockard JW, Quinn MJ, Hasbargen JA. Alternaria peritonitis in a patient undergoing continuous ambulatory peritoneal dialysis. Perit Dial Int 1990;10:313. [ Links ]
113. Reiss-Levy E, Clingan P. Peritonitis caused by Alternaria alternata. Med J Aust 1981;2:44. [ Links ]
114. Bava AJ, Fayad A, Céspedes C, Sandoval M. Fungal peritonitis caused by Bipolaris spicifera. Med Mycol 2003;41:529-31. [ Links ]
115. Gadallah MF, White R, El-Shahawy MA, Abreo F, Oberle A, Work J. Peritoneal dialysis complicated by Bipolaris hawaiiensis peritonitis: successful therapy with catheter removal and oral itraconazol without the use of amphotericin-B. Am J Nephrol 1995;15:348-52. [ Links ]
116. Mise N, Ono Y, Kurita N, Sai K, Nishi T, Tagawa H, et al. Aureobasidium pullulans peritonitis: case report and review of the literature. Perit Dial Int 2008;28:679-81. [ Links ]
117. Caporale NE, Calegari L, Perez D, Gezuele E. Peritoneal catheter colonization and peritonitis with Aureobasidium pullulans. Perit Dial Int 1996;16:97-8. [ Links ]
118. Severo LC, Oliveira F, Garcia CD, Uhlmann A, Londero AT. Peritonitis by Scedosporium apiospermum in a patient undergoing continuous ambulatory peritoneal dialysis. Rev Inst Med Trop Sao Paulo 1999;41:263-4. [ Links ]
119. Vaidya PS, Levine JF. Scopulariopsis peritonitis in a patient undergoing continuous ambulatory peritoneal dialysis. Perit Dial Int 1992;12:78-9. [ Links ]
120. Esel D, Koc AN, Utas C, Karaca N, Bozdemir N. Fatal peritonitis due to Trichoderma sp. in a patient undergoing continuous ambulatory peritoneal dialysis. Mycoses 2003;46:71-3. [ Links ]
121. Guiserix J, Ramdane M, Finielz P, Michault A, Rajaonarivelo P. Trichoderma harzianum peritonitis in peritoneal dialysis. Nephron 1996;74:473-4. [ Links ]
122. Tanis BC, Van der Pijl H, Van Ogtrop ML, Kibbelaar RE, Chang PC. Fatal fungal peritonitis by Trichoderma longibrachiatum complicating peritoneal dialysis. Nephrol Dial Transplant 1995;10:114-6. [ Links ]
123. Febré N, Silva V, Medeiros EA, Godoy P, Reyes E, Halker E, et al. Contamination of peritoneal dialysis fluid by filamentous fungi. Rev Iberoam Micol 1999;16:238-9. [ Links ]
124. Ahmad S, Johnson RJ, Hillier S, Shelton WR, Rinaldi MG. Fungal peritonitis caused by Lecythophora mutabilis. J Clin Microbiol 1985;22:182-6. [ Links ]
125. Shin JH, Lee SK, Suh SP, Ryang DW, Kim NH, Rinaldi MG, et al. Fatal Hormonema dematioides peritonitis in a patient on continuous ambulatory peritoneal dialysis: criteria for organism identification and review of other known fungal etiologic agents. J Clin Microbiol 1998;36:2157-63. [ Links ]
126. Amici G, Grandesso S, Mottola A, Virga G, Teodori T, Maresca MC, et al. Verticillium peritonitis in a patient on peritoneal dialysis. Am J Nephrol 1994;14:216-9. [ Links ]
127. Nayak S, Satish R, Gokulnath, Savio J, Rajalakshmi T. Peritoneal mucormycosis in a patient on CAPD. Perit Dial Int 2007;27:216-7. [ Links ]
128. Nakamura M, Weil WB Jr, Kaufman DB. Fatal fungal peritonitis in an adolescent on continuous ambulatory peritoneal dialysis: association with deferoxamine. Pediatr Nephrol 1989;3:80-2. [ Links ]
129. Sedlacek M, Cotter JG, Suriawinata AA, Kaneko TM, Zuckerman RA, Parsonnet J, et al. Mucormycosis peritonitis: more than 2 years of disease-free follow-up after posaconazole salvage therapy after failure of liposomal amphotericin B. Am J Kidney Dis 2008;51:302-6. [ Links ]
130. Fergie JE, Fitzwater DS, Einstein P, Leggiadro RJ. Mucor peritonitis associated with acute peritoneal dialysis. Pediatr Infect Dis J 1992;11:498-500. [ Links ]
131. Pimentel JD, Dreyer G, Lum GD. Peritonitis due to Cunninghamella bertholletiae in a patient undergoing continuous ambulatory peritoneal dialysis. J Med Microbiol 2006;55:115-8. [ Links ]
132. Keane W, Bailie G, Boeschoten E, Gokal R, Golper T, Holmes C, et al. ISPD guidelines/recommendations. Adult peritoneal dialysisrelated peritonitis treatment recommendations: 2000 update. Perit Dial Int 2000;20:396-411. [ Links ]
133. Scotter JM, Stevens JM, Chambers ST, Lynn KL, Patton WN. Diagnosis of Aspergillus peritonitis in a renal dialysis patient by PCR and galactomannan detection. J Clin Pathol 2004;57: 662-4. [ Links ]
134. Arrieta J, Bajo MA, Caravaca F, Coronel F, García-Pérez H, González-Parra E, et al. Guías SEN. Guías de Práctica Clínica en Diálisis Peritoneal. Nefrología 2006; 26 (Supl. 4). [ Links ]
135. Boer WH, Van Ampting JM, Vos P. Successful treatment of eight episodes of Candida peritonitis without catheter removal using intracatheter administration of amphotericin B. Perit Dial Int 2007;27:208-10. [ Links ]
136. Blowey DL, Garg UC, Kearns GL, Warady BA. Peritoneal penetration of amphotericin B lipid complex and fluconazole in a pediatric patient with fungal peritonitis. Adv Perit Dial 1998;14:247-50. [ Links ]
137. Kleinpeter MA. Successful treatment of Candida infections in peritoneal dialysis patients: case reports and review of the literature. Adv Perit Dial 2004;20:58-61. [ Links ]
138. Selgas R, Cirugeda A, Sansone G. Peritonitis fúngicas en diálisis peritoneal: las nuevas soluciones pueden ser una esperanza. Nefrología 2003;23:298-9. [ Links ]
139. Zaruba K, Peters J, Jungbluth H. Successful prophylaxis for fungal peritonitis in patients on continuos ambulatory peritoneal dialysis: six years' experience. Am J Kidney Dis 1991;17:43-6. [ Links ]
140. Wong PN, Lo KY, Tong GM, Chan SF, Lo MW, Mak SK, et al. Prevention of fungal peritonitis with nystatin prophylaxis in patients receiving CAPD. Perit Dial Int 2007;27:531-6. [ Links ]
141. Wadhwa NK, Suh H, Calbralda T. Antifungal prophylaxis for secundary fungal peritonitis in peritoneal dialysis patients. Adv Perit Dial 1996;12:189-95. [ Links ]
142. Moreiras-Plaza M, Vello-Román A, Sampróm-Rodríguez M, Feijóo- Piñeiro D. Ten years without fungal peritonitis: a single center's experience. Perit Dial Int 2007;27:460-3. [ Links ]
143. Thodis E, Vas SI, Bargman JM, Singhal M, Chu M, Oreopoulos DG. Nystatin prophylaxis: its inability to prevent fungal peritonitis in patients on continuous ambulatory peritoneal dialysis. Perit Dial Int 1998;18:583-9. [ Links ]
144. Hidaka H, Nakao T. Preservation of residual renal function and factors affecting its decline in patients on peritoneal dialysis. Nephrology 2003;8:184-91. [ Links ]
145. Adachi Y, Nakagawa Y, Nishio A. Icodextrin preserves residual renal function in patients treated with automated peritoneal dialysis. Perit Dial Int 2006;26:405-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rebeca García Agudo,
Sección de Nefrología.
Complejo Hospitalario La Mancha-Centro,
Alcázar de San Juan, Ciudad Real
E-mail: rgarciaagudo@hotmail.com