My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nefrología (Madrid)
On-line version ISSN 1989-2284Print version ISSN 0211-6995
Nefrología (Madr.) vol.31 n.5 Cantabria 2011
Estimación del estado de hidratación mediante bioimpedancia espectroscópica multifrecuencia en la enfermedad renal crónica avanzada
Hydration status assessment by multi-frequency bioimpedance in patients with advanced chronic kidney disease
F. Caravaca, C. Martínez del Viejo, J. Villa, R. Martínez Gallardo, F. Ferreira
Servicio de Nefrología. Hospital Infanta Cristina. Badajoz
Dirección para correspondencia
RESUMEN
Introducción: La bioimpedancia espectroscópica multifrecuencia (BIS) es un método preciso y objetivo para estimar la composición corporal y el estado de hidratación, que podría ser de utilidad en el tratamiento de la enfermedad renal crónica avanzada (ERCA).
Objetivos: Los objetivos del presente estudio fueron determinar la prevalencia de las alteraciones del estado de hidratación estimadas por BIS y su relación con las características clínicas y bioquímicas, y establecer el valor de predicción del ángulo de fase a 50 kHz (AF) sobre la mortalidad.
Pacientes y métodos: Se estudiaron 175 pacientes con ERCA. Para la medición de la BIS se utilizó un monitor BCM Fresenius. Los resultados del estado de hidratación (desviación con respecto a la teórica hidratación normal) fueron correlacionados con las principales características clínicas y parámetros bioquímicos. Tras un seguimiento prospectivo (mediana seguimiento = 481 días), se establecieron los mejores determinantes de la mortalidad mediante regresión de Cox, incluyendo entre otras covariables el AF.
Resultados: El 85% de los pacientes tenían un estado de hidratación dentro de unos límites de ± 5% agua corporal total. El estado de hidratación se correlacionó con las características clínicas (edemas e hipertensión arterial severa), y con algunos parámetros bioquímicos, entre los que destacaba la asociación negativa con la albúmina plasmática, el índice de masa corporal y el cociente Na/K en orina. Durante el período de seguimiento fallecieron 16 pacientes (9%). Los mejores determinantes de la mortalidad fueron: índice de comorbilidad (HR = 4,304; p = 0,001), y el ángulo de fase (por cada grado; HR = 0,491; p = 0,026).
Conclusiones: En conclusión, la estimación de la composición corporal y el estado de hidratación por BIS aportan información útil en la ERCA que podría ayudar a su tratamiento. El AF es un predictor independiente de mortalidad a corto plazo.
Palabras clave: Ángulo de fase, Bioimpedancia, Enfermedad renal crónica, Hidratación, Mortalidad, Prediálisis.
ABSTRACT
Introduction: Body composition assessment has the potential to improve the care of patients with chronic kidney disease (CKD). Whole-body multiple-frequency bioimpedance spectroscopy (BIS) appears to be a useful and appropriate technique for assessing hydration status and body composition in CKD patients.
Objective: The aims of this study were to determine the hydration status by BIS in patients with advanced CKD, and to analyse the association of body fluid status with common clinical and biochemical characteristics. The prognostic value of the phase angle at 50KHz (PA) was also evaluated.
Patients and methods: The study group consisted of 175 patients (66±14 year, 77 females) with eGFR<40ml/min not yet on dialysis. Body composition was assessed by BIS (BCM, Fresenius). Hydration status was expressed as a percentage of the total body water (TBW). Patients were prospectively followed-up for a median of 481 days, and the main determinants of mortality were estimated by Cox regression analysis.
Results: The majority of patients (85%) showed a hydration status within ±5% TBW. Patients with oedemas or uncontrolled arterial hypertension showed mean estimate fluid overload significantly higher than that of the other study patients. Fluid overload was negatively associated with serum albumin levels, body mass index and urinary sodium/potassium ratio; and positively with male gender and diabetes. During the follow-up period, 16 patients died (9%). The main determinants of mortality adjusted for other potential covariates were: Davies comorbidity index (HR=4.304; P=.001), and PA (per each o; HR=0.491; P=.026).
Conclusions: BIS may help identify changes in hydration status in CKD patients not fully appreciated by clinical or biochemical assessment. PA was a significant predictor of mortality in these patients.
Key words: Phase angle, Bioimpedance, Chronic kidney disease, Hydration status, Mortality, Predialysis.
Introducción
El conocimiento de la composición corporal se considera una herramienta diagnóstica valiosa en muchas especialidades médicas1-3. El desarrollo de métodos que estiman la composición corporal está ayudando a diagnosticar de forma más precisa las distintas alteraciones del estado de nutrición e hidratación1-3. Estas alteraciones son de relevancia en nefrología, y especialmente en la enfermedad renal crónica (ERC), en la que la caquexia-desnutrición4 y los estados de sobrehidratación5,6 son procesos que marcan de forma significativa el pronóstico vital de estos pacientes, y en los que el diagnóstico clínico convencional, basado en exploraciones clínicas y bioquímicas, está sujeto a muchas imprecisiones.
En la actualidad existen numerosos métodos de estimación de la composición corporal2,7,8, entre los que destacan: dilución de isótopos, densitométricos (peso bajo el agua o pletismografía), antropometría, DEXA (dual energy X-ray absorptiometry), imagen corporal (resonanciamagnética [RM] o tomografíacomputarizada [TC]) y bioimpedancia (BIA).
Por la inocuidad, facilidad de uso, bajo coste y portabilidad, la BIA es el método de estimación de la composición corporal más extendido7-10.
La BIA está basada en el principio de la impedancia bioeléctrica (vector de la suma de la resistencia y reactancia)10. Aunque hasta el momento la BIA monofrecuencia (50 kHz) ha sido la forma más utilizada, la BIA espectroscópica multifrecuencia (BIS) ha surgido como un método con bases teóricas más desarrolladas y complejas con el objetivo de estimar con más precisión no sólo el agua corporal total sino también los diferentes compartimentos de distribución (intracelular y extracelular)7,11,12.
Existe una amplia experiencia con el uso de BIA en pacientes sometidos tanto a hemodiálisis como a diálisis peritoneal3,7,13-15. Los parámetros que se obtienen con este procedimiento son muy útiles para monitorizar la masa magra, la grasa y el estado de hidratación. Sin embargo, la experiencia que se tiene de la monitorización y utilidad de estos parámetros en pacientes con estadios avanzados de ERC no sometidos a diálisis es todavía escasa16-19.
Los objetivos del presente estudio fueron los siguientes: 1) determinar la composición corporal mediante BIS en pacientes con estadios avanzados de enfermedad renal crónica no sometidos a diálisis (ERCA); 2) analizar la prevalencia de las alteraciones del estado de hidratación y su relación con signos y síntomas comunes en la ERCA como son los edemas, los calambres o la hipertensión arterial (HTA) no controlada, así como explorar otras características clínicas y bioquímicas asociadas con el estado de hidratación, y 3) establecer el valor pronóstico del ángulo de fase a 50 kHz, parámetro que ha sido referido previamente como determinante de una peor evolución no sólo en pacientes con ERC20,21, sino también en pacientes con otros procesos crónicos22,23.
Pacientes y métodos
Pacientes
El número total de pacientes incluidos en este estudio fue de 175 (edad media 66 ± 14 años, 77 mujeres y 98 hombres) seleccionados durante el período comprendido entre 1 de septiembre de 2009 y el 1 de febrero de 2010 en la consulta externa de ERCA del Hospital Infanta Cristina, Badajoz.
Los criterios de inclusión fueron: edad mayor de 18 años, presentar una insuficiencia renal crónica con filtrado glomerular (eGFR) inferior a 40 ml/min/1,73 m2 no en diálisis y no secundaria a fracaso de un trasplante renal, ausencia de proceso agudo intercurrente que pudiera potencialmente influir sobre el estado de hidratación o nutrición, ausencia de marcapasos o dispositivos metálicos intravasculares, consentimiento tras información de los fines e inocuidad de la prueba, suficiencia funcional para poder realizar la exploración en camilla, y ausencia de amputaciones u otras alteraciones extremas de la composición corporal (obesidad mórbida o emaciación).
Todas las exploraciones fueron realizadas por la mañana, tras la extracción de sangre para los análisis de laboratorio y la toma de un pequeño desayuno. La temperatura ambiental en el momento de la prueba oscilaba entre los 22 y los 24 oC.
Los datos clínicos fueron obtenidos por la historia y anamnesis. La presencia de edemas en miembros inferiores fue confirmada por al menos dos observadores antes de conocer los resultados de la BIS. El resultado final fue incluido en el estudio como presencia/ausencia de edemas, sin cuantificación de la gravedad.
La información sobre la presencia o la ausencia de calambres se obtuvo mediante anamnesis, recogiendo este dato como positivo si los síntomas eran habituales (más de tres veces por semana), tanto diurnos como nocturnos, en los miembros superiores o en los inferiores.
La HTA no controlada fue definida como presiones arteriales sistólicas (PAS) o diastólicas (PAD) superiores a 150/90 mmHg en más de la mitad de las mediciones extrahospitalarias o domiciliarias en pacientes con prescripción de, al menos, tres medicamentos antihipertensivos.
En todos los pacientes se realizó una medida de la presión arterial en reposo con un dispositivo automático Omron M3, y los resultados fueron incluidos en el estudio.
Cada paciente incluido en el estudio fue pesado con una báscula digital calibrada, y tallado. El índice de masa corporal (IMC) fue calculado por la fórmula convencional de Quételet (kg/m2). No se realizó ninguna otra medición antropométrica.
Análisis de laboratorio
Tras ayuno nocturno y coincidiendo con el día de la exploración mediante BIS, se extrajo sangre a todos los pacientes para estudio hematológico (hemograma) y bioquímico que incluía, entre otros, los siguientes parámetros de interés para el estudio: urea, creatinina, albúmina (método bromocresol púrpura), sodio, potasio, cloro, calcio y fósforo. Las determinaciones bioquímicas se realizaron con un autoanalizador (Advia Chemistry, Siemens Healthcare Diagnostics).También se determinó el bicarbonato en sangre venosa (analizador de gases ABL 800 FLEX, Radiometer Ibérica).
En la orina recogida durante las 24 horas antes del estudio analítico se analizaron los siguientes parámetros bioquímicos: urea, creatinina, proteinuria, sodio y potasio.
El eGFR fue estimado mediante la fórmula MDRD-424.
Bioimpedancia espectroscópica multifrecuencia
Para la determinación de esta prueba se utilizó un monitor de composición corporal (Body Composition Monitor, Fresenius), y para el cálculo de los diferentes parámetros se utilizó el software «Fluid Management Tool», versión 3.1.11. Con unos rangos de emisión de frecuencias comprendidos entre 5 y 1.000 kHz, la estimación del espacio intracelular y extracelular se computó siguiendo el modelo de Cole-Cole25 y las ecuaciones de composición corporal espectrocópica12.
El paciente descalzo, y sin portar elementos metálicos, se acostaba en la camilla sobre una superficie no conductora de la electricidad, separando suficientemente los miembros para que no contactaran entre sí. Si por las características anatómicas del paciente esta separación no era completa, se colocaba entre las piernas una entremetida. Los electrodos se colocaron pegados a la piel en el dorso de la mano y muñeca, y en el dorso del pie y del tobillo.
Los parámetros que se recogieron para el estudio fueron: estado de hidratación o desviación con respecto a la normohidratación (± en litros), agua corporal total (l), agua intracelular, agua extracelular, masa magra total (kg), masa grasa total (kg), masa celular total (kg) y ángulo de fase a 50 kHz (o).
El estado de hidratación fue normalizado al agua corporal total y al agua extracelular, expresado como porcentajes de estos últimos parámetros.
El ángulo de fase se calculó a partir de la resistencia y reactancia26 según la fórmula:
Ángulo Fase = arco-tangente reactancia/resistencia x 180o/π
A una frecuencia de 50 KHz, la impedancia corporal siempre tiene componente de resistencia y reactancia, con coeficientes de variación pequeños. La variabilidad de estos parámetros puede ser mucho mayor si se utilizan frecuencias de corriente más altas. Ésta es la razón por la que se eligió esta frecuencia de 50 KHz para medir la reactancia y la resistencia para el cálculo del ángulo de fase.
Diseño del estudio y métodos estadísticos
El estudio consta de dos partes: una transversal descriptiva, en la que se muestran los parámetros de hidratación y su asociación con las características clínicas y bioquímicas. Tras un seguimiento prospectivo, se analizaron los determinantes de la mortalidad; entre otros parámetros se incluye el ángulo de fase a 50 kHz medido al comienzo del seguimiento.
Los pacientes fueron seguidos tras la evaluación inicial con visitas regulares cada uno-tres meses mientras continuaron en la consulta de ERCA, o a través de la comunicación de cualquier cambio evolutivo después del inicio de diálisis; se censuraron en caso de muerte por cualquier causa o finalización del período de estudio (1 de febrero de 2011).
La mediana de seguimiento hasta el fallecimiento o censura fue de 481 días (rangos intercuartiles: 435-505 días).
Para la comparación de medias de variables continuas con distribución normal se utilizó el test de la t de Student, tanto para muestras relacionadas como independientes. Para la comparación de variables continuas sin distribución normal se utilizaron pruebas no paramétricas, como el test de Mann-Whitney para muestras independientes.
Para determinar el grado de asociación entre variables continuas se utilizaron modelos univariables y multivaribles de regresión lineal. Para la selección de las covariables con los mejores modelos de predicción se empleó el proceso automático de eliminación progresiva condicional (hacia atrás).
Para establecer si existía una asociación independiente entre el ángulo de fase y la supervivencia de los pacientes incluidos en el estudio se utilizaron modelos multivariables de riesgo proporcional de Cox, y se determinaron las relaciones de tasas instantáneas (hazard ratios), con sus intervalos de confianza del 95%. El parámetro ángulo de fase fue analizado como variable continua en los modelos de regresión de Cox, y como variable discreta (por encima o por debajo del valor de la mediana) en análisis de supervivencia univariable con curvas de Kaplan-Meier. Las covariables potencialmente relacionadas con la mortalidad incluidas en el análisis fueron edad, sexo, índice de comorbilidad (índice de Davies27), IMC, hemoglobina, albúmina sérica, fósforo sérico, proteinuria, filtrado glomerular basal, diagnóstico de diabetes, PAS y PAD.
El porcentaje de datos ausentes fue menor del 0,5% en todas las variables. Las variables cuantitativas perdidas fueron repuestas con el valor de la medía aritmética del resto de los datos presentes.
Los resultados se expresan como media o mediana y desviación típica o rangos, respectivamente. Una p <0,05 fue considerada como estadísticamente significativa. Para el análisis estadístico y generación de gráficos se utilizó el programa SPSS versión 15.
Resultados
Estado de hidratación y asociaciones clínicas
En la tabla 1 se muestran las características clínicas y bioquímicas de los pacientes que fueron incluidos en el estudio. En la tabla 2 se exponen los parámetros obtenidos mediante la BIS.
Tabla 1. Características clínicas y bioquímicas de los pacientes incluidos en el estudio 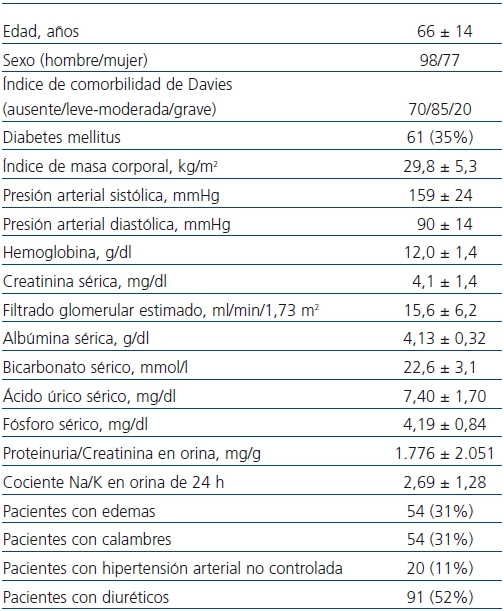
Tabla 2. Características clínicas y bioquímicas de los pacientes incluidos en el estudio 
a Resultados expresados como media ± desviación estándar y valores máximo y mínimo.
Como se puede observar en el histograma de frecuencias (figura 1) de los porcentajes de las variaciones del estado de hidratación con respecto al agua corporal total, la mayoría de los pacientes estudiados tenían un estado de hidratación dentro de los rangos de la normalidad; fueron muy pocos los que presentaron sobre hidratación o deshidratación superior al 5% del agua corporal total (19 y ocho pacientes, respectivamente).

Figura 1. Histograma que muestra la distribución de frecuencias del estado
de hidratación expresada como porcentaje del agua corporal total.
Los pacientes con edemas evidentes en la exploración física tenían un estado de hidratación por BIS significativamente más elevado que el de los que no presentaron edemas (1,51 ± 3,78 frente al0,04 ± 3,36% agua corporal total; p = 0,001 test de Mann-Whitney). Sin embargo, no hubo diferencias significativas en el estado de hidratación entre los pacientes que referían o no calambres (0,53 ± 3,54 frente a0,48 ± 3,57% agua corporal total).
Los 20 pacientes con HTA no controlada según el criterio tomado en este estudio presentaron un estado de hidratación significativamente superior al de los que tenían un buen control de la presión arterial (2,36 ± 4,01 frente a 0,25 ± 3,42% agua corporal total; p = 0,003 test de Mann-Whitney), aunque, como se puede apreciar en la figura 2, esta situación de mal control de la presión arterial también fue compatible con algún estado de teórica deshidratación.

Figura 2. Diagrama de cajas que muestra el estado de hidratación expresado
como porcentaje del agua corporal total en los pacientes con control adecuado
de la presión arterial (PA) (n = 155) y en los que no presentaban un control
adecuado de la presión arterial (n = 20)
Los pacientes que estaban siendo tratados con diuréticos (52%) no mostraron diferencias significativas en el estado de hidratación con respecto a los no tratados (0,85 ± 3,68 frente a0,11 ± 3,38% agua corporal total).
Por regresión lineal múltiple (tabla 3), las variables que mejor se asociaron con el estado de hidratación expresado como porcentaje del agua corporal total fueron el sexo masculino y la diabetes (mayor sobrehidratación), mientras que el IMC, el cociente urinario Na/K, la albúmina plasmática y la hemoglobina mostraron una asociación negativa con la sobrehidratación.
Tabla 3. Covariables asociadas con el estado de hidratación (porcentaje de agua
corporal total) por regresión lineal múltiple 
IC: intervalo de confianza.
Variables que no alcanzaron significación: edad, función renal residual, bicarbonato,
proteinuria, diuréticos, índice de comorbilidad, úrico y fósforo séricos.
Ángulo de fase y relación con la mortalidad
El ángulo de fase medio en el grupo de estudio fue de 5,43 ± 1,03o, y la mediana de 5,30o.
Mediante regresión lineal múltiple, los mejores determinantes del ángulo de fase se exponen en la tabla 4. Como se puede observar, el ángulo de fase se asociaba con algunos reconocidos determinantes de la mortalidad en pacientes con insuficiencia renal crónica. La edad se asoció de forma negativa con el ángulo de fase (figura 3), mientras que la albúmina sérica y la relación entre agua intracelular y extracelular (agua intracelular en litros dividida entre agua extracelular en litros) (figura 4) tuvieron una importante asociación positiva.
Tabla 4. Covariables asociadas con el ángulo de fase por regresión lineal múltiple 
IC: intervalo de confianza.
Variables que no alcanzaron significación: edad, función renal residual, bicarbonato,
proteinuria, diuréticos, índice de comorbilidad, úrico y fósforo séricos.
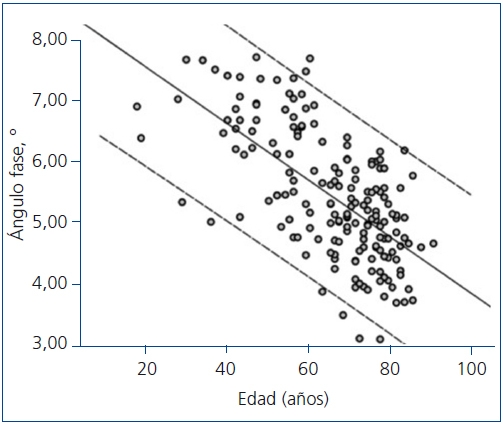
Figura 3. Regresión lineal entre el ángulo de fase y la edad. La línea continua
representa la recta de regresión (ángulo fase = 8,506-0,046 x edad), y las
líneas discontinuas representan los intervalos de confianza del 95% individuales.
R2 = 0,414; p <0,0001.

Figura 4. Regresión lineal entre el ángulo de fase y relación de agua intracelular
y extracelular (litros de agua intracelular divididos entre litros de agua extracelular).
La línea continua representa la recta de regresión (ángulo fase = -0,302 + 4,868
x relación agua intracelular/extracelular), y las líneas discontinuas representan
los intervalos de confianza del 95% individuales.
R2 = 0,452; p <0,0001.
Durante el período de seguimiento fallecieron 16 pacientes (9%). Dos pacientes fallecieron de forma súbita en domicilio, seis debido a causas cardiovasculares, uno por patología infecciosa, seis por procesos oncológicos, y una paciente por insuficiencia hepática. Dos pacientes necesitaron iniciar tratamiento con diálisis, y no hubo ninguna pérdida de seguimiento.
Los pacientes con un ángulo de fase por encima del valor de la mediana (5,3o) mostraron una mejor supervivencia que el resto (figura 5).

Figura 5. Gráfico de supervivencia actuarial (Kaplan-Meier) de los pacientes
con ángulo de fase superior o inferior a 5,3o (mediana del grupo de estudio).
Rango logarítmico = 9,88; p = 0,002. En la parte inferior se muestra el número
de pacientes en riesgo en cada grupo a lo largo del seguimiento.
Mediante análisis de regresión de Cox, los mejores determinantes de la mortalidad fueron: índice de comorbilidad (HR = 4,304; intervalo de confianza [IC] 95%, 1,824-10,155; p = 0,001), y el ángulo de fase (por cada grado; HR = 0,491; IC 95%, 0,263-0,917; p = 0,026). Destaca el hecho de que la edad, como covariable, no entró a formar parte de la mejor ecuación predictiva de la mortalidad como suele ser habitual, y en cambio sí lo hizo el ángulo de fase.
Discusión
Los resultados muestran que la mayoría de los pacientes con ERC avanzada analizados en este estudio tenían un estado de hidratación con variaciones dentro de unos márgenes de ± 5% del agua corporal total. A pesar de las ligeras modificaciones en el estado de hidratación, éste se correlacionó tanto con las características clínicas (edemas y HTA grave), como con los parámetros bioquímicos, entre los que destacan la asociación negativa con la albúmina plasmática, el índice de masa corporal y el cociente Na/K en orina. Los pacientes diabéticos también mostraron una tendencia a estar más sobrehidratados.
Aunque la BIA es un método muy extendido para el estudio de la composición corporal en pacientes sometidos a diálisis3,7,13-15, la experiencia en pacientes con ERCA es más escasa16-19.
Un hallazgo común en estos estudios en prediálisis fue la importante proporción de pacientes que presentaban sobrehidratación (>60%)18,19, además de las modificaciones de los parámetros de nutrición, especialmente la masa magra16,17 y la reducción del ángulo de fase16-19.
Aunque el número de pacientes con HTA no controlada según los criterios que se tomaron en el presente estudio fue reducido (20 pacientes), el grado de sobrehidratación en este subgrupo fue significativo con respecto al resto de los pacientes. Estos resultados sugieren que el conocimiento del estado de hidratación mediante BIS podría ayudar en la toma de decisiones terapéuticas en casos de hipertensión arterial refractaria28,29.
La relación negativa entre el estado de hidratación y la albúmina plasmática podría ser explicada por la hemodilución (p. ej.,mayor volumen extracelular, mayor volumen plasmático, dilución y reducción de la concentración de la albúmina). De igual modo, este fenómeno podría explicar, al menos parcialmente, la relación inversa entre hidratación y la concentración de hemoglobina.
Además de la hemodilución, la hipoalbuminemia secundaria al síndrome nefrótico es un estímulo para el balance positivo de agua y sal, y desarrollo de expansión del volumen extracelular30, aunque esta circunstancia no siempre garantiza una adecuada expansión del volumen intravascular efectivo31. La asociación entre sobrehidratación y cociente Na/K en orina (más sobrehidratado cuanto menor es este cociente), apoyaría el papel del hiperaldosteronismo en el desarrollo de la sobrecarga de volumen extracelular en estos pacientes.
La asociación negativa entre el IMC y la hidratación no puede explicarse por razones biológicas o patológicas, y podría estar relacionada con las interferencias que suponen las variaciones extremas de la composición corporal en la estimación de la relación de distribución del agua extracelular e intracelular, base para el cálculo del exceso de fluidos32.
El ángulo de fase es un parámetro que se calcula a partir de la resistencia y de la reactancia26, cuyo significado biológico es aún incierto. Podría tratarse de un indicador de la integridad de la membrana celular y de la distribución del agua intracelular y extracelular33,34. También podría reflejar la masa celular total y, por tanto, ser un parámetro importante en la valoración del estado de nutrición22,23,33,34. De acuerdo con estas hipótesis, los valores del ángulo de fase a 50 kHz que mostraron los pacientes incluidos en el presente estudio se correlacionaron con la edad, la distribución del agua corporal, el índice de comorbilidad, el IMC, la albúmina sérica y la hemoglobina, de tal forma que el sentido de la asociación fue siempre concordante con el significado pronóstico que tiene cada una de estas variables.
El valor del ángulo de fase se relaciona con el pronóstico vital no sólo en los pacientes en diálisis20,21,35 sino también en otros procesos patológicos crónicos22,23,33. De acuerdo con estas observaciones, el ángulo de fase junto con el índice de comorbilidad fueron los mejores determinantes de la mortalidad a corto plazo de los pacientes incluidos en el presente estudio.
El poder predictor sobre la mortalidad fue mejor con el ángulo de fase que con la edad. Este hallazgo sorprendente podría explicarse por la edad media elevada del grupo y el breve período de seguimiento, circunstancias que favorecen el papel más protagonista de la predicción a factores relacionados con la gravedad de la comorbilidad o con la edad biológica, como es posible que refleje el valor del ángulo de fase.
Este estudio tiene limitaciones. El grupo de estudio podría no representar adecuadamente las características de todos los pacientes que son remitidos a una consulta de ERCA, ya que se excluyeron algunos pacientes con dispositivos metálicos endovasculares, marcapasos o alteraciones extremas de la composición corporal. Este sesgo de selección podría haber influido en los resultados del estudio prospectivo.
El tiempo de seguimiento fue muy breve (aproximadamente un año), y esta circunstancia podría haber influido en los determinantes de la mortalidad, como ya se ha señalado anteriormente. No obstante, como los parámetros obtenidos por BIS están sujetos a variaciones en el tiempo, su relación con sucesos a corto plazo podría ser más fiable que con los que pudieran ocurrir a largo plazo.
Aunque en este estudio se incluyeron las principales covariables potencialmente relacionadas con la mortalidad en la ERC, no se analizó ningún marcador de inflamación.
En conclusión, la estimación de la composición corporal y el estado de hidratación por BIS aportan una información útil en los pacientes con ERCA que podría ayudar a su tratamiento. El ángulo de fase a 50 kHz representa un compendio de numerosos factores pronósticos, pero es un determinante independiente de la mortalidad a corto plazo, incluso en pacientes de edad avanzada y con enfermedades asociadas.
Referencias Bibliográficas
1. Kyle UG, Piccoli A, Pichard C. Body composition measurements: interpretation finally made easy for clinical use. Curr Opin Clin Nutr Metab Care 2003;6:387-93. [ Links ]
2. Lee SY, Gallagher D. Assessment methods in human body composition. Curr Opin Clin Nutr Metab Care 2008;11:566-72. [ Links ]
3. Woodrow G. Body composition analysis techniques in adult and pediatric patients: how reliable are they? How useful are they clinically? Perit Dial Int 2007;27(Supl 2):S245-S249. [ Links ]
4. Stenvinkel P, Heimbürger O, Lindholm B. Wasting, but not malnutrition, predicts cardiovascular mortality in end-stage renal disease. Nephrol Dial Transplant 2004;19:2181-3. [ Links ]
5. Raimann J, Liu L, Ulloa D, Kotanko P, Levin NW. Consequences of overhydration and the need for dry weight assessment. Contrib Nephrol 2008;161:99-107. [ Links ]
6. Wizemann V, Wabel P, Chamney P, Zaluska W, Moissl U, Rode C, et al. The mortality risk of overhydration in haemodialysis patients. Nephrol Dial Transplant 2009;24:1574-9. [ Links ]
7. Levin NW, Zhu F, Seibert E, Ronco C, Kuhlmann MK. Use of segmental multifrequency bioimpedance spectroscopy in hemodialysis. Contrib Nephrol 2005;149:162-7. [ Links ]
8. Ellis KJ. Human body composition: in vivo methods. Physiol Rev 2000;80:649-80. [ Links ]
9. Kyle UG, Bosaeus I, De Lorenzo AD, Deurenberg P, Elia M, Gómez JM, et al.; Composition of the ESPEN Working Group. Bioelectrical impedance analysis-part I: review of principles and methods. Clin Nutr 2004;23:1226-43. [ Links ]
10. Jaffrin MY. Body composition determination by bioimpedance: an update. Curr Opin Clin Nutr Metab Care 2009;12:482-6. [ Links ]
11. Earthman C, Traughber D, Dobratz J, Howell W. Bioimpedance spectroscopy for clinical assessment of fluid distribution and body cell mass. Nutr Clin Pract 2007;22:389-405. [ Links ]
12. Moissl UM, Wabel P, Chamney PW, Bosaeus I, Levin NW, Bosy-Westphal A, et al. Body fluid volume determination via body composition spectroscopy in health and disease. Physiol Meas 2006;27:921-33. [ Links ]
13. Kaysen GA, Zhu F, Sarkar S, Heymsfield SB, Wong J, Kaitwatcharachai C, et al. Estimation of total-body and limb muscle mass in hemodialysis patients by using multifrequency bioimpedance spectroscopy. Am J Clin Nutr 2005;82:988-95. [ Links ]
14. Piccoli A; Italian CAPD-BIA Study Group. Bioelectric impedance vector distribution in peritoneal dialysis patients with different hydration status. Kidney Int 2004;65:1050-63. [ Links ]
15. Crepaldi C, Soni S, Chionh CY, Wabel P, Cruz DN, Ronco C. Application of body composition monitoring to peritoneal dialysis patients. Contrib Nephrol 2009;163:1-6. [ Links ]
16. O'Sullivan AJ, Lawson JA, Chan M, Kelly JJ. Body composition and energy metabolism in chronic renal insufficiency. Am J Kidney Dis 2002;39:369-75. [ Links ]
17. Cupisti A, D'Alessandro C, Morelli E, Rizza GM, Galetta F, Franzoni F, et al. Nutritional status and dietary manipulation in predialysis chronic renal failure patients. J Ren Nutr 2004;14:127-33. [ Links ]
18. Dumler F, Kilates C. Prospective nutritional surveillance using bioelectrical impedance in chronic kidney disease patients. J Ren Nutr 2005;15:148-51. [ Links ]
19. Bellizzi V, Scalfi L, Terracciano V, De Nicola L, Minutolo R, Marra M, et al. Early changes in bioelectrical estimates of body composition in chronic kidney disease. J Am Soc Nephrol 2006;17:1481-7. [ Links ]
20. Maggiore Q, Nigrelli S, Ciccarelli C, Grimaldi C, Rossi GA, Michelassi C. Nutritional and prognostic correlates of biompedance indexes in hemodialysis patients. Kidney Int 1996;50:2103-8. [ Links ]
21. Chertow GM, Johansen KL, Lew N, Lazarus JM, Lowrie EG. Vintage, nutritional status, and survival in hemodialysis patients. Kidney Int 2000;57:1176-81. [ Links ]
22. Schwenk A, Beisenherz A, Römer K, Kremer G, Salzberger B, Elia M. Phase angle from bioelectrical impedance analysis remains an independent predictive marker in HIV-infected patients in the era of highly active antiretroviral treatment. Am J Clin Nutr 2000;72:496-501. [ Links ]
23. Toso S, Piccoli A, Gusella M, Menon D, Bononi A, Crepaldi G, et al. Altered tissue electric properties in lung cancer patients as detected by bioelectric impedance vector analysis. Nutrition 2000;16:120-4. [ Links ]
24. Levey AS, Coresh J, Greene T, Stevens LA, Zhang YL, Hendriksen S, et al. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med 2006;145:247-54. [ Links ]
25. De Lorenzo A, Andreoli A, Matthie J, Withers P. Predicting body cell mass with bioimpedance by using theoretical methods: a technological review. J Appl Physiol 1997;82:1542-58. [ Links ]
26. Baumgartner RN, Chumlea WC, Roche AF. Bioelectric impedance phase angle and body composition. Am J Clin Nutr 1988;48:16-23. [ Links ]
27. Davies SJ, Phillips L, Naish PF, Russell GI. Quantifying comorbidity in peritoneal dialysis patients and its relationship to other predictors of survival. Nephrol Dial Transplant 2002;17:1085-92. [ Links ]
28. Wabel P, Moissl U, Chamney P, Jirka T, Machek P, Ponce P, et al. Towards improved cardiovascular management: the necessity of combining blood pressure and fluid overload. Nephrol Dial Transplant 2008;23:2965-71. [ Links ]
29. Passauer J, Petrov H, Schleser A, Leicht J, Pucalka K. Evaluation of clinical dry weight assessment in haemodialysis patients using bioimpedance spectroscopy: a cross-sectional study. Nephrol Dial Transplant 2010;25:545-51. [ Links ]
30. Koomans HA, Braam B, Geers AB, Roos JC, Dorhout Mees EJ. The importance of plasma protein for blood volume and blood pressure homeostasis. Kidney Int 1986;30:730-5. [ Links ]
31. Schrier RW, Fassett RG. A critique of the overfill hypothesis of sodium and water retention in the nephrotic syndrome. Kidney Int 1998;53:1111-7. [ Links ]
32. Chamney PW, Wabel P, Moissl UM, Müller MJ, Bosy-Westphal A, Korth O, et al. A whole-body model to distinguish excess fluid from the hydration of major body tissues. Am J Clin Nutr 2007;85:80-9. [ Links ]
33. Barbosa-Silva MCG, Barros AJD, Wang J, Heymsfield SB, Pierson RN. Bioelectrical impedance analysis: population reference values for phase angle by age and sex. Am J Clin Nutr 2005;82:49-52. [ Links ]
34. Buffa R, Floris G, Marini E. Migration of the bioelectrical impedance vector in healthy elderly subjects. Nutrition 2003;19:917-21. [ Links ]
35. Pupim LB, Kent P, Ikizler TA. Bioelectrical impedance analysis in dialysis patients. Miner Electrolyte Metab 1999;25:400-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Francisco Caravaca Magariños,
Servicio de Nefrología,
Hospital Infanta Cristina,
Avda Elvás, s/n,
060800, Badajoz
E-mail: fcaravacam@senefro.org
Enviado a Revisar: 18 Abr. 2011
Aceptado el: 25 Abr. 2011














